促黑曲霉产糠醛和五-羟甲基糠醛的诱导子筛选及优化
2022-05-17丁轩刘建蕊杨青青冉丽郑姚佩田羽韦永琴刘维芳李祝
丁轩 刘建蕊 杨青青 冉丽 郑姚佩 田羽 韦永琴 刘维芳 李祝
摘要:本试验利用10种生物诱导子和6种非生物诱导子提高黑曲霉(Aspergillus niger)xj发酵液中糠醛和5-羟甲基糠醛(5-HMF)的产量。先采用单因素试验筛选诱导子及诱导条件,再设计Box-Behnken试验并结合响应面法优化得到最佳的诱导条件。结果表明:将黑曲霉xj的种子液与诱导子一同接入发酵培养基,加入0.675%还原糖浓度为10 μg/mL的金葡萄球菌代谢产物诱导子,诱导8.6 h,此时发酵液中糠醛的产量为50.49 μg/mL,相较优化之前糠醛的含量提高了37%;而在此条件下发酵液中5-HMF的产量为41.12 μg/mL,提高了31%。该试验结果可为后续黑曲霉发酵产糠醛和5-HMF提供参考。
关键词:糠醛;5-羟甲基糠醛;黑曲霉;诱导子;响应面优化
中图分类号:Q939文献标识码:A
文章编号:1008-0457(2022)03-0034-08国际DOI编码:10.15958/j.cnki.sdnyswxb.2022.03.005
糠醛(Furfural)是一种重要的生物质平台化合物,其分子结构中含有呋喃环和醛基,化学性质活泼,可作为多种化学产品的起始原料,广泛应用于医学、食品、化工、能源等领域[1-3]。张素等[4]、赵妗颐等[5]试验发现黑曲霉xj菌株粗提物中对齐整小核菌和链格孢菌具有拮抗作用的物质可能是糠醛,说明糠醛可能具有抑菌作用。目前生产糠醛主要是酸水解法,戊糖经酸催化环化脱水形成,而大多含有戊糖的物质都可作为原材料生产糠醛[6]。五-羟甲基糠醛(5-Hydorxymethylfurfural,简写为5-HMF),因其具有呋喃环、醛基及羟基,所以稳定性差、性质活泼,是一种重要的平台化学物。可通过缩合反应、氧化反应、氢化反应和缩醛等反应,合成多种具有高附加价值的衍生物如2,5-二呋喃甲醛(DFF)、五-酰基糠酸(HMFCA)等。5-HMF的众多衍生物可作为有机导体、生物燃料,在医药方面具有抗癌细胞增值活性,降血糖等药理作用[7-10]。马明超等[11]展示了许多制备5-HMF的方法,其中葡萄糖转化制备 5-HMF的方法达到72%的产率。虽然目前生产糠醛和5-HMF的方法众多,但仍存在产率较低、生产资源浪费等情况。
黑曲霉(Aspergillus niger)属于半知菌亚门、丝孢纲、丝孢目、丛梗孢科,是丝状真菌中一个常见真菌[12-13]。具有生长旺盛、发酵周期短、不产生毒素等特点,属于GRAS菌种,是应用于食品工业上发酵和生产酶制剂的主要菌种[14]。黑曲霉的基因组中发现了大量与次级代谢有关的基因簇,可以产生多种次级代谢产物[15],关丽萍等[16]在海洋真菌Aspergillus niger 2HL-M -8的发酵液中发现11个黑曲霉的次级代谢产物。因其具有高产、高分泌、高安全性等优点而被广泛地应用于发酵工业中,其中黑曲霉已被用于规模化大量发酵生产柠檬酸。
目前提高次级代谢产量的方法主要有菌株选育、发酵优化、微生物共培养[17-19]。诱变选育菌株[17]包含化学诱变、物理诱变以及复合诱变。在诱变选育中常使用2种以上的诱变方法复合诱变提高诱变效应;发酵优化[18]为发酵培养基成分的优化和培养条件的优化;而微生物共培养发酵[19]可以使活性粗提取物增加、促进次级代谢产量的提高以及诱导新的次级代谢物的合成,还可诱发原次级代谢物的类似物的共同途径。除以上三种提高次级代谢产物的方法外,目前诱导子也广泛应用于提高次级代谢產量。
诱导子(Elicitor)最初定义为可诱导植物细胞产生和积累植保素的化学物质[20],但随着诱导子的应用领域扩大,发现诱导子是一类可以特异激活植物或微生物产生次生代谢产物的活性物质[21-22]。目前诱导子已广泛应用于提高植物中次级代谢产物的产量且诱导机制较成熟透彻[23-25]。而诱导子在微生物方面的应用主要是关于促进纳他霉素的产量,试验发现产黄青霉代谢产物诱导子和黑曲霉代谢产物诱导子对产纳他霉具有较好的促进作用[26-27]。目前将诱导子用于提高黑曲霉次级代谢产量的研究很少见,本试验主要利用诱导子来提高黑曲霉产生次生代谢产物—糠醛和5-HMF的产量,以便为后续的黑曲霉发酵产糠醛和5-HMF提供参考。
1材料与方法
1.1材料
1.1.1主要试验菌种
黑曲霉(Aspergillus niger)xj,由贵州大学真菌资源研究所分离[5],现于中国典型培养物保藏中心保存(CCTCC No:M206021)。
1.1.2培养基及试剂
马铃薯液体培养基(PDB);马铃薯固体培养基(PDA);LB培养基;0.1%吐温-80溶液。
1.2试验方法
1.2.1诱导子的制备
1.2.1.1诱导子类型
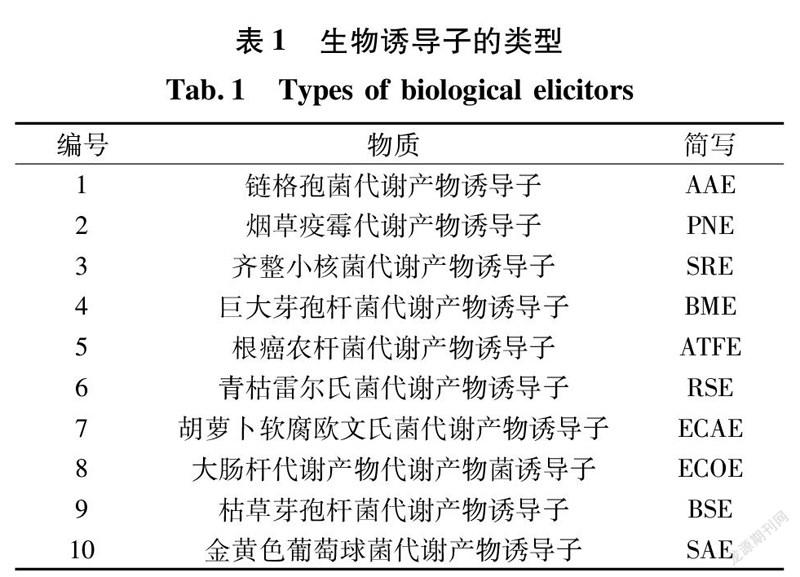
本次试验以10种生物诱导子(表1)和6种非生物诱导子CuSO4、苯甲酸钠、氨基寡糖素、抗坏血酸、苯丙氨酸、色氨酸为筛选目标。
1.2.1.2非生物诱导子的制备
参考聂丽[28]的试验方法,将上述非生物诱导子配成浓度为10 μg/mL的溶液,经0.45 μm滤膜后得到的溶液即为非生物诱导子。
1.2.1.3生物诱导子的制备
采用冻融研磨法制备生物诱导子。除微生物的培养方式不同外,其余步骤与聂丽[28]相同,改动如下。
真菌诱导子:用打孔器分别将链格孢菌(Alternaria alternata)、烟草疫霉(Phytophthora nictotianae)、齐整小核菌(Sclerotium rolfsis)制成菌饼后,分别接种到PDB 培养基(100 mL/250 mL)中,于28 ℃,180 r/min 培养7 d,其中齐整小核菌28 ℃静止培养7 d,过滤收集菌体。将收集的菌体参照聂丽[28]的冻融研磨法制备诱导子,后置于4 ℃冰箱中备用。
细菌诱导子:分别将青枯雷尔氏菌(Ralstonia solanacearum)、根癌农杆菌(Agrobacterium tume faciens)、巨大芽孢杆菌(Bacillus megaterium)、胡萝卜软腐欧文氏菌(Erwinia carotovora)接种到LB培养基(100 mL/250 mL)中30 ℃,150 r/min培养2 d;大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)接种到LB培养基中,于37 ℃,180 r/min培养2 d,10000 r/min离心10 min 收集菌体。收集到的菌体同真菌诱导子制备方法一致。
1.2.1.4生物诱导子还原糖含量的测定
以还原糖含量作为生物诱导子质量浓度的指标,采用3,5 一二硝基水杨酸(DNS)比色法测定其还原糖含量。参照赵凯等[29]试验利用DNS比色法测定还原糖浓度,选取DNS试剂2在波长为550 nm处测定。
1.2.2黑曲霉种子液的生长曲线
将活化的黑曲霉接种于PDA培养基中,于26 ℃、150 r/min恒温培养箱中培养5 d,用适量的0.1%吐温-80无菌溶液洗下孢子。参照袁洪威等[30]的试验方法用分光光度计测定黑曲霉孢子悬浮液浓度。制备浓度为107CFU/mL孢子悬浮液,以6%的接种量加入种子培养基(50 mL/250 mL)中。培养8 d,每24 h取样测定菌体干重。
1.2.3发酵液中糠醛和5-HMF含量的测定
1.2.3.1建立糠醛和5-HMF标准曲线模型
试验方法参照彭秋菊等[31]和张素等[32]用HPLC法测定黑曲霉发酵液中五-羟甲基糠醛和糠醛的含量,建立糠醛和5-HMF的标准曲线。
1.2.3.2发酵液中糠醛和5-HMF含量的测定
参照彭秋菊等[31]和张素等[32]用HPLC法测定黑曲霉发酵液中糠醛和5-HMF的含量。稍有改动,改动如下:将斜面培养基中的黑曲霉活化,制成107CFU/mL孢子悬浮液,将孢子悬液以8%~12%(V/V)接种于发酵瓶中培养7 d。发酵液处理方法以及色谱条件与彭秋菊等[31]试验一致。
1.2.4诱导子筛选及优化
主要以发酵液中糠醛含量为评价指标,将处于对数生长末期的种子液按6%的接种量加入发酵培养基(50 mL/250 mL)中,在此基础上进行单因素试验设计。
1.2.4.1诱导子种类及最佳添加时间的筛选
将浓度为10 μg/mL的氨基寡糖素、抗坏血酸、苯丙氨酸、色氨酸和浓度为10 μmol/mL的CuSO4和苯甲酸钠,还原糖浓度为10 μg/mL的生物诱导子以1%的添加量,在诱导时间为72 h的条件下,添加时间设为0 d、3 d、5 d,测糠醛和5-HMF的含量。以糠醛含量为指标,筛选最佳诱导子及最佳添加时间。以不添加诱导子为空白对照。
1.2.4.2诱导子添加量的筛选
在诱导子为10 μg/mL SAE,添加时间为0 d,诱导时间为72 h的条件下,添加量设为1%、2%、4%、6%、8%、10%,测糠醛和5-HMF含量。
1.2.4.3诱导子诱导时间的筛选
在添加量为1%的10 μg/mL SAE,添加时间为0 d的条件下,诱导时间设为12 h、24 h、36 h、48 h、60 h、72 h,测糠醛和5-HMF含量(诱导时间从诱導子加入后开始计算,而发酵时间针对空白对照,包含添加时间)。1.2.5响应面优化发酵条件
根据单因素试验结果,选取最佳条件作为0因素水平,设计三因素三水平的Box-Behnken试验(表2)。利用Design-Expert软件设计Box-Behnken试验方案,以黑曲霉发酵液中的糠醛产量为响应指标进行响应面分析,预测诱导子在黑曲霉发酵体系中的最佳诱导条件。(因为最佳添加时间为0 d,左边已是极值,故选用1d为0水平)
2结果与分析
2.1还原糖的标准曲线
利用DNS法测定还原糖浓度(即生物诱导子质量浓度)。以葡萄糖含量(mg)为横坐标,OD值为纵坐标绘制葡萄糖标准曲线,其线性回归方程为y=0.4957x-0.0088(R2=0.998),葡萄糖含量在0~1.2 mg之间,具有良好线性关系。
2.2黑曲霉在种子培养基中的的生长曲线
将浓度为107CFU/mL孢子悬浮液以6%的接种量接入种子培养基,装液量为50 mL/250 mL。由图1可知,经过3 d培养后菌种生物量最大,即将进入稳定期,可将对数生长期末期(3 d)的培养液作为种子液,进行发酵试验。
2.3糠醛和五羟甲基糠醛的标准曲线
利用HPLC法测定糠醛和5-HMF的标准曲线,其中糠醛的标准曲线线性回归方程为y=57.582x+195.82(R2=0.999)。5-HMF的标准曲线线性回归方程为y=72.107x-11.357(R2=0.999)。两个方程在0~60 μg/mL浓度范围具有良好线性关系。
2.4诱导子种类及诱导时间筛选
分别向已培养0 d、3 d、5 d的发酵培养液中添加10种生物诱导子及6种非生物诱导子。其中非生物诱导子对于黑曲霉的作用效果不明显,但生物诱导子有较明显的作用效果。综合图2-4来看,相比于CK培养基液中的糠醛产量,0 d添加的ATFE、SAE、AAE、PNE具有促进作用。其中SAE的诱导效果最佳,其余诱导子对糠醛产量均表现为抑制作用,其中PNE对菌体的生长也具有抑制作用;在3 d时添加诱导子均表现为促进作用;在5 d时添加诱导子较0 d糠醛的产量减少。可知0 d添加SAE效果显著优越,糠醛含量达47.44 μg/mL,较空白对照(CK)提升了19.18 μg/mL;5-HMF含量达38.59 μg/mL,较空白对照提高了16.50 μg/mL。故选择最佳诱导子为SAE,最佳添加时间为0 d。
2.5诱导子最佳添加量的筛选
在诱导子为10 μg/mL SAE,添加时间为0 d,诱导时间为72 h的条件下,添加量按1%、2%、4%、6%、8%、10%与黑曲霉种子液一起加入发酵液中,测定糠醛和5-HMF的含量。由图5可知,1%的添加量产生糠醛含量较高,其余浓度对产糠醛影响不大,故选取1%为最佳添加量。
2.6诱导子最佳诱导时间的筛选
在添加量为1%的10 μg/mL SAE,添加时间为0 d的条件下,诱导培养12 h、24 h、36 h、48 h、60 h、72 h(从加入诱导子时间开始计算)。由图6可知,诱导子时间为12 h对促进黑曲霉产生糠醛含量最大达到53.22 μg/mL;5-HMF含量达42.46 μg/mL。故最佳诱导时间为12 h。
2.7响应面法优化诱导条件
2.7.1响应面的模型建立与统计分析
确定单因素的最佳值后,进行Box-Behnken试验,以发酵液中的糠醛(Y)的产量为响应值,诱导子的添加时间(A)、添加量(B)以及诱导时间(C)为变量,进行响应面优化试验,结果如表3所示。
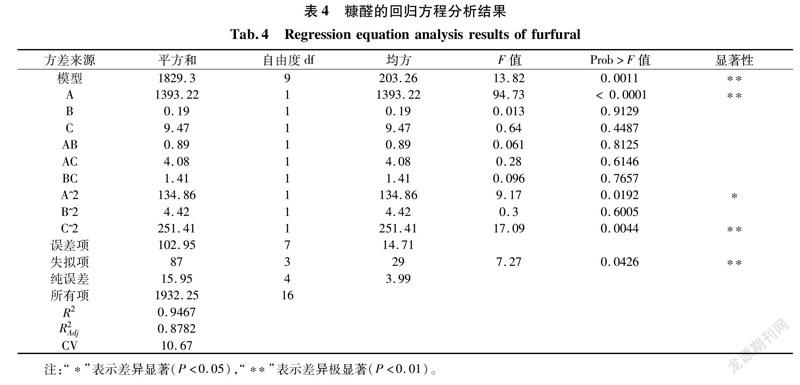
根据表3的试验结果,利用Design Expert 8对数据进行回归分析,得到糠醛的回归方程:Y1=42.71-13.2A-0.15B-1.09C+0.47AB+1.01AC+0.59BC-5.66A2-1.02B2-7.73C2。
由表4可知,添加时间(A)的一次项和诱导时间的二次项(C2)对发酵液中糠醛的产量影响具有极显著性(P<0.01),添加时间的二次项(A2)对发酵液中糠醛的产量影响具有显著性(P<0.05),其余的变量影响不显著(P>0.05)。根据α=0.05的显著水平除去不显著因素后,将回归方程简化为Y1=42.71-13.2A- 5.66A2-7.73C2。该回归方程的变量与因变量之间的线性关系显著(R2=0.9467),模型调整复相关系数为R2Adj=0.8782,说明该模型可以解释87.82%响应值的变化,拟合程度较好[33]。
2.7.2响应面分析及优化
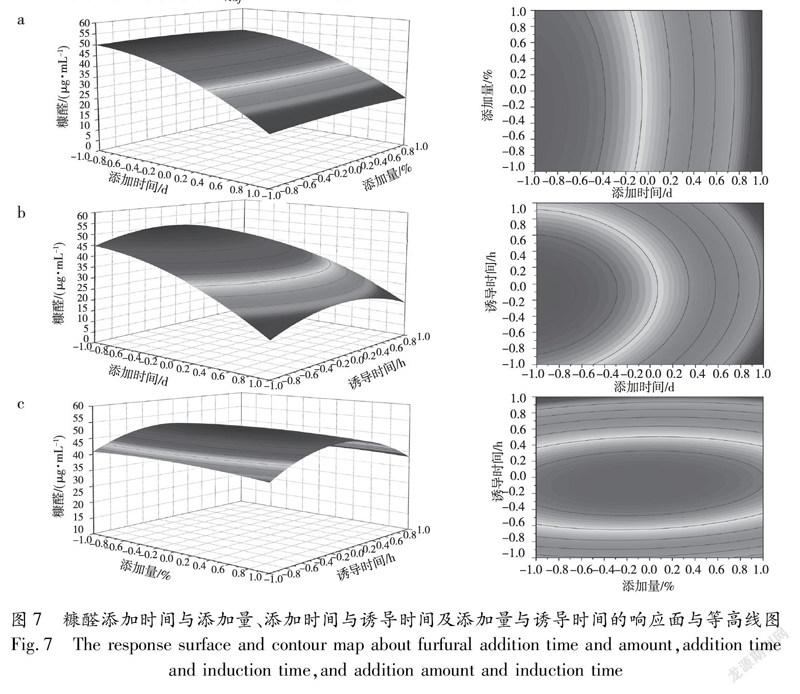
利用Design Expert根据回归方程进行响应面分析,寻找糠醛产量最大的诱导条件。响应面的陡峭程度可以表明变量对因变量的影响程度,响应面越陡峭说明相关因素影响效果越明显。由图7可知,三个因素对黑曲霉产糠醛的影响表现为:添加时间(A)>诱导时间(C)>添加量(B)。对模型进行分析,得到最优的培养条件:添加时间为0 d、添加量为0.675%、诱导时间为8.6 h,此条件下的糠醛含量理论值为50.52 μg/mL。根据给出的最佳培养条件设计试验进行验证(设置三组平行试验)得出发酵液中糠醛的实际含量分别为50.51、50.47、50.48 μg/mL,与预测值较为接近,说明此模型可以较好地预测诱导条件下的糠醛产量。而在糠醛的最佳诱导条件下发酵液中5-HMF的实际产量也达到了41.12 μg/mL。
3结论与讨论
用诱导子提高微生物次级代谢的产量,不仅与黑曲霉自身的发酵特性有关,还跟诱导子的种类、诱导子的含量、添加时间和诱导时间有密切的关系。聂丽[28,34]等试验表明细菌诱导子内的活性成分主要是多糖类物质和蛋白质,并且在诱导链霉菌合成农抗702时也是细菌诱导子具有较好的诱导效果。结果显示,对黑曲霉发酵作用最好的诱导子为金葡萄球菌代谢产物,是一种细菌代谢产物诱导子,说明细菌代谢产物诱导子对微生物产次生代谢产物具有一定的作用效果,但对于SAE内的具体有效物质还是未知的。在确定最佳诱导子后,观察诱导子的含量、添加时间和诱导时间对其诱导效果的影响。本试验在添加浓度为1%时产糠醛量最大,但随着诱导子的含量增加,出现产糠醛含量较高的添加量。有人将诱导子含量与次生代谢产物的产量的关系概括为饱和型和最适型[35],最适型可以解释本试验的情况。本试验的最佳添加时间是将种子液与金葡萄球菌代谢产物诱导子一同接入发酵培养基,即为0 d,表明在对数生长期末期时加入诱导子,次生代谢产物产量较多。在边猛[36]试验中利用Bacillus sp.代谢产物诱导子作用于海洋真菌,结果表明将真菌培养至对数生长期末期加入诱导子,产生的次生代谢产物含量最高,这与本试验的结果一致。关于诱导子最佳添加时间出现的情况,可能是由于在真菌培养早期合成糠醛和5-HMF的关键酶前体物质不足,导致早期加入诱导子无法激活关键酶的活性,而在对数生长期末期关键酶前体物质充足,受到诱导子的刺激导致关键酶活性增强,次生代谢产物含量增多。对于不同的诱导时间,在12~48 h内诱导子具有明显的促进效应,说明在发酵初期诱导子的作用效果较明显。但是随着诱导子的诱导时间推移,糠醛产量降低,诱导子的作用效果不显著。而在64 h后出现空白对照的含量高于样品组,可能是由于前期发酵大量消耗了培养基中的成分,导致添加诱导子的样品后期次生代谢产物较空白组少。
响应面优化法优化发酵条件具有优化速度快,预测结果偏差小等优点[37]。目前,已有报道将响应面优化法应用于发酵条件的优化以及诱导子筛选等方面。如彭秋菊等[31]用响应面优化黑曲霉产糠醛的培养基条件较优化前糠醛产量提高了20.2%;魏宝东等[33]利用响应面法优化促进纳他霉素合成的诱导子诱导条件,经优化后纳他霉素产量提高了1.68倍。以上试验说明响应面优化法对于发酵具有较好的优化效果。本试验利用经单因素试验确定了诱导子的种类、诱导子添加时间、诱导量及诱导时间的范围后,利用Box-Behnken试验并结合响应面优化筛选出黑曲霉產糠醛最佳条件为:糠醛的添加时间为0 d、添加量0.675%,诱导时间8.6 h。在此条件下培养黑曲霉发酵液中糠醛含量为50.49 μg/mL,较空白对照(36.84 μg/mL)提高了37%;5-HMF的含量为41.12 μg/mL,较空白对照(32.08 μg/mL)提高了31%。(责任编辑:段丽丽)
参考文献:
[1]余先纯,李湘苏,龚铮午.黑曲霉联合固体酸水解花生壳制备糠醛的研究[J].食品工业科技,2012,33(1):230-233.
[2]隋光辉.糠醛洁净生产工艺及生物质综合利用研究[D].长春:吉林大学,2019.
[3]邱勇,赵姗,黄婕,等.紫外分光光度法测定黑曲霉发酵液中糠醛的含量[J].山地农业生物学报,2018,37(5):80-83.
[4]张 素,袁洪威,李祝,等.黑曲霉超临界萃取物抑制链格孢作用机制的初步研究[J].植物保护,2019,45(2):57-63.
[5]赵妗颐,肖洋,李祝,等.黑曲霉xj粗提物的拮抗机制及其抗氧化活性[J].农药学学报,2020,22(4):642-651.
[6]高礼芳,徐红彬,张懿,等.高温稀酸催化玉米芯水解生产糠醛工艺优化[J].过程工程学报,2010,10(2):292-297.
[7]伊秋婷.羟甲基糠醛的合成研究[D].天津:天津工业大学,2019.
[8]冯云超,左淼,曾宪海,等.葡萄糖制备5-羟甲基糠醛[J].化学进展,2018,30(Z1):314-324.
[9]张听伟.碳基固体酸催化生物质制取糠醛、5-羟甲基糠醛的研究[D].合肥:中国科学技术大学,2019
[10]陈家祥,徐策,张素,等.黑曲霉发酵液中5-HMF含量的测定[J].山地农业生物学报,2018,37(6):87-91.
[11]马明超,胡曼曼,孙永先,等.5-羟甲基糠醛的合成研究[J].化工时刊,2018,32(12):21-23,30.
[12]Znameroski E A,Glass N L .Using a model filamentous fungus to unravel mechanisms of lignocellulose deconstruction[J].Biotechnology for Biofuels,2013,6(1):6.
[13]Kowalczyk J E,Benoit I,De Vries R P,et al.Regulation of plant biomass utilization in Aspergillus[M].Advances in Applied Microbiology,2014.
[14]安宝聚.高产纤维素酶黑曲霉ANSTJ01菌株的分离鉴定与生物学性状探究[D].泰安:山东农业大学,2017.
[15]吕扬勇.黑曲霉FGSC A1279次级代谢调控研究[D].广州:华南理工大学,2014.
[16]关丽萍,周婷婷,李达翃,等.海洋真菌黑曲霉2HL-M-8次级代谢产物的分离鉴定及抗肿瘤活性[J]中国药物化学杂志,2016,26(1):49-55.
[17]佘秋生,杨海波,杨冠军,等.紫外诱变黑曲霉筛选高产果胶酶菌种[J].中国酿造,2012,31(6):134-137.
[18]伍玉春,陈显玲,苏龙.产柚苷酶黑曲霉SL2K发酵条件优化[J].中国酿造,2018,37(6):125-130.
[19]Pettit R K .Mixed fermentation for natural product drug discovery[J].Applied Microbiology and Biotechnology,2009,83(1):19-25.
[20]Hahn,Michael G.Microbial elicitors and their receptors in plants[J].Annual Review of Phytopathology,1996,34(1):387-412.
[21]古绍彬,龚慧,杨彬,等.真菌诱导子在发酵工业中的应用现状及展望[J].生物工程学报,2013,29(11):1558-1572.
[22]叶辉,王兆慧,陈佩林,等.微生物诱导子对诺卡氏菌属№5205菌株发酵的影响[J].生物技术,2004(6):57-58.
[23]崔晋龙,付少彬,高芬,等.真菌诱导植物次生代谢产物积累的信号机制及在药用植物中的应用[J].中草药,2012,43(8):1647-1651.
[24]赵鸿莲,于荣敏.诱导子在植物细胞培养中的应用研究进展[J].沈阳药科大学学报,2000 (2):77-81.
[25]何梦玲,李磊,梁威,等.茉莉酸甲酯和水杨酸对广藿香悬浮细胞中百秋李醇积累的影响[J].时珍国医国药,2018,29(11):2597-2600.
[26]史强,陶文沂.真菌代谢产物中促进纳他霉素合成的诱导子的研究[J].食品与发酵工业,2010,36(10):15-18.
[27]王亚洲,古绍彬,刘胜男,等.真菌诱导子对纳他霉素生物合成的影响[J].中国食品添加剂,2015(2):63-68.
[28]聂丽.诱导子对链霉菌702合成农抗702的影响[D].南昌:江西农业大学,2017.
[29]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008(8):534-536.
[30]袁洪威,陈湖芳,高东民,等.分光光度法测定黑曲霉孢子浓度的研究[J].中国酿造,2017,36(4):122-126.
[31]彭秋菊,趙姗,孙冉,等.黑曲霉产糠醛的培养条件优化[J].生物学杂志,2022,39(2):74-79.
[32]张素,吉玉玉,肖洋,等.HPLC法检测黑曲霉发酵液中5-羟甲基糠醛的研究[J].中国酿造,2018,37(3):154-156.
[33]魏寶东,潘娅慧,王亚男,等.促进纳他霉素合成的真菌诱导子筛选及诱导条件优化[J].食品科学,2013,34(7):196-200.
[34]聂丽,游思远,樊聪静,等.高效诱导子的制备方法及诱导成分研究[J].江苏农业科学,2018,46(4):90-93.
[35]赵俊云.棉花植保素与桔梗皂甙的诱导生成研究[D].武汉:华中师范大学,2002.
[36]边猛.海洋真菌产生物碱代谢调节的研究[D].青岛:青岛科技大学,2007.
[37]李欢欢.优化试验设计方法的比较研究[J].内蒙古科技与经济,2021(4):63-65.
Screening and Optimization of Elicitors for Furfural and 5-Hydroxymethyl Furfural Production by Aspergillus niger
Ding Xuan,Liu Jianrui,Yang Qingqing,Ran Li,Zheng Yaopei,Tian Yu,Wei Yongqin,Liu Weifang,Li Zhu*
(College of Life Sciences,Guizhou University,Guiyang,Guizhou 550025,China)
Abstract:In this study,ten biological elicitors and six abiotic elicitors were used to increase the contents of furfural and 5-hydroxymethyl furfural (5-HMF) in the fermentation broth of Aspergillus niger xj.Firstly,elicitors and inducible conditions were screened by single factor,box-Behnken test was designed,and then response surface method was used to optimize the best inducible conditions.The results showed that:the seed liquid of A.niger xj and the elicitor were added into the fermentation medium,0.675% of staphylococcus aureus metabolite elicitor with a reducing sugar concentration of 10 μg/mL was added and induced for 8.6 h.The furfural yield in the fermentation liquid was 50.49 μg/mL,which was 37% higher than that before optimization.Under these conditions,the yield of 5-HMF in fermentation broth was 41.12 μg/mL,an increase of 31%.The results can provide reference for furfural and 5-HMF production by Aspergillus niger fermentation.
Keywords:furfural;5-hydorxymethyl furfural;Aspergillus niger;elicitor;response surface optimization
