藜麦ZF-HD转录因子的全基因组鉴定及其对盐胁迫的响应分析
2022-05-16时丕彪王德领蒋润枝李斌晏军方迪闫凯旋顾闽峰
时丕彪 王德领 蒋润枝 李斌 晏军 方迪 闫凯旋 顾闽峰


摘要:以藜麦的高质量基因组为参考,对藜麦锌指同源异型结构域(ZF-HD)转录因子基因CqZF-HD进行全基因组鉴定,并利用生物信息学方法对其编码的蛋白质理化性质、二级结构、亚细胞定位、保守结构域以及基因结构、系统进化关系进行了分析。同时,利用前期转录组测序结果分析了CqZF-HD家族基因在盐胁迫下的表达模式。结果表明,在藜麦中共鉴定出21个ZF-HD转录因子,大部分定位在细胞质,二级结构以无规则卷曲为主,氨基酸序列长度68~284 aa,相对分子质量7.54×103~30.20×103,理论等电点6.01~9.54;每个ZF-HD蛋白都含有ZF或HD保守结构域,系统进化树将其划分为5个亚家族。盐处理下表达分析结果显示,11个CqZF-HD基因响应藜麦盐胁迫,其中8个基因呈上调表达,3个基因呈下调表达,说明ZF-HD家族基因在参与藜麦盐胁迫中发挥着不同的作用。
关键词:藜麦;锌指同源异型结构域(ZF-HD);全基因组;盐胁迫;基因表达
中图分类号:S512.9文献标识码:A文章编号:1000-4440(2022)02-0304-08
Genome-wide identification of ZF-HD transcription factors and expression analysis of response to salt stress in quinoa
SHI Pi-biao,WANG De-ling,JIANG Run-zhi,LI Bin,YAN Jun,FANG Di,YAN Kai-xuan,GU Min-feng
Abstract:Zinc finger-homeodomain (ZF-HD) proteins are plant-specific transcription factors that play important roles in plant growth, development and various stress responses. In this study, the CqZF-HD gene was identified at genome-wide level with the high-quality quinoa genome as a reference. The physicochemical properties, secondary structure, subcellular localization and conserved domains of CqZF-HDs, phylogenetic relationship and gene structure were analyzed by bioinformatics method. Meanwhile, the expression pattern of CqZF-HD family genes under salt stress was also analyzed by preliminary transcriptome sequencing results. The results showed that 21 ZF-HD transcription factors were identified in quinoa, most of which were located in the cytoplasm, the secondary structure was dominated by random coils, amino acid sequence length was 68-284 aa, relative molecular weight was 7.54×103-30.20×103, and theoretical isoelectric point was 6.01-9.54. All of the ZF-HDs were divided into five subfamilies by phylogenetic tree analysis, and each member contained conserved domains ZF or HD. The expression analysis under salt treatment showed that 11 CqZF-HDs responded to salt stress in quinoa, eight genes were up-regulated, and three genes were down-regulated. In conclusion, ZF-HD family genes play different roles in response to salt stress in quinoa.
Key words:quinoa;zinc finger-homeodomain (ZF-HD);genome-wide;salt stress;gene expression
鋅指同源异型结构域(ZF-HD)蛋白是植物所特有的一类转录因子,在植物生长发育和各种胁迫反应中发挥着重要作用[1-2]。ZF-HD转录因子的氨基酸序列中具有保守的HD结构域(Homeodomain)和C2H2型ZF结构域(C2H2-type zinc finger domain)[3-4]。HD结构域是一种特征明确的DNA结合结构域,通过与DNA结合调控靶基因的表达水平,从而参与植物的生长发育[5]。ZF结构域广泛存在于调控蛋白中,并与DNA结合和蛋白质互作,在植物抵御胁迫反应中起着重要作用[6-7]。ZF-HD蛋白通常以一种核心序列ATTA与特异性DNA序列结合,形成同型二聚体或异型二聚体[1]。ZF-HD家族可分为ZHD和MIF (Mini zinc finger)2个亚家族,其中MIF基因编码ZF-HD蛋白的ZF结构域,并不编码HD结构域[3]。
在黄顶菊中首次发现ZF-HD蛋白,可能是编码C4磷酸烯醇式丙酮酸羧化酶基因的调控因子[8]。随后,在拟南芥[1]、水稻[9]、番茄[10]、大白菜[4]、棉花[11]和苦荞[12]等植物中也发现了ZF-HD基因,并对其进行了基因家族鉴定及功能分析。拟南芥中有17个ZF-HD成员,它们作为转录因子,具有独特的生理特性,在花的发育中起着非常重要的作用[3]。AtZHD1能够与ERD1 (EARLY RESPONSE TO DEHYDRATION STRESS 1)启动子特异性结合,并且其表达受干旱、盐和脱落酸(ABA)处理诱导,NAC和AtZHD1的过表达增强了拟南芥的耐旱性[13]。AtHB33受ARF2 (Auxin response factor2)负调控,是种子萌发和主根生长所必需的[14]。OsZHD1和OsZHD2通过调控鳞状细胞的数量和排列方式而引起水稻叶片卷曲[15];OsZHD2的过表达不仅能促进根的生长,还能增加水稻产量[16]。干旱、NaCl和低温处理对番茄SlZHD18基因具有明显的诱导作用,而热胁迫对其没有明显诱导作用[10]。在响应干旱胁迫和高盐胁迫时,葡萄VvZHD基因呈上调表达[17]。因此,ZF-HD基因不仅在植物的各个生长发育阶段发挥着一定的作用,还参与了植物对盐分等逆境胁迫的响应。
藜麦是一种新型全营养作物,也是未来最具潜力的农作物之一。然而,关于藜麦ZF-HD基因的研究至今尚未见报道。随着藜麦基因组的公布[18],使得在全基因组范围内分析藜麦ZF-HD基因家族成为可能。本研究以现有的藜麦基因组信息为基础,借助生物信息学手段对藜麦ZF-HD基因家族进行全基因组鉴定,并对其基因结构、系统进化关系以及ZF-HD蛋白的理化性质和保守结构域等进行分析,同时利用转录组数据探究其在盐胁迫下的表达情况,为进一步解析ZF-HD基因家族与藜麦耐盐性的关系及其抗性遗传改良奠定基础。
1材料与方法
1.1藜麦ZF-HD基因家族的鉴定和藜麦ZF-HD蛋白理化性质分析
从植物转录因子数据库PlantTFDB(http://planttfdb.gao-lab.org/)下载拟南芥AtZF-HD转录因子的氨基酸序列,并在藜麦基因组数据库Chenopodium quinoa v1.0 (https://phytozome.jgi.doe.gov/pz/portal.html#!info?alias=Org_Cquinoa_er)進行Blastp比对,设置E-value为1×e-5。在Pfam (http://pfam.xfam.org/)和CDD (https://www.ncbi.nlm.nih.gov/cdd)上在线分析候选CqZF-HD蛋白的保守结构域,去除编码不完整蛋白质和不含ZF或HD结构域的蛋白质,最终得到藜麦ZF-HD转录因子家族所有成员。利用ExPasy网站(http://au.expasy.org/tool.html)分析藜麦ZF-HD蛋白家族的氨基酸序列长度、相对分子质量和理论等电点。
1.2 藜麦ZF-HD蛋白的二级结构和亚细胞定位
利用在线网站GORIV (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)分析藜麦ZF-HD蛋白的二级结构特征。使用PSORT (http://psort1.hgc.jp/form.html)对ZF-HD蛋白进行亚细胞定位预测。
1.3藜麦ZF-HD基因家族的基因结构和藜麦ZF-HD蛋白保守结构域分析
根据藜麦ZF-HD基因的基因组序列和编码序列,确定基因的外显子和内含子起止位置,并利用在线软件GSDS 2.0 (http://gsds.cbi.pku.edu.cn/)绘制基因结构图。经CDD分析得到藜麦ZF-HD蛋白保守结构域的氨基酸序列起始位点,利用IBS 1.0软件[19]将保守结构域位置进行可视化显示,再使用ClustalX 2.0软件[20]对保守结构域氨基酸序列进行多重比对。
1.4ZF-HD基因家族的系统进化分析
利用MEGA 5.0[21]内置软件ClustalW对藜麦(21个)和拟南芥(17个)ZF-HD蛋白的氨基酸序列进行多重比对,再利用MEGA 5.0软件对比对结果进行系统进化关系分析,用邻接法(Neighbor-Joining, NJ)构建无根进化树,bootstrap重复次数设置为1 000次。
1.5盐胁迫下藜麦ZF-HD基因的表达分析
利用本课题组已经完成的藜麦高通量测序转录组数据,分析藜麦ZF-HD基因家族在盐胁迫下的表达模式。用3%的双氧水对供试藜麦品种37TES的种子进行表面消毒1 min,然后用无菌水将种子冲洗干净,在光周期为16 h光照/8 h黑暗的28 ℃恒温光照培养箱进行发芽试验。培养7 d后,将长势一致的幼苗转移到Hoagland营养液[22]中进行水培,继续培养28 d。然后进行300 mmol/L NaCl处理,分别在0 h、0.5 h、2.0 h和24.0 h时取根部,用于转录组测序和qRT-PCR验证,每个处理设3次重复。藜麦ZF-HD基因家族成员的转录组表达量经logx2均一化处理,使用HemI软件[23]绘制盐胁迫下转录组基因表达图谱。
2结果与分析
2.1藜麦ZF-HD基因家族的全基因组鉴定与特征分析
以拟南芥AtZF-HD基因编码的蛋白质氨基酸序列为查询对象,在藜麦全基因组数据库进行Blastp比对,得到23个具有编码ZF或HD结构域的CqZF-HD基因,其中有2个CqZF-HD编码不完整蛋白质,最终鉴定出21个藜麦ZF-HD基因家族成员,分布在16条scaffold上(表1)。理化性质分析结果表明,不同ZF-HD蛋白氨基酸序列的长度差异较大,其中AUR62021438最小,为68 aa,AUR62019007最大,为284 aa。除AUR62027182和AUR62044191因蛋白质氨基酸序列含有几个连续未定义的氨基酸而无法计算其相对分子质量和等电点(pI)外,其余19个ZF-HD蛋白的相对分子质量为7.54×103~30.20×103,pI为6.01~9.54。pI小于7的只有AUR62021438(6.68)和AUR62039796(6.01),为酸性蛋白质,其他ZF-HD的pI均大于7,为碱性蛋白质。
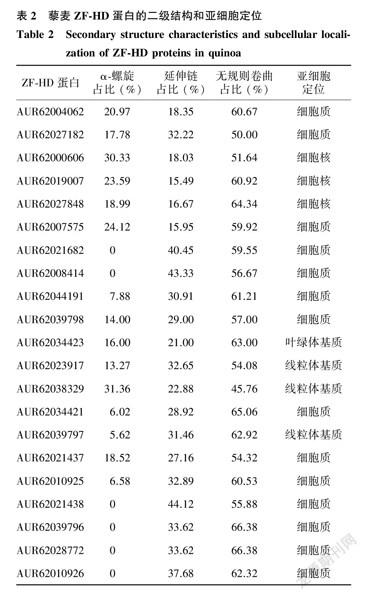
2.2藜麦ZF-HD蛋白的二级结构和亚细胞定位预测
藜麦ZF-HD基因编码的蛋白质二级结构主要包括α-螺旋、延伸链和无规则卷曲,均不含β-折叠,其中AUR62021682、AUR62008414、AUR62021438、AUR62039796、AUR62028772和AUR62010926也没有α-螺旋结构(表2)。大部分ZF-HD成员的二级结构成分中,无规则卷曲占比最高,其次是延伸链,α-螺旋占比相对较少。亚细胞定位预测结果显示,14个ZF-HD成员定位于细胞質,3个成员定位于细胞核,3个成员定位于线粒体基质,1个成员定位于叶绿体基质,说明它们可能调控着植物不同的生物学过程。
2.3ZF-HD基因家族的系统进化关系分析
为更好地了解藜麦ZF-HD基因家族成员之间的同源性关系,将17个拟南芥AtZF-HD 基因与21个藜麦CqZF-HD基因编码的蛋白质氨基酸序列进行多重比对并构建系统进化树(图1)。聚类分析结果显示,38个ZF-HD转录因子可以划分为5个亚家族:MIF、ZHDⅠ、ZHDⅡ、ZHD Ⅲ和ZHD Ⅳ,位于不同亚家族的蛋白质可能发挥着不同的生物学作用。藜麦的ZF-HD基因在MIF亚家族数目较多,为12个,在ZHDⅠ存在4个,在ZHD Ⅱ和ZHD Ⅳ均含2个,在ZHD Ⅲ只存在1个,即AUR62000606。藜麦的AUR62007575和AUR62004062与拟南芥的AT2G18350和AT1G75240处于同一分支,说明它们的亲缘关系较近,可能具有类似的功能。
2.4藜麦ZF-HD基因结构特征分析
基因结构分析结果表明,藜麦ZF-HD基因家族的基因结构比较简单,均不含非翻译区,但不同成员间也存在一定差异(图2)。其中,13个基因只有1个外显子,没有内含子;7个基因具有2个外显子和1个内含子;1个基因(AUR62027182)具有4个外显子和3个内含子。AUR62019007和AUR62027848同属ZHDⅠ亚家族,有着相同的基因结构和相似的CDS长度,但因内含子长度差别较大使其基因全长存在显著差异。
为进一步研究藜麦ZF-HD蛋白的特征区域,在CDD网站上对其进行保守结构域分析,结果表明21个ZF-HD蛋白均含有ZF或HD结构域,但这2个结构域在各个亚家族成员的分布有所不同(图3)。MIF亚家族所有成员HD结构域缺失,均只含有1个ZF结构域,并且同源基因对编码蛋白质的氨基酸数量和结构域位置都具有较高的相似性;ZHDⅠ亚家族中除AUR62044191只含有1个ZF结构域外,其他3个成员都含有ZF和HD结构域;ZHD Ⅱ和ZHD Ⅲ的成员都含有ZF和HD结构域;ZHD Ⅳ的2个成员的保守结构域均位于蛋白质的N端,AUR62039796只含有1个HD结构域,而AUR62028772只含有1个ZF结构域。
对藜麦ZF-HD蛋白保守结构域氨基酸序列进行多重比对,发现ZF结构域由31~55个氨基酸组成,HD结构域由31~58个氨基酸组成,并且它们都有多个保守的氨基酸位点,HD结构域在藜麦ZF-HD家族中的保守性比ZF结构域更强 (图4)。保守区域可能通过与其他DNA结合或互作,从而导致ZF-HD转录因子的功能多样性。
2.5藜麦ZF-HD家族基因在盐胁迫下的表达模式分析
为挖掘藜麦耐盐相关ZF-HD基因,提供藜麦耐盐遗传改良基因资源,利用课题组前期完成的转录组数据,对ZF-HD家族基因在盐胁迫下的表达模式进行分析。结果如图5所示,藜麦ZF-HD家族基因在盐胁迫处理后的表达模式存在差异,其中10个基因表达量未发生变化,即不参与对盐胁迫的响应,11个基因表达量在不同处理时间发生不同程度的变化。与对照(0 h)相比,AUR62027848、AUR62008414和AUR62028772基因在各个时间点都呈上调表达,而AUR62004062、AUR62000606和AUR62023917则呈下调表达。盐胁迫0.5 h时,AUR62019007和AUR62007575的表达量上调至最高值,在2.0 h和24.0 h时表达量有所下降并明显低于对照,说明这2个基因可能迅速响应早期盐胁迫。盐胁迫下AUR62021682的表达量呈先降低后升高再降低的趋势,在2.0 h时达到最高峰;AUR62039798和AUR62039796的表达量呈先降低后上升的趋势,在24.0 h达到最大值。为验证转录组数据的可靠性,课题组已对用于测序的样品进行了qRT-PCR分析(图6),结果表明两者具有很强的相关性(R2=0.797 3),证明RNA-seq表达数据是可靠的[24]。同时,ZF-HD家族基因在盐胁迫下呈现出的不同表达模式也说明它们在藜麦盐响应过程中可能发挥着不同的作用。
3讨论
土壤盐分是干旱半干旱地区现代农业的主要非生物胁迫之一,严重影响种子萌发、植物生长发育和作物产量[25-26]。据统计,约有8×108 hm2的土地(占世界土地总面积的6.5%)受到盐胁迫的危害[27]。为了适应盐胁迫,植物进化出了一系列的响应机制来提高其耐盐性,包括复杂的生理特性、代谢和信号通路以及分子调控网络等。随着植物基因组测序的完成及全基因组数据库的公布,越来越多的耐盐基因被挖掘出来,其中鉴定和分析植物基因家族就是挖掘关键功能基因的一种有效手段。植物特异性ZF-HD基因编码一个转录因子家族,该家族存在于陆生植物的主要类群中,包括维管植物和非维管植物,但在原核生物、绿藻和真菌中没有发现。ZF-HD基因家族参与多种过程,包括植物发育和生理过程,以及对生物胁迫和非生物胁迫的抗性。目前,在拟南芥、水稻、玉米和棉花等多种植物中均已鉴定出ZF-HD基因家族,但关于藜麦ZF-HD基因家族的研究至今尚未见报道。在本研究中,我们鉴定并分析了藜麦ZF-HD基因的全基因组及其在盐胁迫反应中的表达。
在藜麦ZF-HD基因家族中共鉴定出21个成员,其数量要多于模式植物拟南芥(17)和水稻(15),可能是因为基因组复制事件导致了异源四倍体物种藜麦ZF-HD基因的扩增。21个ZF-HD基因不均匀地分布在藜麦16条scaffold上,其编码蛋白质的氨基酸数量和相对分子质量存在差异,并以碱性蛋白质居多。基因外显子和内含子结构的差异主要有3种机制,即外显子或内含子的获得或丢失,外显子化或假外显子化和插入或缺失[28-29]。藜麦所有ZF-HD成员中,13个基因没有内含子,7个基因只有1个内含子,1个基因具有3个内含子,这种差异可能是上述3种机制参与所致。有研究结果表明,植物基因内含子的数量越少,其对外界环境的适应性越强[30]。将拟南芥和藜麦的ZF-HD蛋白构建系统进化树,38个ZF-HD转录因子划分为5个亚家族,2种植物ZF-HD在每个亚家族均有分布,说明基因复制是植物基因组进化中基因家族扩增的主要驱动力。藜麦ZF-HD蛋白在结构上与其他物种是相似的,含有ZF和HD结构域,但在亚家族分布上也有不同之处,比如与拟南芥[1]和小麦[2]等植物相比,藜麦的MIF亚家族成员同样只含有ZF结构域,而ZHD亚家族并非都同时含有ZF和HD结构域。氨基酸序列分析结果显示,藜麦ZF和HD结构域都具有高度保守性,并且HD结构域的保守性更强一些,结构域中保守区域可能通过与其他DNA结合或互作,从而导致ZF-HD转录因子的功能多样性。二级结构和亚细胞定位分析结果显示,大部分ZF-HD成员中无规则卷曲占比最高,其次是延伸链,α-螺旋占比相对较少,其中3对同源基因不含α-螺旋;14个ZF-HD属于胞质蛋白,分别有3个成员定位于细胞核和线粒体基质,1个定位于叶绿体基质,说明它们在参与藜麦生物学过程中可能发挥着不同的作用。
植物以一種复杂的方式响应盐胁迫,涉及许多基因、蛋白质以及代谢和信号通路的协同功能与相互作用[31-32]。基因表达调控是植物应对和适应盐胁迫的关键现象之一[33-35]。相关研究结果表明,ZF-HD在植物耐盐胁迫中扮演着重要的角色[10, 17]。本研究利用课题组已经完成的藜麦在300 mmol/L NaCl处理下不同时间点的高通量测序转录组数据,分析了所有ZF-HD基因在响应盐胁迫的表达模式,发现10个成员不参与响应盐胁迫,另外11个成员的表达量在不同处理时间呈现出不同变化,说明它们在藜麦响应盐胁迫过程中发挥着不同的作用。AUR62027848、AUR62008414和AUR62028772基因在盐处理0.5~24.0 h时表达量受到明显诱导,这些基因可能在藜麦抵抗盐胁迫过程中发挥着重要的作用。而AUR62004062、AUR62000606和AUR62023917为盐敏感基因,盐胁迫明显抑制了其表达。AUR62019007和AUR62007575在盐胁迫0.5 h时表达量较高,在胁迫后期显著下降,说明这2个基因可在早期迅速响应盐胁迫,可能直接受到盐胁迫信号的诱导。关于ZF-HD在藜麦抵抗盐胁迫中的功能及作用机理仍需要借助遗传转化手段进行验证。
4结论
本研究对藜麦ZF-HD转录因子进行了全基因组鉴定,共获得21个家族成员,划分为5个亚家族,都具有典型的ZF或HD保守结构域。21个ZF-HD基因在盐胁迫处理下呈现出不同的表达模式,推测不同ZF-HD家族基因在藜麦响应盐胁迫过程中可能发挥着不同的作用。
参考文献:
[1]TAN Q K, IRISH V F. The Arabidopsis zinc finger-homeodomain genes encode proteins with unique biochemical properties that are coordinately expressed during floral development [J]. Plant Physiology, 2006, 140: 1095-1108.
[2]LIU H, YANG Y, ZHANG L S. Zinc finger-homeodomain transcriptional factors (ZF-HDs) in wheat (Triticum aestivum L.): identification, evolution, expression analysis and response to abiotic stresses [J]. Plants, 2021, 10: 593.
[3]HU W, DEPAMPHILIS C W, MA H. Phylogenetic analysis of the plant-specific zinc finger-homeobox and mini zinc finger gene families [J]. Journal of Integrative Plant Biology, 2008, 50: 1031-1045.
[4]WANG W, WU P, LI Y, et al. Genome-wide analysis and expression patterns of ZF-HD transcription factors under different developmental tissues and abiotic stresses in Chinese cabbage [J]. Molecular Genetics and Genomics, 2016, 291: 1451-1464.
[5]BHATTACHARJEE A, GHANGAL R, GARG R, et al. Genome-wide analysis of homeobox gene family in legumes: Identification, gene duplication and expression profiling [J]. PLoS One, 2015, 10: e0119198.
[6]KRISHNA S S, MAJUMDAR I, GRISHIN N V. Structural classification of zinc fingers: Survey and summary [J]. Nucleic Acids Research, 2003, 31: 532-550.
[7]MACKAY J P, CROSSLEY M. Zinc fingers are sticking together [J]. Trends in Biochemical Sciences, 1998, 23: 1-4.
[8]WINDHOVEL A, HEIN I, DABROWA R, et al. Characterization of a novel class of plant homeodomain proteins that bind to the C4 phosphoenolpyruvate carboxylase gene of Flaveria trinervia [J]. Plant Molecular Biology, 2001, 45: 201-214.
[9]JRGENSEN J E, GRNLUND M, PALLISGAARD N, et al. A new class of plant homeobox genes is expressed in specific regions of determinate symbiotic root nodules [J]. Plant Molecular Biology, 1999, 40: 65-77.
[10]KHATUN K, NATH U K, ROBIN A, et al. Genome-wide analysis and expression profiling of zinc finger homeodomain (ZHD) family genes reveal likely roles in organ development and stress responses in tomato [J]. BMC Genomics, 2017, 18: 695.
[11]ABDULLAH M, CHENG X, CAO Y, et al. Zinc finger-homeodomain transcriptional factors (ZHDs) in upland cotton (Gossypium hirsutum): Genome-wide identification and expression analysis in fiber development [J]. Frontiers in Genetics, 2018, 9: 357.
[12]LIU M, WANG X, SUN W, et al. Genome-wide investigation of the ZF-HD gene family in Tartary buckwheat (Fagopyrum tataricum) [J]. BMC Plant Biology, 2019, 19: 248.
[13]TRAN L S, NAKASHIMA K, SAKUMA Y, et al. Co-expression of the stress-inducible zinc finger homeodomain ZFHD1 and NAC transcription factors enhances expression of the ERD1 gene in Arabidopsis [J]. Plant Journal, 2007, 49: 46-63.
[14]WANG L, HUA D, HE J, et al. Auxin Response Factor2 (ARF2) and its regulated homeodomain gene HB33 mediate abscisic acid response in Arabidopsis [J]. PLoS Genetics, 2011, 7: e1002172.
[15]XU Y, WANG Y, LONG Q, et al. Overexpression of OsZHD1, a zinc finger homeodomain class homeobox transcription factor, induces abaxially curled and drooping leaf in rice [J]. Planta, 2014, 239: 803-816.
[16]YOON J, CHO L H, YANG W, et al. Homeobox transcription factor OsZHD2 promotes root meristem activity in rice by inducing ethylene biosynthesis [J]. Journal of Experimental Botany, 2020, 71(18): 5348-5364.
[17]WANG H, YIN X, LI X, et al. Genome-wide identification, evolution and expression analysis of the grape (Vitis vinifera L.) zinc finger-homeodomain gene family [J]. International Journal of Molecular Sciences, 2014, 15: 5730-5748.
[18]JARVIS D E, HO Y S, LIGHTFOOT D J, et al. The genome of Chenopodium quinoa [J]. Nature, 2017, 542: 307-312.
[19]LIU W, XIE Y, MA J, et al. IBS: an illustrator for the presentation and visualization of biological sequences [J]. Bioinformatics, 2015, 31(20): 3359-3361.
[20]THOMPSON J D, GIBSON T J, PLEWNIAK F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools [J]. Nucleic Acids Research, 1997, 25(24): 4876-4882.
[21]TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739.
[22]HU L, LI H, CHEN L, et al. RNA-seq for gene identification and transcript profiling in relation to root growth of bermudagrass (Cynodon dactylon) under salinity stress [J]. BMC Genomics, 2015, 16: 575.
[23]DENG W, WANG Y, LIU Z, et al. HemI: a toolkit for illustrating heatmaps [J]. PLoS One, 2014, 9(11): e111988.
[24]SHI P, GU M. Transcriptome analysis and differential gene expression profiling of two contrasting quinoa genotypes in response to salt stress [J]. BMC Plant Biology, 2020, 20: 568.
[25]HANIN M, EBEL C, NGOM M, et al. New insights on plant salt tolerance mechanisms and their potential use for breeding [J]. Frontiers in Plant Science, 2016, 7: 1787.
[26]JULKOWSKA M M, KOEVOETS I T, MOL S, et al. Genetic components of root architecture remodeling in response to salt stress [J]. Plant Cell, 2017, 29(12): 3198-3213.
[27]ROZEMA J, FLOWERS T. Crops for a salinized world [J]. Science, 2008, 322: 1478-1480.
[28]GUIXIA X, CHUNCE G, HONGYAN S, et al. Divergence of duplicate genes in exon-intron structure [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(4): 1187-1192.
[29]FILIZ E, TOMBULOLU H. Genome-wide distribution of superoxide dismutase (SOD) gene families in Sorghum bicolor [J]. Turkish Journal of Biology, 2015, 39(1): 49-59.
[30]JIN Z, CHANDRASEKARAN U, LIU A. Genome-wide analysis of the Dof transcription factors in castor bean (Ricinus communis L.) [J]. Genes & Genomics, 2014, 36(4): 527-537.
[31]ZHU J K. Genetic analysis of plant salt tolerance using Arabidopsis [J]. Plant Physiology, 2000, 124: 941-948.
[32]APSE M P, BLUMWALD E. Engineering salt tolerance in plants [J]. Current Opinion in Biotechnology, 2002, 13: 146-150.
[33]梁國旺,李增强,周步进,等. 红麻谷胱甘肽还原酶基因(HcGR)的克隆及盐胁迫下表达分析[J].南方农业学报,2020,51(10):2412-2419.
[34]张恒,刘晓婷,陈嵩,等. 盐胁迫下三倍体小黑杨杂种无性系叶片蛋白质差异表达分析[J]. 南京林业大学学报(自然科学版),2020,44(2): 59-66.
[35]JAMIL A, RIZA S, ASHRAF M, et al. Gene expression profiling of plants under salt stress [J]. Critical Reviews in Plant Sciences, 2011, 30: 435-458.
(责任编辑:张震林)
收稿日期:2021-07-11
基金项目:江苏省农业科技自主创新基金项目[CX(19)3116];江苏现代农业(蔬菜)产业技术体系(盐城)推广示范基地项目[JATS(2020)205]
作者简介:时丕彪(1989-),男,山东菏泽人,助理研究员,主要从事农作物新品种选育及分子育种研究。(E-mail)1032175660@qq.com
通讯作者:顾闽峰,(E-mail)ycgmf@126.com
