H2O2对人晶状体上皮细胞AQP1和AQP5表达影响及其机制
2022-05-06李璐彭旭东林静赵桂秋
李璐 彭旭东 林静 赵桂秋


[摘要]目的探究氧化应激对晶状体上皮细胞(HLECs)水通道蛋白(AQPs)表达的影响及其机制。方法取健康人群和白內障病人的晶状体前囊膜,应用实时荧光定量PCR(RT-PCR)和免疫组织化学染色方法检测两组AQP1和AQP5表达与分布情况。应用RT-PCR方法检测不同浓度的H2O2作用HLECs不同时间后AQP1和AQP5 mRNA表达情况;用400 μmol/L的H2O2刺激HLECs不同时间,Western blot方法检测AQP1和AQP5蛋白表达,RT-PCR和Western blot分别检测丝裂酶原激活的蛋白激酶(MAPK)抑制剂联合H2O2(400 μmol/L)共同作用于HLECs后AQP1和AQP5的mRNA与蛋白的表达情况。结果白内障组晶状体前囊膜中AQP1和AQP5的mRNA表达与分布明显低于健康组(t=10.71、5.46,P<0.05)。H2O2刺激HLECs引起的AQP1和AQP5 mRNA表达下调具有浓度和时间依赖性(F浓度=80.38、436.20,F时间=46.95、175.00,F交互=7.99、17.52,P<0.01)。其中以400 μmol/L的H2O2作用最为明显,分别在作用4、24 h时AQP1和AQP5的mRNA与蛋白表达降至最低水平(t=3.32~5.31,P<0.05)。p38和细胞外信号调节激酶(ERK)抑制剂可以抑制H2O2诱导的AQP1的mRNA和蛋白表达下调(t=4.37~7.28,P<0.05),JNK、p38和ERK的抑制剂对AQP5的表达量无明显作用(P>0.05)。结论氧化应激使HLECs AQP1和AQP5表达下降;在氧化应激条件下,MAPK(p38和ERK)途径参与AQP1表达调控,但MAPK途径不参与AQP5的表达调控。
[关键词]晶状体;上皮细胞;水孔蛋白质类;丝裂原激活蛋白激酶类;过氧化氢
[中图分类号]R34;R776.1[文献标志码]A[文章编号]2096-5532(2022)02-0173-05
doi:10.11712/jms.2096-5532.2022.58.049[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220314.0851.001.html;2022-03-1512:03:24
EFFECTS OF H2O2ON EXPRESSION OF AQP1 AND AQP5 IN HUMAN LENS EPITHELIAL CELLS AND THE UNDERLYING MECHANISMS LI Lu, PENG Xudong, LIN Jing, ZHAO Guiqiu (Department of Ophthalmology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT]ObjectiveTo explore the effects of oxidative stress on the expression of aquaporins (AQPs) in human lens epithelial cells (HLECs) and the underlying mechanisms. MethodsThe anterior lens capsules from healthy people and patients with cataract were collected. RT-PCR and immunohistochemistry were used to determine the expression and distribution of AQP1 and AQP5 in both groups. After stimulating HLECs by different concentrations of H2O2for different lengths of time, the mRNA expression of AQP1 and AQP5 was measured by RT-PCR. With H2O2at 400 μmol/L stimulating HLECs for different lengths of time, the protein expression of AQP1 and AQP5 was measured by Western blot. After using mitogen-activated protein kinase (MAPK) inhibitors and H2O2(400 μmol/L) combined to stimulate HLECs, the mRNA and protein expression of AQP1 and AQP5 was determined by RT-PCR and Western blot, respectively. ResultsThe cataract group showed significantly lower mRNA expression and distribution of AQP1 and AQP5 in the anterior lens capsule compared with the healthy group (t=10.71,5.46;P<0.05). H2O2down-regulated the mRNA expression of AQP1 and AQP5 in a concentration- and time-dependent manner (Fconcentration=80.38,436.20;Ftime=46.95,175.00;Finteraction=7.99,17.52;P<0.01). H2O2showed the greatest effects at 400 μmol/L, with the lowest mRNA and protein expression of AQP1 and AQP5 at 4 h and 24 h, respectively (t=3.32-5.31,P<0.05). Inhibitors of p38 and extracellular signal-regulated kinase (ERK) could significantly inhibit H2O2-induced down-regulation of AQP1 mRNA and protein (t=4.37-7.28,P<0.05). Inhibitors of c-Jun N-terminal kinase, p38, and ERK had no significant effects on the expression of AQP5 (P>0.05). ConclusionOxidative stress reduces the expression of AQP1 and AQP5 in HLECs. Under oxidative stress, the MAPK pathways (p38 and ERK) are involved in the regulation of AQP1 expression, but not in the regulation of AQP5 expression.
[KEY WORDS]lens, crystalline; epithelial cells; aquaporins; mitogen-activated protein kinases; hydrogen peroxide
目前,由于人口老龄化程度不断加剧,在成年白内障病人中年龄相关性白内障(ARC)明显多于其他类型,氧化损伤在该类型白内障的发生发展过程中具有重要作用[1]。随着年龄的增长,晶状体内抗氧化物质逐渐降低,从而导致氧化物积聚在晶状体中[2],氧化物的积累使核DNA和蛋白质遭到破坏,从而导致晶状体混浊[3]。氧化应激可以使丝裂酶原激活的蛋白激酶(MAPK)通路中的c-Jun N末端激酶(JNK)、p38、细胞外信号调节激酶(ERK)蛋白磷酸化,参与组织氧化损伤的病理过程[4]。水通道蛋白(AQPs)的作用是通过调节溶质主动转运,使晶状体内外的渗透压达到动态平衡,以维持晶状体的稳态与透明性[5]。 本研究探讨H2O2的氧化作用对人晶状体上皮细胞(HLECs)AQP1和AQP5表达的影响,以及MAPK(JNK、p38、ERK)信号通路是否参与调控该条件下AQP1和AQP5表达的变化。现将结果报告如下。
1材料与方法
1.1实验材料
人晶状体囊膜取自青岛大学附属医院伦理委员会批准的健康供体和白内障病人。白内障组晶状体前囊膜由白内障超声乳化过程中环形撕取前囊膜获得,正常组晶状体前囊膜从我院低温医学科提供的供体眼球获得。将晶状体前囊膜放入-80 ℃冰箱保存。HLECs(广州Jennio Biotech公司);胎牛血清(FBS,美国Hyclone公司);青霉素G、DMEM培养液(美国Gibco公司);硫酸链霉素、蛋白裂解缓冲液(RIPA∶PMSF=1 000∶1)、EDTA液(北京So-labio公司);JNK抑制劑(SP600125)、p38抑制剂(SB203580)、ERK抑制剂(U0126)(美国Selleckchem公司);RNAiso Plus(购自大连TaKaRa公司);BCA蛋白浓度测定试剂盒(购自武汉Elabscience公司);Prime Script RT reagent Kit With gDNA Eraser试剂盒(购自南京Vazyme公司);RM 2025切片机(德国徕卡公司);DAB试剂盒(北京中杉金桥生物技术有限公司);光学显微镜(日本Olympus IXSO公司)。
1.2实验方法
1.2.1HLECs培养将HLECs接种于含有体积分数0.10青霉素G(浓度0.1 μg/L)和硫酸链霉素(0.1 μg/L)的DMEM培养液中,置于37 ℃、含体积分数0.05 CO2、90%湿度环境中培养。 待细胞生长达80%融合时,加入2.5 g/L胰蛋白酶-EDTA液2 mL,调整HLECs密度为1×1011/L的细胞悬浮液,接种到12孔或6孔组织培养板上,待细胞达到80%融合且生长均匀时换成不含血清的DMEM培养液。
1.2.2HLECs分组及处理将细胞随机分为空白对照组、H2O2刺激组和MAPK抑制剂组。空白对照组不做任何处理。H2O2刺激组分别加入100、200、400和800 μmol/L的H2O2,分别培养1、2、4和6 h收集细胞用于RT-PCR检测;H2O2刺激组每孔加入400 μmol/L的H2O2,分别培养4、8、16、24 h收集细胞用于Western blot检测。抑制剂组分别加入JNK抑制剂(2.5×10-5mol/L)、p38抑制剂(1×10-5mol/L)、ERK抑制剂(2×10-5mol/L)预处理1 h后再加400 μmol/L的H2O2,刺激4 h后收集细胞用于RT-PCR检测,刺激24 h后收集细胞用于Western blot检测。
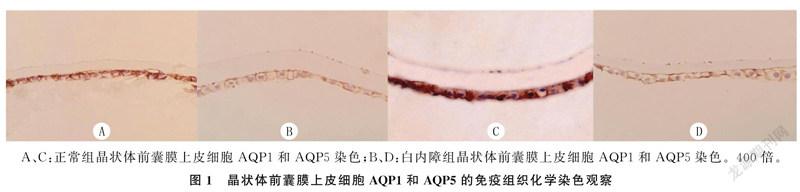
1.2.3免疫组织化学染色检测晶状体前囊膜上皮细胞AQP1和AQP5分布情况晶状体前囊膜经常规固定、脱水、透明、浸润和包埋处理以后,使用RM 2025切片机行4 μm厚切片,然后脱蜡和水合,磷酸盐缓冲液(PBS)冲洗3次。应用柠檬酸缓冲液(pH值6.0)高压修复抗原2 min后再用PBS洗片3次。37 ℃下与兔抗人AQP1和小鼠抗人AQP5一抗(1∶200稀释,美国Abcam公司)反应2 h,洗片后再与聚过氧化物酶羊抗兔/小鼠IgG二抗(上海Beyotime公司)反应30 min。用DAB试剂盒处理切片,光学显微镜下观察,当细胞膜出现棕色颗粒立即用蒸馏水冲洗,然后用苏木精复染1 min,脱水,中性香脂封片后光镜下观察并拍片。用Image-proplus软件分析AQP1和AQP5分布。
1.2.4实时荧光定量PCR(RT-PCR)检测AQP1和AQP5的mRNA表达用RNAiso Plus提取晶状体前囊膜上皮细胞和各组HLECs总RNA,按Prime Script RT reagent Kit With gDNA Eraser试剂盒说明书进行逆转录。以β-actin为内参照,应用RT-PCR仪获得循环数,计算AQP1和AQP5的mRNA表达量。实验重复3次。PCR引物及其序列由大连TaKaRa公司设计与合成。见表1。
1.2.5Western blot检测AQP1和AQP5蛋白表达用蛋白裂解缓冲液收集各组HLECs细胞蛋白[6],4 ℃、12 000 r/min离心10 min,取上清液。用BCA蛋白浓度测定试剂盒检测各样本蛋白浓度
2期李璐,等. H2O2对人晶状体上皮细胞AQP1和AQP5表达影响及其机制175
并计算上样量,经蛋白煮沸变性、电泳、转膜、PBST漂洗后,用封闭液进行2 h封闭,之后加入一抗稀释液β-actin(1∶2 000)、AQP1(1∶1 000)、AQP5(1∶1 000)(美国Abcam公司)4 ℃孵育16 h。PBST摇洗3次后加入二抗(山羊抗兔二抗1∶5 000、山羊抗鼠二抗1∶500)(美国Millipore公司)室温孵育2 h。再次用PBST摇洗3次后使用UVP凝胶成像系统显影并拍照,用Image J软件定量分析条带的灰度值,以其表示蛋白的表达量。
1.3统计学处理
使用SPSS 24.0软件进行统计学分析。计量资料数据以x±s表示,两组数据比较使用LSD-t检验;多组数据比较使用单因素方差分析(one-way ANOVA)或析因设计的方差分析。以P<0.05为差异有统计学意义。
2结果
2.1正常组和白内障组晶状体前囊膜AQP1和AQP5 mRNA表达和分布比较
正常组前囊膜上皮细胞中AQP1和AQP5的mRNA表达明显高于白内障组,差异有显著性(t=10.71、5.46,P<0.05)。免疫组织化学染色显示,与正常组相比,白内障组晶状体前囊膜中的棕色颗粒显著减少,而且细胞大小不一、形状排列不规则。见图1和表2。
2.2不同H2O2处理组间HLECs AQP1和AQP5 mRNA与蛋白表达比较
H2O2刺激HLECs所引起的AQP1和AQP5 mRNA表达下调具有浓度和时间依赖性(F浓度=80.38、436.20,F时间=46.95、175.00,F交互=7.99、17.52,P<0.01)。其中以400 μmol/L的H2O2作用最为明显,在4 h时AQP1和AQP5的mRNA表达降至最低水平(t=3.32~5.31,P<0.05)。见表3、4。在浓度为400 μmol/L的H2O2作用下,AQP1和AQP5蛋白表达下降呈时间依赖性,H2O2不同作用时间AQP1和AQP5蛋白表达差异有统计学意义(F=11.63、8.04,P<0.05),在24 h降至最低水平。见表5。
2.3MAPK抑制剂对AQP1和AQP5 mRNA和蛋白表达的影响
各组间AQP1、AQP5 mRNA和蛋白表达差异有统计学意义(F=9.81~45.34,P<0.05),与单纯H2O2处理组相比,ERK和p38抑制剂预处理显著抑制了H2O2诱导的AQP1 mRNA和蛋白表达下调(t=4.37~7.28,P<0.05),而JNK抑制剂预处理组AQP1 mRNA与蛋白的表达与单纯H2O2处理组相比差异均无统计学意义(P>0.05)。与单纯H2O2处理组相比,ERK、p38和JNK抑制剂预处理组AQP5的mRNA和蛋白表达差异无统计学意义(P>0.05)。见表6。
3讨论
白内障是一种由于晶状体混浊而影响视觉功能的疾病,主要是由与年龄有关的晶状体变性引起的[7-8]。目前,治疗白内障最有效的方式是通过手术摘除混浊晶状体并植入人工晶体(IOL)[9]。但是,手术相关的并发症依然给病人视力的恢复带来极大的挑战[10]。因此,有必要对白内障的发病机制进行进一步的研究,以期获得并发症较少的治疗方式。
目前学术界一致认为,白内障的形成主要是由氧化损伤所导致[11]。构成晶状体蛋白的一些氨基酸对氧化损伤特别敏感,如半胱氨酸、蛋氨酸和色氨酸等,它们的结构变化皆可引起蛋白质的变性,造成晶状体混浊[12]。导致体内氧化损伤的主要因素是活性氧(ROS),而H2O2是细胞中含量最丰富、最稳定的ROS[13]。
AQPs介导水在细胞膜上的被动运输,并参与维持细胞稳态[14]。既往研究结果结果表明,在哺乳动物HLECs中表达的AQPs包括AQP0、AQP1和AQP5[15],与白内障密切相关[16]。有研究表明,敲除小鼠HLECs AQP1和AQP5雖然晶状体形态和透明性没有改变,但其水渗透性比正常小鼠晶状体明显降低,并且在高糖溶液中更容易浑浊[17-18]。为研究白内障病人晶状体前囊膜上皮细胞中AQP1和AQP5的表达变化,本文收集了白内障病人和健康供体的晶状体前囊膜,应用RT-PCR和免疫组化方法进行研究,结果显示白内障组AQP1和AQP5的mRNA表达明显低于正常组,白内障组晶状体前囊膜上皮细胞的数量较正常组明显减少且排列不规则,AQP1和AQP5的分布明显低于正常组。说明AQP1和AQP5的表达下降与白内障的发生发展关系密切。
既往有研究证实,在高氧肺损伤新生小鼠的肺组织中AQP1和AQP5蛋白表达较对照组明显降低[19]。为了探讨氧化损伤对HLECs AQPs表达的影响,本研究体外培养了HLECs,并用H2O2处理模拟了氧化损伤,结果显示,H2O2的浓度越高、作用时间越长,AQP1和AQP5的mRNA和蛋白表达水平下降越明显;H2O2浓度为400 μmol/L时作用最为明显,分别在作用4 h和 24 h 时AQP1、AQP5的mRNA和蛋白表达水平降至最低。
目前,關于氧化损伤引起HLECs的AQP1和AQP5表达下调的具体机制尚不清楚。相关研究发现,MAPK通路参与视网膜氧化损伤过程中AQP1表达的调控[20]。但是,对于AQP5在晶状体氧化损伤过程中表达变化及其具体机制目前尚未见报道。MAPK是一组能够被多种细胞外刺激物激活、参与调控细胞炎症和死亡过程的丝氨酸-苏氨酸蛋白激酶。最近的研究结果表明,氧化应激也可以激活MAPK[21]。晶状体中存在的MAPK途径包括Raf-Mek-ERK、 SAPK-JNK和p38 MAPK[22]。但是,氧化应激下MAPK如何调节AQP1和AQP5的表达目前仍不清楚[23]。本文研究结果显示,HLECs经ERK和p38抑制剂处理后,H2O2介导的AQP1表达下调受到抑制,而JNK抑制剂对AQP1表达无明显影响;ERK、p38和JNK的抑制剂均对AQP5表达无显著作用。这表明在HLECs的氧化损伤过程中,MAPK途径(ERK和p38)在调节AQP1表达中起重要作用,但MAPK途径不参与AQP5的表达调控。
综上所述,白内障病人晶状体前囊膜上皮细胞AQP1和AQP5表达较正常组减少,H2O2刺激可导致HLECs中AQP1和AQP5表达下调。MAPK途径中的ERK和p38途径均介导H2O2刺激引起的HLECs中AQP1表达下调;MAPK途径(ERK、p38和JNK)不参与H2O2介导的AQP5表达变化的调控。
[参考文献]
[1]LIM J C, CABALLERO ARREDONDO M, BRAAKHUIS A J, et al. Vitamin C and the lens: new insights into delaying the onset of cataract[J]. Nutrients, 2020,12(10): E3142.
[2]BARNES S, QUINLAN R A. Small molecules, both dietary and endogenous, influence the onset of lens cataracts[J]. Experimental Eye Research, 2017,156:87-94.
[3]JING R H, MA B, QI T T, et al. Long noncoding RNA OIP5-AS1 inhibits cell apoptosis and cataract formation by blocking POLG expression under oxidative stress[J]. Investigative Ophthalmology & Visual Science, 2020,61(12):3.
[4]TIAN Y, SU Y, YE Q L, et al. Silencing of TXNIP alleviated oxidative stress injury by regulating MAPK-Nrf2 axis in ischemic stroke[J]. Neurochemical Research, 2020,45(2):428-436.
[5]DONALDSON P J, MUSIL L S, MATHIAS R T. Point: a critical appraisal of the lens circulation model: an experimental paradigm for understanding the maintenance of lens transpa-rency[J]? Investigative Ophthalmology & Visual Science, 2010,51(5):2303-2306.
[6]JIANG N, ZHAO G Q, LIN J, et al. Indoleamine 2,3-dioxygenase is involved in the inflammation response of corneal epithelial cells to Aspergillus fumigatus infections[J]. PLoS One, 2015,10(9): e0137423.
[7]ABDELKADER H, ALANY R G, PIERSCIONEK B. Age-related cataract and drug therapy: opportunities and challenges for topical antioxidant delivery to the lens[J]. Journal of Pharmacy and Pharmacology, 2015,67(4):537-550.
[8]WEIKEL K A, GARBER C, BABURINS A, et al. Nutritional modulation of cataract[J]. Nutrition Reviews, 2014,72(1):30-47.
[9]THOMPSON J, LAKHANI N. Cataracts[J]. Primary Care, 2015,42(3):409-423.
[10]CETINEL S, MONTEMAGNO C. Nanotechnology for the prevention and treatment of cataract[J]. Asia-Pacific Journal of Ophthalmology (Philadelphia, Pa), 2015,4(6):381-387.
[11]EROL TINAZTEPE ?, AY M, ESER E. Nuclear and mitochondrial DNA of age-related cataract patients are susceptible to oxidative damage[J]. Current Eye Research, 2017,42(4):583-588.
[12]HAINS P G, TRUSCOTT R J. Proteome analysis of human foetal, aged and advanced nuclear cataract lenses[J]. Proteomics Clinical Applications, 2008,2(12):1611-1619.
[13]PAULSEN C E, CARROLL K S. Orchestrating redox signaling networks through regulatory cysteine switches[J]. ACS Chemical Biology, 2010,5(1):47-62.
[14]VERKMAN A S, ANDERSON M O, PAPADOPOULOS M C. Aquaporins: important but elusive drug targets[J]. Nature Reviews Drug Discovery, 2014,13(4):259-277.
[15]BOGNER B, SCHROEDL F, TROST A, et al. Aquaporin expression and localization in the rabbit eye[J]. Experimental Eye Research, 2016,147:20-30.
[16]VARADARAJ K, KUMARI S S. Lens aquaporins function as peroxiporins to facilitate membrane transport of hydrogen pe-roxide[J]. Biochemical and Biophysical Research Communications, 2020,524(4):1025-1029.
[17]RUIZ-EDERRA J, VERKMAN A S. Accelerated cataract formation and reduced lens epithelial water permeability in aquaporin-1-deficient mice[J]. Investigative Ophthalmology & Vi-sual Science, 2006,47(9):3960-3967.
[18]SINDHU KUMARI S, VARADARAJ K. Aquaporin 5 knoc-kout mouse lens develops hyperglycemic cataract[J]. Bioche-mical and Biophysical Research Communications, 2013,441(2):333-338.
[19]岳冬梅,佟雅潔,薛辛东. 高氧致慢性肺疾病新生鼠肺组织水通道蛋白1、5的表达及其调控作用的研究[J]. 中国现代医学杂志, 2012,22(2):10-14,19.
[20]JIANG Q, CAO C, LU S, et al. MEK/ERK pathway me-diates UVB-induced AQP1 downregulation and water permeability impairment in human retinal pigment epithelial cells[J]. International Journal of Molecular Medicine, 2009,23(6):771-777.
[21]LIU X F, HAO J L, XIE T, et al. Nrf2 as a target for prevention of age-related and diabetic cataracts by against oxidative stress[J]. Aging Cell, 2017,16(5):934-942.
[22]HUANG W R, ZHANG Y, TANG X. Shikonin inhibits the proliferation of human lens epithelial cells by inducing apoptosis through ROS and caspase-dependent pathway[J]. Molecules (Basel, Switzerland), 2014,19(6):7785-7797.
[23]PAN X Y, GUO H, HAN J, et al. Ginsenoside Rg3 atte-nuates cell migration via inhibition of aquaporin 1 expression in PC-3M prostate cancer cells[J]. European Journal of Pharmacology, 2012,683(1-3):27-34.
(本文编辑黄建乡)
