冬小麦叶角质层组分对菲和芘的吸附及影响
2022-05-05王晋峰包环宇蔡军李嘉吴福勇
王晋峰,包环宇 ,蔡军 ,李嘉,吴福勇*
(1.山西农业大学生态环境产业技术研究院/土壤环境与养分资源山西省重点实验室,太原 030031;2.西北农林科技大学资源环境学院,陕西 杨凌 712100;3.农业农村部西北植物营养与农业环境重点实验室,陕西 杨凌 712100)
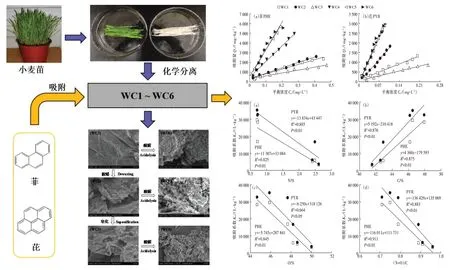
多环芳烃(PAHs)是一类典型的持久性有机污染物,由于其在自然环境中普遍存在而备受关注。煤炭燃烧是我国PAHs 排放的主要来源。最近研究发现,我国大气PAHs 浓度(115 ng·m)明显高于日本(5.76 ng·m)、韩国(19.9 ng·m)、越南(42.8 ng·m)和印度(62.3 ng·m),大气中的PAHs污染不可小觑。小麦是我国主要的粮食作物,其中冬小麦种植面积约占70%。由于冬小麦主要生长期与我国北方地区冬季采暖期高度重合,冬小麦生产面临大气PAHs 污染的威胁。小麦吸收和积累的PAHs 可以通过饮食摄入进入人体,导致潜在的健康风险。因此,探讨冬小麦叶片对大气PAHs 的吸收和富集机制对粮食安全和人体健康具有重要意义。
植物吸收PAHs 通常主要通过根系和叶面两种途径,前者主要通过根系对土壤中PAHs 进行吸收,进而转移到植物体内,后者主要通过植物地上部组织表皮对大气以及大气和土壤中沉降到植物表面PAHs进行吸收。有研究认为,在未污染土壤中,叶面吸收途径是PAHs 进入植物体的主要方式。TAO 等认为在PAHs 污染的土壤中,较高脂溶性PAHs 易与根系的有机组分结合,不易转移到地上部组织,因此冬小麦的叶面吸收是PAHs 富集的重要途径。过去的研究发现,品种、比叶面积、叶蜡含量、叶毛长度、叶孔面积及角质层结构均为影响冬小麦叶面吸收PAHs的重要因素。此外,PAHs 的理化性质也影响植物体内PAHs 的吸收、转移和积累。植物吸收的预测模型大多假设植物通过角质层摄取有机污染物。叶片角质层吸附有机物是叶面对有机物吸收的前提,只有角质层吸附足够的有机物,达到较高浓度,才能进一步被植物吸收,因此探讨PAHs 在植物角质层的吸附过程及其机理对于深入认识叶面吸收途径尤为重要。
植物角质层是由蜡质、角质、角碳和多糖等组成的膜状结构,是大气有机污染物在植物体富集的主要吸收途径,极大地影响着环境污染物的迁移转化。植物角质层蜡质组分通常被认为是有机污染物的主要储存介质。WANG 等的研究发现,PAHs 在冬小麦叶中的分布并不均匀,表皮蜡质中PAHs 含量远高于叶肉组织,蜡质含量是影响PAHs 在叶中吸收和分布的关键因素。早期的一些研究主要通过叶蜡质来预测有机污染物的含量,然而可提取脂类(蜡质)并不足以指示植物体内有机污染物的含量,角质层中较高含量的聚合脂质——角质和角碳组分也是有机污染物的高富集部位。LI 等发现,与可提取脂质(蜡质)相比,松针角质层组分中聚合脂质(角质和角碳)组分对菲和芘表现出较高的吸附能力,而纤维素则表现出较差的亲和力。LI 等报道了马铃薯、苹果、西红柿、葡萄果皮角质层组分中,蜡质和角质是吸附有机污染物的主要组分,而具有较低吸附能力的糖类组分抑制了角质层中角碳组分对有机污染物的吸附能力。过去的研究也表明,相比于其他PAHs,冬小麦叶对菲(PHenan threne,PHE)和芘(Pyrene,PYE)这两种典型PAHs 具有较强的吸收能力。目前关于角质层组分对PAHs 的吸附的研究主要集中在部分水果表皮角质层和树木叶角质层,而禾本科农作物叶角质层组分对PAHs 的吸附效应及机理尚不清楚。因此,本研究通过冬小麦叶角质层分离组分对PHE 和PYR的吸附试验,综合分析了角质层各组分的结构和元素组成对PAHs 吸附的影响机制,并比较了各组分对PHE 和PYR 的相对吸附系数。本研究将为深入了解冬小麦叶片对PAHs 沉降、吸附及其转运过程提供理论基础,对污染区冬小麦的安全生产具有重要的指导意义,同时也对准确评估大气PAHs 污染水平具有重要的参考价值。
1 材料与方法
1.1 冬小麦幼苗的培养
冬小麦(L.)种子(品种为小偃22)购自于陕西省隆丰种子有限公司。小麦种子经3%HO表面灭菌30 min、去离子水冲洗后,放入潮湿滤纸,避光(25 ℃,24 h)催芽。在装有2.5 kg 沙子(<2 mm)的塑料盆中种植12 粒催芽后种子,种子发芽后间苗至8 株。冬小麦每日浇水,保持田间持水量的60%~80%,每周施用全量的霍格兰营养液。幼苗培养于恒温温室(28 ℃/23 ℃),生长至四叶期时采集叶片,蒸馏水冲洗3次后,置于-80 ℃保存备用。
1.2 冬小麦叶角质层分离与提取
冬小麦叶角质层采用草酸-草酸铵化学分离法分离。新鲜冬小麦叶浸入4 g·L的草酸和16 g·L的草酸铵溶液中,在40 ℃下磁力搅拌至叶肉完全脱落。用去离子水彻底清洗叶表皮,除去残余叶肉及草酸铵和草酸,即获得冬小麦叶角质层。角质层60 ℃烘干粉碎后过100 目筛,不同组分提取参考KOGELKNABNER等的方法,具体流程为:将备用的原始角质层(WC1)用体积比为1∶1 的三氯甲烷和甲醇在70 ℃下索氏提取6 h,蜡质组分被去除后,得到脱蜡角质层组分(WC2),提取液用氮吹仪吹干至恒质量,得到蜡质组分(WW),60 ℃烘干后保存;脱蜡角质层于70 ℃下在含有1% KOH 的甲醇溶液中回流搅拌3 h,皂化去除角质层中聚合脂质(角质),剩余残余物使用体积比为1∶1 的甲醇和水的混合液清洗并调节pH 至中性,烘干后得到脱蜡-皂化角质层(WC3)。WC1、WC2、WC3 组 分 用 6 mol·L的 HCl 酸 解 回 流 6 h(100 ℃),去除角质层糖类组分,残留物用蒸馏水清洗至中性,烘干后分别得到脱糖角质层(WC6)、脱蜡-脱糖角质层(WC5)、脱蜡-皂化-脱糖角质层(WC4)。分离得到的7 个角质层组分(WC1~WC6,WW),样品编号及组成见表1。由于蜡质含量较少,本研究未对蜡质组分进行表征。

表1 冬小麦叶角质层各分离组分的组成及缩写Table 1 Composition and abbreviation of components isolated from cuticle of winter wheat leaf
1.3 冬小麦叶面角质层组分表征
本研究用扫描电子显微镜(S-3400N)表征了冬小麦叶角质层和分离角质层各组分的表面结构。用元素分析仪(EA3000)分析了7 种角质层分离组分中C、H、N 元素含量的百分占比。由于角质层灰分含量较低,O 元素含量根据质量守恒用差减法计算得到。基于4 种元素百分含量,经计算得到角质层组分的极性指数(N+O)/C 和 H/C 原子比,其中 H/C 原子比越大,脂肪性越大,芳香性越小。
1.4 冬小麦角质层组分吸附试验
PAHs 污染区冬小麦地上器官中 3、4 环 PAHs 占主导地位,且更易被吸收或转运,因此本研究选取PHE 和PYR 作为研究对象,其理化性质见表2。吸附剂为冬小麦叶片中7 种角质层组分(WC1~WC6,WW)。

表2 菲和芘的理化性质Table 2 The basic physicochemical properties of phenanthrene and pyrene
吸附试验具体步骤如下:为控制离子浓度和抑制微生物生长,用 0.01 mol·L的 CaCl和 200 mg·L的NaN的背景液配制系列PHE 和PYR 吸附质使用液。PHE 和 PYR 分别设置 9 个水平,PHE 浓度分别为 0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mg·L,PYR 浓度分别为0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.50 mg·L。称取定量的叶角质层组分于8 mL 的透明样品瓶中,添加不同浓度的PAHs 使用液至样品瓶中。为确保吸附去除率在30%~90%之间,根据预试验确定固液比(表3)。吸附质使用液体积为8 mL,试验设置溶质空白和溶剂空白,所有浓度处理设置2 次平行。室温(25 ℃)、避光条件下恒温振荡(100 r·min)3 d(预试验表明本研究吸附剂2 d 基本达到平衡)。然后在25 ℃下4 000 r·min离心15 min,取上清液用二氯甲烷萃取后旋转蒸发仪旋干,通过0.22µm 的有机滤膜并用甲醇交换定容至2 mL,避光储存于棕色色谱进样瓶,用于测定PAHs。PHE 和PYR 的吸附量根据溶质的起始浓度和吸附平衡浓度的差值计算,并通过平衡浓度(,mg·L)和吸附量(,mg·kg)绘制角质层组分对PAHs的等温吸附曲线。

表3 冬小麦叶角质层各组分的吸附固液比Table 3 The specific solid-to-solution ratios of sorption in cuticle of winter wheat leaf
1.5 PAHs测定
样品中的 PAHs 浓度 采 用HPLC(Shimadzu,LC-20A)联合紫外检测器(SPD-20A)和荧光检测器(PF-20A)进行分析。质量控制方法参考本课题组前期研究。
1.6 数据分析
有机污染在角质层上的吸附等温线分为线性和非线性吸附两种类型,本研究选择Linear 吸附模型和Freundlich模型对数据进行拟合。
Linear吸附模型方程:

式中:为单位吸附剂的吸附量,mg·kg;为水溶液吸附质的平衡浓度,mg·L;线性等温曲线的斜率为吸附系数,L·kg。
Freundlich 吸附模型方程:

式中:为单位吸附剂的吸附量,mg·kg;为水溶液吸附质的平衡浓度,mg·L;为 Freundlich 吸附系数,为无量纲的等温吸附曲率。
用有机碳含量标化计算有机碳标化的吸附系数:

式中:为冬小麦叶片角质层各组分C 含量的百分占比。并计算了/的值,为有机碳标化辛醇-水分配系数:

式中:为辛醇-水分配系数;为辛醇的C 含量,为73.8%。
通过各组分的产率及吸附系数间接计算了角质组分的吸附系数,公式如下:
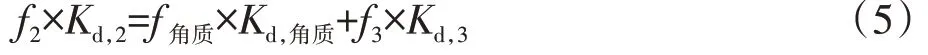
式 中 :、、分 别 表 示 脱 蜡 角 质 层 组 分(WC2)、脱蜡-皂化角质层组分(WC3)和角质的吸附系数,、、表示相应各组分的产量。
2 结果与讨论
2.1 冬小麦叶角质层不同组分表面结构特征
冬小麦叶角质层不同分离组分表面微构型如图1 所示。原始角质层(WC1)表面为较为光滑的平面,这是角质层表面蜡质分布的体现。脱蜡处理后角质层表面蜡质大部分被去除,因此脱蜡角质层(WC2)表面呈现明显的凹陷结构。皂化去除角质组分后,角质层组分变薄并裸露出大量的角质钉(WC3)。去蜡-皂化角质层(WC3)经酸解去除多糖后,部分角质骨架结构消失,角碳组分(WC4)部分破碎为零碎的颗粒状。这说明角质层中角碳组分分布并不连续,其间隙被多糖类物质包裹,使其与外部环境隔离。然而WC1和WC2 酸解去多糖后,角质层组分(WC5 和WC6)骨架并未被明显破坏,且WC5 表现出较为完整的结构,意味着角质层中角质组分的分布较为连续。从图1也可看出,WC1 和WC6 结构的蜡质组分较为丰富,而WC5与WC2的表面结构较为相似,这表明角质层内角质和蜡质相对独立,酸解脱糖过程对角质和蜡质结构均无显著破坏作用。

图1 冬小麦叶角质层各组分的电镜扫描图Figure 1 SEM images of cuticle composition in winter wheat leaf
2.2 冬小麦叶角质层化学和元素组成特征
冬小麦叶角质层各组分含量存在明显差异,单一组分百分含量按糖类、角碳、角质、蜡质的顺序依次降低(表4)。通常认为,角质层丰富的脂质是植物富集有机污染物的主要原因。然而传统的脂肪测定方法为有机溶剂提取,即本研究中的“可提取脂质”,冬小麦叶角质层中“可提取脂质”(蜡质)的百分含量为9.60%,高于松针(5.3%)和番茄(6.3%)角质层蜡质含量,而远低于马铃薯(13.4%)、葡萄(25.1%)和苹果(44.7%)。除“可提取脂质”外,植物角质层组分中还存在一类不溶于有机试剂但可通过皂化解聚的“聚合脂质”,即角质。冬小麦叶角质层中角质含量的百分占比为12.53%,其含量是蜡质的1.3 倍(表4),这与松针角质层角质含量(11.5%)相当,但远低于柑橘叶(47%)和龙舌兰叶(46%)角质层角质含量。过去的研究表明,在使用经典脂肪模型预测黑麦草和大麦根系吸收有机污染物时,预测值远低于实测值,这可能是由于聚合脂质不能被提取。除丰富的脂质组分外,植物角质层中还含有一类不能被皂化提取的高聚物,即角碳。冬小麦叶角质层中角碳含量为26.03%,远高于马铃薯(21.2%)、葡萄(16.0%)和苹果(7.5%)角质层角碳含量,但低于松针(35.2%)角质层角碳含量。这可能与叶、水果周皮以及松针角质层碳骨架的丰富程度有关。这类聚合物具有较强的生物和化学稳定性,是土壤稳定的碳源,也是土壤有机质的重要组成。此外,糖类是冬小麦叶角质层的主要组分,其含量为51.44%,低于木屑、竹叶和根系(60%~99%),与松针(47.9%)、马铃薯(43.8%)和柑橘叶(40%)角质层糖类含量相当,且分别是龙舌叶(19.0%)和苹果(13.2%)角质层糖类含量的2.7倍和3.9倍。
冬小麦原始角质层(WC1)的C 含量为42.55%(表 4),明显低于松针(50.23%)、马铃薯周皮(47.44%)、葡萄(60.07%)、番茄(63.45%)和龙舌兰叶(67.00%)角质层C 含量。这种差异可能是由于植物种类不同,导致角质层组成差异。冬小麦角质层各组分(WC1~WC6、蜡质和角质)的H/C 在1.41~2.30之间,均表现出较强的脂肪性,且冬小麦叶原始角质层的 H/C 为1.81,高于水果角质层的比值。叶各角质层组分极性大小次序依次为:角质(0.58)<角碳(0.79)<蜡质(1.04)<糖类(1.06)。除角质外,其余组分的(N+O)/C 原子比在0.71~1.06 之间。此外,随着角质层蜡质和聚合脂质的逐步去除(WC1~WC3),C 含量逐渐降低,而O 含量逐渐增加,极性指数逐渐增加,芳香性逐渐增强。酸解脱糖后(WC3~WC4),C含量急剧增加,而O 含量急剧下降,芳香性增加。在各角质层组分中,糖类的C 含量最低,为39.18%,O 含量较高,为51.22%,极性指数最大[(N+O)/C 为1.06],而角碳(WC4)的芳香性较强(H/C 为1.41)。随着冬小麦叶角质层脂质的逐步去除,糖含量逐渐增加,极性指数逐渐增加,这也说明C含量影响着角质层组分的极性大小,LI等也发现角质层的极性指数差异与其糖含量呈正相关关系。
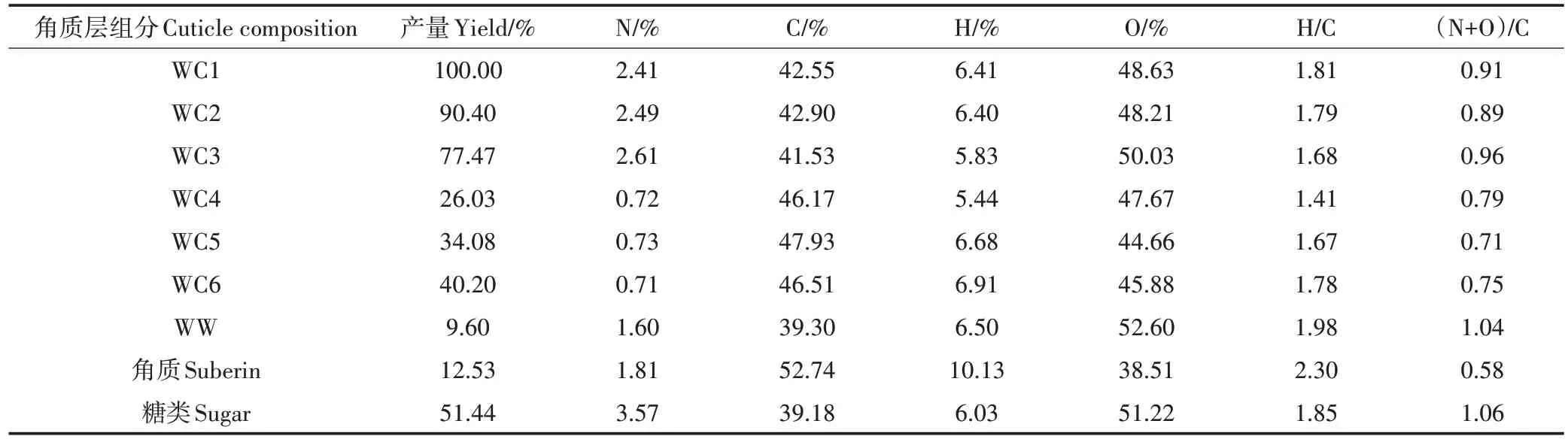
表4 冬小麦叶角质层组分的C、H、N、O元素组成及原子比Table 4 The elemental analysis and atomic ratios in cuticle composition of wheat leaf
2.3 冬小麦叶角质层对PHE和PYR的吸附
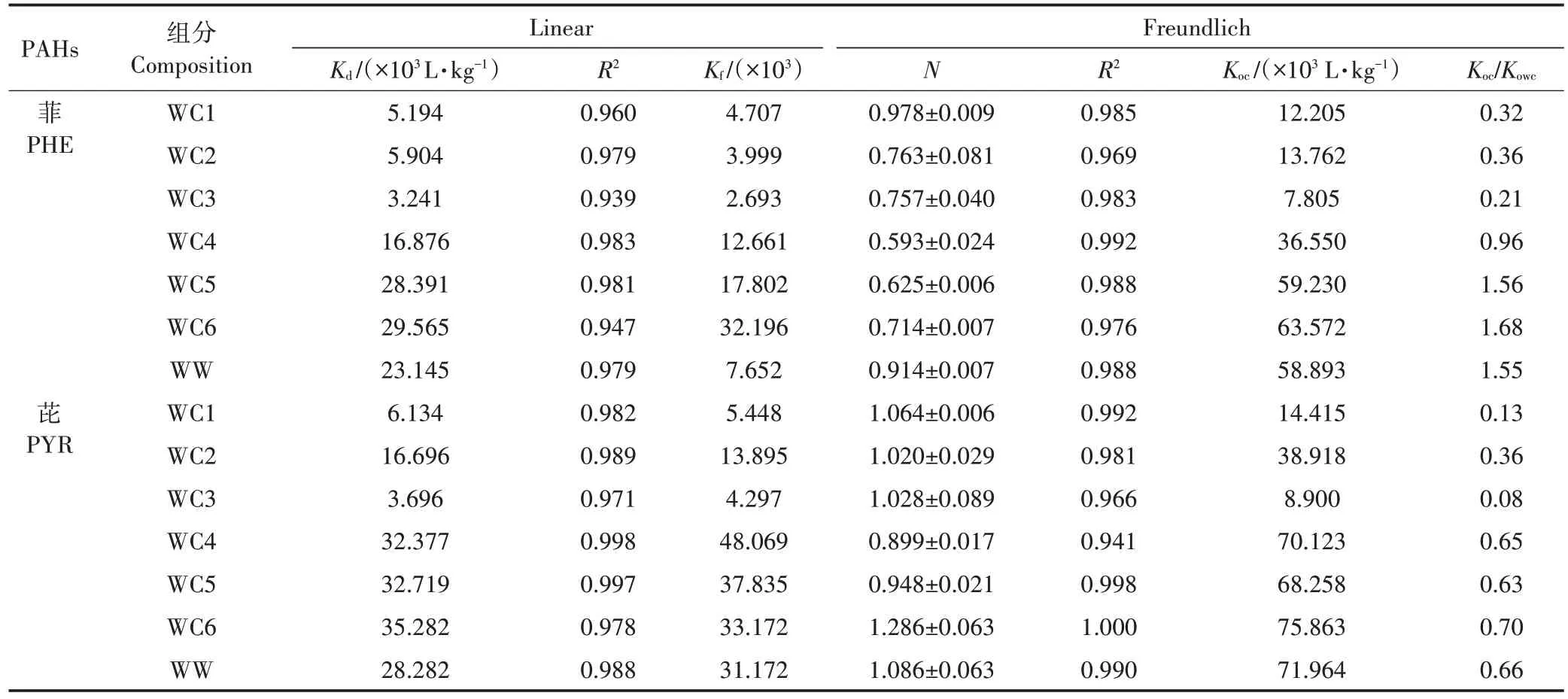
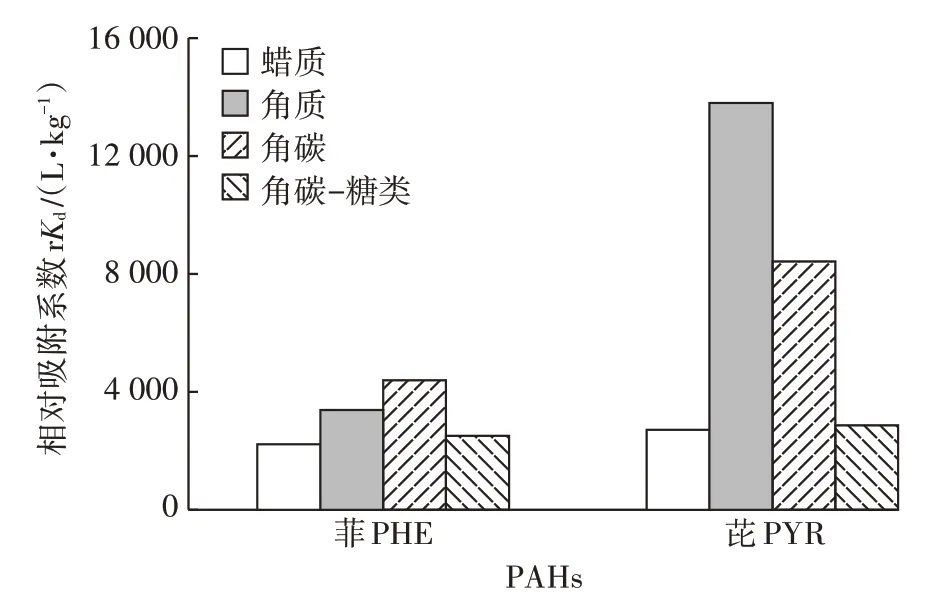
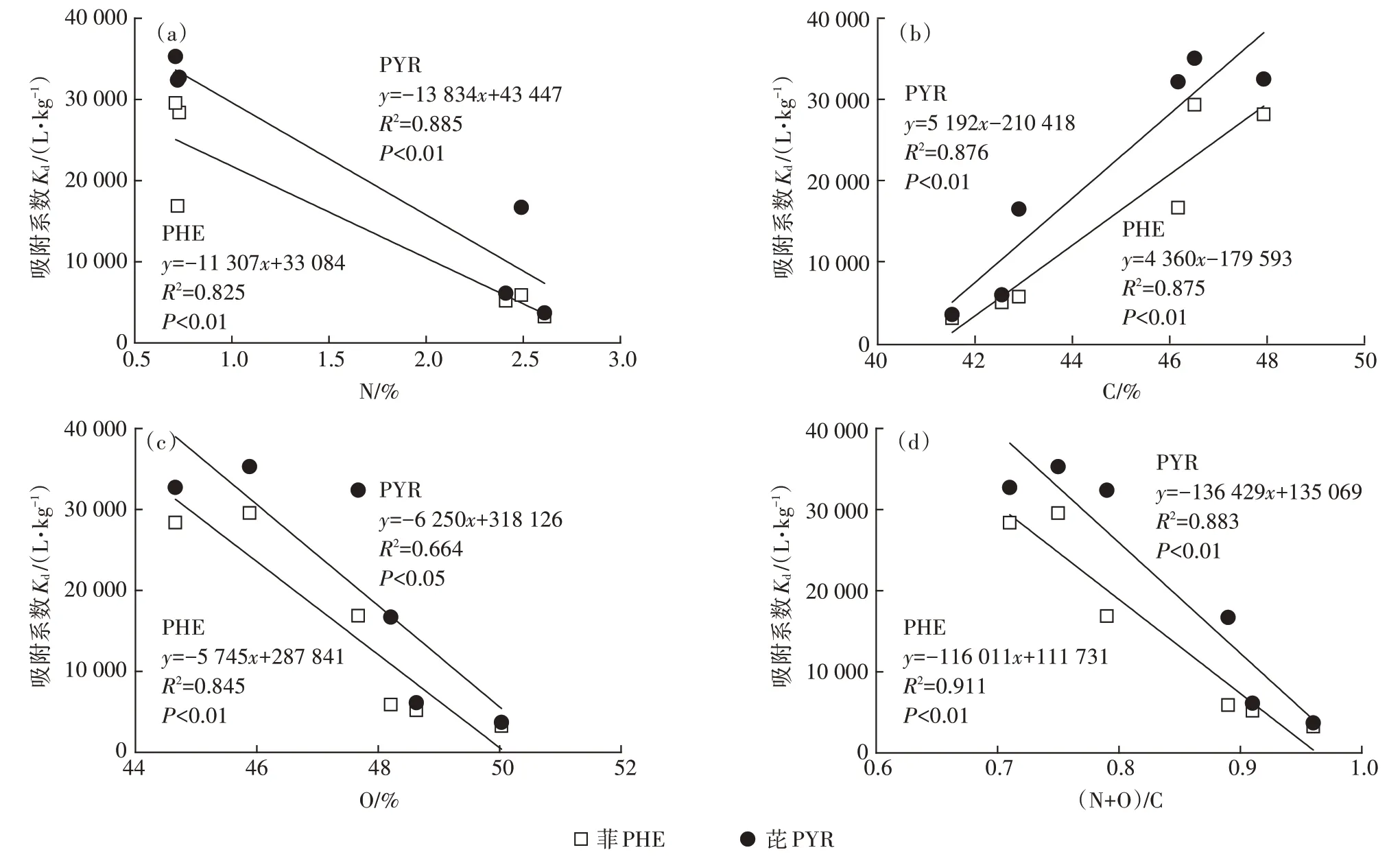
图2 为冬小麦叶7 种角质层组分对PHE 和PYR的等温吸附曲线,其两种吸附模型的回归参数见表5。冬小麦各角质层组分对PHE(=0.593~0.978)和PYR(=0.899~1.286)的吸附曲线均展示了良好的线性关系,表明PHE 和PYR 在角质层各组分间的吸附以分配作用为主。冬小麦叶原始角质层(WC1)对PHE 和 PYR 的分 别 为 5.194×10L·kg和 6.134×10L·kg,其对PHE 的与松针角质层的(6.660×10L·kg)相当,但远低于果实角质层和马铃薯周皮的(1.623×10~5.395×10L·kg),略高于柳枝稷根部组织(3.974×10L·kg)。有研究表明,果实角质层的吸附性能比松针叶角质层要高出4~6 倍。RIE⁃DERER 等发现,果实角质层对2,4-二氯苯氧乙酸的平均分配系数比叶角质层高50%。冬小麦叶角质层组分对PHE 和PYR 较低的可能与其相对较高的糖类含量(51.44%)有关(表3)。有研究显示,松针各角质层组分对PHE 的与多糖含量之间存在显著的负线性关系(=-1 351+73 965,=0.99)。此外,冬小麦叶原始角质层对PYR 的高于PHE,这可能是由于PYR 的辛醇水分分配系数()大于PHE。有研究发现松针角质层对PAHs 的与呈正相关关系,且其值表现为 NAP(6.86×10L·kg) 图2 冬小麦叶角质层组分对PHE和PYR的等温吸附曲线Figure 2 Sorption isotherms of PHE and PYR by cuticle composition of winter wheat leaf 如表5 所示,冬小麦叶角质层组分WC1~WC3 对PHE 和PYR 的等温吸附曲线均呈线性,酸解后等温曲线的非线性增强,这可能是由于酸解后糖类被去除,而被糖类包裹的角碳暴露出来影响PAHs 的吸附。角碳(WC4)对PHE 和PYR 的等温吸附曲线的非线性最强(=0.593和0.899),这主要是由于角碳中芳香碳较为丰富,且更易与PHE 和PYR 发生特殊的ππ 吸附作用。冬小麦叶角质层脱蜡后吸附性能有所增加,PHE 和PYR 的分别增加了13.7%和172.2%。其中蜡质对 PHE 和 PYR 的分别为 2.315×10L·kg和2.828×10L·kg,可能是由于角质层中除“可提取脂质”外还存在一类高吸附组分。因此,仅仅利用可提取脂质对有机污染物的吸附进行预测可能会低估有机污染物在植物体内的富集能力及风险。冬小麦叶角质层皂化后对PHE 和PYR 的吸附性能急剧降低(下降了45.1%和77.9%),这主要是由于皂化去除的聚合脂质角质是脱蜡角质层中的主要吸附介质。经计算发现,冬小麦叶角质对PHE 和PYR 的分别为 2.71×10L·kg和 1.104×10L·kg,且显著高于蜡质的吸附性能,是其的1.2 倍和3.9 倍。SHECH⁃TER 等也发现番茄表皮中角质组分对PHE 具有较高的亲和性,可能是由于这类生物聚合物中有较高水平的无定形石蜡,为PHE 与角质中的柔性长烷基链基团之间的疏水作用提供了分配介质。冬小麦叶角质层中角质组分对PHE 的吸附性能相比于苹果(9.004×10L·kg)和松针(3.6×10L·kg)角质层较弱,可能与植物角质层中角质的化学组成有关,这也导致在皂化去角质后吸附性能急剧下降。酸解去糖后各角质层组分的吸附性能呈现显著增强趋势,其中脱蜡-皂化-脱糖组分(WC4)对PHE和PYR的增加幅度最高,较WC3 分别增加了4.2 倍和7.8 倍;脱蜡-脱糖组分(WC5)较WC2 增加了3.8 倍和1.0 倍;脱糖角质层(WC6)较WC1增加了4.7倍和4.8倍(表5)。此外,脱蜡-皂化组分的吸附性能最差,可能是由于其主要由糖类和角碳组成。过去研究表明,糖类比脂肪对疏水性有机物的吸附能力弱。然而,冬小麦角质层中角碳(WC4)对PHE 和PYR 表现出较强的吸附性能(=1.688×10L·kg和3.238×10L·kg,表5)。其中角碳对PHE 的略低于苹果(2.04×10L·kg)、葡萄(1.857×10L·kg)和松针(3.314 ×10L·kg),这可能是由于角碳被角质层糖类包裹,阻挡其与PAHs 的接触,掩盖了角碳的吸附潜力,从而抑制了脱蜡-皂化后的组分(WC3)中角碳的吸附性能。酸解后各角质层组分的吸附能力均有所增强,其原因可能是酸解去除糖类后,吸附性能较弱的多糖被去除,吸附性能较强的角碳暴露出来,同时,SEM显示在酸解后暴露出裸露的角质钉也证实了这一点。综上所述,冬小麦叶角质层中可提取脂质蜡质和聚合脂质角质是PAHs的主要储存部位,且PHE 和PYR 在角质的分布远大于在蜡质的分布。角质层多糖组分的吸附性能最差,被它们包裹着的角碳组分的吸附潜力受到抑制。 表5 冬小麦叶角质层组分对PAHs等温吸附曲线的回归参数Table 5 Sorption regression parameters of PAHs by cuticular fractions of wheat leaf 如图3 所示,蜡质、角质和角碳-糖类复合体对PHE 和 PYR 的相对吸附系数(r,r=fK,式中:f为各组分产率,为各组分的吸附系数)之和(8.12×10L·kg和 1.938×10L·kg)远高于原始角质层(WC1)的相对吸附系数(5.194×10L·kg和 6.134×10L·kg),这是由于这些组分间稳定的结构组成使各组分的吸附性能未能表现出来。其中4 种组分对PHE 的相对吸附系数大小顺序为角碳>角质>角碳-糖类复合体>蜡质,而对PYR 的相对吸附系数大小顺序为角质>角碳>角碳-糖类复合体>蜡质,这也说明角质和角碳具有较高的吸附PAHs 的能力。角碳对PHE 和PYR 的相对吸附系数是角碳-糖类复合体的1.7 倍和2.9 倍。此外,蜡质在4 种组分中对PHE 和PYR吸收贡献较低,这主要是由于角质层蜡质含量较低。因此,在冬小麦叶角质层中角质和角碳是PAHs的主要储存介质,而蜡质的吸附贡献最低,用蜡质中含量指示有机污染物含量会远远低估其在植物体内的分布水平及暴露风险。 图3 冬小麦叶角质层组分对菲和芘的相对吸附系数Figure 3 The relative sorption coefficient of phenanthrene and pyrene to the cuticle composition of winter wheat leaf 冬小麦叶角质层组分中O含量与其对PAHs的值呈现显著负线性关系(PHE:=0.845,<0.01;PYR:=0.664,<0.05),然而C 含量与呈现显著正线性关系(PHE:=0.875,<0.01;PYR:=0.876,<0.01)(图4)。这表明随着角质层组分C 含量的增加,其对PAHs 的吸附性能也随之增加,而较高的O 含量可能抑制了其对PAHs 的吸附。角质层组分的极性指数(N+O)/C 与其对 PHE 和PYR 的也呈显著的负线性关系(=0.911,<0.01;=0.883,<0.01)(图4),这也说明极性越大,角质层对PAHs 的吸附性能越弱。李怀江等也发现天然沸石负载的基团非极性越强,对甲醛的吸附量越大,反之,沸石负载的基团极性越强,对甲醛的吸附量越小。此外,周丹丹的研究显示秸秆碳质对水中硝基苯的Freundlich 拟合指数与其芳香性(H/C)也呈良好的线性正相关,而回归参数()与H/C 呈良好的线性负相关。然而,本研究并未发现类似的相关性,这可能是PHE 和PYR与硝基苯的极性和芳香性/脂肪性差异导致的。 图4 冬小麦角质层吸附系数与N、C、O含量及(N+O)/N的线性关系Figure 4 Linear relationship between adsorption coefficient of cuticle in wheat leaf and N,C,O content and(N+O)/C (1)冬小麦叶角质层中除可提取脂质蜡质外,还含有丰富的聚合脂质角质,其含量是蜡质的1.3 倍。角质层中角碳并非连续分布,而角质的分布较为连续。其非极性组分主要是角质,极性组分主要是糖类。随着脂质的去除,多糖含量增加,极性增加,芳香性增强,角碳组分的芳香性最强。 (2)冬小麦叶角质层对芘和菲均表现出较强的吸附性能,且主要为分配作用,由于菲具有较高的疏水性,角质层组分对菲的吸附系数高于芘。角质层中角质和角碳组分是多环芳烃(PAHs)的主要存储介质,糖类组分与PAHs 的亲和力最差。由于冬小麦叶角质层中的蜡质含量较低,蜡质对PAHs 的吸附贡献也较低。 (3)角质层组分的元素组成是影响吸附性能的关键因素,随着碳含量增加,吸附性逐渐增强,随着氧含量和极性指数的增加,吸附性能减弱。这对污染区冬小麦生产过程中冬小麦品种的选择提供了理论依据。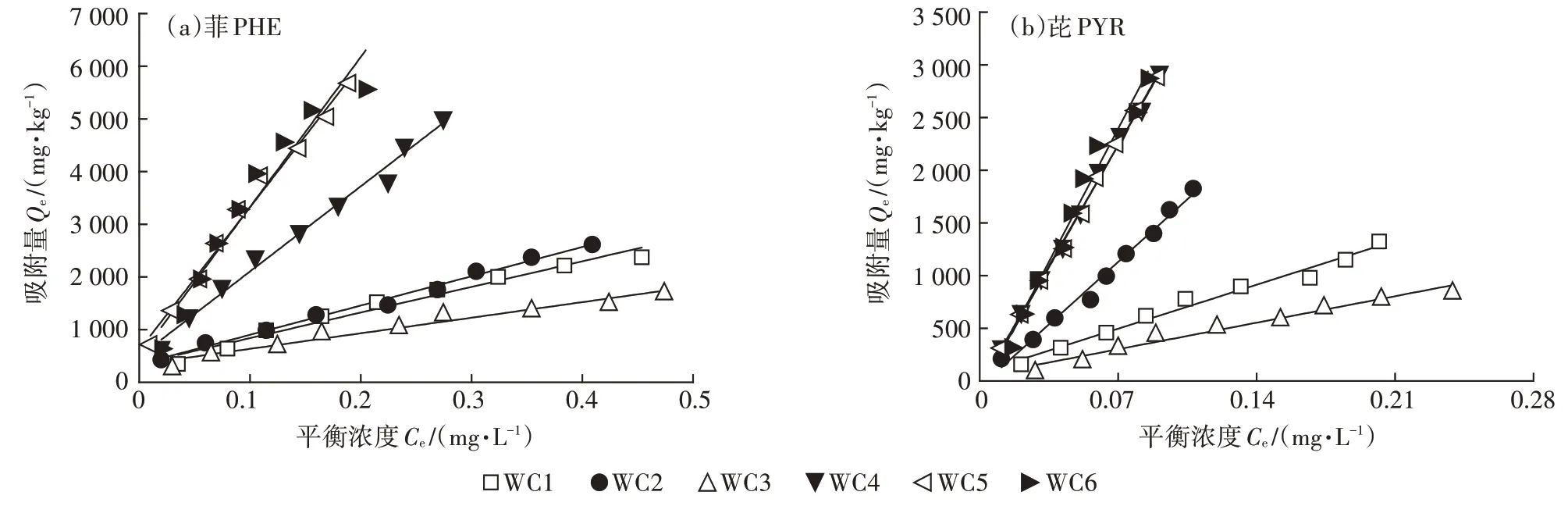
2.4 冬小麦叶角质层分离组分对PHE和PYR的吸附
2.5 冬小麦叶角质层组分性质对PAHs吸附的影响
3 结论
