刺玫果不同醇提物对降糖酶活性影响及其加工稳定性
2022-04-29吴小杰
符 群,吴小杰
(1.东北林业大学 林学院,黑龙江 哈尔滨150040;2.黑龙江省植物资源利用重点实验室,黑龙江 哈尔滨 150040)
刺玫果Rosa davurica也被称为野蔷薇果、玫瑰果,为蔷薇科Rosaceae 蔷薇属Rosa植物,资源产量丰富,在内蒙古、东北和山东沿海地区大量生长,一般集中在海拔1 000~1 750 m 之间的阳坡和阴坡[1]。刺玫果果肉加热后口感甘甜,可制作果酱、复合饮料等产品,含有多种功效成分,市场前景广阔。研究发现刺玫果的有效成分主要包括黄酮类、多酚类、皂苷类、多糖类、单宁类等化合物,其中研究最多的是黄酮类化合物。作为一种药食同源的食源性植物,刺玫果具有很高的营养及药用价值,通过精深加工,可获得较高附加值的产品,具有抗衰老、预防心脑血管疾病、免疫调节、抗疲劳、降血脂血糖等功能[2],《中药大词典》[3]中记载其具有健脾调气、养血调经的功效。
糖尿病是一种由遗传、环境等因素引起的以持续性高血糖为特征的代谢性疾病[4]。α-葡萄糖苷酶和α-淀粉酶可水解α糖苷键、α螺旋式直链淀粉为葡萄糖、麦芽糖等,促进小肠消化吸收,进而引起餐后血糖水平升高[5],因此抑制α-葡萄糖苷酶和α-淀粉酶活性可有效调节高血糖。目前,市面降糖药物多为合成类降糖药物,一些天然产物类降糖剂可通过改变α-葡萄糖苷酶和α-淀粉酶的构象,导致催化活性降低,并具有无毒副作用、来源广泛且疗效稳定的独特优势,越来越受到研究者的关注与社会的重视[6]。
刺玫果活性成分性质不稳定,除受自身结构的影响外,不同加工和储藏因素也会不同程度地降解、氧化或聚合成新物质而改变其性质,导致其生物活性降低、稳定性难以控制[7],限制了刺玫果在精深度加工中的应用。
目前刺玫果正在作为一种天然保健药物被日益重视和广泛开发,而关于刺玫果抑制α-葡萄糖苷酶和α-淀粉酶活性以及活性成分稳定性方面的报道较少。本研究从不同体积分数乙醇提取入手,初步测定刺玫果中主要活性成分及其对α-葡萄糖苷酶、α-淀粉酶的抑制作用,通过研究温度、光照、pH 值和金属离子等常见食品加工条件对其稳定性的影响,以期为刺玫果的加工保藏以及进一步开发利用提供理论基础。
1 材料与方法
1.1 材料与主要试剂
刺玫果鲜果:黑龙江省萝北县林业局提供。
试剂:α-葡萄糖苷酶(700 000 U/mL)、4-硝基苯基-α-D-吡喃葡萄糖苷(PNPG)、α-淀粉酶(5 000 U/g)、没食子酸标准品(≥98%)、芦丁标准品(≥98%)、阿卡波糖:上海源叶生物科技有限公司;葡萄糖、Al(NO3)3、NaOH、Na2CO3等均为国产分析纯。
1.2 主要仪器
T6 新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司);酶标分析仪(EPOCH12):BioTek Instruments,Inc;紫外辐射仪(北京五环通达科技有限公司)。
1.3 试验方法
1.3.1 刺玫果不同醇提物制备
鲜刺玫果清洗去杂,40℃烘干粉碎,过60目筛,按质量体积比1∶2 条件,石油醚浸泡2 h,按质量体积比1∶10 条件分别加入30%、50%、70%、90%乙醇,80℃水浴浸提2 h,减压抽滤,收集滤液,滤渣再次浸提,合并两次提取液,真空浓缩得乙醇提取物,冷冻干燥,-20℃保存备用。
1.3.2 刺玫果不同醇提物主要活性成分含量分析
1)黄酮含量测定
称取芦丁标准品0.005 g,60%乙醇定容于25 mL 容量瓶中,准确吸取不同浓度芦丁标准品于10 mL 具塞试管,分别加5% NaNO2溶液0.3 mL,放置6 min,加10% Al(NO3)3溶液0.3 mL,放置6 min,加入10% NaOH 溶液4 mL,补水至刻度线,摇匀放置15 min,以等量蒸馏水按同样显色操作为空白,于510 nm 处测定吸光度,以芦丁浓度(mg/mL)为X 轴,吸光度为Y 轴绘制标准曲线[8-9]:y=6.88x-0.004 7,R2=0.999 1。按式(1)计算醇提物黄酮含量。

式(1)中:C1为样液黄酮质量浓度(mg/mL);V1为样液体积(mL);N1为稀释倍数;M1为样品质量(g)。
2)多酚含量测定
称取0.025 g 没食子酸标准品,60%乙醇定容至25 mL 容量瓶,吸取不同浓度标品溶液于25 mL 容量瓶并定容。吸取0.5 mL 稀释液,加2.5 mL 10%福林酚试剂、7 mL 7.5% Na2CO3溶液,摇匀避光反应30 min,以等量蒸馏水按同样显色操作为空白,于760 nm 处测定吸光值,以没食子酸浓度(mg/mL)为X 轴,吸光度为Y 轴绘制标准曲线[10]:y=0.069x+0.001 7,R2=0.999 1,按式(2)计算醇提物多酚含量。
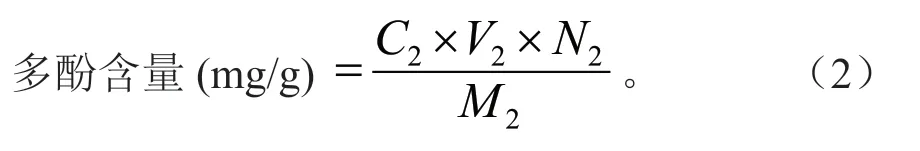
式(2)中:C2为样液总酚质量浓度(mg/mL);V2为样液体积(mL);N2为稀释倍数;M2为样品质量(g)。
3)多糖含量测定
称取无水葡萄糖对照品0.002 5 g定容于250 mL容量瓶,取对照品溶液0.0、0.2、0.4、0.6、0.8 mL 并补水至2.0 mL,加6%苯酚溶液1 mL,摇匀,贴壁缓慢加入浓硫酸5 mL,摇匀放置10 min,于40℃水浴15 min 后冷却至室温,以等量蒸馏水按同样显色操作为空白,于490 nm 处测定吸光度,以葡萄糖浓度(mg/mL)为X 轴,吸光度为Y 轴绘制标准曲线[11]:y=0.296 6x+0.006 2,R2=0.999,按式(3)计算醇提物多糖含量。
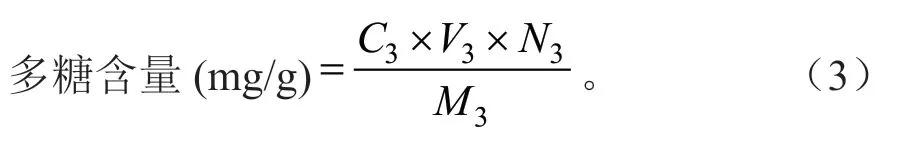
式(3)中:C3为样液多糖浓度(mg/mL);V3为样液体积(mL);N3为稀释倍数;M3为样品质量(g)。
1.3.3 酶活性抑制率的测定
1.3.3.1α-葡萄糖苷酶的抑制活性测定
取配置好的样品溶液100 μL 于96 孔板,加0.5 mg/mL 的PNPG 溶液40 μL,pH 值为6.8 的0.1 mol/L 磷酸盐缓冲溶液50 μL,37℃水浴10 min,加入10 μL 2 800 U/mLα-葡萄糖苷酶溶液,37℃孵育20 min 后,加入0.2 mol/L 的Na2CO3溶液40 μL终止反应,震荡混合均匀,于405 nm 波长处测定吸光度[12-13],按公式(4)计算抑制率:

式(4)中:Ab为待测液与酶反应的吸光度;Ac为只有待测液反应的吸光度;Ad为等量磷酸盐缓冲溶液与酶反应的吸光度;Ae为只有磷酸盐缓冲溶液反应的吸光度。
1.3.3.2α-淀粉酶的抑制活性测定
取配置好的样品溶液80 μL 于96 孔板中,加入0.1%可溶性淀粉20 μL,10 U/mLα-淀粉酶溶液20 μL,震荡混合均匀,在37℃条件下孵育10 min 使酶活化,加入0.4 mol/L HCl 50 μL,I2(KI)溶液70 μL 终止反应,于600 nm 波长处测定吸光度[14],按公式(5)计算抑制率:
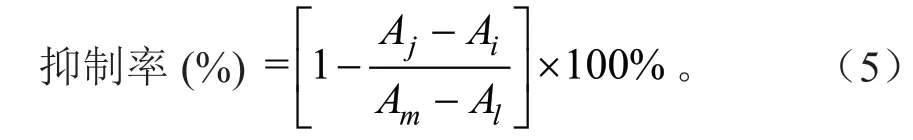
式(5)中:Ai为待测液与酶反应的吸光度;Aj为只有待测液反应的吸光度;Al为等量磷酸盐缓冲溶液与酶反应的吸光度;Am为只有磷酸盐缓冲溶液反应的吸光度。
两种酶的活性抑制实验均以阿卡波糖作为阳性对照,制作标准曲线。
1.3.4 刺玫果醇提物稳定性研究
对降糖酶抑制效果较好的刺玫果醇提物进行加工稳定性研究,分别考察以下4 因素:(1)温度的影响:将醇提液分别置于30、50、70、90℃条件下避光保温2 h。(2)光照影响:醇提液置于室内自然光照下5 天,每隔1 天取样测定;50 w 紫外光照(320~400 nm)下60 min,每隔10 min 取样测定。(3)pH 值的影响:使用pH 值为2.0、4.0、6.0、8.0、10.0、12.0 的溶液配制刺玫果提取物溶液。(4)金属离子的影响:使用浓 度 为1.0、3.0、5.0、7.0、9.0 mmol/L 的Na+、K+、Mg2+、Cu2+配置一定质量浓度的醇提液,室温静置2 h。分别在以上不同因素条件下测定刺玫果醇提物黄酮、多酚以及多糖含量[15-16],并分析刺玫果醇提物稳定性的变化。
1.4 数据处理
采用Excel 2016、Origin 8.6 软件进行数据分析及绘图、SPSS 20.0 软件进行数据处理。
2 结果与分析
2.1 刺玫果不同醇提物对降糖酶活性的抑制作用
碳水化合物水解为葡萄糖的关键酶是以α-葡萄糖苷酶和α-淀粉酶为主,提高这两种酶的抑制率,减少水解淀粉和低聚糖含量,将有助于降低餐后高血糖水平[17]。如图1所示,刺玫果醇提物对α-葡萄糖苷酶的抑制作用,以阿卡波糖为对照(IC50为0.12 mg/mL),醇提物对α-葡萄糖苷酶抑制率表现为70%(IC50为1.91 mg/mL)>50%(IC50为2.46 mg/mL)>30%(IC50为2.64 mg/mL)>90%(IC50为3.05 mg/mL)。刺玫果醇提物对α-淀粉酶抑制率均呈现逐渐上升的线性关系,70%醇提物抑制α-淀粉酶的IC50值(10.561 mg/mL)略低于50%的IC50值(10.212 mg/mL),与刺玫果醇提物对α-葡萄糖苷酶活性影响相比,醇提物对α-淀粉酶的抑制活性较弱,可能是刺玫果醇提物结构中具有更有利于与α-葡萄糖苷酶活性位点结合的基团,而抑制α-淀粉酶时,这种优势似乎不是特别明显[18]。
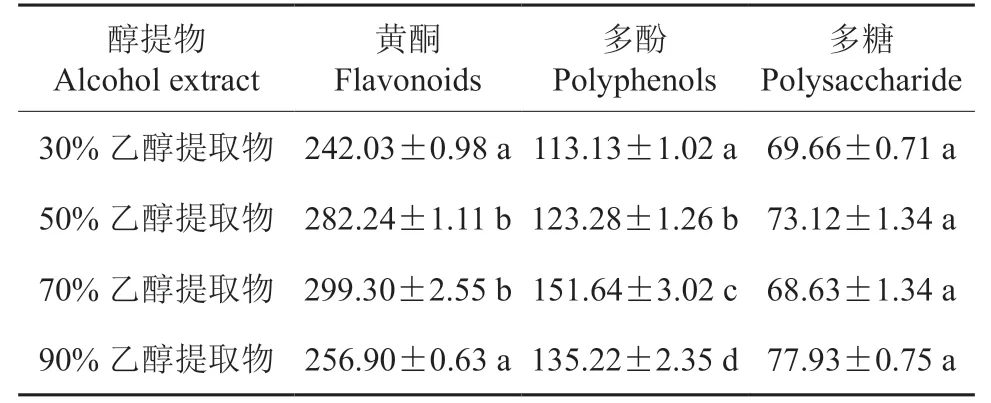
表1 刺玫果不同醇提物的主要活性活性成分含量†Table 1 Content of main active components in different alcohol extracts of Rosa davurica mg·g-1
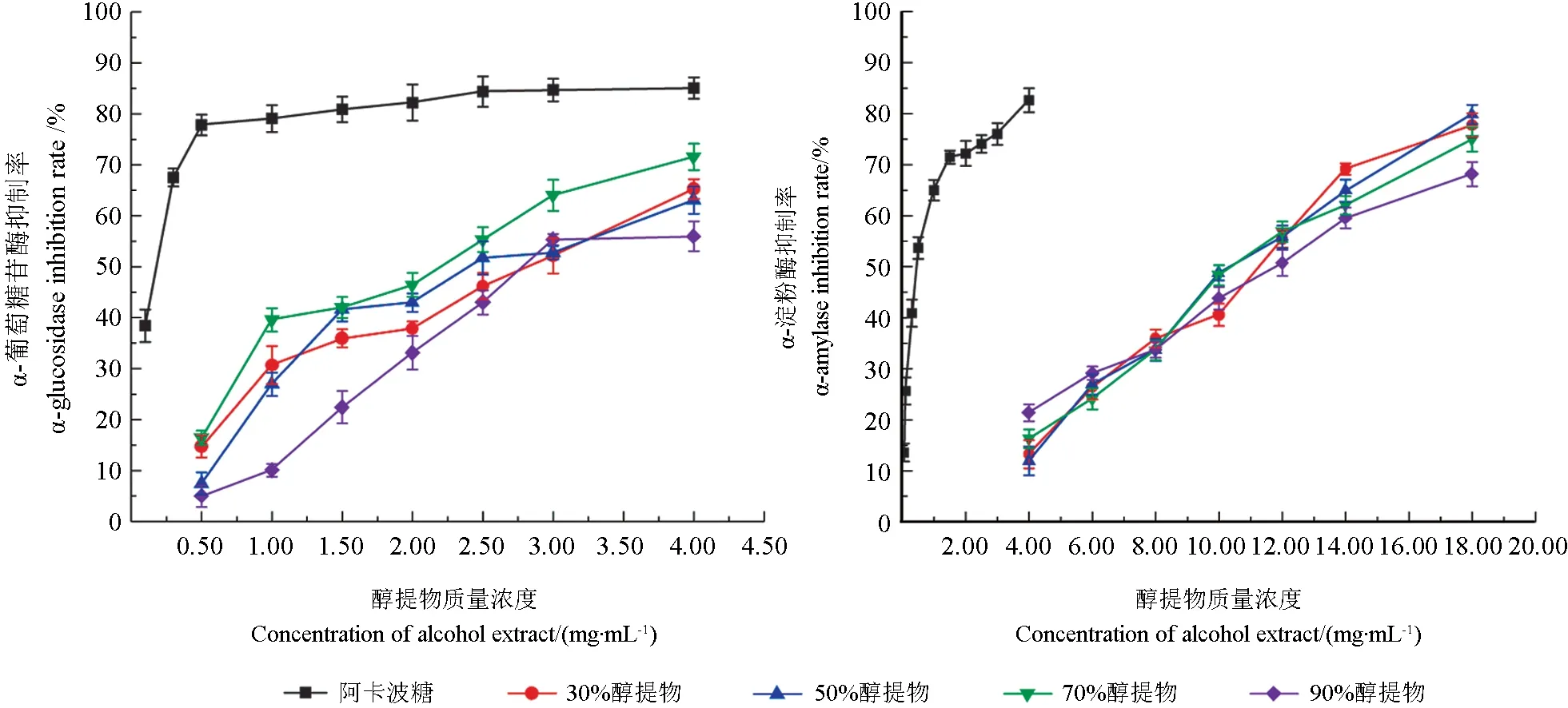
图1 刺玫果不同醇提物对降糖酶活性的影响Fig.1 Effects of different Rosa davurica alcohol extracts on the activity of hypoglycemic enzymes
杨文娟等[19]用70%乙醇回流提取得到醇提物有一定的抗α-葡萄糖苷酶活性。刘燕[20]以不同浓度乙醇提取得到的细叶韭花中有效成分与α-葡萄糖苷酶抑制作用之间具有良好的线性关系。与相似研究对比发现,刺玫果作为一种天然产物活性物质,具有开发成为降糖药物的潜力。
综合考虑,选取70%刺玫果醇提物作为加工稳定性的研究对象。
2.2 温度对刺玫果醇提物稳定性影响
温度对刺玫果醇提物稳定性的影响如图2所示,温度对刺玫果醇提物活性物质含量影响显著(P<0.05)。不同加热温度条件下,随着加热温度不断升高,活性物质含量呈下降趋势,稳定性逐渐减弱。刺玫果醇提物黄酮、多酚含量在50℃以下时稳定性较好,无显著性差异(P>0.05),这可能是因为此温度条件下氧化酶的活性较弱,减少多酚类物质氧化后醌类物质的形成,从而抑制了刺玫果活性物质的分解速率[10],醇提物多糖在30~70℃范围内无显著性差异(P>0.05);在相同时间内,随着温度的升高,90℃处理条件对刺玫果醇提物活性物质含量影响显著(P<0.05),刺玫果醇提物黄酮、多酚和多糖含量较30℃时分别下降了25.3%、13.67%和33.92%。随着处理温度的上升,刺玫果醇提物活性物质的化学结构不断被破坏,加速活性物质分解,显色物质花色苷在高温下不断被氧化,导致其稳定性有所降低[21]。综上所述,以刺玫果深加工产品应于50℃以下条件储藏和加工,以保护刺玫果中的活性成分。
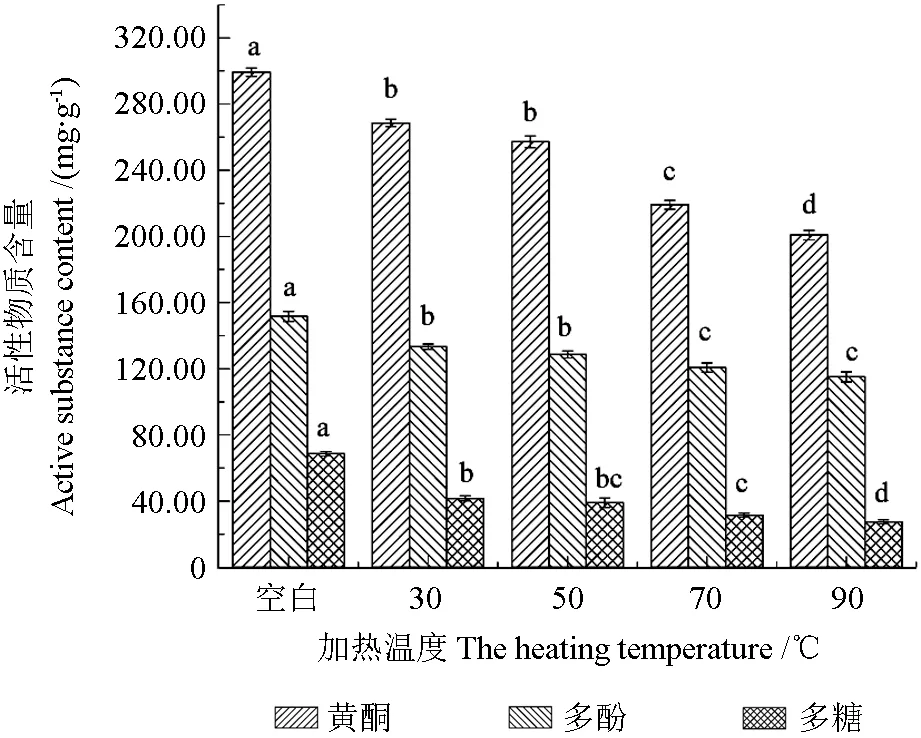
图2 温度对醇提物稳定性的影响Fig.2 Effect of temperature on the stability of alcohol extracts
2.3 光对刺玫果醇提物稳定性的影响
不同光照对刺玫果醇提物的稳定性影响如图3所示,不同光照对刺玫果醇提物含量有着显著影响(P<0.05)。在自然光照下条件,刺玫果醇提物黄酮、多酚含量随着光照天数增加而逐渐下降。光照1~2 d 内,随着光照时间的延长黄酮、多酚含量逐渐下降但变化不显著(P>0.05),光照5 d 后,黄酮、多酚含量较空白降低了22.52%、24.46%。随着紫外照射时间的延长,黄酮、多酚含量也呈现不同幅度的下降趋势,60 min 后黄酮、多酚含量较空白分别下降了37.20%、39.94%,与自然光照结果相较,紫外照射加快黄酮类化合物含量的下降速率。随着光照天数的增加刺玫果醇提物多糖含量呈现下降的趋势,在光照5 d 内无显著性差异(P>0.05),即刺玫果醇提物多糖稳定性在光因素的影响下变化较小。在紫外条件下照射40 min,刺玫果醇提物多糖含量无显著性变化(P<0.05),受辐射50~60 min 时,多糖含量明显下降。

图3 不同光照对醇提物稳定性影响Fig.3 Effect of different light on the stability of alcohol extracts
除此之外,刺玫果醇提液经过紫外辐射后,溶液颜色明显变浑浊,可能是因为紫外辐射使黄酮类化合物内部不饱和键发生降解或缩合,破坏了刺玫果醇提物黄酮化合物的结构[22]。因此,紫外线对刺玫果活性物质破坏性更严重,为保护刺玫果生物性能及功能成分,刺玫果醇提液以及加工制品应尽量避光存放。
2.4 pH 值对刺玫果醇提物稳定性的影响
pH 值对刺玫果醇提物稳定性的影响如图4所示,pH 值对刺玫果醇提物活性物质含量的影响显著(P<0.05)。在pH 值4.0~8.0 条件下黄酮含量波动较小,表现出相对稳定性,随着pH 值升高到达10.0~12.0 的碱性条件,黄酮含量显著降低(P<0.05),强酸强碱环境加速黄酮化合物的降解,相对于碱性,酸性条件更有利于维持刺玫果醇提物黄酮的稳定性,这可能是由于黄酮类物质呈现出的弱酸性促进与碱性物质结合而使自身分解[23]。多酚、多糖含量在pH 值的2.0~6.0 时较稳定,无显著性差异(P>0.05),具有良好的稳定性,在pH 值8.0~12.0 则表现出不同程度的波动(P<0.05),此外刺玫果醇提液在酸性条件下呈透亮的浅黄色,强碱条件下颜色最深,呈现深黄色,产生这种现象,是因为强碱作用对刺玫果醇提液花色苷的结构存在一定的影响,使羟基取代数目减少、位置改变而使颜色呈深黄色[24]。所以在生产或加工刺玫果时,应选择弱酸性环境,最大程度维持刺玫果的生物活性。
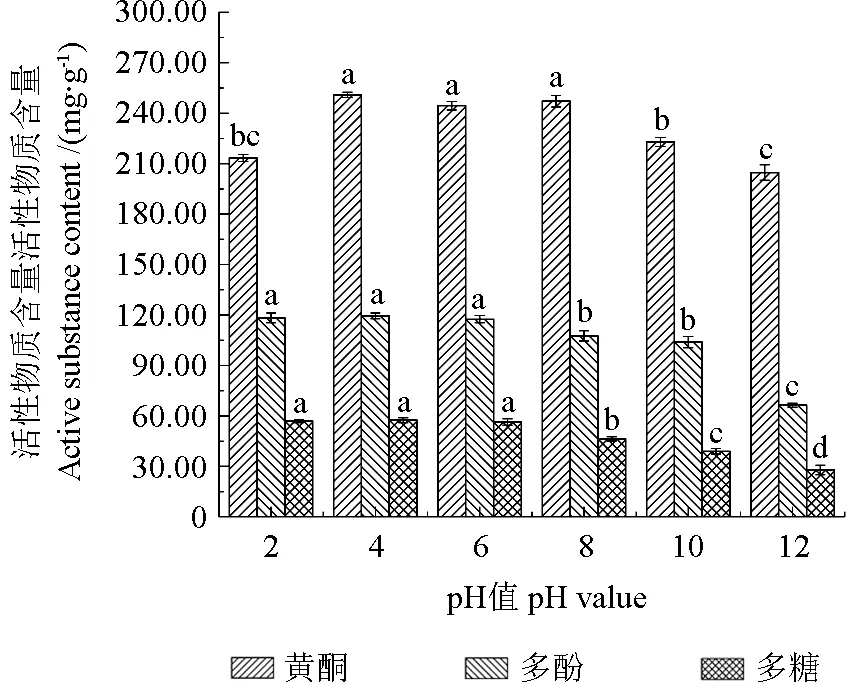
图4 pH 值对醇提物稳定性的影响Fig.4 Effect of pH on the stability of alcohol extracts
2.5 不同金属离子对刺玫果醇提物稳定性的影响
如表2所示,不同浓度金属离子使刺玫果醇提物活性物质含量均有不同程度的波动,说明部分金属离子对刺玫果醇提物稳定性存在影响。

表2 不同金属离子对醇提物稳定性影响†Table 2 Effect of different metal ions on the stability of alcohol extracts
Na+在1~9 mmol/L 浓度范围内对刺玫果黄酮含量影响较小。Mg2+和K+对刺玫果醇提物黄酮有着显著影响(P<0.05),在浓度1~9 mmol/L范围内,醇提物黄酮变化不稳定,无明显规则。Cu2+对刺玫果醇提物黄酮稳定性存在显著影响(P<0.05),黄酮含量随着Cu2+浓度的增大呈现先增大后下降的趋势,在Cu2+浓度7~9 mmol/L时,有明显的絮状沉淀产生,与其他离子相比,Cu2+显著降低了醇提物的黄酮含量(P<0.05),对刺玫果黄酮有严重的破坏作用。出现以上现象,可能是由于黄酮类化合物上的羟基与不同金属离子的络合作用,使刺玫果黄酮结构改变,进而影响稳定性[24]。
Na+对刺玫果醇提物多酚影响显著(P<0.05),无明显规则,在Na+5 mmol/L 时多酚含量出现峰值,而后逐渐减小。K+和Mg2+对刺玫果醇提物多酚有显著影响(P<0.05),但在低浓度1~3 mmol/L 时影响不显著(P>0.05),随后多酚含量随着浓度增大也有所改变。Cu2+对刺玫果醇提物多酚有显著影响(P<0.05),当溶液中Cu2+浓度为9 mmol/L 时,醇提物多酚含量较空白下降了17.69%。
随着Na+浓度不断增加,刺玫果醇提物多糖含量呈现下降趋势,在Na+浓度1~7 mmol/L 时无显著性差异(P>0.05),至高浓度9 mmol/L 时多糖含量下降至最低(40.53±2.19)mg/g。K+/Mg2+对刺玫果醇提物多糖含量有显著性影响(P<0.05),但不同浓度之间无显著性差异(P>0.05),即对刺玫果醇提物多糖稳定性影响较小。Cu2+处理下,溶液颜色随着Cu2+浓度增加不断加深,由最初的浅黄色变为深黄色,醇提物多糖含量在9 mmol/L时达到最高,这说明Cu2+存在条件下刺玫果醇提物多糖不稳定。
3 结论与讨论
抑制α-葡萄糖苷酶和α-淀粉酶的活性,可有效降低葡萄糖和果糖的生成量,有助于降低餐后血糖水平[26]。本研究考察了不同体积分数乙醇提取物对降糖酶活性的影响,结果表明,刺玫果不同醇提物对α-葡萄糖苷酶和α-淀粉酶均有较好的抑制作用。70%刺玫果醇提物对α-葡萄糖苷酶抑制率较高(IC50值为1.905 mg/mL),效果仅次于阿卡波糖(IC50值为0.123 mg/mL),50%刺玫果醇提物对α-淀粉酶的抑制作用较为显著(IC50为10.212 mg/mL)。但与α-葡萄糖苷酶相比,刺玫果醇不同提取物对α-淀粉酶的抑制作用较弱,分析原因可能是刺玫果醇提物中与α-葡萄糖苷酶活性位点结合的基团数量较多,对α-葡萄糖苷酶的活性影响较大。马利华等[27]研究发现70%槐花醇提物对α-淀粉酶的抑制作用很弱,对α-葡萄糖苷酶的抑制作用显著,这与本研究结果一致。刺玫果作为药食同源的原料,具有较高的药用价值,但其果实目前未得到充分利用,因其醇提物对降糖酶活性抑制存在浓度依赖,明确表现出具有调节餐后血糖的作用,该研究结果可为刺玫果的综合开发利用提供参考,70%的刺玫果醇提物的综合降糖效果最佳,可作为天然产物降糖药物成分的主要来源。
不同加工条件和环境因素均影响刺玫果醇提物活性成分的稳定性,这在一定程度上限制了刺玫果的加工利用。因此,选择使其稳定的因素,有助于刺玫果开发加工过程中最大程度地保留其活性成分。本实验研究对降糖酶抑制作用较优的70%刺玫果醇提物稳定性变化可知,醇提物黄酮、多酚、多糖均对温度较为敏感,随着温度的升高刺玫果醇提物稳定性逐渐降低,多糖稳定性与伍亚华等[28]对宣木瓜多糖的研究结果相似,因此适当的低温环境能较好地维持醇提物活性物质稳定性。在自然光照条件下,刺玫果醇提物黄酮、多酚表现出相似的稳定趋势,随着光照时间的增加稳定性逐渐降低,相似研究结果在单性木兰叶多酚稳定性研究中也得到证实[29],多糖则无显著性变化,紫外辐射加速降解刺玫果醇提物黄酮、多酚、多糖的生物活性,破坏最为显著,因此,刺玫果的储藏加工尽量避免阳光直射。本研究中,刺玫果醇提物活性成分受pH 值的影响产生不同的变化,弱酸及中性条件有利于保持黄酮稳定,强酸强碱条件对黄酮结构破坏程度较大,不利于黄酮结构的稳定,赵丁一[30]在研究中也发现山核桃醇提液黄酮质量浓度在弱酸及中性条件下具有良好的稳定性;多酚、多糖在偏酸性条件下趋于稳定。不同金属离子条件下,刺玫果醇提物黄酮、多酚、多糖稳定性表现出多样性和复杂性:刺玫果醇提物黄酮对Na+稳定,K+、Mg2+均不稳定,与其他离子相比,Cu2+的破坏性更为明显;醇提物多酚对低浓度的K+、Mg2+稳定,多糖对低浓度的Na+无显著影响,Cu2+则影响显著,出现以上现象可能是由于不同金属离子与多酚、黄酮、多糖类化合物发生螯合作用,改变了物质的分子结构,产生的其他复杂的化合物影响活性物质显色,致使活性物质稳定性改变[31]。因此,刺玫果醇提物相关产品中,尽量避免添加与Cu2+相关的物质,可在安全范围内添加适量低浓度的K+和Mg2+。
本实验仅研究了刺玫果醇提物对降糖酶活性以及加工稳定性的影响,通过适当条件的加工,可保障活性,为生产刺玫果高附加值的功能性产品提供参考,但对体外的降血糖效果还有待于进一步研究。杜佳林等[32]研究认为刺玫果不同提取物可以明显降低Ⅱ型糖尿病大鼠糖化血红蛋白和果糖胺的含量。本实验后续将对刺玫果70%醇提物进行系统研究,通过建立细胞胰岛素抵抗模型,验证其改善IR-HepG2 细胞糖代谢效应,以表征刺玫果醇提物降糖活性,为进一步开展体内活性验证试验提供参考,从而充分挖掘刺玫果的潜在利用价值。
