全球主要森林系统中植被汞分布特征及其影响因素
2022-04-24常顺利张毓涛
李 鑫,常顺利*,王 训,袁 巍,张毓涛
全球主要森林系统中植被汞分布特征及其影响因素
李 鑫1,常顺利1*,王 训2,袁 巍2,张毓涛3
(1.新疆大学资源与环境科学学院,绿洲生态教育部重点实验室,新疆 乌鲁木齐 830046;2.中国科学院地球化学研究所,贵州 贵阳 550081;3.新疆林科院森林生态研究所,新疆天山森林生态系统国家定位观测研究站,新疆 乌鲁木齐 830063)
基于过去20a全球森林植被中汞循环过程的相关研究,本文通过荟萃分析法阐明全球主要森林类型中植被汞分布特征及其影响因素.结果表明,汞在植被中浓度排序特征(以中值计)依次为凋落物(38.9ng/g )>叶片(24.1ng/g)>树根(18.5ng/g)>树皮(13.2ng/g)>树枝(12.0ng/g)>树干(3.1ng/g).其中,凋落物与叶片汞浓度具有极显著相关性(rho=0.747,<0.01,rho spearman相关系数,且与样本数量有关,下同);叶片与树干具有显著相关性 (rho=0.265,<0.05);而其余组织间无相关性(>0.05).上述的相关性主要受控于植被叶片吸收大气零价汞,从叶片由上而下传输到树木木质部的过程.其次,常绿阔叶林的叶片汞浓度(中值:56.0ng/g,下同)高于针叶林(25.5ng/g)、阔叶落叶林(23.0ng/g)和红树林(18.6ng/g).这是由于在气孔导度、气孔数量、叶面积与叶寿命等因素综合影响下,常绿阔叶林叶片汞富集的能力最强.地区间植被汞浓度差异明显(如叶片汞浓度变化区间:0.90~225ng/g),其最主要原因是地区间植被类型与大气汞浓度差异引起的.本研究为进一步量化全球森林植被汞储库与认识全球森林系统汞循环提供了重要的基础数据与基本认识.
全球森林;汞浓度;影响因素;相关性;荟萃分析
汞是一种生物毒性极强的重金属污染物,能够通过大气环流而进行长距离跨国界传输[1].自工业革命以来,人类活动造成的汞排放使得全球大气汞浓度较工业革命前增加了3倍左右,对人类健康、自然生态环境可持续发展等造成了严重威胁[2-3].
依据物理化学性质,汞在大气中可分为3种主要形态,即:气态单质汞(GEM)、活性气态汞(RGM)和颗粒态汞(PBM)[4].GEM约占大气汞的90%~95%以上,而PBM占比通常在5%~10%以下,RGM占大气总汞的1%~3%[5].RGM与PBM化学性质活泼,能够通过干湿沉降的方式快速地从大气中去除,进而固定到地表和海洋生态系统中;而GEM化学性质稳定且不溶于水,在大气中滞留时间可达约0.5~1.5a[4].目前研究表明,大气中GEM主要以干沉降的途径进入陆地生态系统中[3],如通过叶片气孔吸收或表皮吸附大气汞(Hg0),固定在叶片中,以凋落物的方式进入陆地生态系统[6].此外,GEM还可通过太阳辐射、大气活性自由基与大气氧化物等的作用下转化为RGM,或吸附于颗粒物形成PBM,经降水沉降过程或颗粒物直接干沉降过程,进入陆地生态系统[7].沉降到森林系统的汞,随地表径流、地下渗流等水文过程而进入下游的水生生态系统,经生物的甲基化过程,甲基汞沿食物链的生物放大效应,可对人体健康造成严重威胁[8].
森林生态系统约占全球陆地总面积的31%[9],是全球汞循环中最为活跃的区域之一.全球森林生态系统每年能够以凋落物的形式从大气中转移1000~1200t汞进入森林生态系统中,约占全球大气汞储库的20%.最新的研究表明,全球森林能够从大气中转移的汞总量能够达到3000t以上[10].森林吸收大气汞过程能够显著地影响北半球大气汞含量,即森林生态系统的分布在一定程度上决定着全球大气汞浓度分布规律[11].因此,厘清森林生态系统汞生物地球化学过程是认识全球汞循环及评估汞污染环境健康效应的基础.
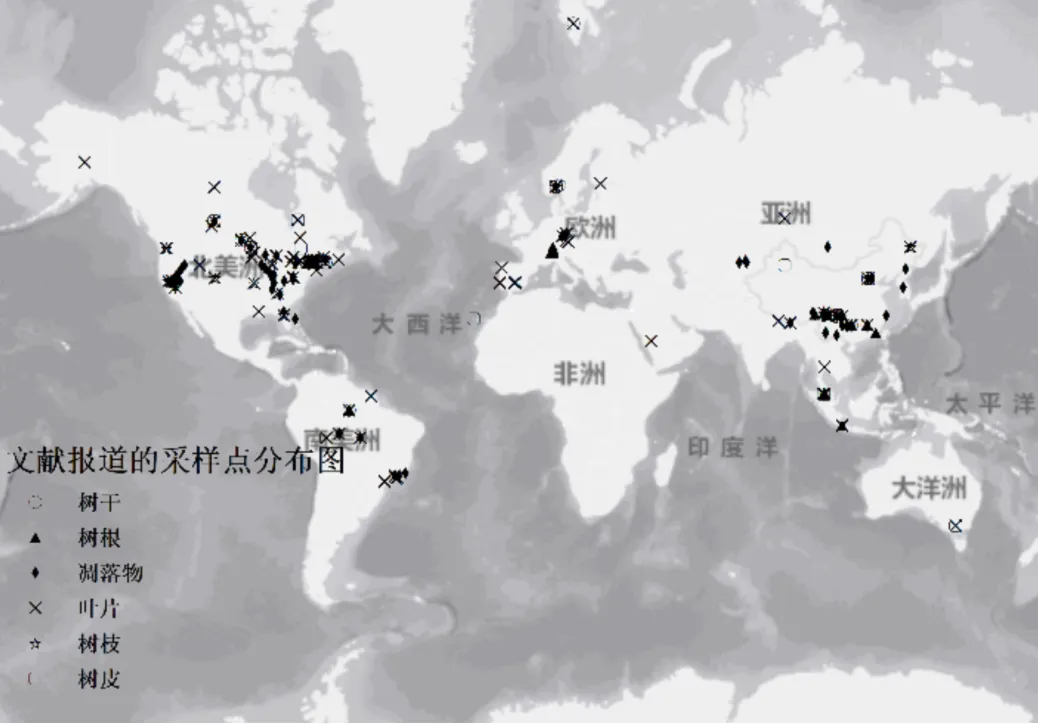
图1 文献报道的全球主要森林生态系统的采样点分布图
本文基于前人开展的大量关于森林生态系统中植物叶片、凋落物、树干等植被重要端源汞浓度的相关研究,采用荟萃分析法在全球尺度下,分析对不同植被组织中的汞浓度分布特征及相关性,研究植被类型与不同地区间的植被汞的浓度差异及其潜在影响因素,以期为全球森林汞循环研究提供数据支持.
1 研究方法与数据处理
1.1 研究方法
本文收集并建立了全球范围内背景地区(指无明显受到人为大点源影响的森林区域)植被中汞的浓度分布特征数据库,主要运用荟萃分析法开展分析.以森林汞为研究主题确定搜索关键词,如汞、森林、树叶、,在Springerlink、PubMed、Sciencedirect等文献数据库检索1996~2020年发表的相关文献,初步筛选得到108篇文献.按需求(包含作者、汞浓度、标准差、端源、物种、位置类型、位置名称、地区、经度、维度、海拔、题目、森林类型、样本数量、测量方法、实验时间、数量来源、备注等共18个要素)把信息整理分类.数据库中研究站点共收集到160个(图1),数据库中39%的数据报道了树木叶片中汞浓度,39%的数据报道了树木凋落物中汞浓度,6%的数据报道了树根中汞浓度,5%的数据报道了树皮的汞浓度,7%的数据报道了树干中汞浓度,4%的数据报道了树枝中汞浓度.位置类型分为偏远地区、城市郊区、城市以及污染区(本文主要讨论偏远地区).按地区来源分布,数据库中28%的数据来自东亚,40%的数据来自北美,7%的数据来自南美,7%的数据来自欧洲,以及1%的数据来自其他地区.按森林类型分布,数据库中27%的数据来自针叶林,37%的数据来自阔叶落叶林,16%的数据来自常绿阔叶林,16%的数据来自红树林,4%的数据来其他类型(主要包括苔藓、地衣、草地等).数据来源主要指来源于文献中的图或表.
1.2 数据处理
本文采用EXCEL进行数据的初步收集与整理,采用IBM SPSS statistics 21软件完成相关统计分析,采用Origin 2018、EXCEL、ArcGIS 10.2.1完成图表制作.主要统计方法采用Kolmogorov- Smirnov检验与Levence检验对样本进行正态性与方差齐性检验.数据收集后预处理分析结果表明,当前收集的数据不具正态性与方差齐性.因此,本文对不同植被类型以及不同地区的汞浓度进行显著性分析采用Kruskal-Wallis检验,探讨植被组织之间汞浓度相关性及其影响因素时采用线性回归分析与Spearman相关性分析.
2 结果与讨论
2.1 森林植被汞浓度分布及影响因素
2.1.1 植被中汞浓度分布特征 植被不同端源中汞浓度分布遵从如下规律(以中值排序):凋落物38.9ng/g(四分位值范围(IQR):31.0~52.3ng/g,均值:(48.2±32.5)ng/g)>新鲜叶片24.1ng/g (IQR:14.4~40.9ng/g,均值:(31.8±27.9)ng/g)> 18.5ng/g(IQR:7.0~45.0ng/g,均值:(29.5±27.6)ng/g)>树皮13.2ng/g (IQR:5.0~23.8ng/g,均值:(26.0±44.4) ng/g)>树12.0ng/g(IQR:6.2~19.0ng/g,均值:(14.0±11.1)ng/g)>树干3.1ng/g(IQR:1.7~9.5ng/g,均值:(6.7±7.2)ng/g) (图2).
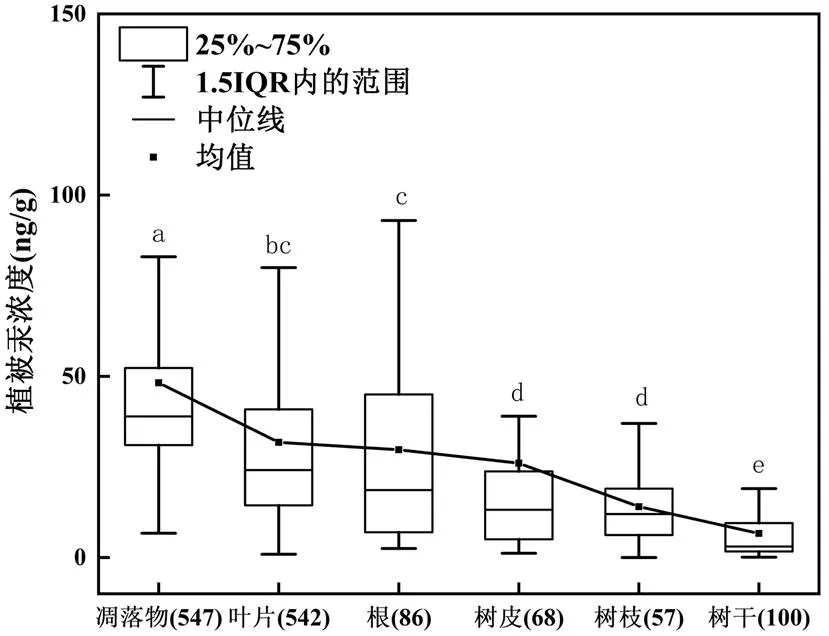
图2 全球植被组织汞浓度分布
箱体上相同字母表示无显著性差异(>0.05) ;箱体中黑色方框代表均值;箱体中横线代表中值;()表示样本数量;折线为均值连接线
目前研究表明,植物体中的汞来源主要包括:通过叶片气孔摄入叶片细胞内、角质层吸附在叶片表面、树皮表面吸附的大气汞以及树木根部从土壤吸收的汞[12].凋落物汞浓度高于叶片汞浓度,且表现为极显著相关(rho=0.747,<0.01,rho: Spearman相关系数与样本数量N有关,下同,图3(a)所示).这主要是由于以下两个原因造成的.一是,植物生长过程中植被叶片持续地从大气中吸收/吸附汞[13-14],自然条件下植物叶片能够在整个生长期内表现为汞浓度线性增长[14].二是,树叶凋落过程中,老叶中的营养物质转运至其他组织,而汞在树叶中移动性很差,故而凋落物的单位质量减轻,使得凋落物汞浓度升高[15].汞在叶片和凋落物中浓度最高,根次之.其主要原因是,植被叶片中汞主要来源于大气中吸收/吸附过程,其次是植物根系从土壤中吸收汞的过程.这一分布规律表明,汞在植物中的来源及迁移转运,可能明显不同于其他重金属元素(如铅、镉等)[16-17]受蒸腾作用驱动下自下而上的迁移模式.叶片与树干汞浓度之间的相关性(rho=0.265,<0.05,图3(b)),虽然在统计检验上表现为显著,但并不具有极显著相关性关系(rhp<0.5).这表明,一方面树叶中汞可迁移传输至树干中;另一方面,树干的汞浓度并不与树叶中的汞表现为强的线性关系,其主要受制于传输过程、植物的生理特性及树木径向生长的质量稀释效应等因素的综合影响[18].叶片与其他部位间汞浓度无相关性(叶片与树皮:rho=0.309,图3(c),>0.05;叶片与树枝: rho=0.009,图3(d);树干与树皮: rho= 0.196,>0.05,图3(f)).其潜在原因是树皮、树干等部位生物量的稀释效应以及树皮等部位存在额外来源的汞,如树皮表面吸附汞.而根中汞浓度与地上部位汞浓度无相关性(叶片与根:rho=0.171, 图3(e),>0.05),其主要原因是根部的汞难以向上迁移.这与先前的室内控制实验的结果吻合,如基于添加汞同位素的实验已经证明,植物根系能够传输至植物地上部分的汞的量极少(仅占根部的汞总量<1%)[19].
2.1.2 不同森林类型植被叶片与凋落物中汞浓度分布特征 森林植被吸收大气汞的潜力,主要受大气汞浓度及不同类型森林植被功能性状共同决定.野外通量袋实验与实验室室内模拟实验均表明植被叶片汞浓度与大气汞浓度呈线性正相关[20-22].叶片功能性状的差异,如叶片表面积扩增[13],气孔密度增加[22],净光合速率增长[23],气孔导度[22, 24]提升,叶片生长周期[14,25]增加等均能够促进植物叶片汞浓度提升.除了环境因素,如温度[26],太阳辐射强度(特别是紫外线)[27],大气湍流[28]等因素能够影响植物叶片积累汞的过程以外,叶片内物质的化学活性,如过氧化氢酶活性[29]和抗坏血酸浓度变化[30],均能影响叶片氧化或者还原汞的过程,进而引起叶片中汞浓度的改变.

图3 不同植被组织间汞浓度相关性分析
相关性分析采用Spearman相关性分析法;rho:表示Spearman相关系数;表示样本数量
全球的分析结果也表明森林植被类型被是驱动植被叶片及凋落物中汞浓度分布特征的重要影响因素.全球不同森林类型植被叶片汞浓度(中值)分布情况依次为:常绿阔叶林的中值为56.0ng/g (IQR:32.0~87.4ng/g,均值:(65.2±46.9)ng/g)>针叶林中值为25.5ng/g(IQR:14.1~41.3ng/g,均值:(29.5±19.9) ng/g)>阔叶落叶林中值为23.0ng/g(IQR:12.6~39.1ng/g,均值:(19.9±9.2) ng/g)>红树林中值为18.6ng/g,(IQR:13.6~24.7ng/g,均值: (26.5±12.6) ng/g) (图4a);凋落物汞浓度(中值)依次为:常绿阔叶林(中值:57.0ng/g,IQR:40.0~85.0ng/g,均值: (65.0±36.1) ng/ g)>阔叶落叶林(中值:39.9ng/g,IQR:33.4~49.9ng/g,均值: (47.6±38.6) ng/g)>针叶林(中值:38.4ng/g,IQR: 21.0~54.9ng/g,均值:(45.1±24.6) ng/g)>红树林(中值:33.5ng/g,IQR:29.8~36. ng/g,均值: (34.9±9.9ng/g) (图4b).
常绿阔叶林叶片与凋落物汞浓度显著高于其他植被类型叶片和凋落物中汞浓度(<0.05, Kruskal-Wallis检验,下同),其主要原因是:常绿阔叶林叶片具有较大的叶面积、较多的气孔数量、较长的叶周期(阔叶落叶林叶周期小于1a,常绿阔叶林通常为1~2a,针叶林通常为2~5a[31]),以及常绿阔叶林叶片较高的气孔导度[32].上述因素均有利于常绿阔叶林植物叶片对于大气汞的吸收/吸附过程.此外,常绿阔叶林多存在热带/亚热带等气候湿润、水热条件配合良好的地区[33],导致植被叶片一年内呼吸与光合作用时间较长、强度较高,因此叶片汞积累量明显多于针叶林及落叶阔叶林等.红树林叶片与凋落物汞浓度显著低于其他森林类型中相应样品汞浓度(<0.05),其原因可能是红树林植被多生长于海陆潮汐带,海陆间大气环流等过程有利于大气汞污染的消散,导致大气汞浓度较低(植被叶片中汞浓度一定程度上受制于大气汞浓度[34]),进而导致红树林叶片汞浓度较低.阔叶落叶林和针叶林叶片得凋落物汞浓度无显著差异(>0.05)(图4),其原因可能是针叶林叶片较长的叶生命周期抵消了大气汞浓度以及叶性状差异(如气孔导度、气孔数量、叶面积等)的影响[35].总的来说,全球森林植被的叶片、凋落物汞浓度是大气汞浓度,气候特征以及植被叶片功能性状共同作用的结果.

图4 不同森林类型叶片与凋落物汞浓度分布
箱体上相同字母表示无显著性差异(>0.05) ;箱体中黑色方框代表均值;箱体中横线代表中值;()表示样本数量
2.1.3 不同森林类型植被其他组织汞浓度分布 不同类型植被中树枝汞浓度表现出大致相近结果:常绿阔叶林12.1ng/g(IQR:12.0~12.5ng/g)、针叶林11.7ng/g(IQR:6.2~20.0ng/g)、阔叶落叶林9.5ng/g (IQR:5.0~17.0ng/g).树皮汞浓度以植被类型划分依次为:针叶林25.7ng/g(IQR:13.4~88.0ng/g)、阔叶落叶林11.3ng/g(IQR:5.0~18.0ng/g)、常绿阔叶林7.0ng/ g(IQR:7.0~22.0ng/g)、红树林1.6ng/g(IQR:1.2~2.0ng/g).针叶林树皮中汞浓度明显较高的原因可能与针叶树皮多褶皱、比表面积大的结构特性有关[36].树干汞浓度以植被类型汞划分依次为:红树林(以中值计,下同)22.5ng/g(IQR:15.0~30.0ng/g)>常绿阔叶林9.3ng/g(IQR:4.0~16.0ng/g)>针叶林2.7ng/g(IQR: 1.9~4.6ng/g)>阔叶落叶林1.8ng/g(IQR:0.8~2.7ng/g) (均值±方差与样本量N由表1所示,下同),其树干汞浓度变化范围为0.1~30.0ng/g,其中常绿阔叶林植被树干(=35)汞浓度显著大于阔叶落叶林(=35)(< 0.05),可能是由于常绿阔叶林植被叶片中汞的浓度较高导致的(图4a).

图5 不同森林植被类型树干、树根、树皮、树枝汞浓度分布
箱体中黑色方块代表均值;箱体中横线代表中值;表示样本数
更为重要的是,考虑到常绿阔叶林树干的生物量通常较大,而较高的汞浓度意味着常绿阔叶林中树干汞储库可能高于其他森林类型.值得注意的是从树叶迁移至树干的这部分汞也是重要的大气汞汇,但在当前模型研究中,这部分汞汇常常被忽略[37],因此未来新全球汞的沉降模型中应予以更全面考量植被的汞汇效应.根汞浓度以植被类型划分依次为:草本39.5ng/g(IQR:30.1~63.0ng/g)、常绿阔叶林25.0ng/g(IQR:23.0~36.0ng/g)、红树林17.6ng/g (IQR: 3.3~19.0ng/g)、针叶林12.7ng/g(IQR: 6.0~18.3ng/g)、阔叶落叶林(7.5ng/g,IQR:6.0~60.0ng/g),根汞浓度变化范围较大(2.5~113.0ng/g),主要原因是植被根中汞浓度很大程度上受制于植被周边土壤中汞浓度,并且由植株地上部分迁移至根中的汞极少[19,38-39],因而存在极大的异质性.

表1 不同森林植被类型组织间总体汞浓度均值(平均值±标准差)(ng/g)
注:表示样本数量;No表示无数据.
2.2 地区植被汞浓度的分布及其影响因素
2.2.1 地区间叶片与凋落物汞浓度分布 不同地区的植被叶片汞浓度一定程度上能反映该地区的大气汞浓度分布规律及源汇关系,因此研究地区植被汞浓度差异对环境健康评价以及全球汞循环具有重要意义.叶片按地区间汞浓度(以中值计)排序依次为南美61.5ng/g(IQR:38.0~99.0ng/g)>欧洲35.5ng/ g(IQR:23.9~54.0)>东亚34.0ng/g(IQR:12.8~53.6ng/g) >北美20.0ng/g(IQR:10.9~31.1ng/g)>东南亚18.9ng/g (IQR:14.3~26.3ng/g)(均值、方差以及N如表2所示,下同)(图6a).南美地区植被叶片汞浓度显著高于其他地区植被叶片汞浓度(<0.05),其原因是南美洲地区已报道数据多为热带森林植被的研究结果,热带常绿阔叶林森林植被叶片气孔数量多及叶片面积大,以及良好的水热配合下有利于热带森林叶片累积大气汞[34];另外,南美洲亚马逊流域由于常年的森林大火与农业毁林[40],以及土法炼金等点源污染的汞排放[41],也是叶片汞浓度较高的潜在原因.东亚大气汞浓度(3.0~5.0ng/m3)高于欧美(1.0~2.0ng/m3),这可能是北美地区叶片显著低于东亚地区森林叶片汞浓度的原因之一(<0.05)(图6a).但东亚与欧洲地区叶片汞浓度无显著差异(>0.05),推测原因为,当前报道的数据,东亚以亚热带常绿阔叶林和温带落叶阔叶林为主,而欧洲地区森林以温带/北方针叶林森林为主,欧洲地区植被较长的叶片生长周期可在一定程度上抵消了东亚地区高大气汞浓度的影响作用,使得上述两个区域的叶片汞浓度整体相当.
凋落物按地区间汞浓度(中值)高低排序为南美(中值:74.1ng/g,IQR:55.5~96.5ng/g)>欧洲(中值: 59.0ng/g,IQR:50.2~63.1ng/g)>北美(中值:41.1ng/g, IQR:34.5~51.2ng/g)>东亚(中值:37.7ng/g,IQR: 22.0~57.2ng/g)(图6B).南美地区凋落物汞浓度显著高于其他地区(<0.05),其可能是由于南美地区植被叶片汞浓度显著高于其他地区;而北美、欧洲、东亚地区之间植被凋落物汞浓度无显著差异(>0.05),与叶片规律相一致.
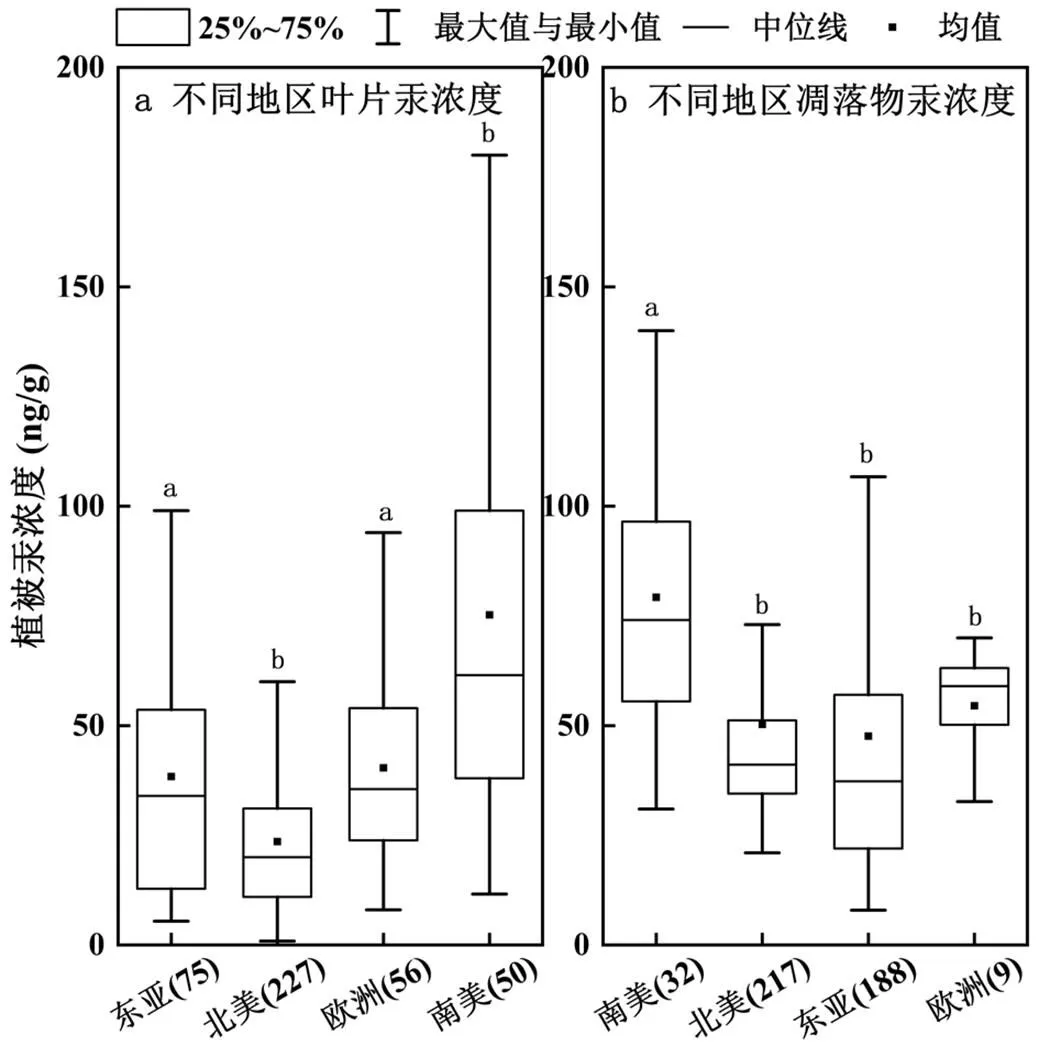
图6 不同地区植被叶片与凋落物汞浓度差异
箱体中黑色方框代表均值;箱体中横线代表中值;箱体上相同字母表示无差异(>0.05);(N)表示样本数量
2.2.2 不同地区植被其他组织汞浓度分布 东亚地区植被根汞浓度为12.6ng/g(IQR:6.0~20.4ng/g)、树干汞浓度为2.8ng/g,(IQR:1.3~7.7ng/g)、树皮汞浓度17.4ng/g(IQR:13.2~24.6ng/g)、树枝汞浓度为10.9ng/g(IQR:6.0~17.8ng/g)(各地区的均值、方差以及N由表2所示,下同);欧洲地区植被根汞浓度为55.0ng/g(IQR:31.0~78.0ng/g)、树干汞浓度为11.0 (IQR:2.0~13.0ng/g)、树枝汞浓度为25.0ng/g(IQR: 17.0~57.0ng/g);北美地区植被树干汞浓度为2.2ng/ g(IQR:1.6~6.3ng/g)、树皮汞浓度为11.3ng/g(IQR: 5.0~21.4ng/g)、树枝汞浓度为11.0ng/g(IQR: 8.0~20.0ng/g);南美地区植被根汞浓度为23.0ng/g (IQR: 12.0~36.0ng/g)、树干汞浓度为20.5ng/g(IQR: 15.0~23.0ng/g);东南亚地区植被根汞浓度为11.6ng/g (IQR:3.3~30.4ng/g)、树皮汞浓度为1.6ng/g(IQR: 1.2~2.0ng/g).各地区间其他植被组织汞浓度变化较大(0.1~137.0g/g),表明其他植被组织汞浓度受气候、海拔、大气汞浓度、土壤汞浓度、植被类型等众多因素的影响,且影响机制较为复杂.这需要未来更多的研究工作,进一步详细探讨其分布规律与影响机制.
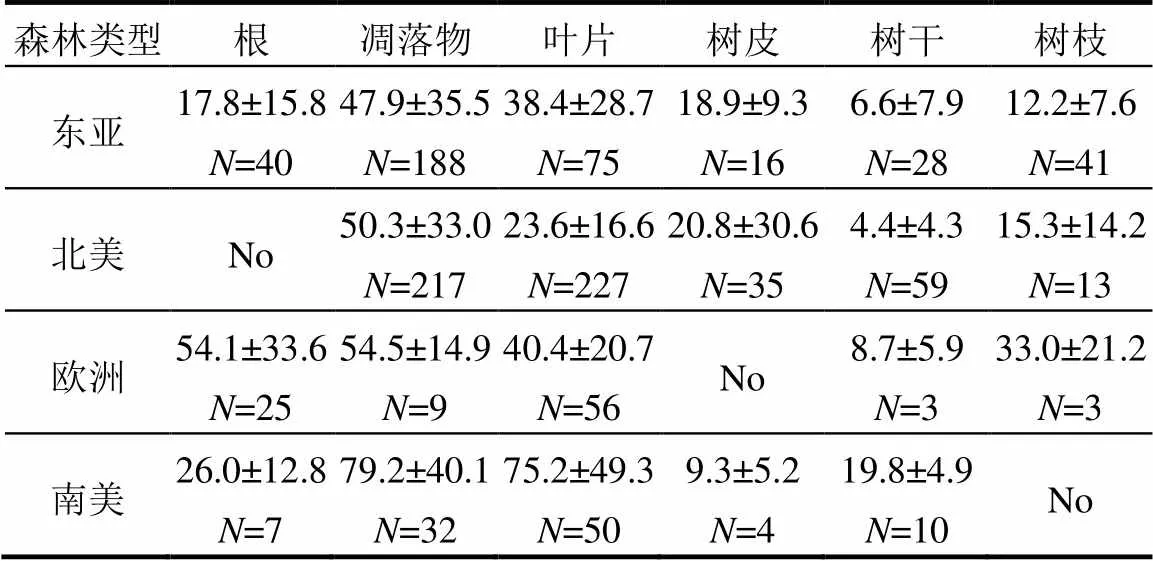
表2 不同地区植被类型组织间总体汞浓度分布情况(平均值±标准差)/ (ng/g)
注:表示样本数量;No表示无数.

图7 不同地区植被根、树皮、树枝、树干汞浓度分布
箱体中黑色方块代表均值;箱体中横线代表中值;n代表样本数量
3 结论
3.1 植被汞浓度特征为凋落物>叶片>根>树皮>树枝>树干,这与其他重金属在植被中的分布规律不同.不同端源汞浓度相关性具有差异,主要受控于大气、土壤来源的汞在植被各组织间的传输、分配过程.
3.2 不同森林类型的植被叶片汞浓度存在明显差异,主要是由大气汞浓度、气候特征和森林植被功能性状等因素共同决定.对全球森林系统而言,热带与亚热带常绿阔叶林存在明显偏高的叶片、树干汞浓度,较高的大气汞汇.
3.3 全球尺度下,南美洲地区植被叶片汞浓度最高,欧洲和东亚地区叶片汞浓度次之,北美地区叶片汞浓度最低.这表明不同气候带下森林类型与大气汞浓度是决定区域汞差异的重要因素.
[1] Hakanson L, Andersson A, Johansson K, et al. Mercury in the Swedish environment — Recent research on causes, consequences and corrective methods [J]. Water Air & Soil Pollution, 1991,55(1/2):xi- 261.
[2] Fitzgerald W F . Is mercury increasing in the atmosphere? The need for an atmospheric mercury network (AMNET)[J]. Water Air & Soil Pollution, 1995,80(1-4):245-254.
[3] 王 训,袁 巍,冯新斌.森林生态系统汞的生物地球化学过程 [J]. 化学进展, 2017,29(9):970-980.
Wang X, Yuan W, Feng X B. Global review of mercury biogeochemical processes in forest ecosystems [J]. Progress in Chemistry, 2017,29(9):970-980.
[4] 冯新斌,仇广乐,付学吾,等.环境汞污染[J]. 化学进展, 2009,21(Z1): 436-457.
Feng X B, Qiu G L, Fu X W, et al. Mercury pollution in the environment [J]. Progress in Chemistry, 2009,21(Z1):436-457.
[5] 冯新斌,洪业汤.汞的环境地球化学研究进展 [J]. 地质地球化学, 1997,(4):104-108.
Feng X B, Hong Y T. Some advances in environment geochemistry of mercury [J]. Earth and Environment, 1997, (4):104-108.
[6] 马 明,赖大坤,孙 涛,等.中亚热带典型林分汞的输入/输出平衡[J]. 中国环境科学, 2017,37(12):4744-4750.
Ma M, Lai D K, Sun T, et al. Mercury dynamics and mass balance in a subtropical forest in southwest China [J]. China Environmental Science, 2017,37(12):4744-4750.
[7] 王立辉,严超宇.大气汞来源、去向与形态分布研究概述 [J]. 现代化工, 2015,35(8):18-22.
Wang L H, Yan C Y. Research progress of the sources,deposition and species of atmospheric mercury [J]. Modern Chemical Industry, 2015, 35(8):18-22.
[8] Leonard A, Mutagenic and teratogenic effects of mercury compounds [J]. Journal of Environmental Hygiene, 1983,114(1):
[9] Rodeny J, Keenan, Gregory A, et al. Dynamics of global forest area: Results from the FAO global forest resources assessment 2015 [J]. Forest Ecology and Management, 2015,352:9-20.
[10] Daniel O, Roy E M, Harrison J L, et al. Previously unaccounted atmospheric mercury deposition in a midlatitude deciduous forest [J]. Proceedings of the National Academy of Sciences of the United States of America, 2021,118(29):e2105477118.
[11] Jiskra M, Sonke J E, Daniel O, et al. A vegetation control on seasonal variations in global atmospheric mercury concentrations [J]. Nature Geoscience, 2018,11(4):244-250.
[12] 付学吾,冯新斌,王少锋,等.植物中汞的研究进展 [J]. 矿物岩石地球化学通报, 2005,(3):232-238.
Fu X W, Feng X B, Wang S F, et al. Advances of research on mercury in plants [J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2005,(3):232-238.
[13] Laacouri A, Nater E A, Kolka R K. Distribution and uptake dynamics of mercury in leaves of common deciduous tree species in Minnesota, U.S.A. [J]. Environmental science & technology, 2013,47(18):10462- 10470.
[14] Yuan W, Sommar J, Lin C J, et al. Stable isotope evidence shows re-emission of elemental mercury vapor occurring after reductive loss from Foliage [J]. Environmental Science & Technology, 2019,53(2): 651-660.
[15] Daniel C. T, Rogerio R. O, Emmanoel V.S-F, et al. Litterfall mercury deposition in Atlantic forest ecosystem from SE – Brazil [J]. Environmental Pollution, 2012,164:11-15.
[16] José A R M, Carmen G, Manuel T, et al. Wood and bark ofas archives of heavy metal pollution in the Mediterranean Region [J]. Environmental Pollution, 2018,239:438-447.
[17] Ronggui T, Ji L, Jia S, et al. The cadmium and lead of soil in timberline coniferous forests, Eastern Tibetan Plateau [J]. Environmental Earth Sciences, 2015,73(1):303-310.
[18] Kaisa V, Juha J. Modeling the flow resistance of woody vegetation using physically based properties of the foliage and stem [J]. Water Resources Research, 2014,50(1):229-245.
[19] Dai Z H, Feng X B, Zhang C, et al. Assessing anthropogenic sources of mercury in soil in Wanshan Hg mining area, Guizhou, China. [J]. Environmental science and pollution research international, 2013,20(11):7560-7569.
[20] Niu Z C, Zhang X S , Wang Z W, et al. Field controlled experiments of mercury accumulation in crops from air and soil [J]. Environmental Pollution, 2011,159(10):2684-2689.
[21] M. Lodenius, E. Tulisalo, A. Soltanpour-Gargari. Exchange of mercury between atmosphere and vegetation under contaminated conditions [J]. Science of the Total Environment, 2003,304(1):169- 174.
[22] Niu Z C, Zhang X S, Wang S, et al. Field controlled experiments on the physiological responses of maize (Zea mays L.) leaves to low-level air and soil mercury exposures [J]. Environmental science and pollution research international, 2014,21(2):1541-1547.
[23] Stamenkovic J, Gustin M S. Nonstomatal versus stomatal uptake of atmospheric mercury. [J]. Environmental Science & Technology, 2009,43(5):1367-1372.
[24] Daniel C. T, Luiz D. L, Emmanoel V, et al. Foliar mercury content from tropical trees and its correlation with physiological parameters in situ [J]. Environmental Pollution, 2018,242(Pt B):1050-1057.
[25] Todd L. L, George E. T J, Mae S. G, et al. Mercury and plants in contaminated soils: 1. Uptake, partitioning, and emission to the atmosphere [J]. Environmental Toxicology and Chemistry, 1998,17 (10):2063-2071.
[26] Yao L, Lei D, Charles T, et al. Foliage/amosphere exchange of mercury in a subtropical coniferous forest in south China [J]. Journal of Geophysical Research: Biogeosciences, 2016,121(7):2006-2016.
[27] Laurier P, Martin P, Emmanuel Y, et al. Mercury concentrations and foliage/atmosphere fluxes in a maple forest ecosystem in Québec, Canada [J]. Journal of Geophysical Research: Atmospheres, 2008,113 (D10).
[28] S.E. Lindberg, P.J. Hanson, T.P. Meyers, et al. Air/surface exchange of mercury vapor over forests—the need for a reassessment of continental biogenic emissions [J]. Atmospheric Environment, 1998, 32(5):895-908.
[29] Ericksen J A, Gustin M S. Foliar exchange of mercury as a function of soil and air mercury concentrations. [J]. The Science of the total environment, 2004,324(1-3):271-9.
[30] Du S H, Fang S C. Uptake of elemental mercury vapor by C3 and C4 species [J]. Environmental and Experimental Botany, 1982,22(4):437- 443.
[31] Florian B, Dieter E, Frank F, et al. Phytoreduction and volatilization of mercury by ascorbate in Arabidopsis thaliana, European beech and Norway spruce [J]. Applied Geochemistry, 2007,23(3):494-502.
[32] Luo T X, Ronald P N,Hanqin T, et al. A model for seasonality and distribution of leaf area index of forests and its application to China [J]. Journal of Vegetation Science, 2002,13(6):817-830.
[33] Graydon J A, St L V L, Lindberg S, et al. Investigation of mercury exchange between forest canopy vegetation and the atmosphere using a new dynamic chamber. [J]. Environmental Science & Technology, 2006,40(15):4680-4688.
[34] 中国科学院.中国植被图集[M]. 北京:科学出版社, 2001.
Chinese Academy of Sciences. Chinese Vegetation Atlas [M]. Beijing: Science Press, 2001.
[35] Obrist D, Kirk J, Zhang L, re al. A review of global environmental mercury processes in response to human and natural perturbations: Changes of emissions, climate, and land use. [J]. Ambio, 2018,47 (2):116-140.
[36] Zhou J, Wang Z W, Zhang X S, et al. Mercury concentrations and pools in four adjacent coniferous and deciduous upland forests in Beijing, China [J]. Journal of Geophysical Research: Biogeosciences, 2017,122(5):1260-1274.
[37] Wang X, Yuan Wei, Lin C H, et al. Underestimated sink of atmospheric mercury in a deglaciated forest chronosequence [J]. Environmental Science & Technology, 2020,54(13):8083-8093.
[38] Mahmud M, Lihawa F, Saleh Y, et al. Study of mercury concentration in plants in Traditional Buladu Gold Mining [J]. IOP Conference Series: Earth and Environmental Science, 2019,314:012018-012018.
[39] Zhou J, Liu H Y, Du B Y, et al. Influence of soil mercury concentration and fraction on bioaccumulation process of inorganic mercury and methylmercury in rice (Oryza sativa L.) [J]. Environmental science and pollution research international, 2015,22(8):6144-54.
[40] Manuel A K. Slash-burn-and-churn: Landscape history and crop cultivation in pre-Columbian Amazonia [J]. Quaternary International, 2012,249:4-18.
[41] Hacon S, Artaxo P, Gerab F, et al. Atmospheric mercury and trace elements in the region of Alta Floresta in the Amazon Basin [J]. Water, Air, and Soil Pollution, 1995,80(1-4):273-283.
Distribution and influencing factors of vegetation mercury in major forest systems across the globe.
LI Xin1, CHANG Shun-li1, WANG Xun2, YUAN Wei2, ZHANG Yu-tao3
(1.College of Resources and Environmental Science, Xinjiang University, Urumqi 830046, China;2.Institute of Geochemistry, Chinese Academy of Sciences, Guiyang 550081, China;3.Institute of Forest Ecology, Xinjiang Academy of Forestry, Xinjiang Tianshan Forest Ecosystem National Observation, Urumqi 830063, China)., 2022,42(4):1884~1891
Based on the studies on the global mercury cycling processes in forests over the last 20-year, this study aims to elucidate the vegetation mercury distribution and its influencing factors in major forest types globally through meta-analysis. Results showed that the descending order of mercury concentrations in vegetation (in terms of median value) was litterfall (38.9ng/g) > foliage (24.1ng/g) > root (18.5ng/g) > bark (13.2ng/g) > branch (12.0ng/g) > stem (3.1ng/g). Litterfall was highly significantly correlated with foliage Hg concentration (rho=0.747,<0.01, rho: Spearman's correlation coefficient, depending on number of samples, hereafter), and a significant correlation (rho=0.265,<0.05) between leaves and trunks, but no correlations among the rest of tissues (>0.05). The above correlations are mainly controlled by the uptake of atmospheric elemental mercury by foliage and the upward transport from foliage to the xylem of trees. In addition, vegetation Hg concentrations in broadleaf evergreen forest leaves (median: 56.0ng/g, below) were higher than those in coniferous (25.5ng/g), broadleaf deciduous (23.0ng/g), and mangrove (18.6ng/g) forests. This is because the combined effects of stomatal conductance, stomatal number, leaf area and leaf longevity lead to the evergreen broadleaf forests with the greatest capacity for mercury enrichment. this study showed a significant inter-regional variation in vegetation Hg concentrations (e.g., up to range of 0.90~225ng/g). This can be attributed to the inter-regional differences in vegetation type and atmospheric mercury concentrations. This study provides important data and expanded our understanding to further quantify the global forest vegetation Hg pool and sink.
global forests;mercury concentrations;influencing factors;correlation;meta-analysis
X131
A
1000-6923(2022)04-1884-08
李 鑫(1996-),男,重庆荣昌人,新疆大学资源与环境科学学院在读硕士,主要从事森林汞循环研究.发表论文1篇.
2021-09-24
国家自然科学基金资质项目(42122053,U1503187)
*责任作者, 副教授, ecocsl@163.com
