菌-藻共生好氧颗粒污泥的稳定性机理
2022-04-24时文歆朱易春刘祖文
刘 怡,张 冰,时文歆*,朱易春,刘祖文
菌-藻共生好氧颗粒污泥的稳定性机理
刘 怡1,张 冰1,时文歆1*,朱易春2,刘祖文2
(1.重庆大学环境与生态学院,三峡库区生态环境教育部重点实验室,重庆 400045;2.江西理工大学土木与测绘工程学院,江西 赣州 341000)
在非曝气条件下接种好氧颗粒污泥(AGS)和绿藻藻种,经过18d的培养,成功构建了菌-藻共生好氧颗粒污泥系统(ABGS).研究表明,在非曝气条件下,与传统的AGS相比,ABGS具有更高的生物活性、除污染效能和机械强度,说明ABGS的稳定性更优.对ABGS的稳定性机理进行分析,发现在颗粒化过程中,胞外聚合物(EPS)特别是紧密结合层EPS(TB-EPS)中蛋白质(PN)含量明显增加,实验末期其含量增加至114.4mg/g MLSS,约为AGS的2.8倍.采用三维荧光光谱进一步分析EPS的组分,结果表明TB-EPS中氨基酸、色氨酸、芳香族蛋白质、络氨酸和色氨酸类物质是维持颗粒结构稳定性的重要原因.在微生物群落结构方面, ABGS的物种多样性和群落丰富度更高,原核生物绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes)、真核生物绿藻门(Chlorophyta)的富集有利于加强系统的稳定性.
菌-藻共生好氧颗粒污泥(ABGS);稳定性;胞外聚合物(EPS);微生物群落
好氧颗粒污泥(AGS)是在各种选择压的驱动作用下形成的微生物聚集体,具有结构致密、沉降性能优良、可实现同步脱氮除磷以及抗冲击负荷能力强等优点[1],因而被誉为“21世纪最具发展潜力的污水生物处理技术之一”[2-3].然而许多研究发现在长期运行过程中,颗粒结构易失稳导致出水水质恶化以及机械曝气能耗过高等弊端制约了该技术的大规模应用[4-6].
近年来,有研究提出将AGS技术与菌-藻共生系统的优势特征进行耦合,构建菌-藻共生好氧颗粒污泥(ABGS)体系,以克服AGS系统中存在的技术难题.在ABGS系统中,藻类通过光合作用同化CO2和水中污染物,产生的O2被好氧细菌用于氧化有机物,同时产生CO2供给藻类利用,“菌-藻”之间的共生关系有利于实现对废水中有机物和氮磷的高效去除[7].刘琳等[8]在光照序批式反应器中培养ABGS,发现该系统对于总氮和磷酸盐的去除效率(50.2%和35.7%)明显高于AGS系统(32.8%和25.6%).在非曝气条件下, ABGS系统的除污效能仍然高于AGS系统.季斌等[9]构建的一种自耦合ABGS系统,在非曝气条件下,在6h内对于有机物、氨和磷的去除率可达92.7%、96.8%和87.2%.上述研究表明,与AGS相比,ABGS的沉降性能更优,系统稳定性更强,能够在高效去除污染物的同时减少曝气能耗,降低运行成本.然而,关于ABGS系统稳定性的机理目前尚不明确,亟待进一步研究.
本文通过探究非曝气条件下ABGS和AGS的理化特性及污染物去除效能,系统分析ABGS和AGS的稳定性差异,并通过考察EPS特性和微生物群落结构的变化规律,揭示ABGS系统稳定性的内在机理.研究结果可为菌-藻共生好氧颗粒污泥技术的实际应用提供理论指导.
1 材料与方法
1.1 接种微藻与接种污泥
实验采用小球藻(FACHB-31)和栅藻(FACHB- 416)作为接种藻种,采用实验室前期培养的成熟AGS作为接种污泥.小球藻、栅藻和接种污泥三者接种体积比为1:2:7.接种后其混合液体积为400mL,藻细胞密度约为106cell/L,悬浮固体浓度(MLSS)约为3.50g/L,污泥体积指数(SVI5)为35.10mL/g,叶绿素a/MLSS比值为0.06mg/g.
1.2 实验装置与操作条件
本实验在2个500mL的锥形瓶中进行.实验组(Rp)为光照条件下培养的ABGS系统,其光照强度约为200μmol/(m2·s),光照周期为12h亮相/12h暗相,对照组(Rc)为避光处理的AGS系统.2个实验装置放置于摇床上,振荡速度为150r/min,温度控制为(25± 2)℃.
采用模拟生活污水作为进水,其组成成分为: 600mg/L COD,60mg/L NH4+-N(NH4Cl),10mg/L PO43--P(K2HPO4/KH2PO4),25mg/L Mg2+(MgSO4×7H2O), 30mg/L Ca2+(CaCl2),1mL/L微量元素[10].每天运行2个周期(12h),运行方式包括1min进水、715min振荡、2min沉降和2min排水.体积交换比为50%,水力停留时间为24h,污泥龄为27d.
1.3 分析项目和方法
取进水和出水水样沉淀分离后,上清液过0.45μm滤膜再进行水质指标检测,其中化学需氧量(COD)采用快速消解分光光度法, NH4+-N采用纳氏试剂光度法,NO2--N采用N-(1-萘基)-乙二胺光度法, NO3--N采用紫外分光光度法, PO43--P采用钼酸铵分光光度法.取曝气末期混合均匀的污泥混合液按照标准方法[11]测定MLSS、混合液挥发性悬浮固体浓度(MLVSS)、SVI5等污泥指标.采用数码相机拍摄污泥的表观形态,采用扫描电子显微镜(SEM, Quattro S,捷克)进一步观察颗粒污泥的微观结构.
ABGS中藻类的富集程度通过叶绿素a(Chl-a)的含量进行表征,按照Zhao等[12]方法测量.颗粒污泥的相对强度以污泥的完整性系数来表示,并根据Ghangrekar等[13]方法测量:取一定量的颗粒污泥样品(25mL)置于150mL量筒中静沉,收集1min内沉降至量筒底部的污泥,并将其稀释至150mL;然后将稀释后的样品置于200r/min的摇床震荡5min;随即置于150mL量筒中静沉,测定1min内因破碎而未沉于底部的污泥样品质量占颗粒污泥总质量的百分比,即为完整性系数.根据Li等[14]方法对接种颗粒污泥、Rc和Rp系统内颗粒污泥的EPS进行由外到内的分级提取,分为松散结合型EPS(LB-EPS)和紧密结合型EPS(TB-EPS). EPS样品中的蛋白质(PN)和多糖(PS)分别采用BCA蛋白质测定试剂盒(Sigma-Aldrich)和苯酚-硫酸法[15]进行定量测定.采用三维荧光光谱仪(FP-6500,日本JASCO公司)记录EPS样品的激发-发射矩阵光谱图(EEM),采用平行因子(PARAFAC)建模处理EEM数据,并使用Matlab R2015a和N-way Toolbox(版本3.20)分析EPS中的荧光组分.
采用16s rRNA和18s rRNA基因高通量测序技术分析接种颗粒污泥、Rc和Rp成熟颗粒污泥中微生物和藻类群落结构的多样性.采用E.Z.N.A.®土壤DNA试剂盒(Omega,美国)提取接种颗粒污泥、Rc和Rp中成熟颗粒污泥样品的DNA,然后按照Zhang等[10]的方法进行测序处理和生物信息学分析.
本研究中的实验平行重复3次,结果以平均值和标准差表示.
2 结果与讨论
2.1 污泥理化特性
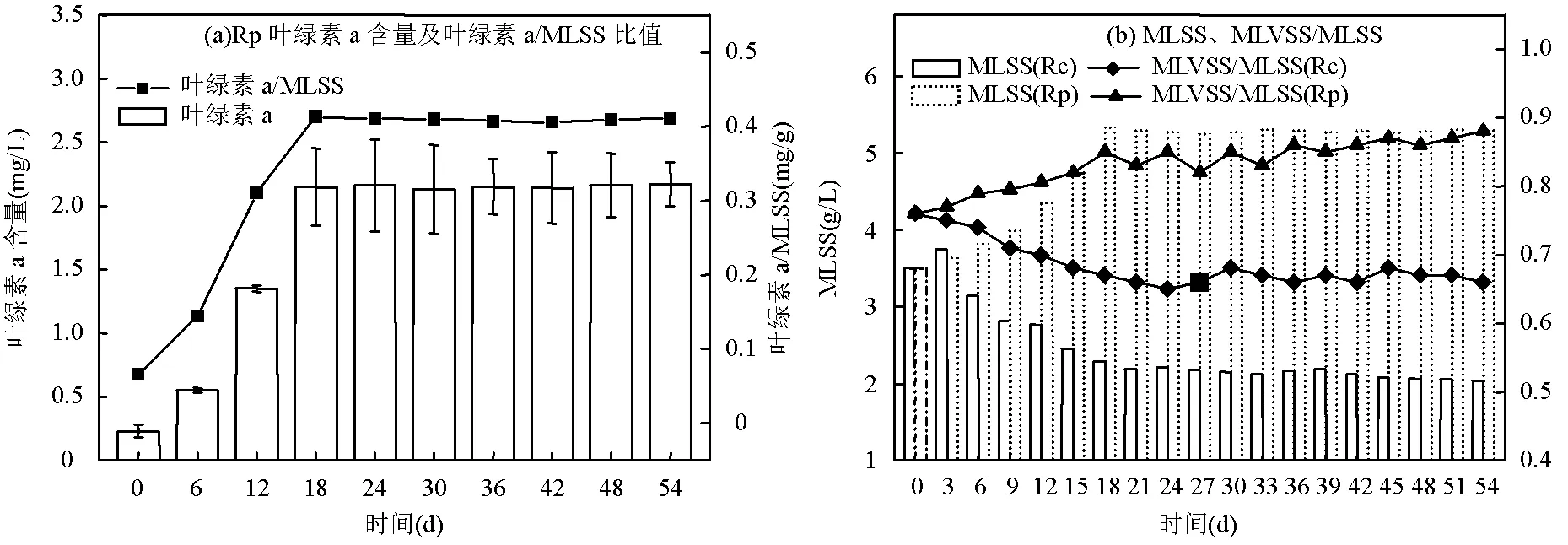
如图1(a)所示, Rp系统中叶绿素a含量呈现显著增加后趋于稳定的变化趋势.叶绿素a/MLSS比值显著增加,在第18d达到峰值0.41mg/g,随后趋于稳定(0.41 ± 0.05) mg/g.结果表明,接种藻类在Rp系统内适应良好,不需要补充接种藻类,18d后Rp反应器内藻类与细菌实现了良好的协同共生,形成了稳定的ABGS[8,16],这与Zhang等[17]的研究结果相近.
图1(b)为反应器内污泥MLSS和MLVSS/MLSS的变化情况.初始接种颗粒污泥MLSS为3.50g/L, MLVSS/MLSS比值为0.76,可生化性高.培养过程中,Rp系统内MLSS不断增加,随后趋于稳定(5.25~5.30g/L), MLVSS/MLSS比值增加至0.88; Rc系统内MLSS在前3d略有增加,随后显著下降至2.04g/L, MLVSS/MLSS比值降低至0.66.分析认为,在非曝气条件下, Rc系统内缺氧导致微生物大量死亡,颗粒污泥破碎解体、结构松散,沉降性能较差的污泥易随出水排出.相比之下,Rp系统内颗粒结构更加致密而稳定.
图1(c)为反应器内颗粒污泥SVI5的变化情况. Rp系统内污泥的SVI5在接种初期存在小幅波动,随后下降并稳定在33.90~36.70mL/g之间.Rc系统内的SVI5呈持续增加的趋势,在实验末期上升至71.85mL/g.结果表明, ABGS具有良好的沉降性能与可生化性,与之相反的是, AGS的沉降性能未见明显的恢复迹象.
图1(d)为反应器内颗粒污泥的完整性系数变化情况.完整性系数数值越低表示颗粒污泥的相对强度越大、结构稳定性越强[18]. Rp内颗粒的完整性系数始终维持在2.9%~4.1%范围内,在接种初期该值小幅上升后迅速降低至2.9%,说明ABGS系统对非曝气的培养条件可以进行快速调整和积极响应. Rc系统内颗粒的完整性系数从接种时的3.8%持续增加到16.7%.以上结果表明,非曝气环境对AGS颗粒稳定性产生了一定负面影响,但ABGS颗粒污泥在非曝气条件下仍具有良好的颗粒结构稳定性.
2.2 污泥形态特征
由图2可知,运行9d后Rp系统内颗粒污泥逐渐变为绿色(图2(a)),说明绿藻在该反应器内适应性良好,生长速率较快.而此时Rc系统内颗粒污泥的边缘变得模糊(图2(e)),分析认为在非曝气条件下缺少适宜的水力剪切力导致了该现象发生.在实验进行至第54d时, Rp系统内颗粒污泥结构致密、形状规则(图2(b)).此时, Rc系统内颗粒污泥结构松散、形状不规则,部分颗粒污泥的结构出现了解体现象(图2(f)).
采用SEM进一步观察实验末期两个系统内颗粒污泥的微观形态.如图2c所示, Rp中成熟ABGS具有清晰的球形轮廓和致密光滑的表面结构,原生动物附着在颗粒污泥表面,表明出水水质良好[19].由高倍SEM图可以观察到Rp中颗粒表面富集了大量的杆状菌、链球菌和结构完整的藻细胞,以及少量的丝状菌,可见大量的孔隙和通道(图2d),分析认为孔隙和通道的存在有利于细菌的黏附,能够促进营养物质、代谢产物和氧气的传递,进而有利于保持较高的生物活性[20].然而, Rc中的成熟AGS表面粗糙不平,中心出现裂解,呈现不规则的颗粒状结构(图2g),这与其完整性系数最大的测量结果相一致.由高倍SEM图(图2h)可以观察到Rc中颗粒表面存在短棒状和球状细菌,但被大量丝状菌覆盖,导致氧气和营养物质传质受阻,核心部位被内源降解[21].

图2 两个反应器中颗粒污泥的形态学观察
2.3 污染物去除效能
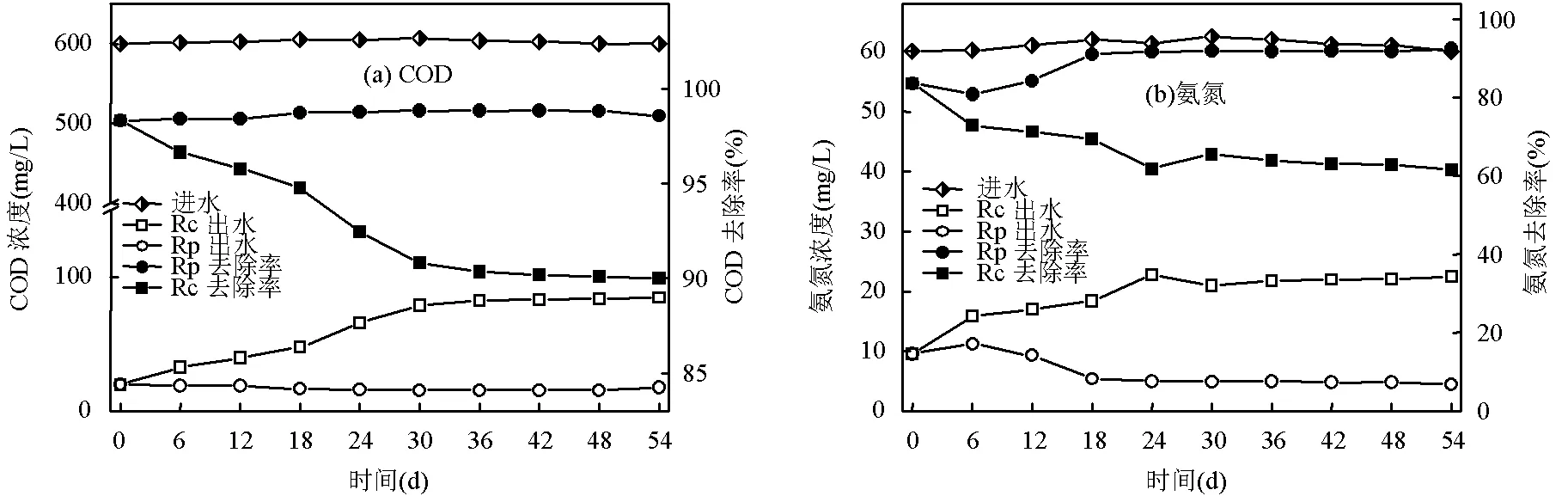
在反应器启动阶段,两个系统对于污染物的去除效率均存在波动,这是由于颗粒污泥对非曝气条件需要一定的适应期.随后Rp系统中污染物的去除效率明显提高,并在第18d趋于稳定(图3).与之相反的是, Rc反应器的去除效率显著降低.在相同的进水基质条件下(详见1.2节), Rp中COD、NH4+-N、TN和PO43--P的平均去除效率分别为98.70%、89.81%、87.14%和76.19%,与对照组Rc相比,分别提高了31.08%、23.97%、30.47%、22.17%.以上结果表明,在非曝气条件下,ABGS对有机物和氮磷等污染物的去除效果明显优于AGS.
2.4 EPS的变化
2.4.1 EPS含量的变化 由图4可知,两个系统内EPS总含量的变化趋势存在明显差异. Rp系统中EPS总含量呈持续增长的趋势,由最初的121.88mg/ g MLSS逐渐增加至155.99mg/g MLSS,其中LB- EPS含量基本维持稳定, TB-EPS含量显著升高(图4a). Rc系统中EPS总含量呈持续下降的趋势,下降至82.55mg/g MLSS,其中LB-EPS含量小幅度增加, TB-EPS含量急剧减少(图4b).以上结果表明, LB- EPS含量增加、TB-EPS含量减少是颗粒污泥稳定性出现差异的主要原因,并且TB-EPS对颗粒稳定性的贡献大于LB-EPS[22].进一步分析发现,两个系统内LB-EPS和TB-EPS中PS含量均未出现明显变化,而TB-EPS中PN含量变化显著. Rp中PN含量由最初的85.46mg/g MLSS增加至114.36mg/g MLSS,约为Rc(41.21mg/g MLSS)的2.8倍,研究表明PN在维持颗粒污泥稳定性方面具有重要作用[23],当颗粒污泥PN/PS值在3~8之间[24],颗粒污泥具有较好的稳定性.本研究中, Rp的PN/PS从4.57增加至5.38,Rc的PN/PS由4.57降低至3.64.较高的PN/PS比值表明其污泥表面具有较高的表面疏水性和较低的表面电荷,有助于维持颗粒污泥结构的稳定性[25].

图4 系统中颗粒污泥LB-EPS和TB-EPS含量及PN/PS的变化情况
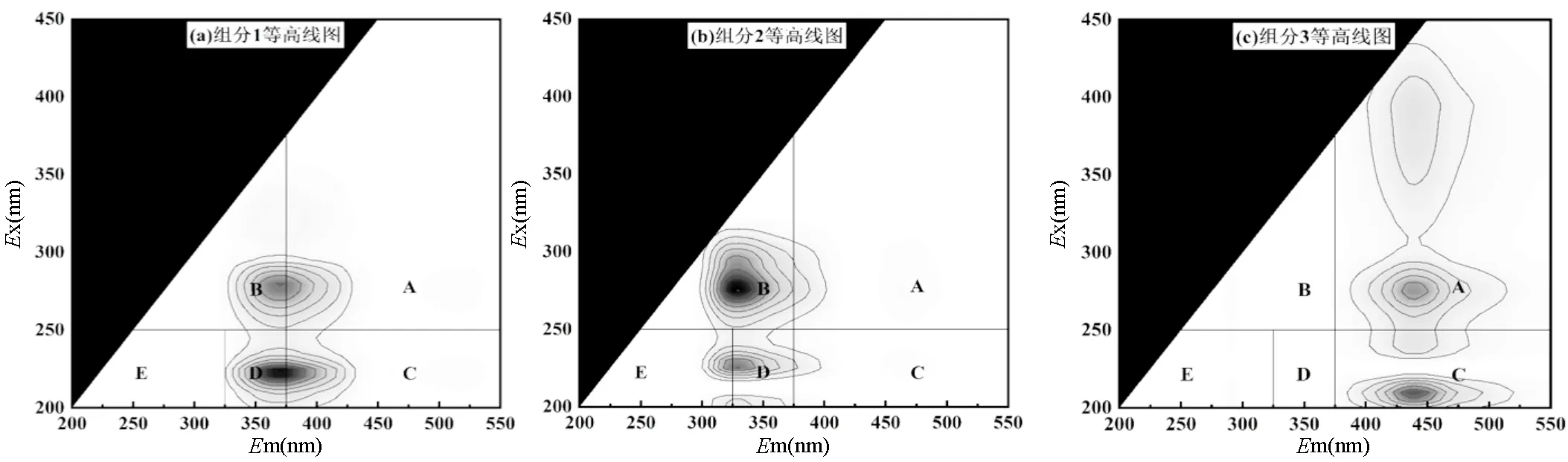
2.4.2 EPS组分分析 图5为接种颗粒污泥、Rc和Rp系统内颗粒污泥的EPS提取物的荧光光谱图.根据Chen等[26]的分类方法,将荧光光谱图分成5个区域:区域A(Ex>250,Em>380)胡敏酸类物质;区域B(Ex>250,Em<380)溶解性微生物副产物,主要是蛋白质衍生的氨基酸和色氨酸;区域C(Ex<250, Em>380)富里酸类物质;区域D(Ex<250, 330 图5 颗粒污泥LB-EPS和TB-EPS的3D-EEM图谱 如图6(g-h)所示, TB-EPS中3种组分的荧光强度与LB-EPS相比均有所提高,其中组分1的荧光强度从824.56(LB-EPS)提高至2566.26(TB-EPS),增加了2.11倍,组分2的荧光强度从709.18(LB-EPS)提高至3066.35(TB-EPS),增加了3.32倍.该结果与前面三维荧光图谱荧光强度对比结果相吻合.此外,可以观察到在TB-EPS中, Rc中组分1和组分2的荧光强度均低于接种颗粒污泥和Rp中对应组分的荧光强度.结合AGS和ABGS系统中颗粒污泥的理化特性,得出TB-EPS中组分1氨基酸、色氨酸和芳香族蛋白质物质、组分2络氨酸和色氨酸类物质含量的增加是维持颗粒结构稳定性的重要原因. 3种颗粒污泥中微生物群落的丰富度和多样性列于表1.3个样品的物种覆盖率均大于99%,表明测序结果能较好地反映样品中微生物分类的真实性.在非曝气条件下, Rc和Rp中获得的具有97%聚类相似性的优化序列分别为35805和42742,均大于初始接种颗粒污泥(33813).对比表1中不同污泥样品ACE和Chao1指数可知, Rp系统中微生物种群丰富度高于Rc.此外, Rp系统中Shannon指数为4.54,高于Rc(4.06)和接种颗粒污泥(3.83), Rp的Simpson指数为(0.028)小于Rc(0.053)和接种颗粒污泥(0.063).以上结果可以得出, Rp系统内物种多样性、群落丰富度更高,说明ABGS的形成有利于提高物种多样性和群落丰富度,进而有利于抵御外界不良环境的干扰以及维持系统的稳定性[17]. 表1 基于97%相似度聚类的OTU数目以及微生物群落丰富度和多样性 在门分类水平上,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)是3个污泥样品中的主要优势菌群(如图7所示).研究表明,这两类细菌具有较强的降解有机物和氨氮的能力[28].ABGS中绿弯菌门(Chloroflexi)的相对丰度由初始接种污泥的2.31%增加至13.15%.绿弯菌门(Chloroflexi)可以与丝状菌相互缠绕形成稳定的聚合物结构,在污泥造粒过程中可作为核心或载体形成污泥颗粒的初始骨架,加固颗粒污泥的结构稳定性[29]. Rp的ABGS中浮霉菌门(Planctomycetes)的相对丰度由初始接种污泥的0.90%增加至1.85%,约是Rc中AGS(0.62%)的3倍.此类细菌可以亚硝酸盐作为电子受体,以CO2作为碳源,通过厌氧氨氧化作用获取能量[30].初始接种污泥中几乎不存在蓝藻门(Cyanobacteria),而ABGS中蓝藻门(Cyanobacteria)含量约为1.75%.光照会诱导蓝藻生长,但系统内绿藻的生长以及交替的明暗条件限制了蓝藻的过度生长[8,31]. 在纲分类水平上,γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)和拟杆菌纲(Bacteroidia)仍是两个系统内的优势菌群,但其相对丰度存在差异.其中, Rc中与EPS分泌有关的γ-变形菌纲(Gammaproteobacteria)的相对丰度由接种污泥的56.84%降低至32.59%,这可能是导致EPS含量下降的主要原因(图4)[32].此外, ABGS中属于绿弯菌门的厌氧绳菌纲(Anaerolineae)其相对丰度增加了4.7倍.这类细菌可以有效降解碳水化合物[33],同时该类细菌可参与到生物除磷过程中[34].以上结果可以得出,ABGS的形成在一定程度上改变了系统内特征菌群的相对丰度,选择性地促进或者抑制某些特定的细菌种类,从而构建了稳定的菌藻共生环境. 图7(c)显示了Rp系统中的藻类在属水平上的相对丰度.从属分类水平上来看, Rp中真核藻类群落主要由绿藻纲的栅藻()和小球藻()组成.对比发现,栅藻()的相对丰度(48.34%)高于小球藻()的相对丰度(37.95%),这与刘琳等[8]研究结果相似.这两种藻类均具有高效同化氮、磷的能力[35],可在黑暗阶段去除COD、氨和磷酸盐等营养物质[36].此外, Rp中硅藻门(Bacillariophyta)下菱形藻属()的相对丰度为1.31%,有研究表明ABGS中的快速增长可以促进营养物质的去除[37].因此,ABGS具有良好的去除污染物效能,可能是由于这3种藻属的富集和生长.本文 ABGS系统中有接近12%的藻类物种未分类,未分类的藻类物种是否影响菌-藻共生体系稳定性,需要进一步研究其种类和功能. 3.1 在非曝气条件下成功构建了ABGS系统,与传统的AGS相比,ABGS的MLSS稳定在5.25~5.30g/L、SVI5稳定在33.90~36.70mL/g、完整性系数维持在2.9%~4.1%,此外, ABGS对COD、NH4+- N、TN和PO43--P的平均去除率与AGS相比提高了22%~31%,表明ABGS具有更加优良的沉降性能、更致密的结构、更高的生物活性,更优异的除污效能以及更高的机械强度. 3.2 通过分析EPS的含量可知, ABGS中TB- EPS对颗粒结构稳定性的贡献大于LB-EPS, TB- EPS中的PN含量明显增加,从85.46mg/g MLSS增加至114.36mg/g MLSS,约为Rc(41.21mg/g MLSS)的2.8倍, PN含量的增加提高了污泥的表面疏水性,有助于微生物相互凝聚以及维持稳定的颗粒结构. 3.3 进一步分析EPS的荧光组分,TB-EPS中氨基酸和色氨酸及芳香族蛋白质物质、络氨酸和色氨酸类物质是维持颗粒结构稳定性的重要原因. 3.4 与AGS相比, ABGS的物种多样性和群落丰富度更高,原核生物绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes)、真核生物栅藻()和小球藻()是系统中富集的优势物种,菌藻之间的共生关系有利于加强系统稳定性. [1] Sarma S J, Tay J H, Chu A. Finding knowledge gaps in aerobic granulation technology [J]. Trends in Biotechnology, 2017,35(1):66- 78. [2] van Loosdrecht M C M, Brdjanovic D. Anticipating the next century of wastewater treatment [J]. Science, 2014,344(6191):1452-1453. [3] Pronk M, de Kreuk M K, de Bruin B, et al. Full scale performance of the aerobic granular sludge process for sewage treatment [J]. Water Research, 2015,84:207-217. [4] Zhang Q, Hu J, Lee D. Aerobic granular processes: Current research trends [J]. Bioresource Technology, 2016,210(SI):74-80. [5] Lee D, Chen Y, Show K, et al. Advances in aerobic granule formation and granule stability in the course of storage and reactor operation [J]. Biotechnology Advances, 2010,28(6):919-934. [6] Nancharaiah Y V, Reddy G K K. Aerobic granular sludge technology: Mechanisms of granulation and biotechnological applications [J]. Bioresource Technology, 2018,247:1128-1143. [7] Ahmad J S M, Zhao Z, Zhang Z, et al. Algal-bacterial aerobic granule based continuous-flow reactor with effluent recirculation instead of air bubbling: Stability and energy consumption analysis [J]. Bioresource Technology Reports, 2019,7:100215. [8] Liu L, Zeng Z, Bee M, et al. Characteristics and performance of aerobic algae-bacteria granular consortia in a photo-sequencing batch reactor [J]. Journal of Hazardous Materials, 2018,349:135-142. [9] Ji B, Zhang M, Gu J, et al. A self-sustaining synergetic microalgal- bacterial granular sludge process towards energy-efficient and environmentally sustainable municipal wastewater treatment [J]. Water Research, 2020,179:115884. [10] Zhang B, Li W, Guo Y, et al. A sustainable strategy for effective regulation of aerobic granulation: Augmentation of the signaling molecule content by cultivating AHL-producing strains [J]. Water Research, 2020,169:115193. [11] 国家环境保护总局.水和废水监测分析方法 [M]. 4 版.北京:中国环境科学出版社, 2002:210-284. The State Environmental Protection Administration. Standard methods for the examination of water and wastewater [M]. 4th Edition. Beijing: China Environmental Science Press, 2002:210-284. [12] Zhao Z, Yang X, Cai W, et al. Response of algal-bacterial granular system to low carbon wastewater: Focus on granular stability, nutrients removal and accumulation [J]. Bioresource Technology, 2018,268:221-229. [13] Ghangrekar M M, Asolekar S R, Joshi S G. Characteristics of sludge developed under different loading conditions during UASB reactor start-up and granulation [J]. Water Research, 2005,39(6):1123-1133. [14] Li H, Yue W, Cao A, et al. The influence of multivalent cations on the flocculation of activated sludge with different sludge retention times [J]. Water Research, 2014,55C(2):225-232. [15] Dubios M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugar and related substances [J]. Analytical Chemistry, 1956,28:250-256. [16] 刘 琳,叶嘉琦,刘玉洪,等.好氧污泥-微藻耦合颗粒的培养及特性研究[J]. 中国环境科学, 2017,37(7):2536-2541. LIU L, YE J Q, LIU Y H, et al. Research on the development and properties of aerobic sludge-microalgae granular system [J]. China Environmental Science, 2017,37(7):2536-2541. [17] Zhang Y, Dong X, Liu S, et al. Rapid establishment and stable performance of a new algal-bacterial granule system from conventional bacterial aerobic granular sludge and preliminary analysis of mechanisms involved [J]. Journal of Water Process Engineering, 2020,34:101073. [18] Corsino S F, Capodici M, Torregrossa M, et al. Physical properties and Extracellular Polymeric Substances pattern of aerobic granular sludge treating hypersaline wastewater [J]. Bioresource Technology, 2017, 229:152-159. [19] Lemaire R, Webb R I, Yuan Z. Micro-scale observations of the structure of aerobic microbial granules used for the treatment of nutrient-rich industrial wastewater [J]. Isme Journal, 2008,2(5):528. [20] Long B, Xuan X, Yang C, et al. Stability of aerobic granular sludge in a pilot scale sequencing batch reactor enhanced by granular particle size control [J]. Chemosphere, 2019,225(JUN.):460-469. [21] 张 冰.菌藻共生好氧颗粒污泥的形成机理及基于QS的强化机制 [D]. 哈尔滨:哈尔滨工业大学, 2020. Zhang B. The formation and enhancement mechanisms of algal- bacterial symbiotic granular sludge based on quorum sensing [D]. Harbin:Harbin Instituteof Technology, 2020. [22] Yuan D Q, Wang Y L, Feng J. Contribution of stratified extracellular polymeric substances to the gel-like and fractal structures of activated sludge [J]. Water Research, 2014,56(jun.1):56-65. [23] Lotti T, Carretti E, Berti D, et al. Hydrogels formed by anammox extracellular polymeric substances: structural and mechanical insights [J]. Scientific Reports, 2019,9(1):11633. [24] Feng C, Lotti T, Lin Y, et al. Extracellular polymeric substances extraction and recovery from anammox granules: evaluation of methods and protocol development [J]. Chemical Engineering Journal, 2019,374:112-122. [25] Zhang L, Feng X, Zhu N, et al. Role of extracellular protein in the formation and stability of aerobic granules [J]. Enzyme and Microbial Technology, 2007,41(5):551-557. [26] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation- emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science & Technology, 2015,37(24): 5701-5710. [27] Wei D, Dong H, Wu N, et al. A fluorescence approach to assess the production of soluble microbial products from aerobic granular sludge under the stress of 2,4-dichlorophenol [J]. Scientific Reports, 2016, 6(1):24444. [28] Zhong Z, Wu X, Gao L, et al. Efficient and microbial communities for pollutant removal in a distributed-inflow biological reactor (DBR) for treating piggery wastewater [J]. RSC Advances, 2016,6(98):95987- 95998. [29] Li X R, Du B, Fu H X, et al. The bacterial diversity in an anaerobic ammonium-oxidizing (anammox) reactor community [J]. Systematic & Applied Microbiology, 2009,32(4):278-289. [30] Kartal B, Kuenen J G, Loosdrecht M V. Sewage treatment with anammox [J]. Science, 2010,328(5979):702-703. [31] Pei H, Xu H, Wang J, et al. 16S rRNA gene amplicon sequencing reveals significant changes in microbial compositions during cyanobacteria-laden drinking water sludge storage [J]. Environmental Science & Technology, 2017,51(21):12774. [32] He Q, Zhou J, Wang H, et al. Microbial population dynamics during sludge granulation in an A/O/A sequencing batch reactor [J]. Bioresource Technology, 2016,214:1-8. [33] Narihiro T, Terada T, Ohashi A, et al. Quantitative detection of previously characterized syntrophic bacteria in anaerobic wastewater treatment systems by sequence-specific rRNA cleavage method [J]. Water Research, 2012,46(7):2167-2175. [34] Caroline K, Levantesi C, Arjan B, et al. Identity, abundance and ecophysiology of filamentous Chloroflexi species present in activated sludge treatment plants [J]. FEMS Microbiology Ecology, 2007,(3): 671-682. [35] Cai T, Park S Y, Li Y. Nutrient recovery from wastewater streams by microalgae: Status and prospects [J]. Renewable and Sustainable Energy Reviews, 2013,19:360-369. [36] Perez-Garcia O, Escalante F, De- Ba Shan L E, et al. Heterotrophic cultures of microalgae: Metabolism and potential products [J]. Water Research, 2011,45(1):11-36. [37] Meng F, Huang W, Liu D, et al. Application of aerobic granules- continuous flow reactor for saline wastewater treatment: Granular stability, lipid production and symbiotic relationship between bacteria and algae [J]. Bioresource Technology, 2020,295. The stability mechanism of algal-bacterial granular sludge. LIU Yi1, ZHANG Bing1, SHI Wen-Xin1*, ZHU Yi-chun2, LIU Zu-wen2 (1.Key Laboratory of Three Gorges Reservoir Region’s Eco-Environment, Ministry of Education, College of Environment and Ecology, Chongqing University, Chongqing 400045, China;2.School of Civil and Surveying&Mapping Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China)., 2022,42(4):1696~1705 A stable algal-bacterial granular sludge (ABGS) system was established rapidly within 18 days by inoculating with aerobic granules and targeted algae (and) under non-aeration conditions. The results indicated that ABGS had higher biological activity, better nutrients removal performance, and higher mechanical strength than the conventional AGS, indicating the superior stability of ABGS. Moreover, the content of protein (PN) in extracellular polymeric substances (EPS), especially tightly bound layer EPS (TB-EPS), was found increasing significantly during the granulation. Specifically, the PN content of 114.4mg/g MLSS at the end of the operation was about 2.8 times higher than that of AGS. Further analysis of EPS components by three-dimensional fluorescence spectroscopy showed that amino acids, tryptophan, aromatic proteins, complex amino acids and tryptophan-like substances in TB-EPS were conducive to maintain the structural stability of granular sludge. In terms of microbial community structure, the ABGS had a higher microbial diversity and community richness than AGS. The enrichment of the prokaryotic Chloroflexi and Planctomycetes, and the eukaryotic Chlorophyta was beneficial to enhance the stability of the system. algal-bacterial granular sludge (ABGS);system stability;extracellular polymeric substances (EPS);microbial community structure X703 A 1000-6923(2022)04-1696-10 刘 怡(1997-),女,重庆合川人,重庆大学硕士研究生,研究方向为污水生物处理技术. 2021-09-01 国家自然科学基金资助项目(51778172,52000014) *责任作者, 教授, swx@hit.edu.cn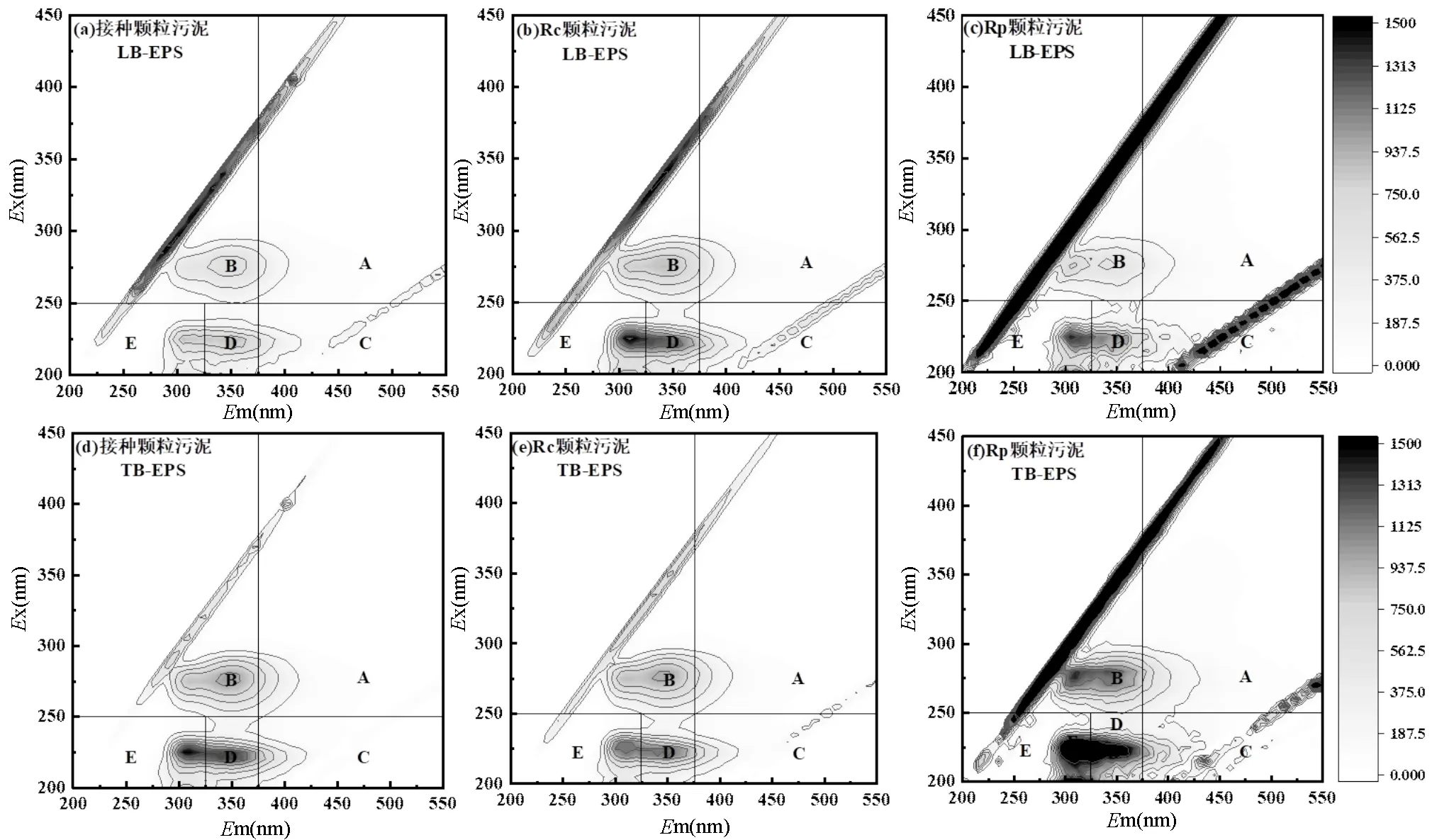
2.5 微生物群落结构

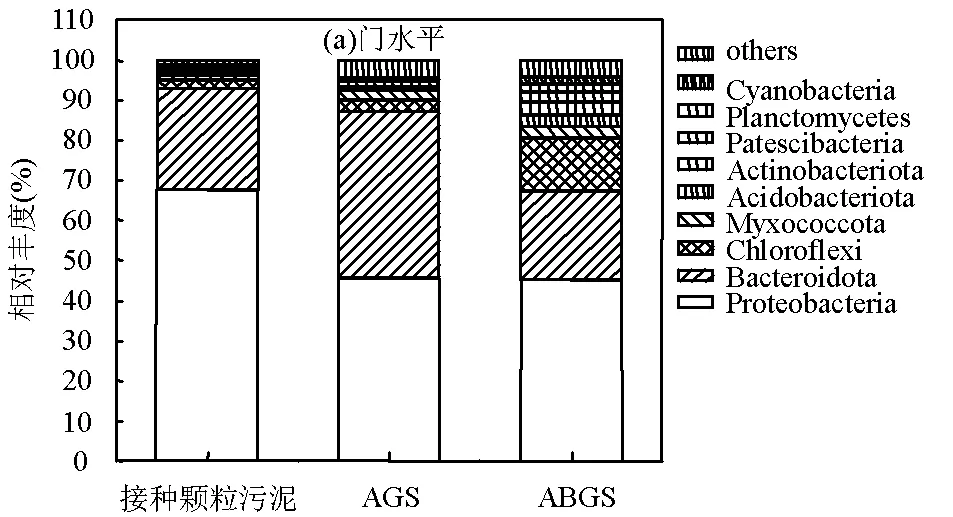
3 结论
