2021版CSCO胃癌诊疗指南转移性胃癌更新解读
2022-04-24陈俊良王风华
陈俊良 王风华
作者单位:中山大学肿瘤防治中心肿瘤内科,华南肿瘤学国家重点实验室,肿瘤医学协同创新中心(广州市510060)
胃癌是侵袭性强和转移率高的肿瘤。在中国,60%以上的患者就诊时已属局部晚期或进展期,晚期胃癌的占比和死亡率明显高于东亚其他胃癌高发国家[1]。对于晚期或转移性胃癌患者,目前公认采取以全身抗肿瘤药物治疗为主的综合治疗延长患者生存时间和改善患者生存质量。近年来转移性胃癌的的多学科综合治疗模式和全程全方位管理得到广泛关注。相关指南的制定强调融合国内外最新的临床研究进展,关注中国人群研究数据,贴近本国临床实践。针对转移性胃癌诊治,2021年4月发布的2021 版中国临床肿瘤学会(CSCO)胃癌诊疗指南[2]更新主要包括:1)抗肿瘤药物治疗选择重点聚焦免疫治疗。2020年是晚期胃癌免疫治疗取得重大突破的一年,多个重磅研究结果相继发布,2021 版CSCO 指南从新的临床证据出发,针对免疫治疗从一线到三线,不同的程序性死亡受体-1(programmed cell death 1,PD-1)单抗药物选择,不同的适用人群都作出了详细推荐及注释,以期规范免疫治疗在晚期胃癌的应用;2)靶向药物治疗方面关注HER2 阳性胃癌治疗进展,增加抗HER2 的新型抗体药物偶联物(antibody drug conjugate,ADC)类药物的阐述;3)强调胃癌的全方位管理,新增胃癌支持治疗章节,包括胃癌的营养支持及并发症处理。
1 免疫治疗在HER2 阴性胃癌的一线治疗推荐
2021 版指南对于晚期胃癌免疫治疗更新推荐从三线到一线,从单药到联合化疗,错配修复缺陷/高度微卫星不稳定(different mismatch repair/microsatellite instability-high,dMMR/MSI-H)胃癌人群从晚期到早期围手术期免疫治疗的管理。更新要点包括:1)HER2 阴性晚期胃癌,程序性死亡配体-1(programcell death-ligand 1,PD-L1) 综合阳性评分(combined positive score,CPS)≥5 分患者一线治疗增加化疗联合纳武利尤单抗,Ⅰ级推荐(ⅠA 类证据);2)HER2 阴性晚期胃癌,PD-L1 CPS≥1 分患者一线治疗增加帕博丽珠单抗单药,Ⅲ级推荐(ⅠB 类证据);3)晚期dMMR/MSI-H 人群增加帕博丽珠单抗单药,Ⅱ级推荐(2A 类证据),2020 版指南仅以注释内容体现;4)dMMR /MSI-H 患者围手术期治疗管理,2020 版指南推荐术后观察或参与临床研究(Ⅱ级推荐,1B 类证据),2021 版CSCO 指南仅以注释内容呈现,建议优先推荐患者参加临床研究 ,其次建议与患者及家属详细沟通可选择根治术后观察或化疗。
1.1 免疫治疗在HER2 阴性胃癌的一线治疗的疗效探索
关于胃癌一线免疫治疗探索,从联合治疗来看,目前已公布结果的对比PD-1 单抗联合化疗与单纯化疗的大型国际多中心Ⅲ期随机对照研究如下。2019年美国临床肿瘤学会(ASCO)公布的KEYNOTE-062结果显示对于PD-L1 CPS≥1 分患者,化疗(卡培他滨或5-FU+顺铂)联合帕博利珠单抗对比单纯化疗未显著延长胃癌患者生存时间[3]。2020年欧洲肿瘤内科学会(ESMO)公布的CheckMate-649 研究[4]和ATTRACTION-4 研究[5]阳性结果改写胃癌一线治疗格局。CheckMate-649 研究论证了首要研究终点的阳性结果,即在PD-L1 CPS≥5 分的患者中,纳武利尤单抗联合化疗较化疗显著延长患者中位总生存期(median overall survival,mOS)(14.4 个月vs.11.1 个月)和中位无进展生存期(median progression-free survival,mPFS)(7.7 个月vs.6.0 个月),次要研究终点CPS≥1分和全人群中的PFS 和OS 的统计学意义有所改善,客观有效率(objective response rate,ORR)提高,且安全性可接受,基于此研究结果,2021 美国国家综合癌症网络(NCCN)V1 版胃癌指南[6]对于CPS≥5 分胃癌患者推荐一线化疗联合纳武利尤单抗。针对部分亚洲人群的ATTRACTION-4 研究证实纳武利尤单抗联合化疗(SOX 或XELOX)较单纯化疗,显著改善PFS(10.45 个月vs.8.34 个月)和提高ORR(57.5%vs.47.8%),但二者OS 相近(17.45 个月vs.17.15 个月),主要原因考虑到两组后续接受免疫治疗的患者比例不同。综合考量已有的研究结果,2021版CSCO胃癌指南对于晚期HER2 阴性且PD-L1 CPS≥5 分胃癌患者的一线治疗,纳武利尤单抗联合FOLFOX(奥沙利铂+亚叶酸钙+5-FU 化疗方案)/XELOX(奥沙利铂+卡培他滨化疗方案)/SOX(奥沙利铂+替吉奥化疗方案)作为Ⅰ级推荐(ⅠA 类证据)。
基于上述的2020 ESMO 公布的CheackMate-649 研究结果,2021年4月美国食品药品监督管理局(FDA)批准纳武利尤单抗+化疗作为晚期胃腺癌全人群(无论CPS 状态)的一线治疗方案。2021年6月ASCO 报道了CheackMate-649 研究所有随机人群进一步的疗效和安全性数据,结果显示纳武利尤单抗+化疗对比化疗,OS 和PFS 持续的临床意义的改善,且反应持续时间也更长,患者健康相关生存质量(healthrelated quality of life,HRQoL)得到维持。2021年4月美国癌症研究协会(AACR)公布了CheckMate-649研究中208 例中国胃癌人群数据[4],显示纳武利尤单抗联合化疗取得具有临床意义生存获益和更高ORR,结果与全球整体人群的结果一致,且中国人群整体表现出更大的获益趋势,如死亡风险下降39%(全球人群20%),疾病进展风险下降43%(全球人群为23%)。2021年8月中国国家药品监督管理局(NMPA)批准纳武利尤单抗联合化疗方案一线治疗晚期或转移性胃癌且不受PD-L1表达水平限制。
2021年9月ESMO 会议汇报了ORIENT-16 研究的期中分析结果,这是一项比较信迪利单抗注射液联合化疗(奥沙利铂+卡培他滨)对比化疗一线治疗不可切除的局部晚期、复发性或转移性胃及胃食管交界处腺癌的有效性和安全性的随机、双盲、多中心、Ⅲ期研究,结果显示信迪利单抗联合化疗显著降低CPS≥5 分人群(HR=0.660,95%CI:0.505~0.864;P=0.002 3)和总体人群(HR=0.766,95%CI:0.626 ~0.936;P=0.009 0)的死亡风险,达到预设的优效性标准;mOS在CPS≥5 分人群延长5.5 个月(mOS 18.4 个月vs.12.9 个月),总体人群延长2.9 个月(mOS 15.2 个月vs.12.3 个月)。OS 在预设的所有亚组分析中获益趋势一致。ORR 更高(ORR:58.2%vs.48.4%),中位缓解持续时间(duration of response,DOR)(9.8 个月vs.7.0 个月)更长,安全性特征与既往报道的信迪利单抗相关临床研究结果一致,无新的安全性信号。同时,ORIENT-16 研究的期中分析结果为在中国胃癌患者中应用信迪利单抗联合化疗作为一线治疗提供了一定的理论支持。且ORIENT-16 研究的期中分析结果表明,无论PD-L1表达高低,中国胃癌患者中应用信迪利单抗联合化疗作为一线治疗均能有生存获益。
1.2 免疫治疗在HER2 阴性胃癌的一线治疗的适应证和选择人群的探索
全人群适应证的批准的合理性临床实践中存在争议。从支持角度来看,PD-L1表达水平与获益人群之间关系不明确,表达阴性人群亦有获益,一线治疗全人群适应证批准可让更多患者从一线免疫联合治疗获益机会。目前,PD-L1表达人群的选择面临困境,因为从抗体选择、组织病理样本送检和检测过程执行和结果判读等均给PD-L1表达作为胃癌免疫治疗生物标志物临床应用带来挑战,比如PD-L1表达存在时空异质性,PD-L1 检测的标准化缺乏,不同检测平台结果难以推广,真实世界中的PD-L1表达检测和研究中的差距巨大等。然而, CheackMate-649 研究亚组分组显示,与化疗相比纳武利尤单抗+化疗的OS 和PFS 获益随PD-L1 CPS 临界值增高而增加,在所有临界值 (包括CPS<1 分和CPS<5 分) 中的ORR 皆更高[4]。免疫治疗的临床实践中考虑到免疫治疗相关毒性、免疫治疗后疾病快速进展的现象即超进展(hyperprogressive disease,HPD)等不利因素,临床上对于PD-L1 CPS<5 分,尤其CPS<1 分患者的一线免疫联合化疗选择或许需要保持一定慎重态度。中国总体经济水平发展目前存在不平衡状况,批准全人群可能给国家和个体带来较低的性价比,治疗选择还应兼顾患者的经济能力和意愿。
胃癌一线免疫治疗单药选择策略来看, KEYNOTE-059 队列3[7]显示,在PD-L1 CPS≥1 分患者中,帕博利珠单抗单药ORR 为26%,mPFS 为3.3 个月、mOS 达20.7 个月;Ⅲ期研究KEYNOTE-062 中,对PD-L1 CPS≥1 分患者,帕博利珠单抗单药组的mPFS(2.0 个月vs.6.4 个月)和ORR(14.8%vs.37.2%)劣于化疗组,但DOR 优于化疗组(13.7 个月vs.6.8 个月),mOS 非劣效于化疗组(10.6 个月vs.11.1 个月,HR=0.91),对于PD-L1 CPS≥10 分患者,帕博利珠单抗相比化疗带来有临床意义的OS 改善(17.4 个月vs.10.8 个月,HR=0.69)。OS 曲线和PFS 曲线早期交叉,提示帕博利珠单抗单药未能避免肿瘤早期进展问题。因此,指南在PD-L1 CPS≥1 分患者的一线治疗中目前不常规推荐免疫治疗单药,建议仅在患者存在化疗禁忌证或拒绝化疗时进行考虑,同时尽量维持患者体力状况及营养功能,也提示需要进一步深化分析临床病理特征、分子特征等,让特殊人群患者在特定的治疗模式下取得更多获益。
2 免疫治疗在dMMR/MSI-H 胃癌人群的治疗推荐
dMMR/MSI-H 不仅具有遗传性疾病筛查和预后分层等传统临床意义,近年更是公认的免疫治疗疗效预测标志物[8]。2021年V1 版胃癌NCCN 指南做出建议所有新诊断的胃癌患者行MSI/MMR 常规检测。2021版CSCO胃癌指南中,dMMR/MSI 检测作为治疗指导和预后的分子标记(Ⅰ级推荐,ⅠB 类证据),新增注释对MMR 蛋白检测和MSI 检测进行说明。
对于晚期转移性胃癌,KEYNOTE-061 研究[9]结果显示与标准化疗紫杉醇相比,帕博利珠单抗单药二线治疗未显著改善PD-L1 CPS≥1 分患者的OS,免疫检查点抑制剂在晚期胃癌单药二线治疗地位尚未确立,不推荐在临床实践中常规单独或联合应用。对于复发转移dMMR/MSI-H 胃癌人群二线治疗,2021 版CSCO 指南推荐帕博利珠单抗单药治疗(Ⅱ级推荐,2A 类证据)。一项纳入KENOTEN-059(队列1)、KENOTE-061、KENOTE-062 研究的结果显示对于MSI-H 的晚期胃癌/胃-食管连接部癌患者,帕博利珠单抗与化疗相比OS 和PFS 更长,帕博利珠单抗获得更高的ORR,在一线、二线、三线的ORR 分别为57.1%、46.7%、57.1%[10]。Ⅲ期研究KENOTE-177[11]奠定了免疫治疗在转移性dMMR/MSI-H 肠癌中优于化疗的一线治疗地位,对于dMMR/MSI-H 胃癌患者一线治疗地位的确立需要临床研究数据积累和专家共识。
对于可切除胃癌,推荐手术联合围手术期化疗或根治术后辅助化疗。然而,国外报道汇总显示dMMR/MSI-H 可切除胃癌患者预后良好,辅助化疗获益结果不一致,总体偏向于接受辅助化疗不能获益[12]。一项多中心 Meta 分析[13]纳入新辅助化疗的 MAGIC 研究及3 项辅助化疗的研究(包括CLASSIC、ARTIST 和ITACA-S),探索 MSI 状态与手术预后及围手术期化疗疗效的关系。结果显示,MSI 与无病生存率和OS独立相关,是一个可靠的预后指标,对于接受手术的MSI-H 的胃癌患者,围手术期或辅助化疗未能改善生存。总的来说,考虑到人群所占比太小,现有证据落实到临床实践还具有一定争议性,兼顾化疗相关不良反应和卫生经济学考量等,dMMR/MSI-H 胃癌(新)辅助治疗决策优先推荐患者参加免疫治疗临床研究,其次建议与患方详细沟通,选择术后观察或化疗。晚期胃癌免疫治疗主要临床试验总结见表1。
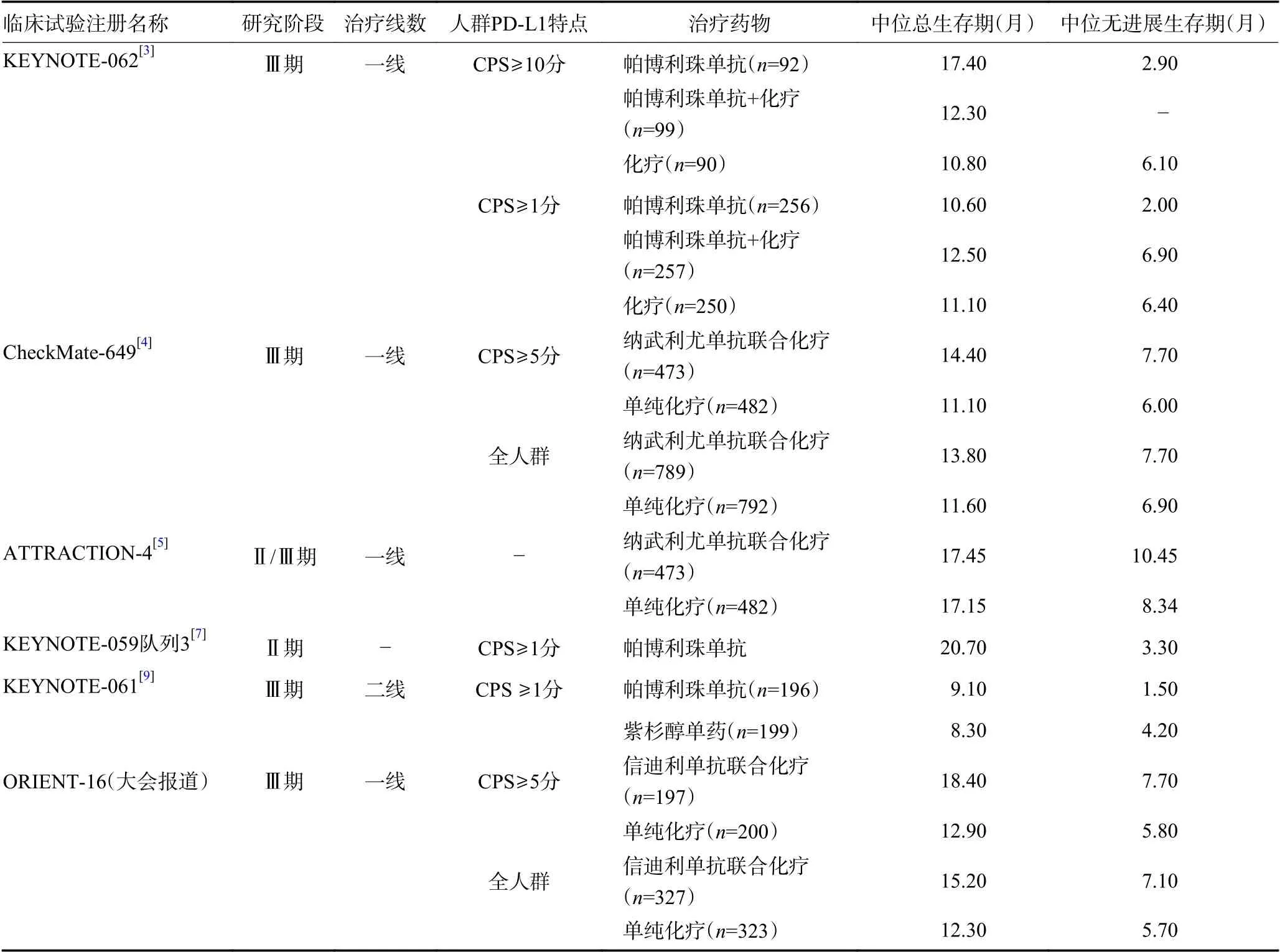
表1 晚期胃癌免疫治疗主要临床试验
3 HER2 阳性晚期胃癌后线治疗新突破
近年来关于HER2 阳性晚期胃癌后线治疗的治疗进展研究汇总见表2。2009年公布结果的ToGA研究[14]入组594 例HER2 免疫组织化学3+或FISH阳性的胃食管连接部和胃腺癌患者,随机分为曲妥珠单抗联合化疗组(顺铂及5-FU 或卡培他滨)和单纯化疗组,共进行6 个周期治疗,曲妥珠单抗持续应用至疾病进展,结果显示联合治疗组较单纯化疗组显著延长mOS(13.5 个月vs.11.1 个月,P=0.004 8),提高ORR(47.3%vs.34.5%,P=0.001 7),HER2 高水平表达者(免疫组织化学2+/FISH+或免疫组织化学3+)生存期达到16.0 个月。从总生存获益角度,其它针对HER2的靶向药物帕妥珠单抗[15]、拉帕替尼[16-17]、TDM-1[18]等在晚期胃癌的一线或二线治疗Ⅲ期研究结果均为阴性,主要原因目前归于胃癌的异质性。曲妥珠单抗联合化疗耐药后的治疗亟待解决。近年来,针对HER2的抗体药物偶联物药物成为研究热点。Trastuzumab deruxtecan (DS-8 201)是一种抗体偶联药物,由人源化的抗HER2 单克隆抗体,连接子和拓扑异构酶Ⅰ抑制剂组成。2021 版CSCO 指南以注释内容关注trastuzumab deruxtecan (DS-8 201)和维迪西妥单抗(RC48-ADC)在晚期胃癌后线治疗获得的研究结果。
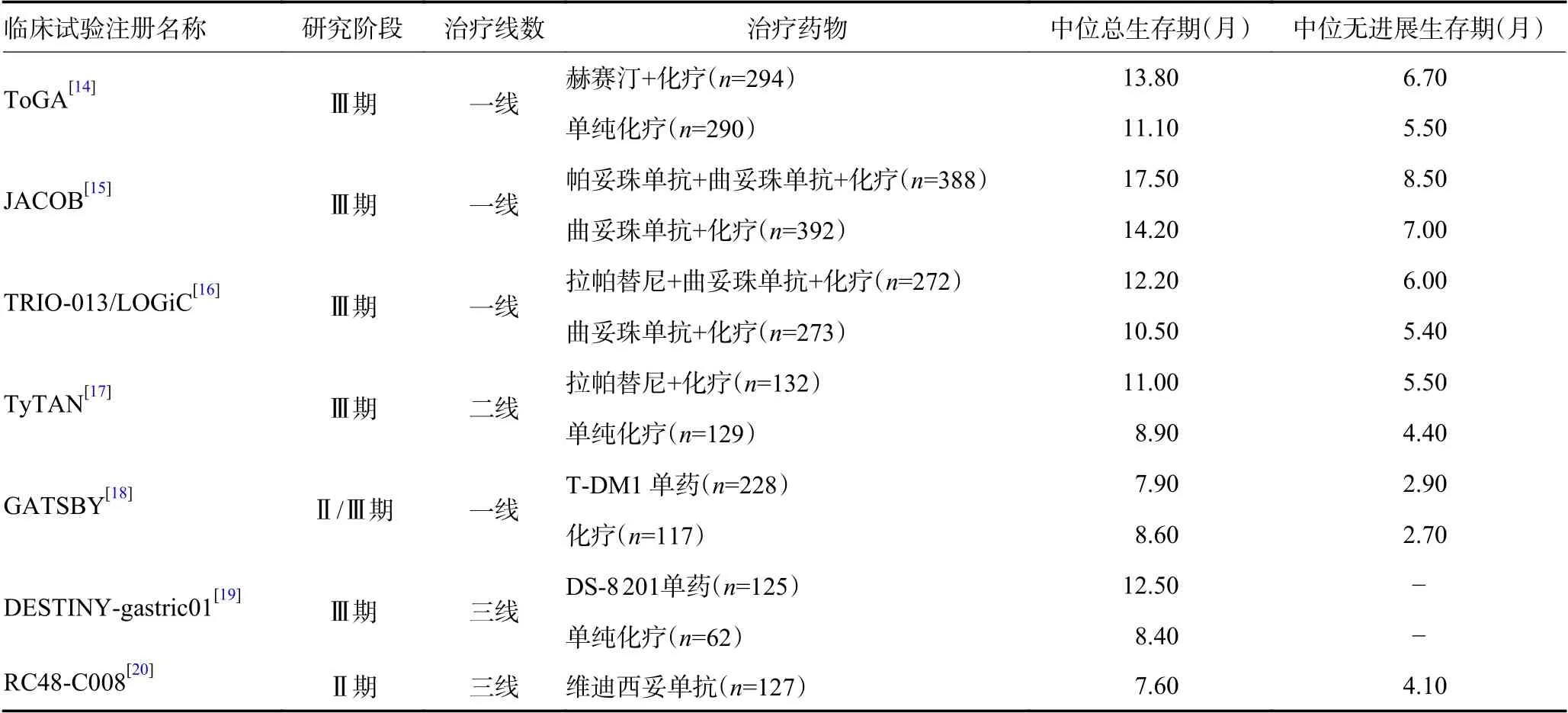
表2 HER2 阳性胃癌主要临床试验
DESTINY-gastric01 多中心Ⅱ期研究[19]评估DS-8201 对比化疗三线治疗HER2 阳性晚期胃癌患者的疗效和安全性。结果显示DS-8201 组(n=125)和化疗组(n=62)的ORR 分别是51.3%和14.3%,DOR 分别为11.3 个月和3.9 个月,mOS 分别为12.5 个月和8.4 个月。安全性方面,最常见的不良事件为胃肠道和血液学毒性,但有12 例(9.6%)患者发生DS-8 201相关性间质性肺病。DS-8 201 显著改善经曲妥珠单抗治疗的HER2 阳性胃癌患者的ORR 和OS,已先后在日本和美国获批适应证。
Ⅱ期研究RC48-C008 探索了维迪西妥单抗在既往至少接受过两线化疗的HER 阳性的转移性胃癌患者的疗效[20]。结果显示ORR 24.4%,疾病控制率为41.7%,mPFS 为4.1 个月,mOS 为7.6 个月。亚组分析显示,74 例既往接受过曲妥珠单抗治疗失败的患者ORR 为27%,其中60 例既往接受过3 线及以上治疗患者的ORR 为25.0%。安全性方面,常见不良事件为粒细胞减少、脱发、乏力、贫血、转氨酶升高、和感觉减退等,以轻中度为主。2021年6月,维迪西妥单抗被NMPA 获批上市用于HER2 中高表达(免疫组织化学2+或3+)晚期胃癌的三线及后线治疗。
4 晚期胃癌支持治疗
抗肿瘤治疗药物选择越来越多和治疗手段的多样化,晚期胃癌的治疗模式也不断发生改变,患者生存期不断延长,综合治疗的全程管理理念凸显重要,其最终目的是给患者带来最大的生存获益和生存质量改善。
指南中晚期胃癌治疗总则认为胃原发病灶的存在直接影响患者的营养摄入,同时可能导致大出血、消化道梗阻或穿孔、胆管梗阻等多种并发症。因此,胃癌全程管理需要强调整个抗肿瘤治疗过程中贯穿多学科综合治疗的理念,关注患者营养状况的维持、并发症的积极预防和及时处理等支持治疗。在中国胃癌患者中重度营养不良患者比例高达80.4%[21],一项探索早期营养及心理干预联合一线标准治疗对初诊晚期食管癌及胃癌患者生存获益的影响的随机对照Ⅲ期研究,共纳入328 例初诊晚期食管癌或胃癌患者,随机分配早期多学科支持治疗联合一线标准治疗组(ESC 组)或一线标准治疗组(SC 组),结果显示ESC组mOS 较SC 组显著延长(14.8 个月vs.11.9 个月;P=0.021),ORR 分别为32% 和27%,ESC 组患者在治疗后9 周的营养及心理评估均显著改善(均P<0.001),结果表明早期营养及心理支持治疗联合标准一线化疗是一种有效的干预措施,对比单纯化疗可显著延长晚期食管癌或胃癌患者的生存时间[22]。
2021 版CSCO 指南新增了胃癌的支持治疗部分,从“营养治疗”及“并发症处理”两个方面进行阐述。在营养治疗方面,建议使用营养风险查量表2002 和患者主观整体评估量表分别用于胃癌营养不良风险筛查和营养不良状态评估,辨别需要进行营养干预的患者,按照“五阶梯”原则给予相应的营养干预措施。大出血、梗阻和疼痛是晚期胃癌患者常见的并发症,且会对患者营养状况以及营养治疗造成影响[23-24]。因此,2021版CSCO 指南着重规范此三大并发症的诊治。
5 结语与展望
2021年,晚期胃癌一线治疗已进入免疫联合治疗时代。目前,需要根据循证医学证据,进一步促使免疫联合治疗方案的选择规范化,全程管理下免疫治疗布局合理化、免疫联合化疗相关不良反应的管理流程化、众多PD-1 单抗药物的选择精准化。同时,由于胃癌时空异质性强,肿瘤微环境复杂,东西方人群在流行病学特征、临床病理特征、治疗模式及药物选择等方面存在差异,应鼓励研究者设计更多关于中国患者的研究,同时鼓励我国患者积极参与,为中国诊疗指南制定提供丰富的循证医学证据。另外,胃癌的抗HER2 分子靶向治疗进展也是目前值得关注的内容,ADC 药物如DS-8 201 和维迪西妥单抗的上世,使得HER2 阳性胃癌患者有了更多的治疗选择,具有良好的有效性和安全性,作为晚期胃癌患者的新型治疗前景可期。
