三甲胺-N-氧化物调节肾素-血管紧张素系统诱导人脐静脉内皮细胞炎症的作用机制研究
2022-04-23郑平陈伟郑艳
郑平 陈伟 郑艳
[摘要] 目的 探討三甲胺-N-氧化物(TMAO)与肾素-血管紧张素系统(RAS)在人脐静脉内皮细胞(HUVECs)炎症中的关系及作用机制。方法 ELISA检测来自2020年9—12月福州市中医院心血管内科的动脉粥样硬化(AS)患者(n=36)与正常人(n=25)血浆中TMAO、血管紧张素Ⅱ(Ang Ⅱ)的表达情况;采用不同梯度的TMAO干预HUVECs细胞诱导炎症;通过CCK-8法检测HUVECs细胞增殖;划痕实验分析HUVECs细胞迁移;血管形成实验分析内皮细胞的功能障碍;通过ELISA实验检测各组HUVECs细胞炎症因子白细胞介素-1β(IL-1β)、白细胞介素-18(IL-18)、内皮型一氧化氮合酶(eNOS)水平;通过WB实验检测RAS系统中血管紧张素原(AGT)、血管紧张素转化酶(ACE)、AngⅡ及血管紧张素受体(ATR)的表达。结果 相比于正常人,AS患者血浆中TMAO与AngⅡ高表达,差异有统计学意义(P<0.05);成功建立了不同梯度浓度的TMAO干预HUVECs细胞的炎症模型;TMAO干预后抑制细胞增殖,且呈剂量依赖性;TMAO能够抑制HUVECs细胞的迁移能力;TMAO干预后内皮细胞血管成环数减少,环变小,抑制血管形成;TMAO干预后促进炎症因子IL-1β、IL-18的表达,抑制eNOS的表达;在TMAO干预下RAS系统中的AGT、ACE、ANGⅡ及ATR的表达水平均显著升高。结论 TMAO能够调节RAS系统诱导HUVECs炎症。
[关键词] 三甲胺-N-氧化物;RAS系统;HUVECs炎症;血管紧张素Ⅱ
[中图分类号] R965 [文献标识码] A [文章编号] 1673-9701(2022)06-0028-05
[Abstract] Objective To explore the relationship and mechanism of trimethylamine-N-oxide(TMAO) and renin-angiotensin system (RAS) in the inflammation of human umbilical vein endothelial cells (HUVECs). Methods The expression of the plasma levels of TMAO and Angiotensin Ⅱ (AngⅡ) in the atherosclerosis (AS) patients (n=36) and the healthy people (n=25) from the Department of Cardiovascular Medicine, Fuzhou Traditional Chinese Medicine Hospital from September to December 2020 were detected by ELISA; different gradients of TMAO was used to interfere with HUVECs to induce inflammation; HUVECs proliferation was detected by CCK-8 method; Scratch test was used to analyze HUVECs migration; the dysfunction of endothelial cells was analyzed by angiogenesis assay; the levels of inflammatory factors, such as interleukin-1β (IL-1β), interleukin-18 (IL-18) and endothelial nitric oxide synthase (eNOS), in each group of HUVECs were detected by ELISA; the expression of angiotensinogen (AGT), angiotensin converting enzyme (ACE), AngⅡ and angiotensin receptor (ATR) in the RAS system was detected by WB assay. Results Compared with the healthy people, TMAO and AngⅡ were highly expressed in the plasma of AS patients, and there were significant differences(P<0.05); different gradient concentrations of TMAO were successfully established to interfere with the inflammation model of HUVECs; after TMAO intervention, cell proliferation was inhibited in a dose-dependent manner; TMAO was able to inhibit the migration ability of HUVECs; after the intervention of TMAO, the number of endothelial cell vascular loops was decreased and the loops became smaller, which inhibited the formation of blood vessels; after TMAO intervention, the expression of inflammatory factors IL-1β and IL-18 was promoted, and the expression of eNOS was inhibited; under the intervention of TMAO, the expression levels of AGT, ACE, ANGⅡ and ATR in the RAS system were significantly increased. Conclusion TMAO can regulate the RAS system to induce the inflammation of HUVECs.
[Key words] Trimethylamine-N-oxide ; RAS system; HUVECs inflammation; Angiotensin Ⅱ
动脉粥样硬化(atherosclerosis,AS)是心血管疾病的主要病理基础。既往研究已证实肾素-血管紧张素系统(renin-angiotensin system,RAS)是促进AS的一个独立危险因素[1]。最近有研究发现,肠道菌群及其代谢产物三甲胺-N-氧化物(trimetrylamine oxide,TMAO)是促进AS发生的一个新的独立危险因素[2]。研究发现,TMAO通过胆汁酸途径影响脂质代谢[3];通过上调巨噬细胞清道夫受体,诱导泡沫细胞形成[4],促进AS斑块发生。TMAO通过激活ROS-TXNIP-NLRP3炎性小体,抑制eNOS/NO合成[5],抑制人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)增殖、迁移和粘附,导致内皮炎症和功能障碍,促进AS的早期病理过程[6]。此外,循环TMAO升高,会诱导HUVECs异常增殖和迁移受损,导致血管功能障碍和重构,加速血管衰老[7]。AS患者中TMAO 水平升高,通过调节脂质代谢和炎症,增加AS发生风险[8]。
过去,将TMAO、RAS组分血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)单独作为AS发生的风险因素进行研究,TMAO诱导AS血管炎症反应的机制是否与RAS系统有关,尚未见到报道。因此,本文将在HUVECs中探讨TMAO与RAS的关系及作用机制,现报道如下。
1 材料与方法
1.1材料来源
36例AS患者与25例正常人血浆样本来自2020年9—12月福州市中医院心血管内科;本研究经福州市中医院医学伦理委员会审查批准(批件号:2019-09-05-01)。人脐静脉血管内皮细胞HUVECs购自武汉普诺赛生命科技有限公司;TMAO购自阿拉丁;Lipofectamine3000、LipofectamineTM 2000 Transfection Reagent购自Invitrigen;DMEM-H培养基、Penicillin-Streptomycin(10,000 U/mL)、Trypsin-EDTA (0.25%)、phenol red、L-Glutamine 200 mM(100×)、0.25%Trypsin-EDTA(1×)购自Gibco;优质胎牛血清FBS购自PAN biotech;PBS购自Hyclone;Qpcr Mix购自PROMEGA;彩色预染蛋白质分子量购自碧云天;BCA 蛋白浓度测定试剂盒(50T)、5×蛋白上样缓冲液、Human eNOS ELISA KIT购自北京索莱宝科技有限公司;ECL发光试剂购自Thermo;NucleoZol购自基因生物技术国际贸易(上海)有限公司;Cell Counting Kit-8 (CCK-8)购自Dojindo;Human IL-18 ELISA Kit、Human IL-1 beta ELISA Kit购自博士德生物;Corning matrigel basement membrane matrix购自Corning;Human Angiotensin Ⅱ(AngⅡ)ELISA kit购自SAB;人三甲基胺氧化物(TMAO)酶聯免疫分析购自上海酶免;GAPDH Monoclonal antibody、Angiotensinogen Polyclonal Antibody、ACE Polyclonal Antibody、ATR Polyclonal Antibody、Angiopoietin 2 Polyclonal Antibody购自Proteintech。
1.2 方法
1.2.1 ELISA法检测AngⅡ浓度 准备好稀释后的标准品、空白和样品孔。标准孔7孔,空白孔1孔。分别在相应孔中加入标准品、空白和样品稀度各50 μl。然后立即在每孔中加入50 μl的检测试剂A。轻轻摇板,用封板器盖住。37℃孵育1 h。各孔取1×洗涤液300 μl,静置1~2 min。将孔板轻拍在吸水纸上,将所有孔中的剩余液体完全除去,共洗3次。在最后一次清洗后,将孔板倒置,用吸水纸吸干。每孔加检测试剂B工作液100 μl。盖上封板膜,37℃孵育1 h,清洗5次,甩孔中液体。每孔加90 μl底物溶液。用新的封板器盖住。37°C孵育15~25 min(不超过30 min)。避光。随着底物溶液的加入,液体会变蓝。每孔加50 μl终止液,加入终止液后,液体会变黄。通过轻拍孔板的侧面混合液体。擦拭孔板底部的水滴和指纹,确认液体表面没有气泡,酶标仪450 nm处检测OD值。
1.2.2 ELISA法检测TMAO浓度 根据说明书稀释标准品,分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。在酶标包被板上标准品准确加样 50 μl,待测样品孔中先加样品稀释液40 μl,然后再加待测样品 10 μl(样品最终稀释度为5倍)。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。用封板膜封板后置37℃温育30 min。将试剂盒中的洗涤液稀释至1×后使用。板温育后,小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置 30 s后弃去,如此重复5次,拍干。每孔加入酶标试剂 50 μl,空白孔除外,37℃温育30 min,洗5次板。每孔先加入显色剂A 50 μl,再加入显色剂B 50 μl,轻轻震荡混匀,37℃避光显色10 min,每孔再加入50 μl终止液,终止反应(此时蓝色立转黄色)。以空白孔调零,450 nm 波长依序测量各孔的吸光度(OD 值)。测定应在加终止液后15 min内进行。
1.3不同浓度TMAO干预HUVECs诱导炎症
将培养至对数生长的HUVECs细胞消化后,接种于6孔板中,保持每孔中的细胞数量差不多,置于5%CO2、37℃细胞培养箱中培养,待每孔细胞密度达到60%,每孔中分别加入0、100、200、300、400、600 mM的TMAO进行干预,细胞培养箱中培养72 h。
1.4 CCK-8检测细胞增殖
将上述不同浓度TMAO干预的HUVECs细胞分别接种于不同的96孔板中,保持每孔中的细胞数量差不多,待每孔细胞密度为50%~70%时,分别在0、24、48、72 h四个时间点向每孔细胞中加入10 μl 10% CCK-8溶液,继续培养1~2 h。用酶联免疫检测仪在OD450 nm处检测各孔的吸光值。
1.5 Western-blot检测细胞中蛋白表达情况
收集细胞加入含PMSF的蛋白裂解液,冰上静置20 min,4℃,12 000 rpm离心20 min,取上清蛋白液于EP管中。BCA蛋白测定法检测样品总蛋白浓度,沸水变性后进行SDS-PAGE电泳、转膜,用5%BSA,40 rpm摇床上室温封闭2 h。封闭完后将NC膜放入装有一抗的抗体杂交盒中,摇床4°C孵育过夜。第2天用TBST洗涤孵育好的NC膜,洗3次,每次10 min。清洗完畢后,将NC膜放入1∶5000稀释的鼠二抗杂交盒中,水平摇床上室温孵育2 h;如果室温高同样可适当缩短时间。结束后,同样用TBST洗3次,每次10 min。将NC膜平置于透明膜上,Thermo ECL试剂盒的A液和B液等体积混合后加到膜表面,暗处静置3 min后去除膜上发光液,置于透明膜上。采用凝胶成像系统Versa DocTM imaging system发光检测,收集条带图像。用凝胶成像系统分析条带灰度值,确定样品中目的蛋白表达的相对含量。
1.6内皮细胞血管形成实验
试验前1d提前把Matrigel基底胶4℃冰箱解冻,枪头、96孔板预冷;吸取50 μl/孔Matrigel至96孔板中,整个操作尽量保持低温环境(冰上进行),不可以产生气泡;37℃培养箱放置至少30 min,使试剂充分凝固,凝胶过程中进行细胞消化处理;细胞以3×104/孔加入铺有Matrigel的96孔板中,每孔100 μl的完全培养基,同样注意别产生气泡,枪头不可触碰到胶;37℃培养8 h(每隔一段时间观察),选取最佳成管时间;在倒置显微镜下,以100×放大倍数观察内皮管形成效果,并随机选取视野拍照保存。
1.7 划痕实验检测迁移能力
将处于对数生长期的各实验组细胞胰酶消化后,完全培养基重悬成细胞悬液,细胞计数,调整悬液浓度为 3×105 cells/ml,24 h后,细胞能刚刚长满单个小孔。在 ibidi 细胞插件的每孔中加入70 μl的细胞悬液,注意不要大力晃动培养皿,以防止细胞不均匀;当所有细胞均贴壁且刚长满时,用镊子将伤口愈合插件提出,加入无血清培养基,0、24 h观察伤口愈合情况。
1.8 ELISA法检测HUVECS细胞干预后炎症因子IL-1β、 IL-18、eNOS表达水平
收集细胞,采用细胞裂解液(用于ELISA)裂解细胞,离心取上清,-80℃保存。严格按照ELISA试剂盒说明书操作,检测炎症因子IL-1β、IL-18、eNOS水平。
1.9 统计学分析
采用SPSS 20.0统计学软件进行实验数据分析,符合正态分布的计量资料以(x±s)表示,采用t检验;多组比较采用单因素方差分析;不符合正态分布时,采用非参数检验。计数资料采用χ2检验,多因素分析采用logistic回归分析。P<0.05为差异有统计学意义。
2 结果
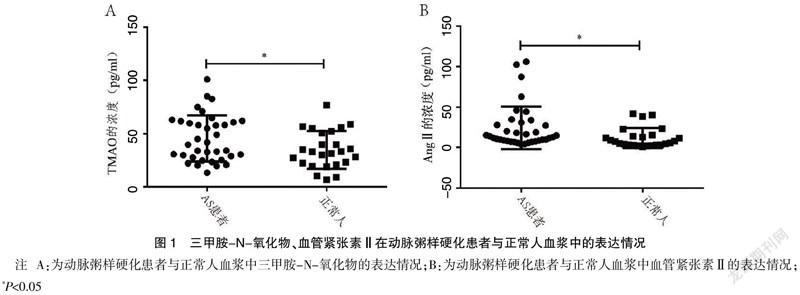
2.1 TMAO与AngⅡ在AS患者血浆中高表达
TMAO与AngⅡ在AS患者和正常人血浆中的表达情况分别如图1A、图1B所示。AS患者血浆中的TMAO与AngⅡ的浓度均明显高于正常人,差异有统计学意义(P<0.05)。
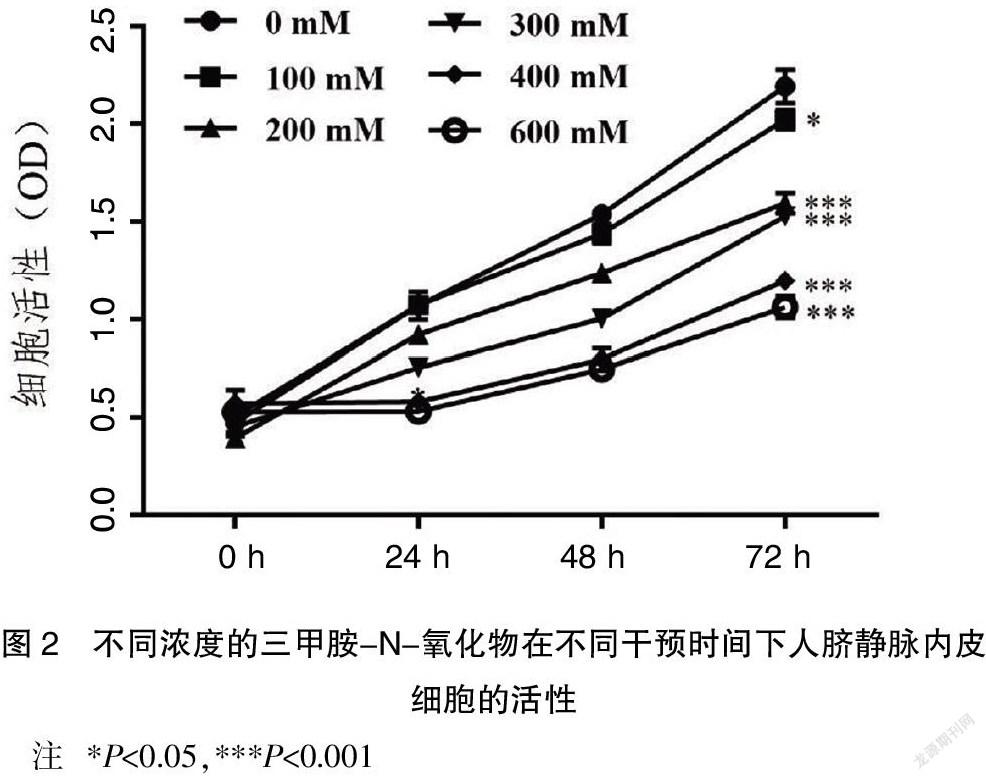
2.2 TMAO能够抑制HUVECs细胞的增殖
为了进一步证明TMAO是否能影响AS的发生,建立了6个不同梯度浓度下的TMAO干预HUVECs细胞的炎症模型,利用CCK-8实验检测细胞的增殖情况。TMAO对HUVECs细胞的增殖影响情况见图2。当TMAO对HUVECs细胞的干预浓度为100 mM时,随着干预时间的增加,HUVECs细胞的活性始终比TMAO的干预浓度为0 mM时低,差异有统计学意义(P<0.05)。且TMAO的干预浓度越高,HUVECs细胞的活性越低,不同浓度下HUVECs细胞的活性均有显著差异。
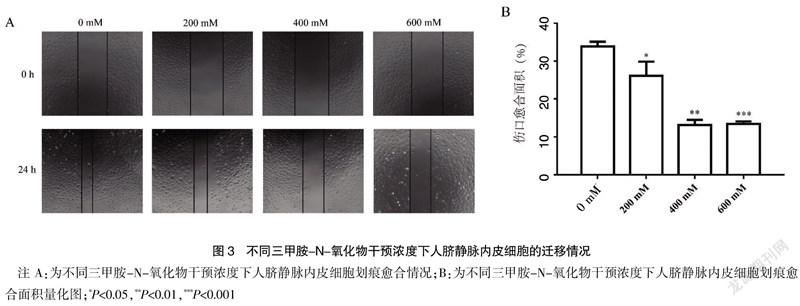
2.3 TMAO能够抑制HUVECs细胞的迁移能力
不同TMAO干预浓度下HUVECs细胞的迁移情况见图3。图3A为细胞划痕图,在4种TMAO干预浓度下,HUVECs细胞生长24 h后,划痕愈合面积最多的是无TMAO干预的细胞,其次是TMAO干预浓度为200 mM的细胞,而浓度为400 mM与600 mM时,划痕愈合面积明显较少。图3B为划痕愈合面积的量化图。由此可知,当TMAO干预浓度为200 mM、400 mM、600 mM时划痕愈合面积显著小于TMAO干预浓度为0 mM时,差异有统计学意义(P<0.05,P<0.01,P<0.01),且TMAO干预浓度越高细胞越难愈合。
2.4 TMAO的干预抑制了血管的形成
为了验证TMAO是否对血管形成产生影响,利用内皮细胞血管形成实验观察4种TMAO干预浓度下血管的形成情况(封三图3)。当TMAO干预浓度为0 mM时,HUVECs细胞成环数较多,环较大,成环情况较好;当TMAO干预浓度为200 mM时,细胞成环数较少且环较小;当TMAO干预浓度为400 mM和600 mM时成环数明显少于前两组,且成环情况较差,TMAO的浓度越高越难形成血管。
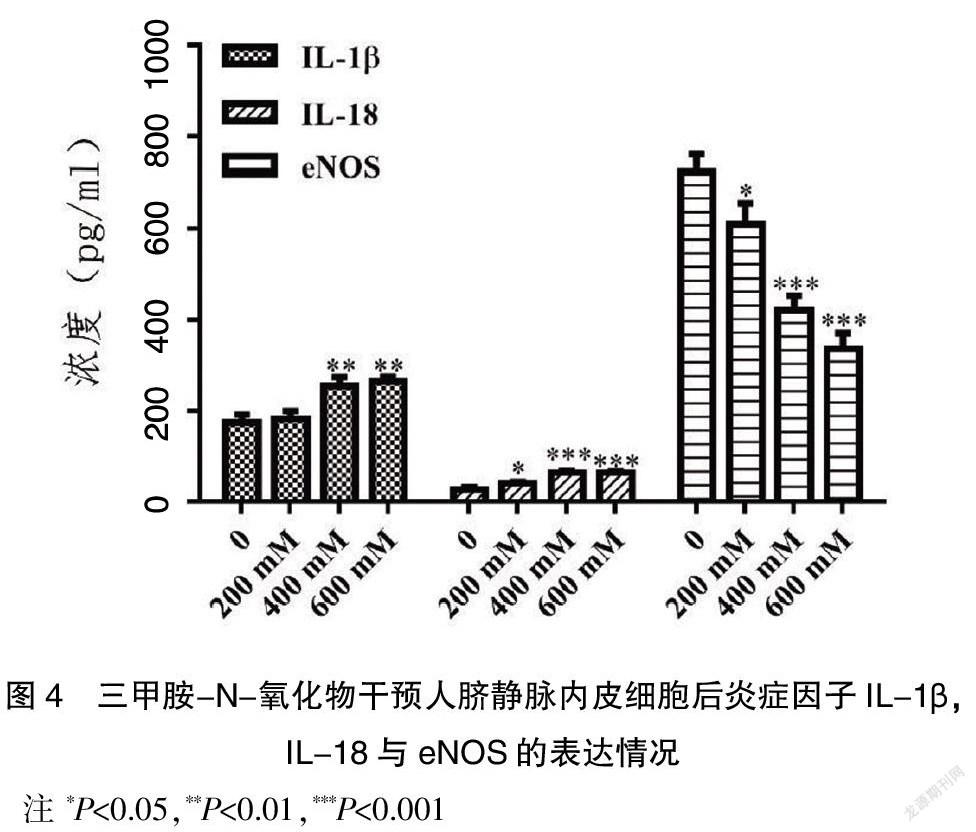
2.5 TMAO干预HUVECs细胞后促进炎症因子白细胞介素-1β(IL-1β),白细胞介素-18(IL-18)的表达,抑制内皮型一氧化氮合酶(eNOS)的表达
利用ELISA法检测不同TMAO干预浓度下HUVECs细胞中IL-1β、IL-18及eNOS浓度的表达情况见图4。当TMAO干预浓度为400 mM和600 mM时,与无TMAO干预相比,HUVECs细胞中IL-1β浓度显著升高,差异有统计学意义(P<0.01);当TMAO干预浓度为200 mM、400 mM和600 mM时,与无TMAO干预相比,HUVECs细胞中IL-18浓度显著升高,差异有统计学意义(P<0.05,P<0.001);当TMAO的干预浓度为200 mM、400 mM和600 mM时,与无TMAO干预相比,HUVECs细胞中eNOS浓度显著降低,差异有统计学意义(P<0.05,P<0.001)。
2.6 TMAO干预HUVECs细胞后促进RAS系统血管紧张素原(AGT)、血管紧张素转换酶(ACE)、AngⅡ和血管紧张素受体(ATR)的表达
为了探讨TMAO与RAS系统的关系,利用WB实验检测了TMAO干预HUVECs细胞后RAS系统中AGT、ACE、AngⅡ和ATR的蛋白表达量。封三图4为不同TMAO干预浓度下HUVECs细胞中AGT、ACE、AngⅡ、ATR蛋白的表达情况。封三图4A为WB结果图,AGT、ACE、AngⅡ、ATR蛋白印迹随着TMAO干预浓度的增加而加深;封三图4B为封三图4A的量化图,AGT、ACE、AngⅡ、ATR蛋白的表达量随着TMAO干预浓度的增加皆显著增加,差异有统计学意义(P<0.05,P<0.01,P<0.001)。
3 讨论
AS是心血管疾病中主要的致死原因,其对人体的健康造成极大的威胁。AS的发病机制复杂,由多种危险因素共同作用引起,已有多项研究表明,代谢紊乱、免疫反应、炎症及内皮功能障碍均能导致AS的发生,其中血管壁的慢性炎症反应是AS发生发展的主要因素[9]。有研究发现,TMAO可诱导内皮细胞功能障碍及促进血管炎症,从而引发AS的发生发展[10],RAS系统是血压调控系统,该系统中的AngⅡ作为主要效应分子参与AS的发展,但TMAO与RAS系统在AS中是否能够相互影响还未见报道。本研究发现TMAO与AngⅡ在AS患者血浆中均高表达,说明TMAO与RAS系统可能共同影响AS的发生发展。血管内皮细胞损伤后会引发炎症[11]、功能衰退,诱导白细胞向血管炎症部位聚集[12],促进AS的发生发展,是AS发病的重要因素之一[13],因此本研究利用HUVECs细胞探讨TMAO对内皮功能障碍的影响。本研究构建TMAO干预后的HUVECs细胞炎症模型,发现TMAO能够抑制HUVECs细胞增殖、迁移及血管形成,且呈剂量依赖性抑制,说明TMAO能够导致血管内皮功能障碍,从而诱发AS,与Ma等[6]的研究结果一致。Sun等[5]首次证明TMAO可激活ROS-TXNIP-NLRP3炎症小体从而诱导炎症和内皮功能障碍,炎症小体的激活促进了炎症因子IL-1β与IL-18的表达,且抑制了内皮型一氧化氮合酶eNOS的表达。本研究结果显示,不同浓度的TMAO干预下的HUVECs细胞中的IL-1β与IL-18呈剂量性依赖显著增加,eNOS的浓度则显著下降,与上述研究者的研究结果一致,说明TMAO能够诱导血管炎症,且进一步证明HUVECs细胞炎症模型的成功构建。因此在此基础上本文利用该模型探讨TMAO与RAS系统的关系。本研究通过WB检测不同浓度TMAO干预后HUVECs细胞中AGT、ACE、AngⅡ和ATR的蛋白表达量,结果显示TMAO干预HUVECs细胞后促进了RAS系统AGT、ACE、AngⅡ和ATR的表达,且有呈TMAO剂量依赖性增加的趋势。有研究表明,AngⅡ作为RAS系统的末端活性产物也可促进血管壁的炎症反应,而ACE的抑制剂能够阻断该系统所导致的炎症反应,血管内皮细胞的功能得到改善,缓解了AS的发生[14];与TMAO一样,RAS系统的激活也同样会导致内皮功能障碍[15]。结合本研究的结果可以说明TMAO能够调节RAS系统诱导HUVECs发生炎症。
综上所述,TMAO与AngⅡ在AS患者血浆中高表达预示着TMAO与RAS系统可能共同影响AS的发生发展,通过利用TMAO干预建立HUVECs细胞炎症模型,验证了TMAO能够抑制HUVECs细胞的增殖、迁移以及血管的形成导致血管内皮功能障碍,且TMAO能够促进IL-1β与IL-18的表达,抑制eNOS的表达,说明TMAO能够诱导血管炎症。该模型中RAS系统AGT、ACE、AngⅡ和ATR蛋白表达量呈TMAO剂量依赖性增加,说明TMAO能够调节RAS系统诱导HUVECs发生炎症。而这两者之间相互作用的具体机制还需要进一步探讨。联合检测TMAO和RAS可能更有助于AS的临床评估,同时针对TMAO和RAS的治疗策略或许是AS治疗的一个新方向。
[参考文献]
[1] 徐銀川,陈晓锋,Daugherty A,等. 肾素血管紧张素系统与动脉粥样硬化[J].中华高血压杂志,2017,25(6): 511-512.
[2] 蒋小燕,段家怀.三甲胺-N-氧化物致动脉粥样硬化机制研究进展[J].中华老年多器官疾病杂志,2019,18(2):157-160.
[3] 王猛,邓洁琳,孟冠南,等.肠道微生物与心血管疾病的研究进展[J].医学综述,2018, 24(18):13-17,23.
[4] 何花花,连新福,唐智群.三甲胺-N-氧化物在动脉粥样硬化发病机制中的研究进展[J].中南大学学报(医学版),2017,42(8):986-990.
[5] Sun X,Jiao X,Ma Y,et al.Trimethylamine N-oxide induces inflammation and endothelial dysfunction in human umbilical vein endothelial cells via activating ROS-TXNIP-NLRP3 inflammasome[J].Biochem Biophys Res Commun,2016,481(1-2):63-70.
[6] Ma G,Pan B,Chen Y, et al.Trimethylamine N-oxide in atherogenesis: Impairing endothelial self-repair capacity and enhancing monocyte adhesion[J].Biosci Rep,2017, 37 (2):BSR2016 0244.
[7] Ke Y,Li D,Zhao M,et al.Gut flora-dependent metabolite trimethylamine-N-oxide accelerates endothelial cell senescence and vascular aging through oxidative stress[J].Free Radic Biol Med,2018,116:88-100.
[8] Senthong V,Li XS,Hudec T,et al.Plasma trimethylamine- N-oxide,A gut microbe-generated phosphatidylcholine metabolite,is associated with atherosclerotic burden[J].J Am Coll Cardiol,2016,67(22):2620-2628.
[9] 何花花,连新福,唐智群.三甲胺-N-氧化物在动脉粥样硬化发病机制中的研究进展[J].中南大学学报(医学版),2017,42(8):986-990.
[10] Seldin MM,Meng Y,Qi H, et al.Trimethylamine N-oxide promotes vascular inflammation through signaling of mitogen-activated protein kinase and nuclear factor-κB[J].J Am Heart Assoc,2016,5(2):e002 767.
[11] Ross R.Atherosclerosis-An inflammatory disease[J].N Engl J Med,1999,340(2):115-126.
[12] Mestas J,Ley K.Monocyte-endothelial cell interactions in the development of atherosclerosis[J].Trends Cardiovasc Med,2008,18(6):228-232.
[13] Antohe F.Endothelial cells and macrophages,partners in atherosclerotic plaque progression[J].Arch Physiol Bioc- hem,2006,112(4-5):245-253.
[14] 楊亚培.肾素过表达及联合用药对动脉粥样硬化及斑块炎症影响的实验研究[D].济南:山东大学,2011.
[15] 梁俊清,孙士然,吴以岭,等.疲劳应激致血管内皮功能障碍与肾素-血管紧张素-醛固酮系统变化的关系及通络方药的干预[J].中国病理生理杂志,2009,25(6):1064-1069.
(收稿日期:2021-06-08)
