不同物种端粒结合蛋白和端粒酶的研究进展
2022-04-19石桂英黄艺滢雷雪裴李欣悦白
石桂英黄艺滢雷雪裴李欣悦白 琳
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
端粒是位于真核生物染色体末端的蛋白质-DNA 复合体,在复制过程中保护染色体末端的完整性,防止染色体融合、重组、降解等[1-3]。 端粒DNA由TTAGGG 重复序列组成,不同物种的端粒长度不同,人出生时端粒长度约为8~20 kb,猕猴的端粒长度约为15~18 kb,而实验动物大小鼠的端粒长度约为25~500 kb(表1)[4]。 端粒DNA 的3’末端有一段>12 核苷酸的单链序列,此单链序列插入端粒双链序列形成T 环结构[5]。 端粒长度会随细胞复制而缩短,端粒长度的维持通过两个复合体来完成即shelterin 和CST。 哺乳动物shelterin 复合体由6 个蛋白组成,即端粒重复结合因子1 和2(telomeric repeat binding factor 1 and 2,TRF1、TRF2)、端粒保护蛋白1(protection of telomeres 1,POT1)、TRF1 和TRF2 相互作用核蛋白2(the TRF2- and TRF1-interacting nuclear protein 2,TIN2)、抑制/激活蛋白1(repressor/activator protein 1,RAP1)、POT1-TIN2 组织蛋白(the POT1-TIN2 organizing protein,TPP1,又称为ACD、TINT1、PTOP、PIP1)。 CST 包括3 个蛋白即CTC1(conserved telomere maintenance component 1)、STN1(suppressor of CDC thirteen homolog) 和TEN1(telomere length regulation protein TEN1 homolog)。 shelterin 保护端粒避免DNA 损伤应答,通过端粒酶调节端粒长度;而CST 控制端粒酶对端粒的延伸和C 链插入序列的合成[6](表1、图1)。
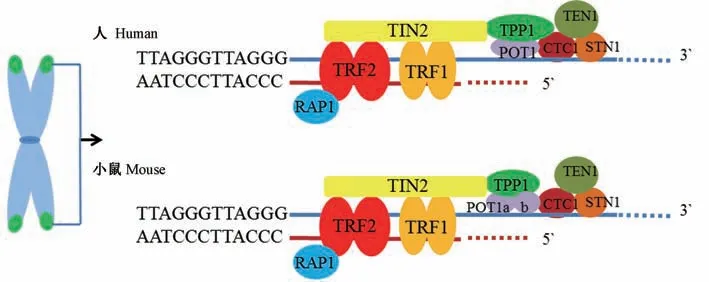
图1 人和小鼠shelterin 复合体和CST 复合体示意图Figure 1 Schematic of human and mouse shelterin complex and CST complex

表1 不同物种端粒生物学特点Table 1 Telomere biology of different species
1 shelterin
端粒DNA 重复序列与shelterin 结合,可以区分染色体正常末端和损伤断裂部位,抑制DNA 修复反应,调控端粒酶维持端粒长度。 裂殖酵母中shelterin由6 种蛋白组成,即TAZ1、RAP1、POZ1、TPZ1、CCQ1和POT1。 TAZ1 结合端粒双链DNA,Pot1 结合端粒单链DNA[7]。 哺乳 动物shelterin 由TRF1、TRF2、POT1、TIN2、RAP1 和TPP1 组成。 其中哺乳动物端粒蛋白TRF1 和TRF2,与酵母TAZ1 同源[8],结合双链端粒DNA,RAP1 单独与TRF2 相互作用,提高TRF2对端粒重复序列的特异性[9]。 POT1 结合单链端粒DNA,POT1-TPP1 复合体对单链端粒DNA 有高度特异性[10]。 TIN2 是复合体的关键蛋白,位于shelterin的中心位置,同时与TRF1、TRF2 和TPP1 相互作用,保证复合体的稳定[10-11](表2)。

表2 不同物种shelterin 复合体的组成Table 2 Shelterin complex of different species
1.1 TRF1 和TRF2
二者有TRF 同源结构域(TRF homologydomain,TRFH)和C 末端SANT/Myb DNA 结合域。 TRF1 可以使端粒DNA 成环状配对伸展,TRF2 可以使端粒DNA 形成T 环结构。 TRF 同源结构域可以结合其它蛋白。 TRF1 和TRF2 蛋白表达丰富,可以覆盖每个端粒。 二者都可以被磷酸化、磺酰化、对羟基化、泛素化等[13-14]。
已有研究发现,二者可通过多种方式维持端粒稳定。 在人和小鼠中随年龄增长,TRF1 水平降低。提高TRF1 的表达,可延缓衰老相关生理变化的发生。 在小鼠不同组织中TRF1 缺失可影响干细胞功能,从而导致组织稳态失衡[15]。 当小鼠端粒缺失TRF1 时,DNA 损伤修复和染色质重塑相关的蛋白会发生重组。 小鼠TRF1 可抑制早幼粒细胞白血病蛋白(promyelocytic leukemia ,PML)、breast cancer 1(BRCA1)、染色质结构维持(structural maintenance of chromosomes,SMC)5/6 复合体的累积,这些蛋白可促进同源重组和端粒模板RNA 的翻译[16]。
在细胞周期中,周期依赖性激酶2(cyclindependent kinases 2,CDK2)调控TRF2 的磷酸化,控制T 环的形成,从而保护端粒,并避免不必要的DNA 损伤应答[17]。 TRF2 的TRFH 可以抑制ATM(ataxia-telangiectasia mutated)的活性,同时也参与调节T 环的形成[18]。 TRF2 通过主动招募起始点识别复合物2(origin recognition complex,ORC2)到端粒,介导端粒的复制启动,以防止端粒功能障碍,而蔗糖非发酵蛋白2 同源物(sucrose non-fermenting protein 2 homologous,SNF2H)敲除会减少ORC2 的募集和端粒的复制启动[19]。 TRF2 还招募核仁蛋白TCOF1 协调端粒的转录复制[20]。
但是,在小鼠胚胎干细胞(embryonic stem cell,ESCs,简称ES)和上皮干细胞的研究中发现,TRF2在端粒保护中可有可无。 ES 细胞中T 环的形成不依赖于TRF2[21]。 TRF2 敲除ES 并未出现端粒融合现象,仍可以无限扩增[22]。
1.2 RAP1
RAP1 是酵母和哺乳动物中唯一保守的shelterin 蛋白。 在甲基营养型耐热多形汉逊酵母DL-1 中, RAP1 有 2 个 基 因 即 HpRAP1 A 和HpRAP1 B。 HpRAP1 B 可识别保护端粒DNA,HpRAP1 A 与亚端粒区域相关。 在核糖体蛋白基因的启动子中,有HpRAP1 A 和HpRAP1 B 的特有结合位点[23]。 裂殖酵母中酪蛋白激酶2 可以使RAP1多个位点磷酸化,从而促进RAP1 与BQT4 和POZ1的相互作用,进而维持端粒与核被膜的距离,促使染色质沉默结构的形成[7]。 酿酒酵母RAP1 在代谢、炎症、氧化应激等反应中都有重要作用[24]。
哺乳动物中RAP1 是TRF2 结合伴侣,与TRF2形成复合体,其在端粒中的位置和稳定性依赖于TRF2,敲除TRF2 时,RAP1 也会消失。 在端粒酶缺失的情况下,RAP1 对端粒的维持和保护具有重要作用。 与端粒酶缺失小鼠相比,同时缺失RAP1 和端粒酶的小鼠,其生存能力随传代进行性降低[25]。在仍有增殖能力的人老化细胞中,下调RAP1 会导致端粒丢失融合;在端粒酶阳性细胞系中,当端粒酶被抑制时,敲除RAP1 会增加端粒的融合[26]。 在人老化细胞中,RAP1 与组蛋白异四聚体结合,参与核小体位移,从而调节基因表达,但不影响细胞衰老进程[27]。
在人间充质干细胞和神经干细胞中,RAP1 负调节端粒长度,同时作为转录调节因子,调节基因启动子的甲基化状态。 RAP1 缺失可以促进人间充质干细胞的自我更新,延缓其衰老;在人神经干细胞中未见类似作用[28]。 成纤维细胞自然老化过程中TRF2 和RAP1 水平降低,相较于TRF2,RAP1 更稳定。 在老化细胞中,细胞核和细胞质中的RAP1含量相似,过氧化氢处理的细胞,其细胞核中的RAP1 减少,而细胞质中的没有改变[29]。
1.3 TIN2
TIN2 位于shelterin 的中心位置,可以结合TRF1、TRF2 和TPP1,还介导端粒酶与端粒的结合[30],TIN2 与TPP1/POT1 协作可以刺激端粒酶活性[11]。 TIN2 有3 种异构体,即TIN2L、TIN2M、TIN2S,三者都位于端粒中,TIN2 异构体在生化特性和功能上完全不同,TIN2 编码基因突变的病人其shelterin 功能发生改变[31]。 在先天性角化不良症中TIN2 发生突变,在端粒酶阴性成体细胞中会出现端粒功能失调表型,在端粒酶阳性干细胞中则加重端粒的维持问题[32]。 人抗原R(human antigen R,HuR)结合TIN2 mRNA 3’非翻译区。 HuR 耗竭时,可以促进TIN2 表达,导致线粒体TIN2 增加,使ROS增加, 从而诱导生长停滞, 但不影响细胞核TIN2[33]。 Siah2(seven-in-absentia honolog 2)蛋白具有E3 泛素连接酶的活性,可调节一些蛋白的泛素化和降解,TIN2 是其中之一。 在体内,TIN2 与Siah2结合后被泛素化,Siah2 过表达可以导致TIN2 蛋白降解,从而使端粒中的TIN2 缺失;而敲除Siah2 后,TIN2 稳定性增加[34]。
1.4 POT1
POT1 是存在于多种生物的一种单链DNA 结合蛋白,与富含鸟嘌呤的单链DNA 3’悬浮端结合[35]。人POT1 是一个管家基因,有22 个外显子,在人的各种组织细胞中广泛表达。 POT1 启动子活性与POT1 表达和端粒长度正相关,与人端粒酶表达呈负相关[36]。 POT1 与TPP1 结合形成复合体,此复合体对单链端粒DNA 有高度特异性[12]。 POT1-TPP1 复合体可以解开端粒二级结构,提高端粒酶活性[37]。 在 真 核 细 胞 多 种 活 动 中, microRNAs(miRNAs)可以调节基因表达,miR-185 可直接作用于POT1 3’非翻译区。 在人肿瘤细胞和原代成体细胞中,miR-185 过表达都可导致端粒功能失调。 在原代细胞中,miR-185 过表达可加速衰老进程[38]。
啮齿类动物有2 个POT1 蛋白,即POT1a 和POT1b,二者密切相关,POT1a 抑制ATR(ataxia telangiectasia and Rad3-related kinase)介导的DNA损伤修复机制,避免端粒末端被识别为DNA 断端,POT1b 调控端粒3’悬浮端长度。 人POT1 同时具有这两种功能。 在人细胞中,CST 复合体结合POT1和TPP1,在小鼠中只结合POT1b。 POT1 与单链DNA 结合,伸展G4 DNA 结构,抑制同源重组介导的修复反应,从而稳定和保护端粒单链DNA;抑制ATR 介导的DNA 反应。 在黑色素瘤、慢性淋巴细胞白血病等多种肿瘤中,发现POT1 突变[39]。
1.5 TPP1
TPP1 的N 末端有7 个寡核苷酸/寡糖结合结构域(oligonucleotide/oligosaccharide binding,OB),与端粒酶密切相关;人TPP1 N 末端OB 结构域突变可降低其对端粒酶的刺激作用,影响端粒酶与端粒的结合,导致端粒缩短[40]。 TPP1 C 末端结构域介导其与TIN2 的相互作用[41]。 敲降小鼠TPP1 会诱导p53 依赖性生长停滞和ATM 依赖性DNA 损伤应答。 在小鼠胚胎成纤维细胞中,TPP1 基因缺失增加姐妹染色体端粒融合,减少端粒酶与端粒的结合[42]。
在哺乳动物细胞中TPP1 与细胞周期调控因子激酶NEK6 相互作用,在G2/M 期NEK6 介导TPP1 Ser255 的磷酸化,从而调节端粒酶活性及其与TPP1的相互作用。 而POT1 负调控TPP1 Ser255 的磷酸化[43]。 在人肺癌细胞中,TPP1 OB 结构域蛋白抑制端粒酶募集到端粒上,从而抑制细胞增殖,诱导细胞凋亡[44]。 人多能干细胞端粒长度设定点的调控主要依赖于TPP1,TPP1L104A 突变可改变人干细胞端粒长度设定点[45]。
2 CST
CST 复合体由3 个亚单位组成,即CTC1、STN1和TEN1。 酵母CDC13 是哺乳动物CTC1 的同源物。 CST 复合体位于单链端粒DNA,限制端粒酶作用,以防悬浮端过度延伸。 TEN1 有助于稳定CTC1-STN1 与端粒DNA 的相互作用。 CTC1 可以刺激DNA 聚合酶α(Polα),在端粒复制中起关键作用。STN1-TEN1 的作用类似复制蛋白A,在复制压力下使细胞正常复制。
小鼠CTC1 基因缺失导致C 链端粒DNA 的迅速丢失,从而导致端粒的灾难性丢失和过早死亡。CTC1 在CST 复合体中起关键作用,其突变对细胞环境具有致死性。 已知CTC1 的多个自发性突变与Coats plus disease ( CP) 和先天性角化不良(dyskeratosis congenita,DC)相关。 STN1 有2 个结构域,N 末端OB 区和C 末端STN1 结构域,TEN1 只有1 个OB 结构域。 人TEN1 不与单链端粒DNA 相互作用。 而人STN1 与单链端粒DNA 亲和力高,但缺乏特异性。 STN1-TEN1 复合物的形成对于正常发挥CST 复合物的功能至关重要。 STN1 突变与CP相关[6]。
尽管在纤毛虫、酵母、植物和哺乳动物中都存在CST 复合体,序列同源性较低,物种间差异显著。酵母和人的CST 复合体中,STN1 和TEN1 在结构上高度保守,而CST 复合体的重要组分CDC13 和CTC1,没有序列同源性,在长度和功能上差异显著。酵母CDC13 与端粒酶全酶中的EST1 相互作用,从而募集端粒酶到端粒上。 人CTC1 则抑制端粒酶到端粒的募集。 近期研究发现嗜热四膜虫的p75-p45-p19 与CST 序列没有同源性,但其功能类似纤毛虫CST 复合物,协调G 链和C 链的合成[46]。
3 端粒酶
端粒酶是一种核蛋白,人端粒酶核蛋白由端粒酶RNA(telomerase RNA component,TERC)、端粒酶反转录酶(telomerase reverse transcriptase,TERT),以及附属蛋白 dyskerin、 端粒酶卡哈尔体蛋白
(telomerase Cajal Body protein 1 homolog,TCAB1)、
核糖核蛋白NOP10、NHP2、GAR1 组成[47]。 不同物种间,TERC 的大小和序列差异显著,hTERC 有451个核苷酸(nucleotides,nt),纤毛虫~150 nt,酿酒酵母~1150 nt,粉色面包霉菌>2000 nt。 TERC 的大小和序列并非高度保守,所有TERC 有4 个功能特性:反转录模板、假结结构域、与TERT 相互作用的干环(stem-loop)、RNA 稳定所需的3’元素。 hTERC 由RNA 聚合酶II 从其自身启动子转录而来。 多数生物中,TERT 蛋白含有4 个功能结构域:端粒酶N 末端结构域(telomerase essential N-terminal domain,TEN)、TERC 结合结构域(telomerase RNA binding domain,TRBD),反转录酶结构域、C 端扩展区(Cterminal extension,CTE)。 hTERT 中TEN 在端粒酶募集至端粒的过程中起关键作用,参与催化端粒重复序列的合成[9,13,48]。
各组织中端粒酶活性,恒河猴、日本猕猴、食蟹猴与人相似:在多数成体组织中端粒酶活性受到抑制,在脾、胸腺、消化道中有弱活性,睾丸中活性较高。 在牛、羊、马、鹿的成纤维细胞和各种绵羊或马的成体组织中均未检测到端粒酶活性。 猪的多个成体组织,如淋巴结、肺、肾和小肠等具有显著水平的端粒酶活性[49]。 提高端粒酶活性可以促进大鼠和人颗粒细胞、小鼠卵巢中类固醇激素基因的表达和激素生成[50]。
端粒酶附属蛋白同样具有重要作用。 dyskerin的编码基因是DKC1,位于X 染色体。 dyskerin 可以稳定hTR,增强hTERT 活性。 dyskerin 过多或过少都会导致癌症,乳腺癌和前列腺癌中dyskerin 水平较高,dyskerin 水平降低与脑垂体癌变有关,DC 中dyskerin 水平较低。 DKC1 基因突变小鼠可发生多种恶性肿瘤[51]。 NHP2 敲除可以抑制TERT 表达,破坏端粒酶复合体的稳定,从而抑制细胞增殖,促进细胞凋亡[52];NHP2 的致病性突变减少小核仁RNA(small nucleolar RNAs,snoRNAs)的累积,影响核糖体RNA(ribosome RNA,rRNA)的加工处理,NHP2 缺失可减少rRNA 生成,导致肺纤维化和Høyeraal-Hreidarsson 综合征[53]。 NOP10 可预测肺癌的预后,其相关snoRNAs 可以促进肺癌细胞的生长、增殖、迁移和侵袭[54]。 在乳腺癌中NOP10 高表达也预示预后不良[55]。 DKC1 和NOP10 突变导致肾病综合征,包括白内障、听力障碍、小肠结肠炎等[56]。 在癌细胞中,抑制TCAB1 表达,可减少p21蛋白降解,从而诱导细胞衰老[57]。
4 总结与展望
端粒结合蛋白、端粒酶,以及端粒酶附属蛋白,在维持端粒长度和稳定中起重要作用,这些蛋白基因突变或表达量改变,可导致多种疾病,如以短端粒为特点的端粒病,包括先天性角化不良、肺纤维化、再生障碍性贫血等[58];在多种肿瘤中也发现端粒结合蛋白的突变,如在乳腺、胃、甲状旁腺等肿瘤中都有POT1 突变[12]。 与端粒功能障碍相关的疾病,在治疗时,可以将端粒结合蛋白、端粒酶、端粒酶附属蛋白等作为治疗靶点。
已有研究表明,哺乳动物端粒的长度与寿命呈负相关,端粒酶活性与体重呈负相关。 小鼠的寿命较短,体重较小,其端粒较长,各组织有不同程度端粒酶活性;而人的寿命较长,体重较大,端粒较短,多数组织无端粒酶活性,因此人有复制性衰老现象[59]。 端粒酶敲除的啮齿类动物模型是研究端粒和端粒酶基本生物特性的良好模型,但很难用于深入研究人类衰老和疾病中端粒和端粒酶的作用。要深入研究端粒和端粒酶在人类疾病中的作用,还需寻找合适的模型。
