卡拉胶水凝胶在生物医学领域中的应用进展*
2022-04-11刘盼盼张书俐王海宾郭建峰黄晶晶刘琳琳
刘盼盼,张书俐,高 莉,王海宾,郭建峰,黄晶晶,刘琳琳
(中北大学 化学工程与技术学院, 太原 030051)
0 引 言
水凝胶是一种亲水性聚合物的三维网络,能在水中膨胀而不溶解。由于聚合物中含有大量的亲水性基团,水凝胶能吸收并锁住大量的水分,而吸水后,水凝胶网络也能保持原有形状不被破坏[1]。水凝胶因其制备简单、机械性能可调性强、生物相容性好以及弹性和柔软性与人体大多数组织和细胞外基质极为相似等特点,在组织工程[2-3]、药物传递[4-5]、生物传感[6]等领域发展迅速。根据制备水凝胶的来源,水凝胶可分为天然水凝胶和合成水凝胶。由于社会对可持续产品的需求,来自天然材料的水凝胶,特别是可再生资源的水凝胶,受到人们的关注。在可再生资源中,多糖因其固有的亲水性和生物降解性而成为最有前景的水凝胶前体。
卡拉胶是从红藻中提取的硫酸化多糖,它是由D-半乳糖和3,6-脱水半乳糖交替单元经α-1,3和β-1,4-糖苷键连接而成[7]。卡拉胶根据其硫酸盐含量、提取来源和溶解度分为6种基本形式,即:k-卡拉胶、t-卡拉胶、λ-卡拉胶、μ-卡拉胶、ν-卡拉胶和θ-卡拉胶[8-9]。而k-卡拉胶、t-卡拉胶和λ-卡拉胶由于具有胶凝和粘弹特性而具有重要的商业价值[10-11](如表1)。t-卡拉胶和k-卡拉胶具有形成水凝胶的能力,通过相邻硫酸基的交联形成三维双螺旋网络,而λ-卡拉胶的硫酸基不发生交联,因此不形成凝胶[12-13]。卡拉胶上羟基/硫酸盐基团的存在使其易于发生物理或化学交联,赋予卡拉胶更好的理化性质、新的特殊功能和特性[14]。卡拉胶水凝胶已广泛应用于生物医学和组织工程领域,如药物递送、创面敷料、组织工程支架材料等。本文就卡拉胶水凝胶的几种类型及其在生物医学领域的应用进展进行综述。
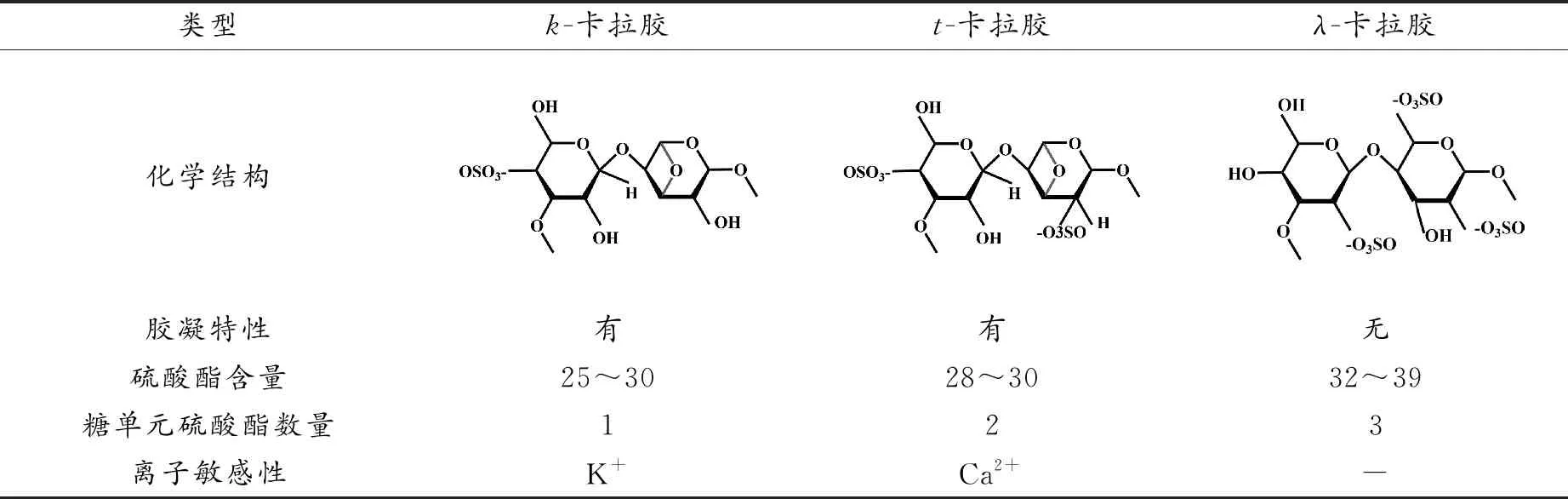
表1 卡拉胶的主要类型Table 1 Main types of carrageenan
1 卡拉胶水凝胶的几种类型
传统上,k-卡拉胶和t-卡拉胶分别在K+和Ca2+存在下通过离子交联形成脆性水凝胶(如图1)。为了改善卡拉胶的性能,其中的一个措施是改变交联方式,物理交联是通过非化学键如氢键范德华力或者相互缠结交联的,化学交联是链与链之间之间通过化学键连接的。将卡拉胶与聚乙烯醇、明胶、纤维素、丝素蛋白等高分子材料复合,通过一定的交联方式(物理交联、基于交联剂的化学交联)可以得到性能优良的水凝胶[15-16]。而在此基础上,研究者们研究了不同类型的卡拉胶水凝胶,包括光交联水凝胶、互穿聚合物网络水凝胶、水凝胶支架、纳米凝胶和3D生物打印生物墨水等等。
1.1 光交联水凝胶
光交联通常是在卡拉胶结构中引入甲基丙烯酸基团,然后添加光引发剂使其具有光敏特性,最后通过紫外光或可见光照射使其固化交联。Lhan等[17]通过将甲基丙烯酸基团并入κ-卡拉胶主链(KaMA),合成过程中,κ-卡拉胶的阴离子性质不受影响,在化学光引发剂(Irgacure 2959)存在下进行紫外光交联,与其他水凝胶相比,光交联水凝胶最突出的优点是其力学性能可由多种因素调节,如KaMA浓度、光引发剂的种类、光交联时间、光引发过程中的紫外线剂量等。Tavakoli等[18]制备的基于可见光交联甲基丙烯酸k-卡拉胶(KaMA)的可注射可喷涂水凝胶凝胶强度高,失重率低,并且具有高的保水能力,在体外可维持细胞的贴壁和增殖。其在软组织工程、无缝线粘合剂和生物印刷应用方面具有巨大的潜力。
为了进一步研究可见光交联卡拉胶水凝胶的物理化学性能,Mokhtari等[19]使用氧化石墨烯对光交联k-卡拉胶水凝胶进行改性,改性之后的水凝胶力学性能显著提高,水凝胶的高含水量、与天然细胞外基质(ECM)相似性、可注射性使其有望应用于软骨组织工程。光交联水凝胶并非没有挑战,在考虑机械性能等物理化学性能的同时还应满足生物相容性,像例2和例3中采用的可见光交联方式没有任何与紫外光交联水凝胶体系相关的有害副作用。
1.2 互穿聚合物网络
互穿聚合物网络(IPN)是交联聚合物的“合金”,其中至少一种聚合物是在另一种聚合物的直接存在下合成和/或交联的,它们之间没有任何共价键,除非化学键被打破,否则不能分离[20]。互穿聚合物网络中的一个网络结构刚且脆,另一个软且韧,在受力时,刚且脆的网络主要承受力,软且韧的网络主要阻止凝胶断裂。卡拉胶互穿网络可以模仿椎间盘髓核区的自然力学机制,Chan等[21]以κ-卡拉胶和聚己内酯为原料构建了互穿聚合物网络凝胶用于椎间盘再生,得到的凝胶具有较高的机械强度,而粘弹性不受影响,该凝胶能够促进3T3成纤维细胞的粘附、增殖和迁移。同样,Lohani等[22]以κ-卡拉胶和羧甲基纤维素为原料制备了互穿聚合物网络凝胶,将其应用于载药控释,凝胶在酸性介质中可减少药物释放,在碱性介质中可调节药物释放,有助于减少模型药物布洛芬的胃毒副作用。
研究者们也构建了自愈合的互穿聚合物网络,能够自主恢复受损部位,Chen等[23]以魔芋葡甘聚糖(KGM)和硼砂化学交联的水凝胶为第一网络,k-卡拉胶与氯化钾交联的水凝胶为第二网络,k-卡拉胶链上的-OSO3基团也会与KGM链上的羟基相互作用,形成氢键,将两个网络结合成一个整体。水凝胶的拉伸强度可以达到100.2 kPa,第二物理网络结构具有温度敏感性和可恢复性,因此该水凝胶具有优异的自愈合性能,在60 ℃热处理30 min后,机械强度可恢复96.7%。Deng等[24]通过双物理交联开发了一种新的κ-卡拉胶/聚丙烯酰胺(KC/PAM) DN水凝胶,以具有延展性的疏水缔合PAM为第一个网络,而刚性钾离子(K+)交联的κ-卡拉胶为第二个网络,具有良好的断裂拉伸应力((1 320±46)kPa)和韧性(断裂能量:(6 900±280)kJ/m3),此外,由于其独特的双物理交联结构,KC/PAM水凝胶还表现出快速的自我恢复、自愈合能力以及对干细胞的良好细胞相容性。
1.3 水凝胶支架
凝胶支架具有优良的表面附着力,促进细胞黏附、增殖以及分化;还具有高度多孔结构,能够提供充足的空间供细胞黏附、刺激新的组织生长[25]。研究者们通过各种物理和化学方法开发能够模拟体内天然细胞外基质(ECM)的卡拉胶凝胶支架。Jhamak等[26]将不同浓度的κ-卡拉胶与丝素蛋白(SF)混合制成复合凝胶,然后通过冷冻干燥制备支架,以模拟骨细胞外基质成分,该支架具有相互连接的高度多孔结构,在模拟体液(SBF)中浸泡7天后,卡拉胶结构中的硫酸根吸附了SBF中的Ca2+离子,使表面成功沉积磷灰石层;此外,支架还可以促进人成骨肉瘤MG63细胞的增殖和提高碱性磷酸酶ALP活性,在模拟骨细胞外基质成分上很有潜力。Nayak等[27]利用冷冻凝胶技术将不同比例的聚乙烯醇(PVA)和t-卡拉胶混合制备得到了三维、互联、高多孔、可生物降解支架,凝胶支架与血红蛋白高度相容;且7∶3和8∶2聚乙烯醇-卡拉胶比例的支架材料具有良好的组织工程应用和细胞长期冷冻保存特性。Pourjavadi等[28]在k-卡拉胶水凝胶中引入了金纳米粒子制备导电支架,该支架对细胞的生长和增殖有促进作用。
1.4 纳米凝胶
“纳米凝胶”是指由物理或化学交联网络形成的尺寸范围为1~1 000 nm的纳米水凝胶[29-30]。卡拉胶纳米凝胶网络能够包封药物、蛋白质、DNA等,为多价生物结合提供了一个大的表面积[31]。Rahmani[32]以N, N'-亚甲基双丙烯酰胺(MBA)为交联剂,以壳聚糖(CS)和κ-卡拉胶骨架接枝丙烯酸甲酯/丙烯酸钠单体,合成了以瑞伐斯汀为模型药物的新型pH敏感纳米凝胶,该纳米凝胶不仅生物相容性好,而且溶胀能力好,药物包封率高,能够保证包封药物的可控释放。 Ghasem等[33]开发了生物相容性纳米凝胶/水凝胶纳米复合材料,将pH、热响应和磁响应特性引入纳米复合材料中用作左旋多巴(L-DOPA)的缓释药物载体,作为治疗帕金森病症状的主要药物。作者考察了不同pH条件下左旋多巴的体外释放,这种软性纳米复合材料的pH依赖性释放活性药物的时间可以维持11天以上。该缓释模型可推广应用于其他药物。
1.5 3D生物打印的生物墨水
3D生物打印是一种多功能的逐层制造技术,通过预先定义的数字模型直接引导逐步添加材料(生物墨水)来制造3D对象,它可以用活细胞来制造复杂的组织结构[34]。卡拉胶具有生物相容性、生物降解性、剪切稀释性和离子凝胶化等特性,但凝胶化特性难以控制,不适合在3D生物打印中应用。研究者们通过在卡拉胶结构里引入甲基丙烯酸酯、阳离子聚合物(如明胶)以及其他物质使其适用于3D生物打印。Li[35]利用两种带相反电荷的水凝胶(即明胶和κ-卡拉胶)之间的静电相互作用,研究了一种3D打印生物墨水,水凝胶结构在37 ℃具有良好的生物相容性和结构完整性。Lim等[36]首先合成甲基丙烯酸k-卡拉胶,通过离子交联和紫外(UV)交联形成水凝胶,并将NIH-3T3(小鼠胚胎)细胞包埋其中,该水凝胶满足生物墨水的要求,负载细胞的水凝胶显示细胞相容性并且能够保留细胞形态。Jiang等[37]利用混合水凝胶墨水(聚乙烯醇(PVA)和κ-卡拉胶)3D打印的水凝胶结构具有优异的流变性,水凝胶具有良好的细胞相容性,最重要的是,细胞不仅能很好地粘附在水凝胶表面,而且能延伸到网格空间。卡拉胶水凝胶为组织工程、药物传递、骨再生等领域提供了许多发展机遇。
2 卡拉胶在生物医学领域中的应用
2.1 伤口敷料
理想的伤口敷料是无毒、抗菌、保持皮肤表面湿润、对伤口毒素吸收有良好的效果并且可以加速伤口愈合,并且在去除时不会对愈合的皮肤造成任何创伤。卡拉胶除了生物降解性、生物相容性和显著的溶胀性,还表现出高延展性,能够更好的与皮肤接触,是理想的伤口敷料[38-39]。
Jaiswal 等[40]以木质素为原料,合成了银纳米粒子(AgNPs),将这些AgNPs掺入κ-卡拉胶水凝胶中来制备抑菌敷料。此外,Jaiswal 等[41]还将硫纳米粒子和葡萄柚籽提取物添加到卡拉胶水凝胶膜中。这两种水凝胶均具有高的溶胀率、良好的气体阻隔性,而且对表皮葡萄球菌和大肠杆菌具有很强的抗菌活性,能在2周内明显愈合大鼠创面,创面面积缩小到3%以下。Karuppusamy等[42]以虾青素、α-生育酚和k-卡拉胶为原料制备了纳米复合水凝胶,制备的纳米复合水凝胶通过皮肤给药能显著恢复小鼠体重,降低空腹血糖水平,提高糖耐量,从而提高糖尿病小鼠伤口的快速愈合能力;如图2,可以清楚地观察到纳米复合水凝胶具有明显的促进伤口愈合作用。
随着创面敷料研究的深入,卡拉胶水凝胶创面敷料趋于智能化,Karine[43]以卡拉胶、刺槐豆胶和蔓越莓提取物为原料,研制了一种用于伤口细菌感染监测的智能创面敷料,如图2,水凝胶膜在pH值为5.0、7.3和9.0的PBS溶液中浸泡后,呈现出明显的颜色变化,还可以抑制革兰氏阳性和革兰氏阴性细菌在水凝胶膜表面的粘附。该纳米凝胶可用于细菌性伤口感染的早期检测。
2.2 药物递送
药物递送在持续向伤口提供药物或关键成分(包括抗菌素)方面发挥着关键作用。药物递送体系能以更好的方式将治疗药物传递到器官和组织的靶部位[44-45]。卡拉胶良好的生物相容性、可调的粘弹性、简单的凝胶机理和热可逆凝胶化,具有良好的释药能力。因此,基于卡拉胶的水凝胶是很有前途的药物传递体系材料[13,46]。

图2 (a)水凝胶在pH 5.0、7.3、9.0的PBS中浸泡30 min后颜色变化图;(b)水凝胶膜在37 ℃与未接种和接种的琼脂表面接触37 ℃、60 min孵育[43]Fig 2 (a) The color changes of hydrogels after soaking for 30 minutes in pH 5, 7.3 and 9 PBS; (b)the hydrogel membrane was incubated for 37 degrees 60 min with uninoculated and agar agar surfaces[43]
刺激响应性水凝胶是一种很有吸引力的药物传递应用的候选材料。Swain等[47]以卡拉胶和瓜尔胶为原料构建了互穿聚合物网络,以甲硝唑为模型药物,在pH为7、12内释药率为72%,随着pH的增加其释放量减小。Fahmy等[48]以k-卡拉胶与海藻酸钠(SA)混合并与钾离子交联,以氯霉素为模型药物,在pH值为4.1时,在体外释放约3h后达到稳定值。Rasool等[49]开发的基于卡拉胶、海藻酸钠、不同分子量的聚乙二醇与(3-氨基丙基)三乙氧基硅烷交联的水凝胶能够控制利多卡因的释放而且具有良好的细胞相容性,可作为一种成功的控释给药系统。NGUYEN等[50]将鱼鳞胶原蛋白和k-卡拉胶的pH敏感水凝胶珠作为一种新的别嘌呤醇载药系统,以提高别嘌呤醇的生物利用度,用于治疗痛风和人体高尿酸水平;实验结果证明了卡拉胶/胶原蛋白/别嘌呤醇水凝胶在不同模拟体液中的溶解比纯别嘌呤醇增加1.6 ~ 6.7倍。
综上所述,卡拉胶水凝胶在释放药物时受pH影响较大,物理交联型的水凝胶在不同pH环境下会发生脱水收缩或者吸水膨胀,从而控制药物释放;化学交联型水凝胶,通过分子链上的酸敏感化学键合,在酸性条件下化学键断裂,破坏化学交联的结构,从而释放药物。
2.3 组织工程
三维细胞培养对组织修复、替换或再生起着重要的作用[51-52]。细胞外基质(ECM)是产生不同类型细胞的重要成分,是特殊组织的基础[53]。生物材料要应用于3D细胞培养,必须模仿细胞外基质的特性,卡拉胶是一种与天然糖胺聚糖结构相似的天然多糖,是组织细胞外基质的重要成分之一。
Sathain等[54]制备了多孔生物活性海藻酸钠/卡拉胶/硅酸钙骨组织工程支架。37 ℃模拟体液浸泡后,可以观察到支架表面羟基磷灰石晶体的形成,而且以双氯芬酸为模型药物的支架体外释药行为适合于术后急性炎症的治疗,该支架是骨替代的候选材料。Zhang等[55]以聚乙烯醇(PVA)和卡拉胶为原料,制备了具有轴向孔结构的水凝胶仿生支架,它比传统方法制备的无定向支架具有具有轴向排列的孔隙结构,这种定向支架的微环境可以模拟天然软骨细胞外基质的生化和物理信号,指导胚胎瘤细胞(ATCD5)在体外的空间组织增殖分化,显示其在软骨修复策略中的潜力。Tytgat等[56]结合3D打印技术开发了由甲基丙烯酰胺改性明胶和甲基丙烯酸κ-卡拉胶组成的支架,将脂肪组织源性干细胞接种到支架上,14天后细胞存活率高达90%,脂肪组织源性干细胞能够在水凝胶共混支架上分化成脂肪细胞系。角膜组织工程需要高的机械强度和水化强度,Rinawati等[57]研制了以卡拉胶为基质的复合胶原-卡拉胶水凝胶,其平衡含水率为87.07%,粘度为10.7346 Pa·s,使其更接近角膜组织特征。
2.4 生物智能传感
生物传感通常是在生物传感器(分析设备)的帮助下检测生物分子。这些生物传感器将汗液、唾液或其他重要体液等生物成分与一个物理化学探测器结合起来[58-59]。由于传感器具有便携性、诊断时间极短、样品制备需求减少,受到了越来越多的关注。近年来,卡拉胶水凝胶作为智能可穿戴传感设备在健康监测方面取得了突破性进展[60]。
FAN等[61]将卡拉胶引入聚丙烯酰胺中,制备了双网络水凝胶(PAAm),第一个网络是疏水连接的PAAm,第二个网络是离子交联的卡拉胶,这两个网络是物理交联的;该水凝胶具有近800 kPa的拉伸强度和近4000 kJ/m3的韧性,具有良好的自恢复能力和导电性,此外,坚固的双网络水凝胶也显示出优异的自愈合能力,水凝胶应变传感器具有良好的柔韧性、快速响应性和稳定性,如图3,水凝胶应变传感器不仅可以检测人体的大范围运动,而且可以检测微小的生理信号。Yang等[62]报道了在一个创新的含K+的聚离子液体(PIL)和κ-卡拉胶之间通过多重交联制备多功能水凝胶。所得水凝胶具有优异的机械性能、物理化学性质及粘附能力,其在可穿戴式应变传感器实时监测人体健康方面显示出巨大的应用潜力。
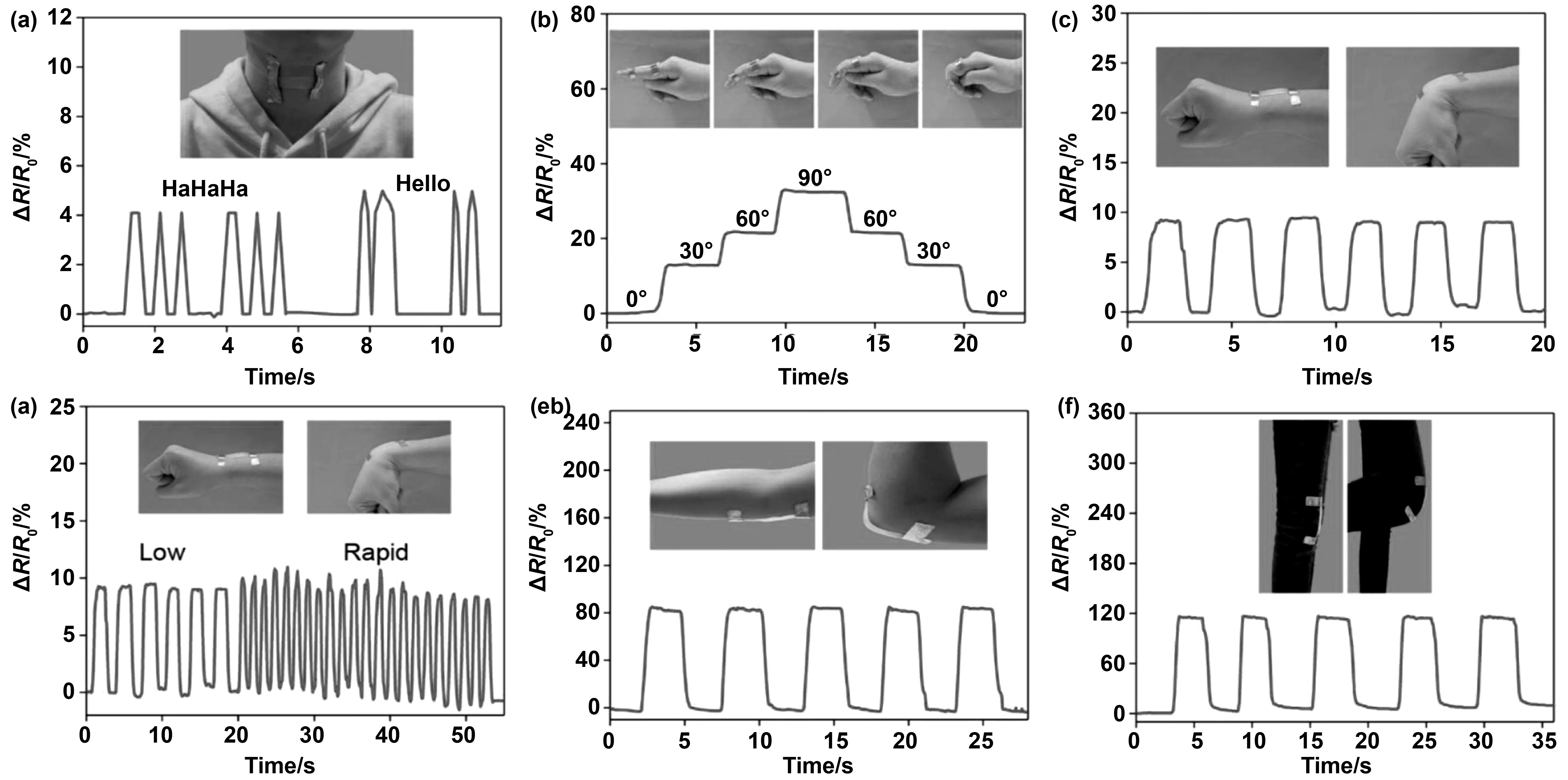
图3 PAAm/CAR10水凝胶应变传感器检测各种人体运动:(a)对不同语音信号的抵抗变化:“哈哈哈”和“你好”;(b)手指在不同角度(0°、30°、60°、90°弯曲时相对阻力的变化;(c)阻力随手腕反复弯曲而变化;(d)手腕在不同速度下反复弯曲时阻力变化;相对阻力随人体关节运动的变化:(e)肘和(f)膝[61]Fig 3 PAAm/CAR10 hydrogel strain sensor detects various human movements [61]
3 结 语
卡拉胶因其优异的生物相容性、生物降解性、抗氧化、抗病毒和抗肿瘤等特性而成为一种具有广泛功能的有前途的生物聚合物。在生物医学应用中,卡拉胶能够在交联剂的帮助下与其他聚合物形成相互连接的网络。这种三维网络为复合材料提供了力学稳定性,同时保持了足够的孔隙度,而孔隙度对基本营养物质的供应、细胞的增殖等都至关重要。在这篇综述中,着重介绍了近年来卡拉胶基水凝胶在伤口敷料、药物输送、组织工程和生物传感方面的生物医学应用。
尽管卡拉胶复合材料的研究正在向多个领域发展,但仍有一些不足需要考虑和解决以满足实用标准:(1)目前关于卡拉胶基生物材料在组织工程、药物递送方面的研究多集中在体外方面,体内和体外-体内相关性研究较少,卡拉胶生物材料的长期毒性、生物相容性、免疫原性等应在临床转化前在动物模型(如小鼠、大鼠)中得到证实;(2)卡拉胶的胶凝特性和粘度特性促进其在药物递送方面的应用,但口服卡拉胶仍面临免疫反应、有害胃肠道反应及其他潜在副作用,需要更多的研究来阐明卡拉胶在作为药物递送系统时的消化情况;(3)为保证卡拉胶基生物材料的生物安全性,材料的制备方法很重要,在满足降解性能、生物活性、机械性能等的同时应探究新的交联方式以模拟自然组织的环境;(4)开发对pH、温度等敏感的功能化卡拉胶材料具有较好的应用前景。
