脊尾白虾EcERR基因的克隆与表达分析*
2022-04-11张春霞李吉涛王佳佳李文洋李明栋
张春霞 李 健 李吉涛 王佳佳 李文洋 李明栋
脊尾白虾基因的克隆与表达分析*
张春霞1,2李 健2①李吉涛2王佳佳2李文洋2李明栋1,2
(1. 水产科学国家级实验教学示范中心(上海海洋大学) 上海 201306;2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东 青岛 266071)
雌激素相关受体(estrogen-related receptor,)是一种真核转录因子,与雌激素的效应有密切关系,参与生物体的能量代谢、细胞增殖分化和性腺发育等生理过程。为了解基因在脊尾白虾()卵巢发育中的作用,采用cDNA末端快速扩增技术(RACE)克隆获得脊尾白虾基因的cDNA序列,该基因全长为2025 bp,包括5′非编码区241 bp,3′非编码区410 bp,开放阅读框1374 bp,编码457个氨基酸。组织表达分析结果显示,在脊尾白虾各组织中均有表达,卵巢组织的表达量最高(<0.05);在卵裂期的表达量显著高于胚胎及幼体发育时期(<0.05);在卵巢发育过程中呈先降低后升高的趋势,卵巢发育Ⅰ期的表达量最高;5-羟色胺浸泡后,实验组的表达量显著高于对照组(<0.05),同时,实验组卵巢发育关键基因卵黄蛋白原基因的表达量显著高于对照组(<0.05)。研究表明,基因参与了脊尾白虾卵巢发育的调控,在脊尾白虾卵巢发育的早期发挥关键作用。
脊尾白虾;雌激素相关受体;卵巢发育;5-羟色胺;基因表达
雌二醇是甲壳动物体内重要的类固醇激素,在甲壳动物生殖过程中发挥重要的作用。甲壳动物体内雌二醇的含量会影响其蜕壳、卵母细胞生长及卵黄的发生(陆剑锋等, 2010)。在脊椎动物中,雌二醇主要通过与雌激素受体(estrogen receptor,)结合来直接或间接调控卵巢发育(Lü, 2016),然而,在甲壳动物中尚未发现基因的存在。雌激素相关受体(estrogen-related receptor,)与具有高同源性,尤其在DNA结合域,并且与雌激素效应密切相关(Giguére, 2002)。脊椎动物中基因与其性腺分化和发育有关(张照斌等, 2008)。对于甲壳动物,已经在多个物种中发现的存在。三疣梭子蟹()(陆洋等, 2016)的基因与其蜕皮、卵原生殖细胞的增殖有关;在罗氏沼虾()中,基因通过调控卵母细胞的减数分裂、生殖相关激素的合成与释放以及卵黄的生成,进而影响罗氏沼虾卵巢的发育(刘金磊等, 2018),推测甲壳动物的雌激素可能通过与基因结合来调控卵巢发育(柳梅梅等, 2015)。
5-羟色胺(5-hydroxytryptamine)是甲壳动物体内重要的活性物质,广泛分布于甲壳动物的神经系统和外周器官,参与甲壳动物色素迁移、生殖活动、蜕皮活动、骨骼肌收缩等多项生理过程(Richardson, 1991)。5-羟色胺能刺激脑、胸神经节分泌性腺刺激激素,从而促进性腺的发育。一定浓度5-羟色胺的刺激,能促进虾、蟹卵巢指数和卵母细胞直径的增加(Kulkarni, 1992),通过5-羟色胺的注射或浸泡能够加快甲壳动物的卵巢发育(蔡生力等, 2000)。
脊尾白虾()广泛分布于我国沿岸,因其具有生长快、繁殖能力强、味道鲜美且营养价值高等优点,已成为我国海水池塘养殖的主要虾类品种(连春盎等, 2017; 窦全伟等, 2019)。脊尾白虾因卵巢可连续多次发育并抱卵繁殖而为人们所关注,是研究十足目(Decapoda)真虾繁殖机制的潜在模式生物(马骊等, 2018)。然而,通过人工控制技术仍未解决脊尾白虾无法全年繁殖的难题。本研究基于前期转录组研究筛选到可能调控脊尾白虾卵巢发育的基因,利用cDNA末端快速扩增技术(RACE)克隆获得脊尾白虾基因全长序列,分析其在不同组织、卵巢发育不同阶段的表达情况,探究其响应外源5-羟色胺的表达模式,以期阐明基因在卵巢发育过程中的作用,为深入了解脊尾白虾等甲壳动物卵巢发育问题奠定理论基础。
1 材料与方法
1.1 实验材料
脊尾白虾取自山东日照海辰水产有限公司,均为活力好、生长健康的个体,将实验用虾暂养于200 L的PVC桶中,暂养7 d。24 h持续充氧,每天换水清污1次,换水量为1/3,每天早晚2次饲喂蛤蜊肉。取10尾健康的脊尾白虾各组织,包括肌肉、眼柄、触角腺、甲壳(不带表皮)、胃、心脏、肠道、卵巢、鳃和肝胰脏于液氮中研磨,用于RNA的提取。
1.2 5-羟色胺对脊尾白虾卵巢发育的影响
随机选取暂养7 d的脊尾白虾雌虾进行实验。根据预实验结果,设置对照组和实验组,实验组5-羟色胺浓度为50 μg/mL,此剂量间隔3 d浸泡1次,即第1、5和9天分3次浸泡对亲虾进行促熟实验,每组30尾脊尾白虾,设置3个平行。实验期间的管理与暂养相同。实验结束后,取卵巢组织,每组取6尾,置于液氮中保存,用于RNA的提取。采用qRT-PCR方法检测浸泡后脊尾白虾卵巢中基因和卵黄蛋白原基因的含量。
1.3 EcERR基因的cDNA全长克隆
使用Trizol法提取脊尾白虾卵巢总RNA,选择质量及完整性较好的卵巢组织的总RNA,使用SMARTTMRACE cDNA amplification kit分别合成3′和5′RACE的cDNA第一链。从脊尾白虾转录组文库中获得基因部分EST序列,利用Primer Premier 5软件设计中间片段引物验证其准确性后,设计3′和5′RACE特异性引物(表1)。3′和5′RACE引物分别与UPM引物配对进行cDNA的3′和5′末端扩增。利用Omega公司的琼脂糖凝胶回收试剂盒对目的片段进行切胶回收,将目的片段与Peasy-T1载体(北京全式金生物技术有限公司)连接,然后转入到感受态细胞Trans1-T1中,过夜培养后,通过蓝白斑筛选挑出阳性单克隆,经PCR检测合格后送测序。
1.4 反转录及qRT-PCR检测
根据王绪峨(1989)对脊尾白虾早期胚胎发育的特征描述,对脊尾白虾早期胚胎发育各时期(卵裂期、囊胚期、原肠期、无节幼体期、前溞状幼体期、后溞状幼体期和溞状幼体)进行取样。使用Trizol法提取脊尾白虾各组织(肌肉、眼柄、触角腺、甲壳、胃、心脏、肠道、卵巢、鳃和肝胰腺)、胚胎和幼体发育的不同时期及不同卵巢发育时期的卵巢组织的总RNA,用紫外分光光度计与1.0%琼脂糖凝胶电泳检测总RNA的质量及完整性。
cDNA的合成:基因组DNA去除,在RNase-free的离心管中配制如下混合液:2 μL RNA,10 μL RNase free ddH2O,4 μL 4×gDNA wiper mix,瞬时离心数秒,使溶液聚集于管底,用移液器轻轻吹打混匀,42℃ 2 min;配制逆转录反应体系,在上一步反应液中直接加入4 μL 5×HiScript Ⅱ qRT SuperMix Ⅱ,50℃15 min,85℃ 5 s。合成的cDNA用于后期脊尾白虾基因的克隆及qRT-PCR检测。
Duan等(2013)研究发现,脊尾白虾18S rRNA (18S)作为内参基因具有稳定性,本研究以18S rRNA作为内参基因。根据脊尾白虾内参基因18S rRNA (NCBI登录号: GQ369794)、基因、卵黄蛋白原基因(NCBI登录号:JQ319034)的ORF序列,合成qRT-PCR引物(表1)。按照ChamQTMSYBR®Color qPCR master mix说明书,利用ABI 7500 Fast荧光定量PCR仪器进行荧光定量分析。10 μL反应体系:5.0 μL SYBR Color qPCR master mix (2×),0.2 μL Rox reference dyeⅡ(50×),正、反向引物各0.4 μL (10 μmol/L),3.0 μL去离子水,1.0 μL cDNA。反应程序:95℃ 30 s,95℃5 s,60℃ 34 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。每个实验组设置3次重复,采用2–ΔΔCt方法(Livak, 2001)计算目的基因的相对表达量,利用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),运用Duncan多重比较进行显著性检验。
表1 本研究所用引物序列

Tab.1 Sequences of the primers used in this study
1.5 生物信息学分析
利用SeqMan进行序列拼接与组装,得到基因的cDNA全长。NCBI ORF Finder (https://www. ncbi.nlm.nih.gov/orffinder/)确定其开放阅读框并预测氨基酸序列,利用BLAST(http://blast.ncbi.nlm.nih. gov/Blast.cgi)进行同源性比对。利用SignalP 4.0软件分析信号肽,利用MEGA 6.0软件(Tamura, 2011)中的neighbor-joining法(Saitou, 1987)构建系统树。
2 结果与分析
2.1 EcERR cDNA全长的克隆及氨基酸序列分析
采用RACE法克隆得到脊尾白虾cDNA全长,命名为,GenBank登录号为MN265353。cDNA全长为2025 bp,其中,5′端非编码区241 bp,3′端非编码区410 bp,开放阅读框1374 bp,编码457个氨基酸,预测分子量大小为50.83 kDa,理论等电点为7.84,N端具有特殊的信号肽序列(1~29 aa)(图1)。SMART软件分析预测,含有2个保守功能结构域、1个核受体C4锌指结构(ZnF_C4)(124~195 aa)、1个配体结合结构域(HOLI结构域)(267~426 aa)及1个低复杂性区域(11~23 aa) (图2)。
预测EcERR氨基酸亲水性的平均值为–0.331,说明该蛋白具有较强的亲水性,但在2个保守的功能结构域存在多个疏水区,其中,368位点的疏水性最强,为2.656,207位点的亲水性最强,为–3.056。在配体结合区,可以明显看到9个疏水区域(图3)。
2.2 EcERR同源性分析及系统进化树结构
使用NCBI BLAST(http://blast.ncbi.nlm.nih.gov/ Blast.cgi)对脊尾白虾基因编码的氨基酸序列与其他物种基因编码的氨基酸序列进行同源性比较。结果发现,其与罗氏沼虾同源性最高达到98.47%,与拟穴青蟹()、三疣梭子蟹和中华绒螯蟹()同源性分别为80.84%、78.82%和79.43%。利用MEGA 6.0软件对脊尾白虾EcERR氨基酸序列进行系统进化分析,并构建系统进化树(图4),结果显示,EcERR氨基酸与同为长臂虾科(Palaemonidae)的罗氏沼虾的亲缘关系最近,其与甲壳动物聚为一支,然后与昆虫类聚为一大支;哺乳动物、鸟类、鱼类等脊椎动物存在、和3种亚型,且和亚型的进化关系更近。
2.3 EcERR的组织表达特征
利用qRT-PCR方法分析脊尾白虾基因在各个组织中的表达情况(图5)。结果显示,在眼柄、肌肉、肝胰腺、心脏、卵巢、鳃、触角腺、甲壳、胃和肠中均有表达,其中,在卵巢中相对表达量最高,胃和心脏次之,在肌肉和肝胰腺的表达量最低。

图1 脊尾白虾EcERR的核苷酸序列及其编码的氨基酸序列
黑色框标记起始密码子和终止密码子;实线表示信号肽;双下划线表示多腺苷酸信号AATTAAA
The black box marks the start codon and the stop codon; The solid line represents the signal peptide. Double underline represents the polyadenylation signal AATTAAA

图2 EcERR结构域预测
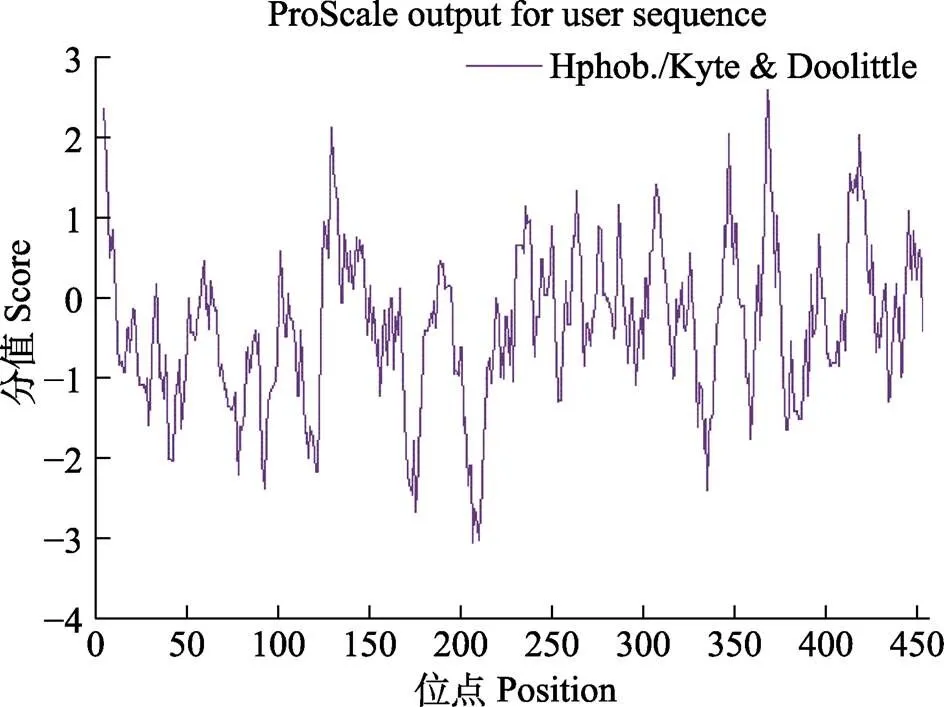
图3 EcERR氨基酸序列疏水性结果预测
2.4 EcERR基因在胚胎发育过程中的表达特征
脊尾白虾基因在胚胎发育过程中的表达特征如图6所示,卵裂期基因的表达量显著高于其他发育时期(0.05),随胚胎发育和细胞分裂,其整体呈先下降再升高再下降的趋势。无节幼体期与前溞状幼体期无显著性差异,基因在前溞状幼体期、无节幼体期的表达量显著高于囊胚期、原肠期、后溞状幼体期和溞状幼体第1天(<0.05)。
2.5 EcERR基因在卵巢发育时期的表达
利用qRT-PCR分析在脊尾白虾不同卵巢发育时期的表达水平如图7所示,在卵巢发育过程中,基因呈先下降再上升的趋势。基因在卵巢发育Ⅰ期表达量最高(<0.05),随后表达量显著下降,到卵巢发育Ⅲ期表达量最低;卵巢发育Ⅱ、Ⅲ和Ⅳ期之间,表达量无显著差异;卵巢发育Ⅳ期表达量显著低于卵巢发育Ⅴ期(<0.05);卵巢发育Ⅰ期和Ⅴ期的表达量相比无显著差异。

图4 EcERR氨基酸序列NJ系统进化树
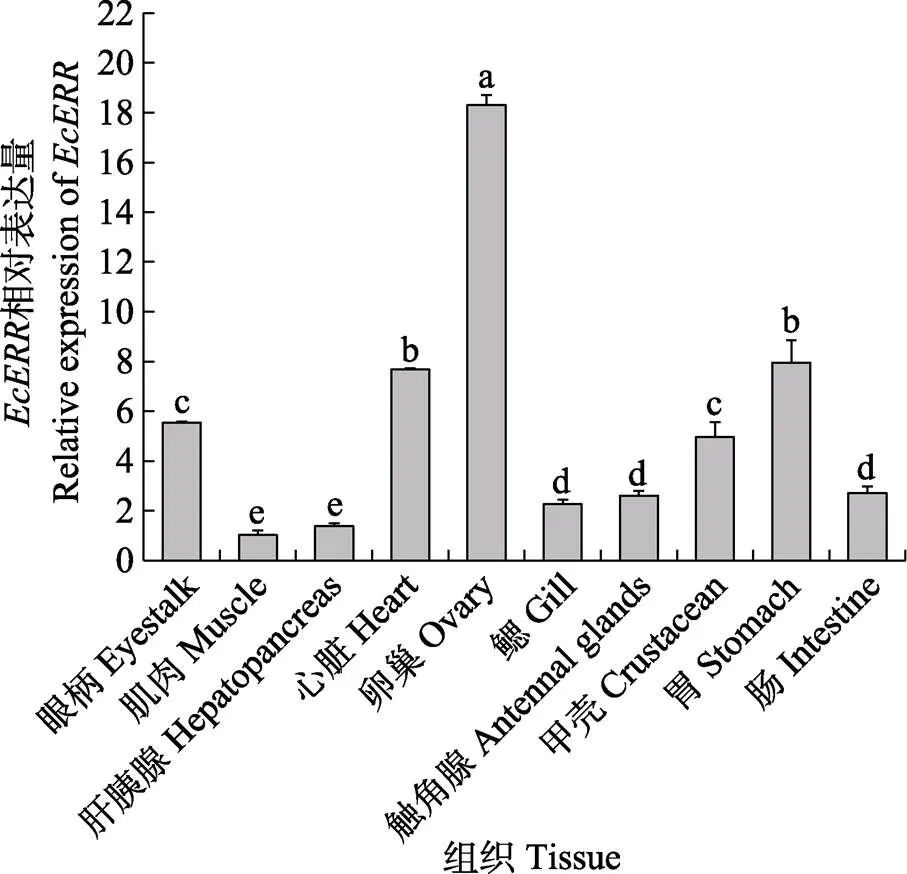
图5 脊尾白虾EcERR在各组织中的表达
不同字母代表差异显著(<0.05)。下同
Different letters mean significant difference (<0.01). The same as below
2.6 5-羟色胺对EcERR和卵黄蛋白原基因表达的影响
脊尾白虾经5-羟色胺浸泡后,脊尾白虾卵巢发育Ⅰ期的卵巢组织中卵黄蛋白原基因(vitellogenin,)的表达情况如图8所示。经5-羟色胺浸泡后的实验组卵黄蛋白原基因的表达量极显著高于对照组(未浸泡5-羟色胺组)(<0.01),是对照组的15.15倍;实验组脊尾白虾卵巢中基因的表达量极显著的高于对照组(<0.01),是对照组的4.48倍。

图6 EcERR在不同胚胎发育时期的表达

图7 EcERR基因在卵巢发育各时期的表达
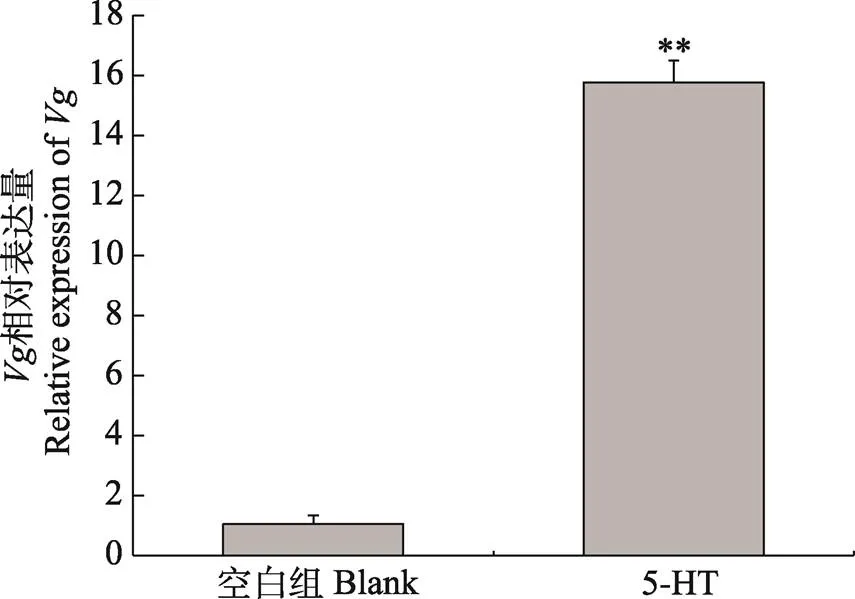
图8 卵黄蛋白原基因在脊尾白虾卵巢中的表达
** 代表差异极显著(<0.01)。下同
** means highly significant difference (<0.01). The same as below

图9 EcERR基因在卵巢中的表达
3 讨论
3.1 EcERR基因cDNA全长的克隆及序列分析
本研究克隆脊尾白虾基因,其编码的蛋白序列与其他甲壳动物大小及结构基本一致,N端具有29个氨基酸组成的信号肽序列。脊尾白虾基因与多数核受体基因结构一样,包含1个DNA结合域(ZnF_C4锌指结构域)、1个配体结合结构域及1个低组分复杂区域,2个结构域的生理功能主要是通过调控基因表达来实现。基因与具有很强的同源性,但作用方式不同。基因属于孤儿核受体家族成员,缺乏天然的内源性配体,只能以非配体依赖型方式发挥作用,即其必须与相关辅调节因子结合,形成ERR-辅调节因子复合物,识别目标调控基因上的ERE或ERRE位点,激活启动下游靶基因表达,参与信号通路的调控(Long, 2020; 陈健等, 2001)。
3.2 EcERR在脊尾白虾卵巢发育中的功能研究
具有组织表达特异性,Real-time PCR的结果表明,其在卵巢中的表达量显著高于其他组织(<0.05),为鳃、肌肉等组织的8~18倍(图5)。研究表明,基因在多种物种的性腺中高表达,哺乳动物中,基因在小鼠()生殖系统中大量表达,其表达从生殖细胞开始一直维持到性别分化(Park, 2017);在鱼类中,在青鳉和底鳉()的脑和性腺组织中表达量最高(Cheung, 2013; Tarrant, 2006);在软体动物中,在贻贝()(Nagasawa, 2015)的生殖腺中大量表达;在甲壳动物中,在罗氏沼虾的卵巢中表达量最高(赵苗鑫等, 2017)。基因在不同物种性腺组织的高表达,均说明可能在动物的生殖发育和性成熟中发挥着重要的调控作用。
基因在无脊椎动物的卵巢和胚胎发育过程中发挥重要作用。研究发现,敲除家蚕()受精卵的基因后,其胚胎发育时间会延迟,发现其作为转录因子调控糖酵解途径中的3大限速酶基因(丙酮酸激酶、己糖激酶和磷酸果糖激酶),推测其可能通过调控糖酵解途径来影响家蚕的胚胎发育(龙威, 2019)。本研究发现,基因在受精卵期的表达显著高于其他胚胎发育时期(<0.05),随着细胞分裂,表达量呈下降趋势,推测可能通过调节糖酵解途径,为细胞分裂提供能量。基因在拟黑多刺蚁()卵巢的卵子发生过程中的滤泡细胞和生长期,卵黄发生期的卵母细胞中的表达量较高(欧阳霞辉等, 2014);表达定位于地中海贻贝()、贻贝卵巢的滤泡细胞中,可与基因相互作用调控卵母细胞的发育(Nagasawa, 2015);Liu等(2019)研究发现,基因在罗氏沼虾卵巢发育早期的表达量较高,在Ⅱ和Ⅲ期的表达量降低,推测其可能对罗氏沼虾卵巢发育早期进行调控。根据王绪峨(1987)的研究,将脊尾白虾卵巢发育大致分为5期,本研究根据卵巢大小和颜色收集了脊尾白虾不同发育时期的卵巢样本,发现在卵巢发育早期表达量较高,随着卵巢的逐渐成熟,随之降低,在卵巢发育Ⅲ期表达量最低,随后逐渐回升,说明参与了脊尾白虾卵巢发育,推测其在卵巢发育早期发挥关键的调控作用。
5-羟色胺作为生物胺,广泛分布于甲壳动物体内。研究发现,5-羟色胺具有促进卵巢发育的效应,其通过调控神经器官中性腺刺激激素的释放,从而影响卵巢发育,在大西洋招潮蟹()中注射5-羟色胺激动剂,其卵巢指数和卵母细胞直径显著增大(Meeratana, 2006);体外注射5-羟色胺可以明显促进中国对虾()的卵巢发育(蔡生力等, 2000)。卵黄蛋白原基因是非哺乳卵生动物卵细胞发育过程中产生的重要物质成分,为胚胎及幼体发育提供营养和功能性的物质,是卵巢发育重要的标记基因(Wang, 2020)。Köhler等(2007)研究发现,在无脊椎动物中,雌激素必须与基因的雌激素反应元件结合,才能启动卵黄蛋白原等基因的转录调控。本研究通过5-羟色胺浸泡脊尾白虾后发现,实验组脊尾白虾的卵巢开始发育,而对照组不发育;且实验组脊尾白虾卵巢发育Ⅰ期的卵巢组织中卵黄蛋白原基因的表达量是空白组的15.15倍。实验组脊尾白虾卵巢中基因的表达量显著高于对照组(< 0.05),是空白对照组的4.48倍,说明5-羟色胺对脊尾白虾卵巢发育有一定的促进作用,参与脊尾白虾的卵巢发育的过程,但其调控机理有待进一步研究。
CAI S L, YANG C H. Induced ovarian maturation ofby injection of four kinds of hormones. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2000, 39(S1): 91–95 [蔡生力, 杨丛海. 体外注射激素对中国对虾卵巢发育的影响. 中山大学学报(自然科学版), 2000, 39(S1): 91–95]
CHEN J, ZHOU D J. Progresses in estrogen receptor-related receptors. Chemistry of Life, 2001, 21(6): 487–489 [陈健, 周度金. 雌激素受体相关受体研究进展. 生命的化学, 2001, 21(6): 487–489]
CHEUNG N K M, CHEUNG A C K, YE R R. Expression profile of estrogen receptors and estrogen-related receptors is organ specific and sex dependent: The Japanese medakamodel. Journal of Fish Biology, 2013, 83: 295–310
DOU Q W, LI J T, LIU P,. cDNA cloning and immunological properties of two variants of hemocyanin subunit with higher molecular weight in. Acta Hydrobiologica Sinica, 2019, 43(1): 37– 44 [窦全伟, 李吉涛, 刘萍, 等. 脊尾白虾2种血蓝蛋白大亚基变体的克隆及功能分析. 水生生物学报, 2019, 43(1): 37–44]
DUAN Y, LIU P, LI J,. cDNA cloning, characterization and expression analysis of peroxiredoxin 5 gene in the ridgetail white prawn. Molecular Biology Reports, 2013, 40(12): 6569–6577
GIGUÉRE V. To ERR in the estrogen pathway. Trends in Endocrinology and Metabolism, 2002, 13(5): 220–225
KÖHLER H R, KLOAS W, SCHIRLING M,. Sex steroid receptor evolution and signalling in aquatic invertebrates. Ecotoxicology, 2007, 16(1): 131–143
KULKARNI G K, NAGABHUSHANAM R, AMALDOSS G. In vivo stimulation of ovarian development in the red swamp crayfish(Girard), by 5-hydroxytryptamine. Invertebrate Reproduction and Development, 1992, 21(3): 231–240
LIAN C A, LI J, LI J T,. Effects of dry exposure on the respiratory metabolism-related enzymes of. Progress in Fishery Sciences, 2017, 38(4): 53–60 [连春盎, 李健, 李吉涛, 等. 干露胁迫对脊尾白虾()呼吸代谢相关酶的影响. 渔业科学进展, 2017, 38(4): 53–60]
LIU J L, CHEN H P, ZHAO M X,. Molecular characterization of estrogen-related receptor (ERR) ofand its differential expression during ovary development stages and np exposures. Turkish Journal of Fisheries and Aquatic Sciences, 2019, 19(7): 561–570
LIU J L, DENG S P, JIANG D N. Screening of ovarian genes associated with reproduction inand their changes in expression pattern in different development stages after ERR interference. Journal of Guangdong Ocean University, 2018, 38(3): 8–16 [刘金磊, 邓思平, 江东能, 等. ERR-dsRNA对罗氏沼虾卵巢中ERR及生殖相关基因表达的影响. 广东海洋大学学报, 2018, 38(3): 8–16]
LIU M M, WU X G, LIU Z J. Distribution and changes of two estrogen receptors in the ovaries and hepatopancreas during the ovarian development of Chinese mitten crab. Acta Hydrobiologica Sinica, 2015, 39(4): 822–830 [柳梅梅, 吴旭干, 刘智俊, 等. 中华绒螯蟹卵巢发育期间两种雌激素受体在卵巢和肝胰腺的分布及变化. 水生生物学报, 2015, 39(4): 822–830]
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod. Methods, 2001, 25(4): 402–408
LONG W, WU J, SHEN G,. Estrogen-related receptor participates in regulating glycolysis and influences embryonic development in silkworm. Insect Molecular Biology, 2020, 29: 160–169
LONG W. Estrogen-related receptor () participates in regulating glycolysis and influences embryonic development in silkworm. Master´s Thesis of Southwest University, 2019 [龙威. 家蚕雌激素相关受体()参与调节糖酵解并影响家蚕胚胎发育的研究. 西南大学硕士研究生学位论文, 2019]
LU J F, CHANG G L, WU X G,. Hormonal regulations of ovarian development and vitellogenesis in Chinese mitten crabfed on two different diets. Oceanologia et Limnologia Sinica, 2010, 41(4): 505–512 [陆剑锋, 常国亮, 吴旭干, 等. 两组不同饲料对中华绒螯蟹()卵巢发育及卵黄发生的激素调控. 海洋与湖沼, 2010, 41(4): 505–512]
LU Y, WU X G, PAN G P,. Expression analysis ofduring the molting cycle in. Journal of Shanghai Ocean University, 2016, 25(3): 321–328 [陆洋, 吴旭干, 潘桂平, 等. 三疣梭子蟹雌激素相关受体基因在蜕皮过程中的表达分析. 上海海洋大学学报, 2016, 25(3): 321–328]
LÜ Z M, LIU W, LIU L Q,. Cloning, characterization, and expression profile of estrogen receptor in common Chinese cuttlefish,. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 2016, 325(3): 181–193
MA L, GE Q Q, XU Y,. Cloning of the translationally controlled tumor protein gene (TCTP) and expression analysis of autophagy regulatory related genes during the development of ovary in. Progress in Fishery Sciences, 2018, 39(4): 101–109 [马骊, 葛倩倩, 许杨, 等. 脊尾白虾翻译控制肿瘤蛋白基因TCTP克隆及自噬调控相关基因在卵巢发育期的表达. 渔业科学进展, 2018, 39(4): 101–109]
MEERATANA E, WITHYACHUMNAMKUL B, DAMRONGPHOL P,. Serotonin induces ovarian maturation in giant freshwater prawn broodstock,de Man. Aquaculture, 2006, 260(1/2/3/4): 315–325
NAGASAWA K, TREENC N, KONDO R,. Molecular characterization of an estrogen receptor and estrogen-related receptor and their autoregulatory capabilities in twospecies. Gene, 2015, 564(2): 153–159
OUYANG X H, HOU X L, GAO D D,. Expression of estrogen relative receptor gene in gonad of. Journal of Northwest Minzu University (Natural Science), 2014, 35(1): 53–57 [欧阳霞辉, 侯兰新, 高丹丹, 等. 拟黑多刺蚁()性腺雌激素相关受体基因的表达. 西北民族大学学报(自然科学版), 2014, 35(1): 53–57]
PARK E, KUMAR S, LEE B,. Estrogen receptor-related receptor γ regulates testicular steroidogenesis through direct and indirect regulation of steroidogenic gene expression. Molecular and Cellular Endocrinology, 2017, 452: 15–24
RICHARDSON H G. DEECARAMAN D, FINGERMAN M. The effect of biogenic amines on ovarian development in fiddler crab,. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 1991, 99(1/2): 53–56
SAITOU N, NEI M. The neighbor-joining method: A new method for reconstructing phylogenetic trees. Molecular Biology and Evolution, 1987, 4(4): 406–425
TAMURA K, PETERSON D, PETERSON N,. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011, 28(10): 2731–2739
TARRANT A M, GREYTAK S R, CALLARD G V,. Estrogen receptor-related receptors in the killifish: Diversity, expression, and estrogen responsiveness. Journal of Molecular Endocrinology, 2006, 37(1): 105–120
WANG L, GUO Q, LEVY T,. Ovarian development pattern and vitellogenesis of ridgetail white prawn,. Cell and Tissue Research, 2020, 382(2): 367– 379
WANG X E. A preliminary study on the reproductive biology of. Chinese Journal of Zoology, 1987, 22(1): 7–10 [王绪峨. 脊尾白虾繁殖生物学的初步研究. 动物学杂志, 1987, 22(1): 7–10]
WANG X E. Early embryonic development onand relation of its incubation with temperature and salinity. Journal of Fisheries of China, 1989, 13(1): 59–64 [王绪峨. 脊尾白虾早期胚胎发育以及温、盐度与其孵化的关系. 水产学报, 1989, 13(1): 59–64]
ZHANG Z B, HU J Y, SAI S X,. Gene cloning, sequence analysis and tissue expression of estrogen-related receptor α(ERRα) in Japanese medaka and its transcriptional responses after differential EDCs exposure. Environmental Science, 2008, 29(11): 3153–3158 [张照斌, 胡建英, 赛思翔, 等. 青鳉ERRα的克隆、序列分析、组织表达及其对不同EDCs暴露的响应. 环境科学, 2008, 29(11): 3153–3158]
ZHAO M X, CHEN H P, LIU J L,. Prokaryotic expression and purification of estrogen related receptor () gene from. Journal of Guangdong Ocean University, 2017, 37(1): 108–112 [赵苗鑫, 陈华谱, 刘金磊, 等. 罗氏沼虾雌激素相关受体()基因原核表达与纯化. 广东海洋大学学报, 2017, 37(1): 108–112]
Cloning and Expression Analysis ofin
ZHANG Chunxia1,2, LI Jian2①, LI Jitao2, WANG Jiajia2, LI Wenyang2, LI Mingdong1,2
(1. National Demonstration Center for Experimental Fisheries Science Education (Shanghai Ocean University), Shanghai 201306, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao, Shandong 266071, China)
Estrogen-related receptor () is a eukaryotic transcription factor that is closely related to the effect of estrogen and is involved in the regulation of energy metabolism, cell proliferation and differentiation, gonadal development, and other physiological processes. To understand the role of estrogen-related receptors in the ovarian development of, thewas cloned using RACE technology. The gene is 2025 bp long, including an open reading frame of 1374 bp, a 5′ untranslated region of 241 bp, and a 3′ untranslated region of 410 bp, which encodes 457 amino acids. Tissue expression analysis showed thatwas expressed in manytissues, with the highest expression level in ovarian tissue. The expression level ofin the cleavage stage was significantly higher than in that of other embryo and larval development stages (<0.05). The expression level offirst decreased and then increased during ovarian development, with the highest expression level in StageⅠ. After 5-hydroxytryptamine invaded, the expression levels of vitellogenin andin the experimental group were significantly higher than in the control group (<0.05). The results showed thatis involved in the regulation ofovarian development and plays a key role in its early stages.
; Estrogen-related receptor; Ovarian development; 5-Hydroxytryptamine; Gene expression
LI Jian, E-mail: lijian@ysfri.ac.cn
S917.4
A
2095-9869(2022)02-0185-09
10.19663/j.issn2095-9869.20210129001
* 国家重点研发计划课题(2019YFD0900403)、财政部和农业农村部: 国家现代农业产业技术体系专项资金、国家自然科学基金(32072974)和中国水产科学研究院基本科研业务费项目(2020TD46)共同资助 [This work was supported by the Earmarked Fund for the National Key Research and Development Program of China (2019YFD0900403), China Agriculture Research System of MOF and MARA, National Natural Science Foundation of China (32072974), and Central Public-Interest Scientific Institution Basal Research Fund, CAFS (2020TD46)]. 张春霞,E-mail: zhangchunxiacx@163.com
李 健,研究员,E-mail: lijian@ysfri.ac.cn
2021-01-29,
2021-02-22
张春霞, 李健, 李吉涛, 王佳佳, 李文洋, 李明栋. 脊尾白虾基因的克隆与表达分析. 渔业科学进展, 2022, 43(2): 185–193
ZHANG C X, LI J, LI J T, WANG J J, LI W Y, LI M D. Cloning and expression analysis ofin. Progress in Fishery Sciences, 2022, 43(2): 185–193
(编辑 冯小花)
