脑室注射和饲料缺乏组氨酸或缬氨酸对翘嘴鳜摄食的调控作用
2022-03-31邹家明何珊梁旭方朱强胜
邹家明,何珊,梁旭方,朱强胜
华中农业大学水产学院/华中农业大学鳜鱼研究中心/
长江经济带大宗水生生物产业绿色发展教育部工程研究中心,武汉 430070
近年研究证据表明,鱼类中存在营养感应机制[1-2],但氨基酸传感机制与食物摄入调控的关系尚不清楚。鱼类中关于氨基酸的研究,主要集中在亮氨酸和精氨酸,在肌肉和肝脏等外周组织,以及氨基酸水平变化对哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路的影响等方面[3-4]。有关鱼类中组氨酸和缬氨酸通过下丘脑信号整合调节食物摄入的研究较少[5]。组氨酸是合成组胺的前体,在鱼类中含量丰富,是水产动物饲料中不可或缺的一种必需氨基酸[5]。缬氨酸属于支链氨基酸,是参与蛋白合成与代谢的重要成分之一。氨基酸代谢受损会改变摄食行为并调节下丘脑中的食欲神经肽表达[6]。此外,鱼类摄食的调控是通过中枢摄食系统和外周饱食系统协同作用实现的。脑室注射氨基酸后会直接引起鱼类中枢系统对脑室氨基酸水平的感知从而传递摄食控制信号[7-8],而鱼类摄食剥夺或缺乏氨基酸的饲料会间接刺激机体外周系统对营养信号的感知进一步调节饲料的摄入[3,9]。下丘脑中GCN2 信号通路是大多数真核生物中保守的氨基酸信号传感途径,可通过感知胞内氨基酸水平,调节下游Eif2α 磷酸化并激活转录因子atf4,进而调节动物的摄食[10-11]。此外,下丘脑神经系统中的两类重要神经元(NPY/AGRP 促食欲神经元和POMC/CART 抑食欲神经元)可根据机体的营养状况整合摄食控制信号,调节动物的摄食行为[12]。
对于试验对象翘嘴鳜(Siniperca chuatsi),笔者所在课题组前期已采用脑室注射的方式开展相关研究[7-8],证明此方法具有可行性。为了研究中枢神经的直接信号感知以及外周组织的间接信号感知,本研究通过脑室注射组氨酸和缬氨酸和饲料缺乏组氨酸和缬氨酸2 种方式来探索这2 种氨基酸对翘嘴鳜摄食的影响,以及GCN2 信号通路和食欲因子在其中可能存在的调控作用,以期完善必需氨基酸调控翘嘴鳜摄食的机制。
1 材料与方法
1.1 试验材料
试验用翘嘴鳜及其饵料鱼麦鲮(0.37±0.05 g)均由华中农业大学鳜鱼研究中心提供。翘嘴鳜人工配合饲料原料购自武汉高龙公司,饲料级氨基酸原料购自上海源叶生物科技有限公司,细胞级L-组氨酸、L-缬氨酸(晶体氨基酸)购自Sigma-Aldrich 公司,GCN2抑制剂GCN2iB购自MCE公司。
1.2 试验分组及处理
1)脑室注射试验。筛选40 尾体表无伤、摄食状态优良的翘嘴鳜,平均质量(40±4)g,随机分为4组,每组10 尾,每个水族缸(50 cm×40 cm×40 cm)投放1尾翘嘴鳜。正式试验前在循环水系统中暂养1周,每天2 次饱食投喂,记录摄食的饵料鱼数量以供正式试验时饵料鱼的投放数作参考。正式试验时,24 h 饥饿处理后用MS-222 将翘嘴鳜麻醉,选用10 μL 量程的微量注射器进行脑室注射,脑室注射方法参照文献[8]。氨基酸溶于PBS、注射剂量参照文献[8],GCN2 抑制剂GCN2iB 参照试剂说明溶于二甲基亚砜(DMSO)。试验设空白对照组、氨基酸注射组、GCN2iB 抑制组和药物对照组。其中空白对照组注射2 μL DMSO 30 min后再注射2 μL PBS,氨基酸组注射2 μL DMSO 30 min 后再注射20 μg(溶于2 μL PBS)的L-组氨酸、L-缬氨酸,抑制剂组注射10 μg GCN2iB(溶于2 μL DMSO)30 min 后再注射20 μg(溶于2 μL PBS)的L-组氨酸、L-缬氨酸,药物对照组注射10 μg GCN2iB(溶于2 μL DMSO)30 min后再注射2 μL PBS。注射后15 min内翘嘴鳜恢复正常运动,每缸投放30 尾饵料鱼,统计注射后1 h 及4 h各组累计摄食量。
2)饲料驯饲试验。200 尾翘嘴鳜平均质量为(250±10)g,暂养至水泥池中,筛选108 尾大小规格一致、体表无伤、摄食状态优良的翘嘴鳜随机分为3组(对照组、组氨酸缺乏组、缬氨酸缺乏组),每组6个网箱,每个网箱(100 cm×100 cm×100 cm)投放6 尾翘嘴鳜,网箱内水温维持在(26±1)℃。饲料驯饲试验前1周,采用对照组饲料投喂使试验鱼的生理状态趋于同一水平,各组饲料成分含量见表1、表2。其中,鱼粉中含64.5%粗蛋白和8.6%粗脂肪;酪蛋白中含88.7%粗蛋白和0.8%粗脂肪;淀粉中含0.3%粗蛋白和0.2%粗脂肪;鱼油中含98%粗脂肪;大豆油中含98%粗脂肪。维生素预混料的成分为(每千克饲料):胆碱,1 000 mg;肌醇,600 mg;维生素A,40 mg;维生素D,60 μg;维生素C,210 mg;维生素E,200 mg;维生素K,10 mg;维生素B6,20 mg;维生素B12,0.1 mg;烟酸,200 mg;泛酸,50 mg;叶酸,10 mg;硫胺素,15 mg;核黄素,25 mg;生物素,3.2 mg。矿物质预混料(每千克饲料):CaHPO4,94.9 g;KCl,7.1 g;MgSO4,4.6 g;NaCl,3.8 g;CuSO4,39.1 mg;FeSO4,455.4 mg;ZnSO4,220.3 mg;MnSO4,39.9 mg;Na2SeO3,2.0 g;KI,1.4 mg;Na2MoO4,0.4 mg;CoSO4,0.1 mg;KF,0.8 mg。氨基酸预混料中含86.27%粗蛋白。

表1 试验饲料成分Table 1 Ingredients of experimental feed%
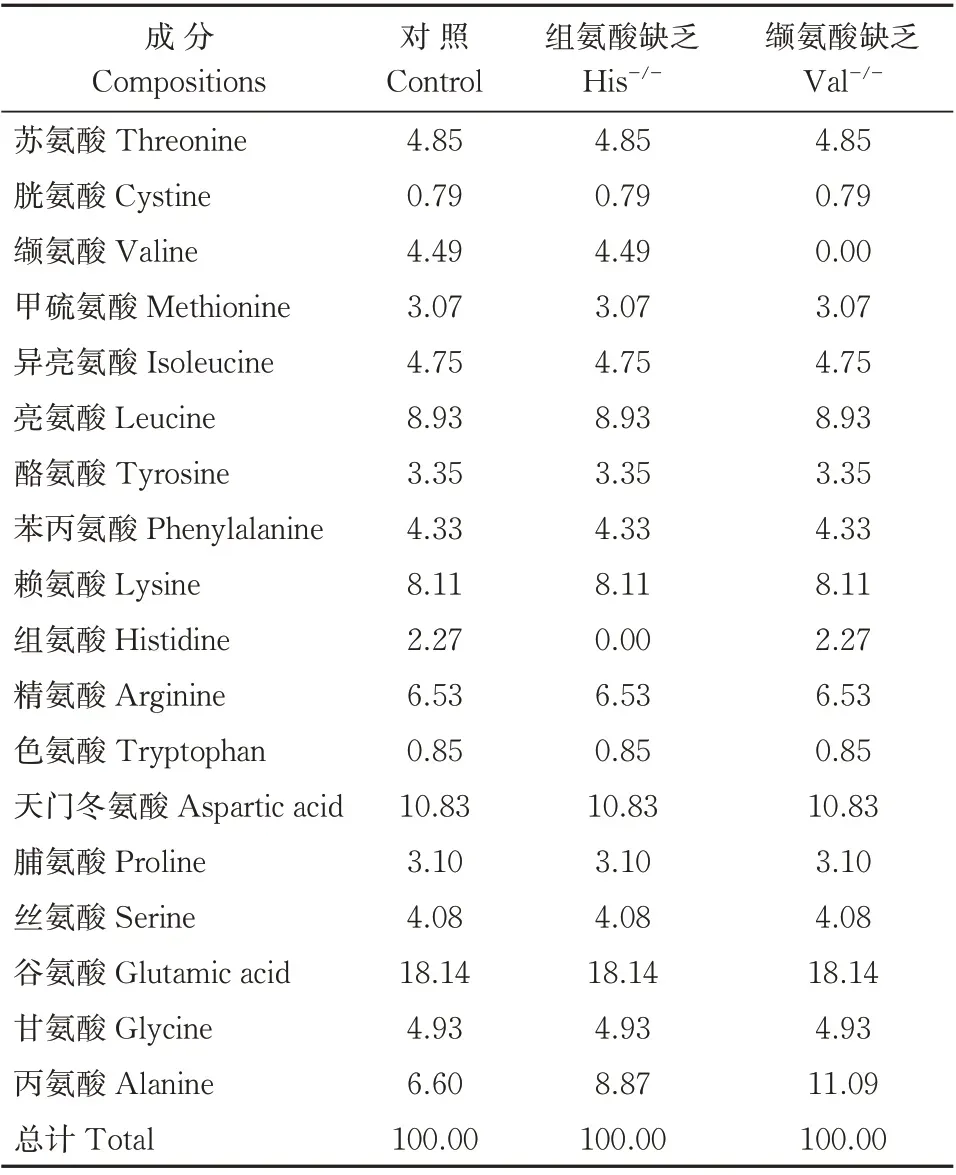
表2 氨基酸预混料成分Table 2 Compositions of amino acid premix%
每天2 次饱食投喂,分别在上午8:00 和下午5:00,且每次在固定点喂食,选用滴水、流水等作为投喂信号。为防止饲料过于硬,在投饲前喷洒池水,以改善饲料口感。正式试验中,提前24 h 饥饿处理后,对照组投喂氨基酸完全饲料,组氨酸缺乏组投喂组氨酸缺乏饲料,缬氨酸缺乏组投喂缬氨酸缺乏饲料,每组投饲30 min后,待80%的翘嘴鳜不摄食则停止投喂,计算摄入饲料颗粒数。每2次试验之间间隔3 d,期间用对照组饲料投喂以恢复各组翘嘴鳜生理状态。
1.3 总RNA提取及q-PCR分析
依据生产商的试剂说明,使用Trizol Reagent(TaKaRa 公司)提取翘嘴鳜下丘脑组织总RNA。然后使用多重检测酶标仪(BioTek,Winooski,USA)检测总RNA 浓度后,-80 ℃保存样品。依据产品说明书,使用Hiscript II Q RT SuperMix for qPCR 逆转录试剂盒(诺唯赞,南京)将总RNA(1 μg)逆转录为cDNA,置于-20 ℃短期保存。
在鳜基因组数据库中检索相关基因的全长序列,由Primer Premier 5.0 软件设计荧光定量引物。目的基因的表达量使用MyiQTM 2双色实时PCR检测系统(Bio-Rad,Hercules,USA)进行检测。mRNA的扩增程序为95 ℃3 min 预变性,然后在95 ℃变性30 s,退火30 s,设置40 个循环。熔解曲线分析从65 ℃开始,0.5 ℃/6 s 逐渐增加至95 ℃,以验证PCR反应的特异性。rpl13a作为内部对照基因,采用2-ΔΔCt计算法量化目的基因的相对表达水平。各基因的PCR引物序列等信息详见表3。

表3 实时荧光定量PCR引物Table 3 Primer sequences used for RT-PCR
1.4 Western blotting
下丘脑组织使用含1% PMSF 和1%去磷酸化酶抑制剂的1×RIPA 蛋白裂解液(碧云天,中国)获取总蛋白。在4 ℃下以12 000 r/min 离心10 min 后,收集上清液并使用BCA蛋白浓度测定试剂盒(翊圣,上海)检测蛋白质浓度。按比例添加5×SDS 蛋白上样缓冲液(碧云天,中国),混匀后于95 ℃高温变性10 min。取等量变性后的蛋白于10%SDS-PAGE中电泳分离条带,采用湿式转印系统(Bio Rad,USA)将蛋白转印至PVDF 膜(Millipore,USA)。1×TBST(含0.1%Tween 20)洗膜2次后,在含10%脱脂奶粉的封闭液中室温封闭4 h,然后4 ℃过夜孵育一抗。目的抗体为P-eIF2a(1∶1 000,CST)、ATF4(1∶1 000,CST)、P-S6(1∶1 000,CST),内参抗体选用β-tubulin(1∶2 000,Bioss)。一抗4 ℃过夜孵育结束后,1×TBST(含0.1%Tween 20)洗膜2 次,二抗室温孵育1 h。二抗选用Goat-anti-rabbit(1∶30 000,CST)、Goat-anti-Mouse(1∶15 000,CST)。 1×TBST(含0.1% Tween 20)洗膜4 次后,于扫膜仪(Licor Odyssey,USA)中显影成像,用Image J 软件进行条带分析。
1.5 数据分析
所有值均表示为“平均值±标准误”。SPSS 22.0软件进行数据的统计分析,使用独立样本t检验比较两组数据之间的差异,使用单因素方差分析(ANOVA)和Duncan’s多重比较分析单变量多组数据,使用双因素方差分析(ANOVA)和Duncan’s多重比较分析双变量多组数据。P<0.05被认为具有统计学意义。
2 结果与分析
2.1 脑室注射组氨酸或缬氨酸对翘嘴鳜摄食的影响
经统计分析脑室注射组别与摄食统计时间对翘嘴鳜摄食量的影响无交互性(P>0.05)。与空白对照组(DMSO+PBS)相比,注射20 μg 组氨酸或缬氨酸1 h 后均能显著降低翘嘴鳜的摄食量(P<0.05),注射组氨酸4 h 后对翘嘴鳜的摄食量无影响(P>0.05),而注射缬氨酸4 h后能够显著降低翘嘴鳜的摄食量(P<0.05)。此外,注射10 μg GCN2iB,可使注射组氨酸1 h 后降低的摄食水平恢复,但对注射缬氨酸引起的摄食降低无恢复作用(P>0.05)。同时注射10 μg GCN2iB 和20 μg 组氨酸时,4 h 组摄食量显著高于1 h组(P<0.05)(图1)。

图1 脑室注射组氨酸(A)或缬氨酸(B)后翘嘴鳜的累计摄食量Fig.1 Accumulative food intake of Chinese perch after ICV administration with histidine(A)or valine(B)
2.2 饲料中缺乏组氨酸或缬氨酸对翘嘴鳜摄食的影响
试验一共开展5 次独立的摄食量统计,且每2 次试验之间间隔3 d,间隔期间投喂对照组饲料以恢复各组翘嘴鳜的生理水平。结果显示,与对照组饲料相比,翘嘴鳜对缺乏组氨酸或缬氨酸的饲料单次实验摄食量整体呈降低的趋势(图2A、B),而且对缺乏组氨酸或缬氨酸的饲料累计摄食量极显著减少(P<0.01)(图2C、D)。
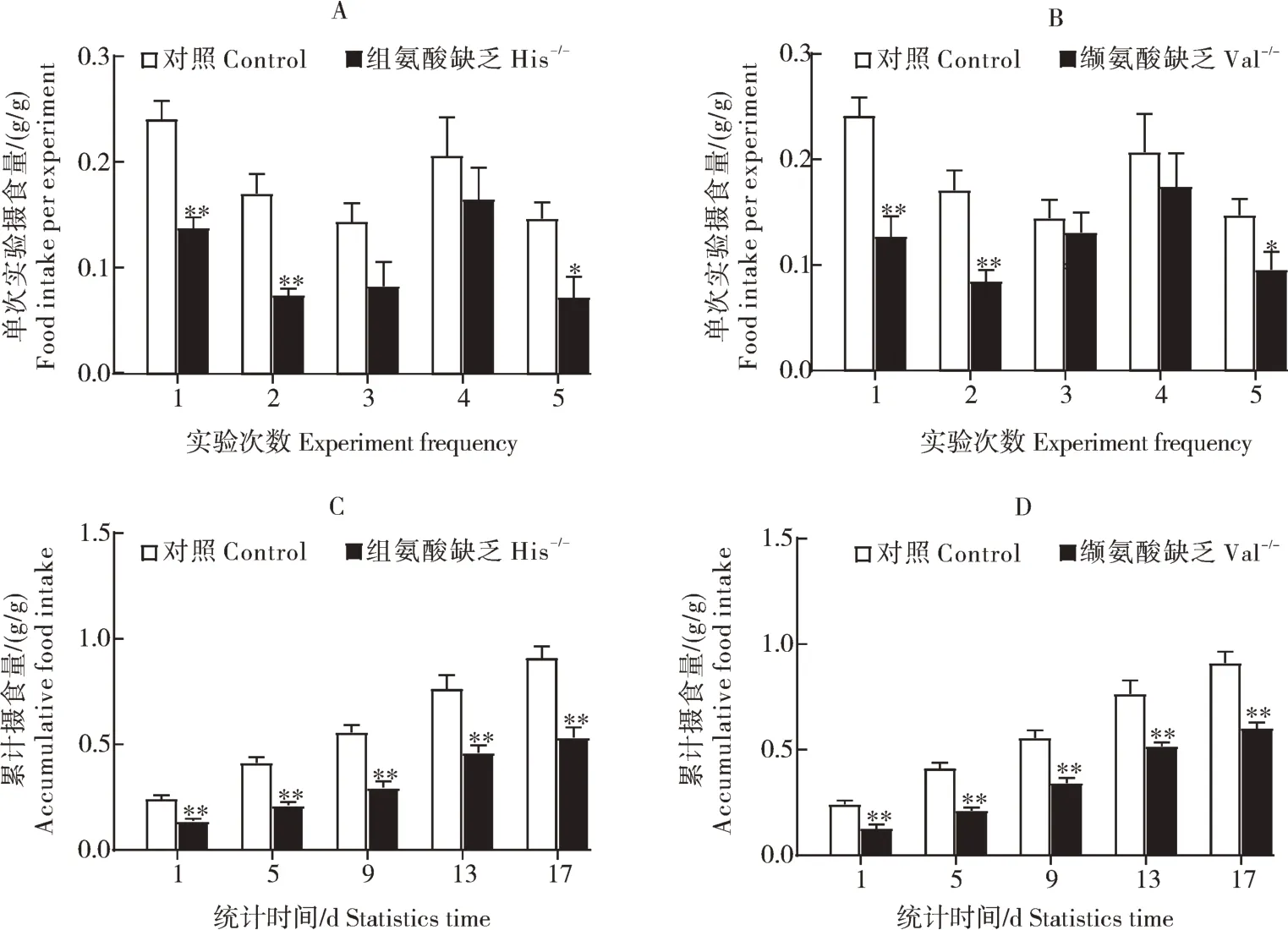
图2 翘嘴鳜对缺乏组氨酸或缬氨酸饲料的摄食量Fig.2 Food intake of Chinese perch on deprived feed of histidine or valine
2.3 饲料中缺乏组氨酸或缬氨酸对翘嘴鳜下丘脑GCN2信号通路的影响
与对照组相比,翘嘴鳜摄食缺乏组氨酸或缬氨酸的饲料后,下丘脑中GCN2 信号通路下游转录因子atf4的基因表达显著降低(P<0.05)(图3A),但Peif2α 的蛋白水平无显著性差异(P>0.05)(图3B、C)。
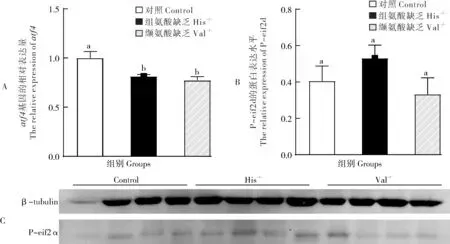
图3 翘嘴鳜摄食缺乏组氨酸或缬氨酸饲料后下丘脑P-eif2α和atf4表达量Fig.3 Expression of P-eif2α and atf4 in hypothalamus after ingesting deprived feed of histidine or valine in Chinese perch
2.4 饲料中缺乏组氨酸或缬氨酸对翘嘴鳜下丘脑食欲基因的影响
翘嘴鳜摄食缺乏组氨酸或缬氨酸的饲料后,其下丘脑食欲基因的表达变化如图4 所示。与对照组相比,翘嘴鳜摄食缺乏组氨酸或缬氨酸的饲料后下丘脑npy、agrp基因的mRNA表达水平呈现下降的趋势(图4A、B),且npy基因的mRNA 表达水平受到显著下调(P<0.05)(图4A),而pomc、cart基因的mRNA表达水平呈现上升的趋势(图4C、D)。
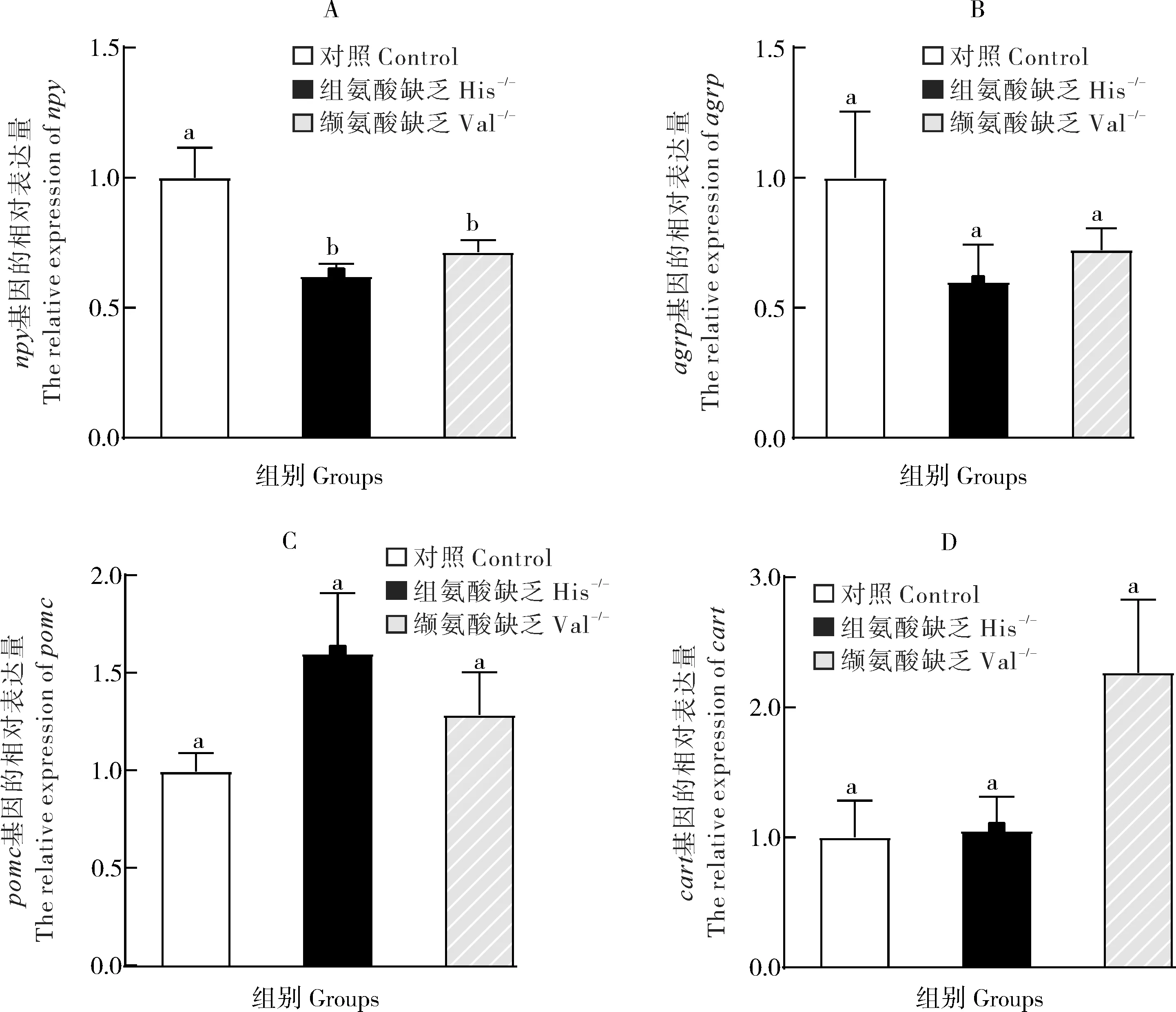
图4 翘嘴鳜摄食缺乏组氨酸或缬氨酸饲料后下丘脑食欲基因的表达变化Fig.4 Expression changes of appetite genes in the hypothalamus after ingesting deprived feed of histidine or valine in Chinese perch
3 讨 论
氨基酸是参与机体合成代谢的重要物质,食物中氨基酸的丰度一定程度上影响了动物对食物的摄入量。本研究结果显示,脑室注射20 μg 组氨酸或缬氨酸1 h 后,翘嘴鳜的摄食量显著降低,表明脑室组氨酸或缬氨酸浓度的升高可在短时间内迅速抑制食物的摄入。这与虹鳟脑室注射亮氨酸后摄食减少[13]、大鼠腹腔注射组氨酸2 h后其食物摄入量受到抑制[14]的结果一致。而这也许是因为一种氨基酸的浓度过高会影响其他氨基酸的吸收效率,从而间接影响鱼类的摄食生长[15]。此外,本研究发现同时注射氨基酸感知通路关键因子GCN2 的抑制剂GCN2iB 和组氨酸1 h后会使翘嘴鳜下降的摄食水平恢复,表明GCN2 信号通路被抑制后,组氨酸将无法发挥抑食作用。但GCN2 信号通路被抑制4 h 后,脑室注射缬氨酸的抑食作用依然存在,可能因为缬氨酸作为支链氨基酸还受到了mTOR 信号通路的调控[8]。以上结果表明,GCN2信号通路可能参与了脑室注射组氨酸抑制翘嘴鳜摄食行为的调节。
动物通常会拒绝必需氨基酸缺乏的食物,这是一种适应性行为[16],食欲降低、生长缓慢、饲料利用率低是鱼类氨基酸不足的主要症状[17]。本研究对翘嘴鳜投喂缺乏组氨酸或缬氨酸的饲料,结果显示翘嘴鳜会显著减少对缺乏组氨酸或缬氨酸饲料的摄入。类似地,大黄鱼摄食缺乏蛋氨酸的饲料后,其食欲减弱、摄食量降低[18]。用缺乏缬氨酸的饮食喂食大鼠,发现大鼠产生了严重的厌食症(食物摄入量减少80%)[19]。动物会减少单一必需氨基酸缺乏食物的摄入量,血清中所含有的该种必需氨基酸水平降低,而整体或其他氨基酸水平增加,缺乏非必需氨基酸不会导致动物体内氨基酸的消耗[20]。因此,本研究组氨酸或缬氨酸缺乏饲料可能引起血液中氨基酸失衡,而这也许导致翘嘴鳜对该氨基酸缺乏食物的拒食。此外,前梨状皮质(anterior piriform cortex,APC)中的神经元能够直接感知食物摄入后血液中氨基酸失衡从而迅速激活蛋白激酶GCN2[21]。小鼠摄食必需氨基酸缺乏的膳食后,GCN2可识别必需氨基酸的消耗,并引起饮食拒绝及相应的适应性策略[22]。然而,本研究结果显示翘嘴鳜摄食缺乏组氨酸或缬氨酸的饲料后,下丘脑GCN2 信号通路Eif2α蛋白磷酸化水平无显著变化,但下游atf4基因表达受到显著性抑制。有研究表明,氨基酸缺乏对于atf4的激活存在定时调控,即长时间的氨基酸缺乏会引起atf4 活性的降低以恢复机体整体蛋白的合成[23]。因此,本研究结果可能是因为取样的时间点存在滞后产生的。但饲料中缺乏组氨酸或缬氨酸引起的摄食抑制与GCN2信号通路仍存在相关性。
中枢神经系统是动物摄食的主要调节器,接受外周刺激,感受血液中的营养和激素信号,影响中枢食欲因子的表达,最终调节摄食量。有研究表明不平衡氨基酸饮食摄入对脑中氨基酸浓度的影响主要集中在下丘脑区域[24],NPY/AGRP 和POMC/CART 神经元则是下丘脑中参与摄食调控的一级神经元[25]。因此,为了进一步研究翘嘴鳜下丘脑对氨基酸不平衡饮食的响应,我们检测了4种食欲因子的mRNA 表达水平,结果显示,与对照组相比,翘嘴鳜摄食缺乏组氨酸或缬氨酸的饲料后下丘脑食欲因子npy基因的mRNA 表达水平显著降低,但agrp、pomc、cart基因的mRNA 表达水平无显著变化。笔者所在课题组以往研究结果表明组氨酸引起翘嘴鳜摄食减少与npy基因的表达降低有关[7]。类似地,大鼠与小鼠喂食缬氨酸缺乏饮食后,npy基因的mRNA表达水平也有降低的趋势[26]。以上结果表明饲料中缺乏组氨酸或缬氨酸可能通过下调npy基因的表达从而抑制翘嘴鳜的摄食量。
综上所述,组氨酸和缬氨酸通过脑室注射和饲料缺乏的方式均可抑制翘嘴鳜摄食,且与GCN2 信号通路有关,饲料缺乏组氨酸或缬氨酸可能通过下调促食欲因子npy基因的表达起到抑食作用。
