西洋参细胞悬浮培养体系的建立
2022-03-31庞富洲韦坤华秦双双强宝宝缪剑华
庞富洲,韦坤华,,王 硕,邱 莉,梁 莹,韦 范,秦双双,强宝宝,缪剑华,,*
(1.广西医科大学药学院 广西,南宁 530021;2.广西药用植物园,广西药用资源保护与遗传改良重点实验室 广西,南宁 530023;3.广西药用植物园,广西壮族自治区中药资源智慧创制工程研究中心 广西,南宁 530023;4.广西药用植物园,西南濒危药材资源开发国家工程实验室 广西,南宁 530023)
西洋参()是五加科()人参属多年生草本药用植物。现代化学及药理学研究表明,西洋参的主要有效成分是人参皂苷,其具有保护心血管、抗癌、抗炎、提高免疫力等功效。目前,西洋参的栽培方式主要为播种繁殖,培育时间长,种植成本高,而且因为农药的使用、病虫害的侵袭、天气的变化以及种植地的不同,导致西洋参产品质量高低不一。因此,寻找一种稳定、高效获得良好的西洋参组织的方法实属必要。
植物组织培养方法具有不受环境因素的影响、培养过程易操作、培养条件易调控等优点。可以利用植物组织培养手段,建立西洋参细胞悬浮培养体系,从而稳定、高效地获得良好的西洋参组织。例如周倩耘等黑枸杞愈伤组织建立细胞悬浮培养体系,实现黑枸杞细胞培养条件的优化;姜鸿运等通过建立水飞蓟细胞悬浮培养体系,优化细胞培养条件,发现了不同因子对水飞蓟宾积累的影响。
本试验采用美国本土西洋参诱导出的愈伤组织作为外植体,通过正交试验研究不同激素对西洋参愈伤组织快速生长的影响、观察西洋参细胞悬浮培养过程中细胞生长动态变化,以及研究了摇床转数、光照及接种量对细胞生长的影响,旨在完善西洋参细胞悬浮培养体系的建立,也为西洋参细胞扩大培养及有效成分的提取提供物质基础。
1 仪器与材料
1.1 实验仪器
超净工作台(型号:NU-425-600),摇床(型号:3500 STD),立式灭菌锅(型号:MLS-3751L),pH测试仪(型号:STARTER 2100),天平(型号:E-Series Balances)
1.2 实验材料
实验外植体经美国中田纳西州立大学高莹教授鉴定为西洋参愈伤组织。水为灭菌超纯水,MS培养基(Phyto-Tech LABS公司,美国),2,4-D试剂(PhytoTech LABS公司,美国),KT试剂(PhytoTech LABS公司,美国),NAA试剂(PhytoTech LABS公司,美国)。
2 实验方法
2.1 愈伤组织生长研究
设计正交试验表,以三因素三水平的正交分析方法研究2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D),萘乙酸(NaPhthaleneacetic Acid,NAA),激动素(6-Furfurylaminopurine,KT)三种激素对西洋参愈伤组织增殖的影响,30d后观察其增殖情况,重复三次。培养基增殖效果指标:愈伤组织增殖倍数;愈伤组织增殖倍数=接种后愈伤组织鲜重/接种前愈伤组织鲜重。正交试验表详情见表1。
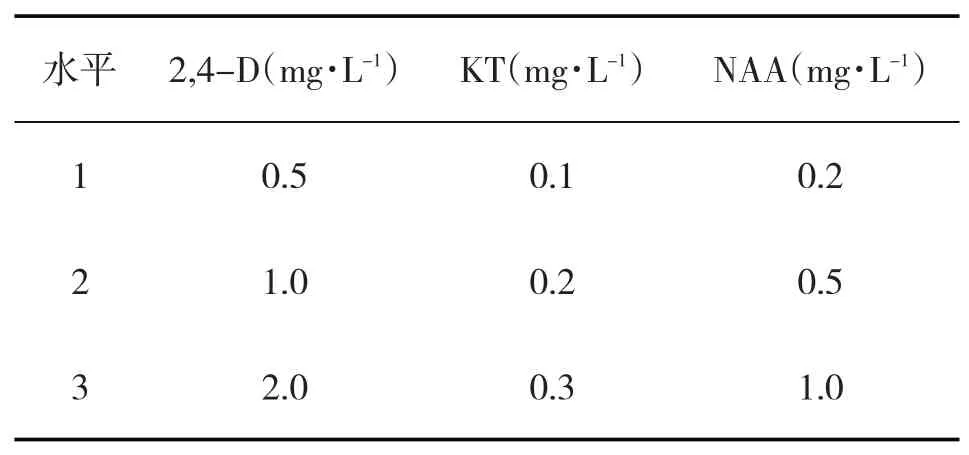
表1 正交试验因素水平表
2.2 西洋参悬浮细胞培养及生长动态变化研究
愈伤组织继代两次之后,选择生长旺盛、结构疏松,易于分散的愈伤组织,将1 g愈伤组织用手术刀切碎后接种至含30mL液体培养基(MS+2,4-D 1.0 mg·L+KT 0.1 mg·L+蔗糖30 g·L)的125mL的锥形瓶中,每隔4d停止培养其中一个培养瓶,用滤纸过滤混合物,收集滤纸上的细胞称鲜重。将测完鲜重的细胞放入35℃烘干箱中,待完全干燥后(2d)记录干重。每组设3个平行对照。培养条件:在转数为100 r·min的摇床上培养。培养温度为(25±2)℃,相对湿度70%,暗培养。
2.3 摇床转速对西洋参细胞生长的影响
为了探明摇床转数对细胞生长的影响,每个培养瓶中接种1g愈伤组织,将接种的培养瓶分别置于转数为80,100,120 r·min的摇床上进行培养,24d后停止培养,用滤纸过滤混合物,收集滤纸上的细胞称鲜重。将测完鲜重的细胞放入35℃烘干箱中,待完全干燥后(2d)记录干重。每组设3个平行对照。
2.4 光照对西洋参细胞生长的影响
为探明光照对西洋参细胞生长的影响,每个培养瓶中接种1g愈伤组织,将接种的培养瓶分别置于无光和16h光照8 h黑暗条件下,在转数为120 r·min的摇床上进行培养,24d后停止培养,用滤纸过滤混合物,收集滤纸上的细胞称鲜重。将测完鲜重的细胞放入35℃烘干箱中,待完全干燥后(2d)记录干重。每组设3个平行对照。
2.5 接种量对西洋参细胞生长的影响
为探明接种量对人参细胞生长的影响,在每个培养瓶中分别接种1,1.5,2g西洋参愈伤组织,将接种的培养瓶置于转数为120 r·min的摇床上进行培养,暗培养。24d后停止培养,用滤纸过滤混合物,收集滤纸上的细胞称鲜重。将测完鲜重的细胞放入35℃烘干箱中,待完全干燥后(2d)记录干重。每组设3个平行对照。
2.6 数据处理
试验数据采用Excel和spss19.0软件统计软件对数据进行分析处理,所得数据均为重复3次的平均值,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
3 实验结果
3.1 激素2,4-D、KT、NAA对西洋参愈伤组织增殖的影响
选取2,4-D、KT、NAA因素,以MS为基础培养基,研究其9种组合对西洋参愈伤组织增殖的影响,在暗培养30d后,统计愈伤组织的增殖倍数。通过表2观察分析可知,极差R的值越大,表明该因素对西洋参愈伤组织增殖的影响就越大。由此可知,对西洋参愈伤组织增殖的影响为:2,4-D>KT>NAA,说明2,4-D对西洋参愈伤组织增殖的影响是最大的。从表2可知,0.5 mg·L2,4-D对应的K值大于1.0 mg·L2,4-D和2.0 mg·L2,4-D对应的K值,即2,4-D的均值K1>K2>K3,说明0.5 mg·L浓度的2,4-D对西洋参愈伤组织增殖的影响最大。同理,KT的均值K1>K3>K2,NAA的均值K1>K3>K2。故在本实验中,最适合西洋参愈伤组织增殖的激素组合为0.5mg/L 2,4-D+0.1mg/L KT+0.2mg/L NAA,见表2。
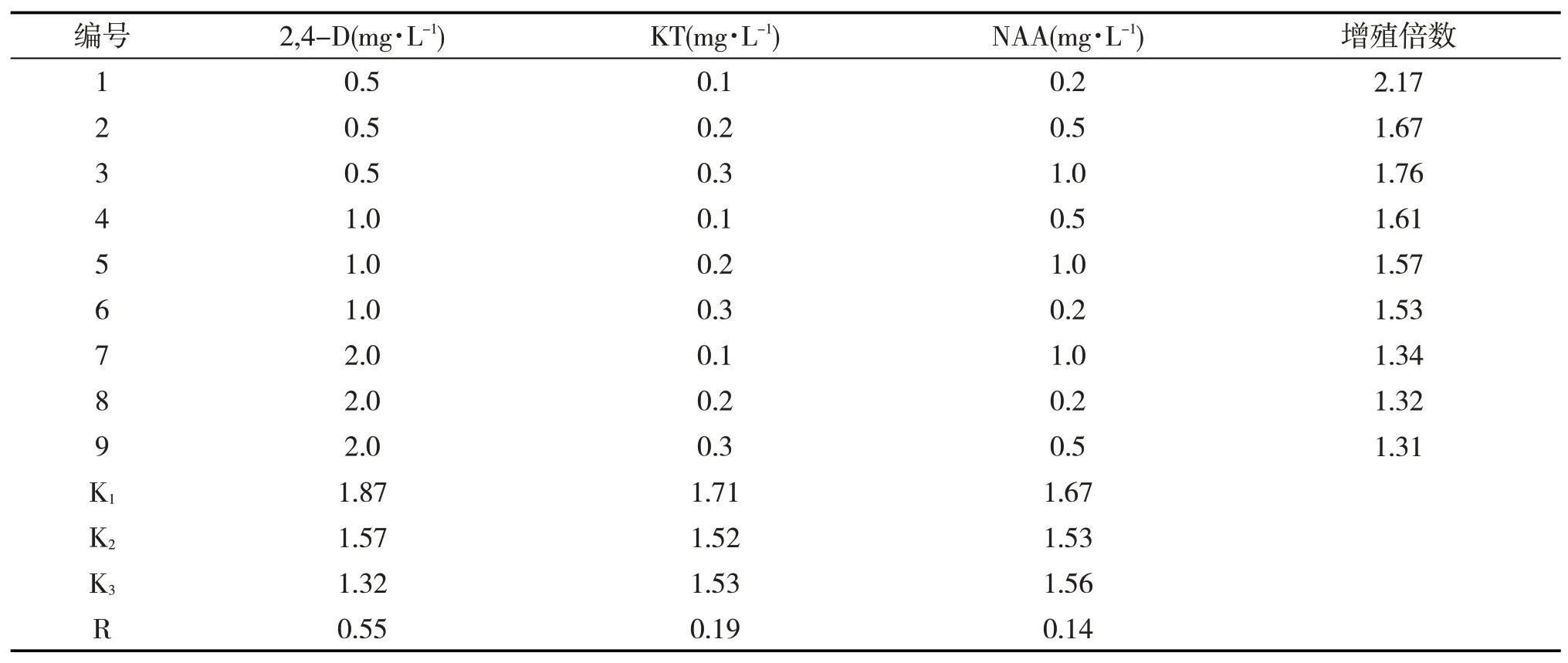
表2 不同激素2,4-D,KT和NAA对西洋参愈伤组织生长影响的正交试验结果
3.2 西洋参细胞生长动态变化
西洋参细胞的鲜重与干重的变化趋势类似,随着培养时期呈增加的趋势,从培养到第4d,细胞的鲜重和干重增长缓慢,从第5d到第8d,细胞鲜重和干重开始缓慢增加,从第9d到24d,细胞鲜重和干重快速增加,细胞培养24d之后,细胞鲜重开始降低,干重增长速度减缓,见图1和图2。
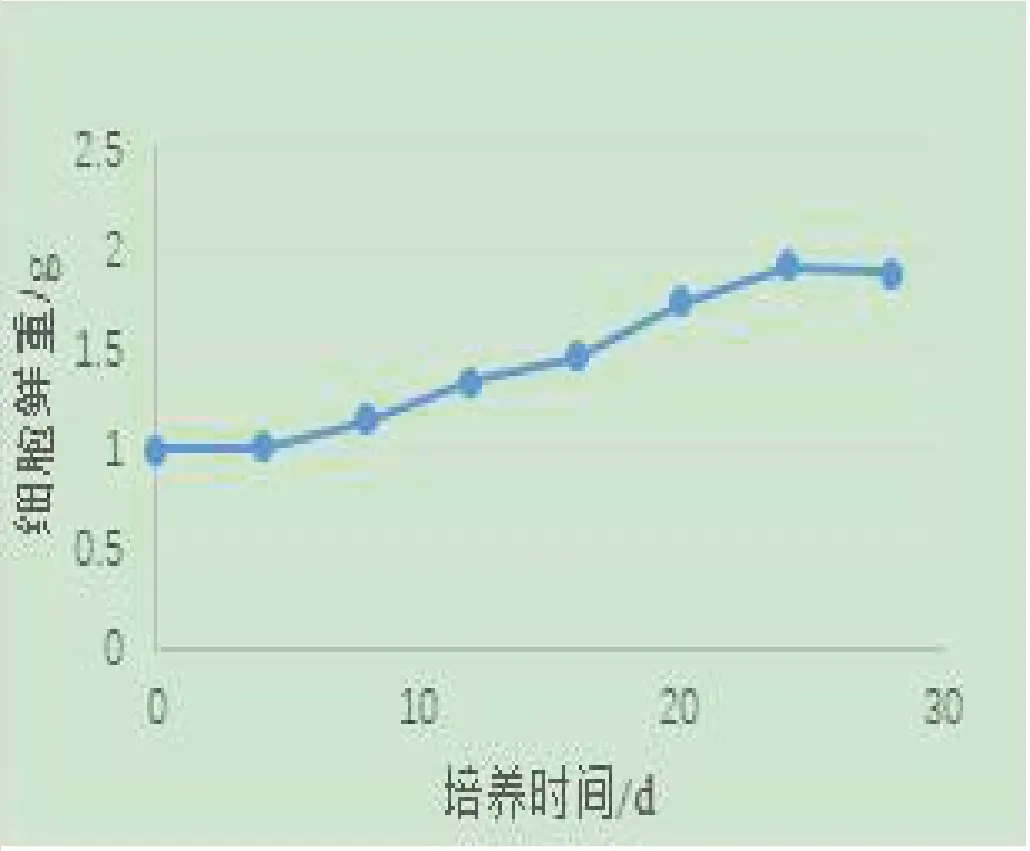
图1 西洋参细胞悬浮培养过程中细胞鲜重的变化
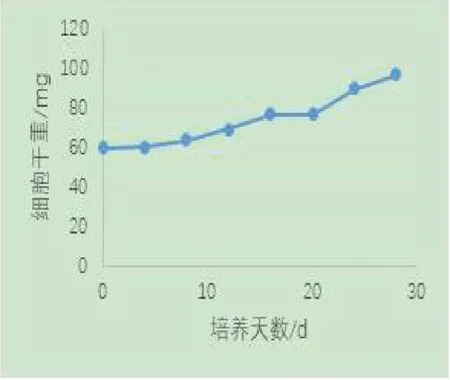
图2 细胞悬浮培养过程中细胞干重的变化
3.3 摇床转速对西洋参细胞生长的影响
将 摇床转 速 分 别设置 为80 mg·L、100 mg·L、120 mg·L,培养24天后发现随着转速的提高,细胞的鲜重、干重也在逐步增加,在摇床转速设置为120 r·min的时候,西洋参细胞的鲜重和干重得到最高值。将西洋参细胞的鲜重和干重进行差异分析,结果显示无统计学差异(P>0.05)见图3。
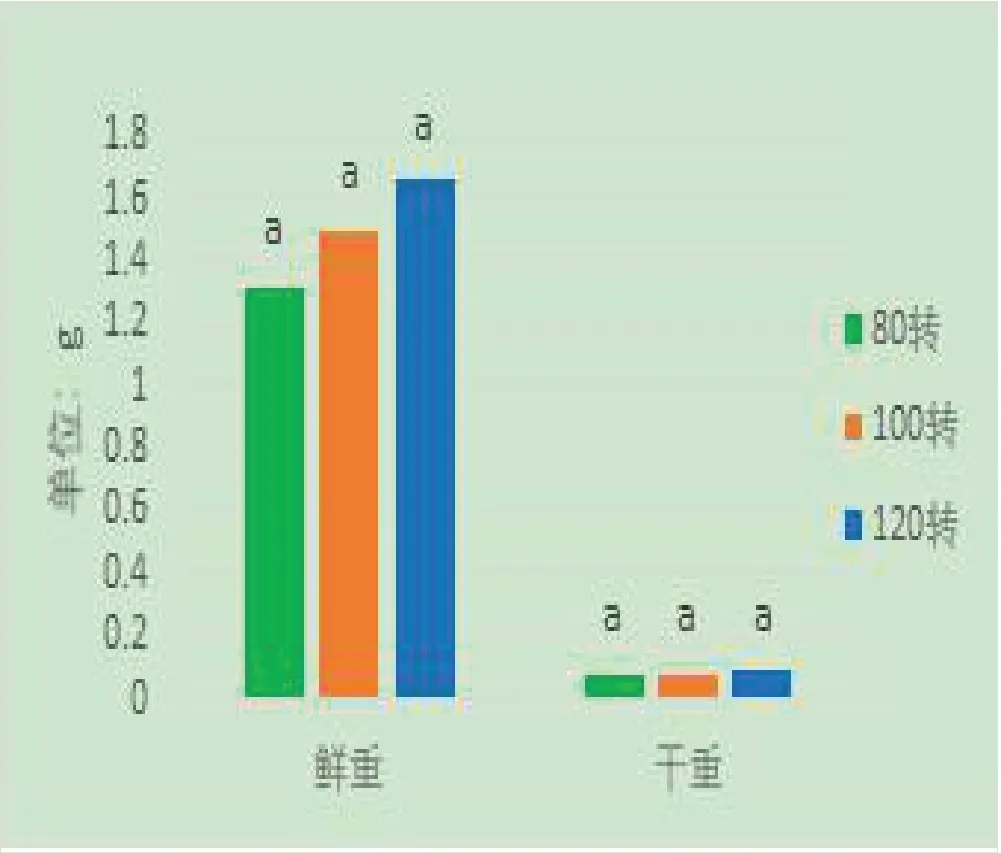
图3 不同转速对西洋参细胞生长的影响
3.4 不同光照对西洋参细胞生长的影响
将西洋参细胞分别置于16/8 h的光照和完全黑暗的条件下培养,培养24d后,测量细胞鲜重和干重得知,西洋参细胞在16/8h光照培养和黑暗培养下的鲜重和干重比较,差异无统计学意义(P>0.05)。说明光照的有无在培养西洋参细胞时没有差别,见图4。
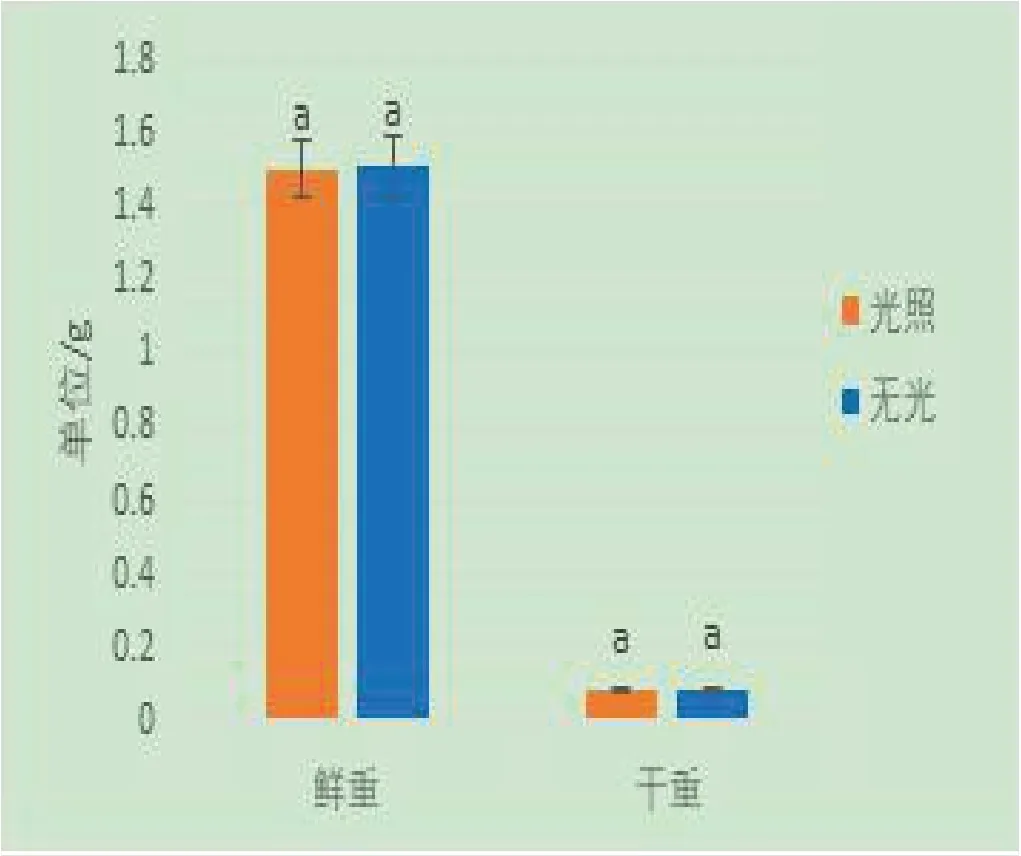
图4 不同光照对西洋参细胞生长的影响
3.5 不同接种量对西洋参细胞生长的影响
为了研究细胞初始接种量对其生长的影响,在培养瓶中分别接入1g、1.5g、2g西洋参愈伤组织进行培养。24d后测量细胞鲜重的干重的时候发现,随着细胞初始接种量的增加,西洋参细胞的鲜重和干重也在增加。然而,在接种量对西洋参细胞生长的研究中,1g和1.5g的细胞接种量其增殖倍数相差不大,而2g细胞接种量的增殖倍数低于其他接种量的增殖倍数,表明细胞的生长受到了抑制。综上,在30mL的培养基中接种1.5g细胞最适合细胞鲜重和干重的积累,经过对西洋参细胞鲜重和干重的差异性分析,1.5g和2g对西洋参细胞鲜重和干重的积累显著高于1.5g接种量,见图5。

图5 不同接种量对西洋参细胞生长的影响
4 讨论
在研究西洋参愈伤组织增殖的实验中,通过正交分析实验结果的R值可知,激素2,4-D是促进西洋参愈伤组织增殖最主要的影响因素。在正交分析结果表中,0.5 mg·L2,4-D对应的K值>1.0 mg·L2,4-D对应的K值>2.0 mg·L2,4-D对应的K值,说明低浓度的2,4-D更有利西洋参愈伤组织的增殖。在Chakraborty,N.的实验研究中,0.5 mg·L的2,4-D是植物愈伤组织的形成的最佳浓度,高浓度的激素会影响愈伤组织的生成量和形成时间。
西洋参细胞的生长是一个动态变化的过程。西洋参细悬浮培养初期,细胞正处于新环境,需要时间适应以便于自身更好的生长发育,该过程为西洋参细胞生长的适应期;在西洋参细胞悬浮培养中期,细胞在充足的营养条件下,进入快速生长状态,细胞数量快速增加,该过程为西洋参细胞生长的快速生长期;在西洋参细胞悬浮培养末期,细胞数目众多,营养物质稀少,同时细胞在培养过程中会产生一些阻碍生长发育的物质,导致西洋参细胞在培养末期生长速度放缓甚至细胞的数量会减少,该过程为西洋参细胞生长的衰退期。西洋参细胞生长的动态变化过程和Beigmohamadi研究的白花丹细胞悬浮培养的生长趋势相一致。
悬浮培养技术会对植物细胞产生剪切力,不同种类的植物细胞对剪切力的敏感度不一样,剪切力过高,会对细胞造成机械损伤,容易引起细胞死亡;同时,在植物细胞悬浮培养的过程中,植物细胞有形成细胞簇的倾向,细胞聚集体过大,会导致细胞聚集中心缺氧,因而剪切力过低,不利于细胞团形成分散状态,并且会导致细胞不能充分的吸收营养物质,生长速率减慢。植物细胞悬浮培养中,剪切力的高低取决于转速的大小,转速越大,剪切力越大。因而摇床的转速不能过低,也不能过高。本实验中,不同转速对西洋参细胞鲜重和干重的积累无显著影响(P>0.05),其原因可能为摇床转速的设置范围太窄,摇床转速对西洋参细胞的影响不明显。光照的有无对西洋参细胞的生长无影响,与Kumar,S.S.的研究中得出的光能促进红毛菊()愈伤组织鲜重和干重的积累的结果不一致,其原因可能为西洋参本身是喜阴植物,对光的需求不高。在本实验中,最高的接种量为2g,虽然收获了最高的生物量,但是增殖倍数(1.23)不如1.5g接种量的增殖倍数(1.48),其原因可能为接种量过多,细胞密度大,在悬浮培养末期,营养物质缺乏,西洋参细胞不能正常生长。因而,西洋参细胞悬浮培养的接种量也不是越多越好。综上,从本研究中,最适和西洋参愈伤组织增殖的激素配方为:MS+0.5mg·L2,4-D+0.1 mg·LKT+0.2 mg·LNAA,西洋参细胞悬浮培养最佳继代时间为24d,1.5g愈伤组织接种于30mL液体培养基中为最佳接种量,摇床和光照对西洋参细胞生长无显著影响。
