lncRNA HOTAIRM1与miR-125b对肝细胞癌生物学行为影响
2022-03-30李玉强李男吴彬孙溶励赵明洲杨微微张佳林蒋磊
李玉强,李男,吴彬,孙溶励,赵明洲,杨微微,张佳林,蒋磊
(锦州医科大学附属第一医院,辽宁 锦州 121000)
在全球范围内,肝癌是第二大最常见的癌症死亡原因,肝细胞癌占原发性肝癌的(85~90)%,每年会导致超过700 000例病人死亡[1]。它通常是一种侵袭性的恶性肿瘤,预后较差,五年生存率估计低于9%。包括肝切除,肝移植和经皮消融在内的外科手术被认为是治疗肝癌最有效的方法。不幸的是,由于存在大量病变和肝外转移,只有约20%的肝癌患者适合手术[2]。虽然靶向药物和免疫疗法的发现,给肝癌治疗带来了巨大的突破。但目前肝癌的治疗显然还不尽如人意,肝癌患者的化学治疗药物也是有限的[3],特别是对于我国这样的肝癌大国来说,更为有效的肝癌药物和肝癌疗法成为了迫切需求。因此,如何进一步阐明肝癌的发病机制并找到可以更有效地阻断这种进展性疾病的新靶标至关重要。
长非编码RNA(lncRNA)是一组长度大于200个核苷酸的非蛋白质编码RNA[4]。越来越多的证据表明,可能作为癌基因或抑癌基因的lncRNA在人类疾病的病理生理中,尤其是在肿瘤的发生和发展中起着至关重要的作用[5]。microRNA(缩写为miRNA)是一种小的非编码RNA分子(包含约22个核苷酸),存在于植物,动物和某些病毒中,在RNA沉默和基因表达的转录后调控中起作用[6-9]。最近的研究表明,miRNA可以通过调节与肿瘤发生有关的过程来充当人类癌症中的癌基因或肿瘤抑制物[10-11]。miR-125b是致癌基因miRNA之一,与多种肿瘤有关,而HOTAIRM1是miR-125b的分子海绵,它调节肝癌细胞的生长和转移。因此本研究主要是探讨lncRNA HOTAIRM1是否可以通过靶向miR-125b相互作用来调节肝细胞癌的生长和转移,研究其表达改变的情况及其可能发生的分子机制。
1 材料与方法
1.1 试剂与仪器
Transwell小室(Corning公司); Enhanced Cell Counting Kit-8(上海碧云天生物技术有限公司);Dual-Luciferase®Reporter Assay System(Promega,美国);Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物技术有限公司); hsa-mir-125b-1慢病毒、HOTAIRM1引物、LV-HOTAIRM1-RNAi干扰慢病毒、LV- HOTAIRM1过表达慢病毒(上海康朗生物科技有限公司构建和包装)。超微量紫外分光光度仪(NanoDROP2000,美国Thermo公司);聚丙烯酰胺凝胶成像系统(ChemiDoc XRS+,美国伯乐医疗);普通PCR仪(C1000 Touch,美国伯乐医疗);实时荧光定量PCR仪(Mx3000P,Agilent)。
1.2 研究对象
1.2.1 细胞:HEPG2(HB-8065)细胞购置于ATCC,LO2和HCC-LM3由中国医科大学肝胆外科实验室馈赠,都具有STR验证报告。
1.2.2 组织样本与资料:选取中国医科大学附属第一医院肝胆外科和锦州医科大学附属第一医院临床生物样本中心2018年1月至2020年10月期间100例经手术切除并经过病理诊断确诊为肝细胞癌的组织样本,我们的排除标准是曾经患有其它恶性肿瘤及接受过辅助放化疗病史的样本。统计资料包括年龄、性别、甲胎蛋白、肿瘤分化程度、肝癌的病理分期等。
1.2.3 血液样本与资料:选取锦州医科大学附属第一医院临床生物样本中心2018年1月至2020年10月期间,肝血管瘤患者的血液样本48例,肝囊肿血液样本6例,共54例肝脏良性病变的血液样本;肝恶性肿瘤的血液样本54例,作为研究对象。
1.3 组织、血液及细胞样本RNA提取
组织、血液及细胞样本RNA的提取采用OMEGA提取试剂盒,用NanoDrop 2000分光光度计检测RNA的浓度。
1.4 lncRNA HOTAIRM1与miR-125b荧光定量PCR
lncRNA HOTAIRM1和miR-125b引物由上海康朗生物科技有限公司设计合成,见表1。HOTAIRM1反应条件:50 ℃ 30 min(1个循环),95 ℃ 3 min(1个循环),95 ℃ 15 s+95 ℃ 30 s(40个循环),95 ℃ 1 min+55 ℃ 30 s+95 ℃ 30 s(1个循环,两步骤中间收集信号)。反应结束后确认扩增曲线、CT值等,结果采用2-△△Ct方法,将GAPDH作为参考基因,确定HOTAIRM1的相对表达量,并进行统计分析。miR-125b反应条件:50 ℃ 15 min(1个循环),94 ℃ 20 s+60 ℃ 34 s(40个循环),95 ℃ 1 min+55 ℃ 30 s+95 ℃ 30 s(1个循环,两步骤中间收集信号)。反应结束后确认扩增曲线、溶解曲线、CT值等,结果采用2-△△Ct方法,将U6作为参考基因,确定miR-125b的比较表达量,并进行统计分析。

表1 HOTAIRM1、GAPDH、miR-125b及U6的引物序列
1.5 慢病毒的构建和细胞转染
LV-HOTAIRM1-RNAi的干扰慢病毒、LV-HOTAIRM1过表达慢病毒以及LV-hsa-mir-125b-1过表达慢病毒由上海康朗生物科技有限公司构建和包装,感染LO2、HEPG2和HCC-LM3细胞后摸索出MOI和最佳的感染条件。
病毒转染后按照不同培养条件分为5组:M组:含有细胞的完全培养基+慢病毒;A组:含有细胞的完全培养基+慢病毒+HiTransG A组,观察HiTransG A是否可以提升感染效果;P组:含有细胞的完全培养基+慢病毒+HiTransG P组,观察HiTransG P是否可以提升感染效果;阴性对照组:含有细胞的完全培养基+阴性对照病毒,和目的病毒做对比,观察目的病毒感染细胞之后产生什么样的变化;空白对照组:含有细胞的完全培养基,监控实验过程中细胞生长是否正常。
1.6 lncRNA HOTAIRM1靶向miRNA预测
为了研究HOTAIRM1在肝癌进展中的详细机制,我们使用StarBase 2.0数据库预测HOTAIRM1的靶向miRNA。
1.7 荧光素酶报告基因实验
将野生型HOTAIRM1和突变型HOTAIRM1序列(miR-125b结合位点突变)克隆到pmirGLO质粒中。pmirGLO-HOTAIRM1或pmirGLO-HOTAIRM1-mut通过Lipofectamine 2000与miR-125b模拟物或miR-NC共转染。将重组载体与miR-NC或miR-125b模拟物共转染HEK293 细胞。共转染48 h后,弃掉原培养基,用100 μL PBS洗涤培养孔1遍,吸尽剩余的PBS;使用去离子水将5×PLB稀释成l×PLB;向96孔板中加入50 μL 1×PLB,裂解细胞15 min;96孔酶标板中(白色不透光的)每孔加上步骤的上清液10 μL,再加入100 μL LARII,静止2 s;每孔加入Stop&Glo Reagent终止反应,静止2 s后,进行数据检测。
1.8 细胞划痕实验
用记号笔在6孔板背后,用直尺比着,均匀地划横线,大约每隔0.5~1 cm划1道,横穿过孔,每孔至少穿过5条线。在孔中加入约5×105个HEPG2和HCC-L3细胞,用构建的慢病毒LV-RIZ1-RNAi,LV-HOTAIRM1-RNAi,LV-HOTAIRM1进行转染。当在镜下观察HEPG2和HCC-L3细胞铺满后,用200 μL的黄枪头比着直尺划垂直线。用枪头将D-PBS缓慢加入6孔板中,缓慢清洗3次,去除划下的细胞,加入无血清培养基。放入37 ℃ 5% CO2培养箱培养。按0、12、24、36、48 h在显微镜下拍照记录。
1.9 Transwell细胞侵袭实验
用Matrigel matrix基质胶对Transwell小室进行制备。取100 μL细胞悬液加入Transweel小室(上室),下室加0.5 mL含10%FBS的培养基,正常培养10~24 h,吸取上室残液,PBS清洗两遍,下室加入0.5 mL 4%多聚甲醛固定30 min后吸去。风干后下室加入0.5 mL 0.1%结晶紫染色20 min;小室风干后正立置于干净载玻片上,显微镜物镜调至200倍镜,每个孔取8个视野拍照。
1.10 CCK8实验
在96孔板中加入100 μL的细胞悬液,将培养板在37 ℃,5% CO2培养箱孵育一段时间(0、24、48、72 h)。向每孔加入10 μL CCK8溶液(注意不要在孔中生成气泡,它们会影响OD值的读数)。将培养板在培养箱内孵育(1~4)h。用酶标仪测定在450 nm处的吸光度。
1.11 细胞凋亡检测
收集细胞悬液,1000转离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数。取5~10万重悬的细胞,1000 g离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞。加入5 μL Annexin V-FITC,轻轻混匀。加入10 μL碘化丙啶染色液,轻轻混匀。室温(20~25 ℃)避光孵育10~20 min,随后置于冰浴中。立即进行检测,确定细胞的凋亡情况。
1.12 统计学方法
使用GraphPad Prism8 V8.02和SPSS 23.0软件进行统计分析,两组样本采用配对样本t检验,所有计量资料结果以均数±标准差表示,所有实验都至少重复3次,以P<0.05为差异有统计学意义。
2 结 果
2.1 预测HOTAIRM1的靶miRNA
我们使用StarBase 2.0数据库预测HOTAIRM1的靶miRNA,发现miR-125b可能是HOTAIRM1的靶miRNA,见图1。
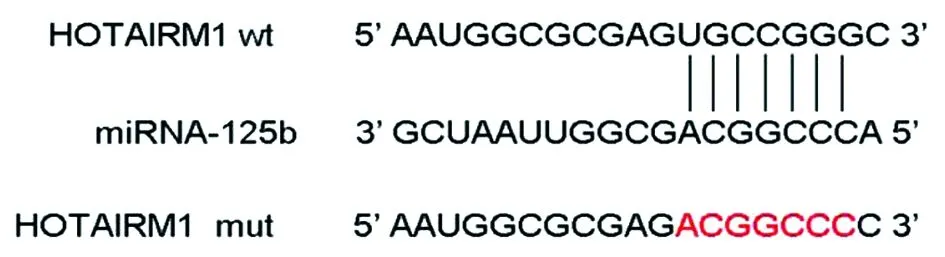
图1 HOTAIRM13’UTR中预测的miR-125b结合位点
2.2 双荧光素酶报告基因实验
我们构建了HOTAIRM1-wt荧光素酶报告基因载体和HOTAIRM1-mut 3’UTR荧光素酶报告基因载体,并进行了荧光素酶报告基因分析。结果表明,miR-125b过表达导致HOTAIRM1-WT的荧光素酶活性显着降低,而HOTAIRM1-MUT则没有。这些结果证明了,HOTAIRM1的靶标是miR-125b,见图2。
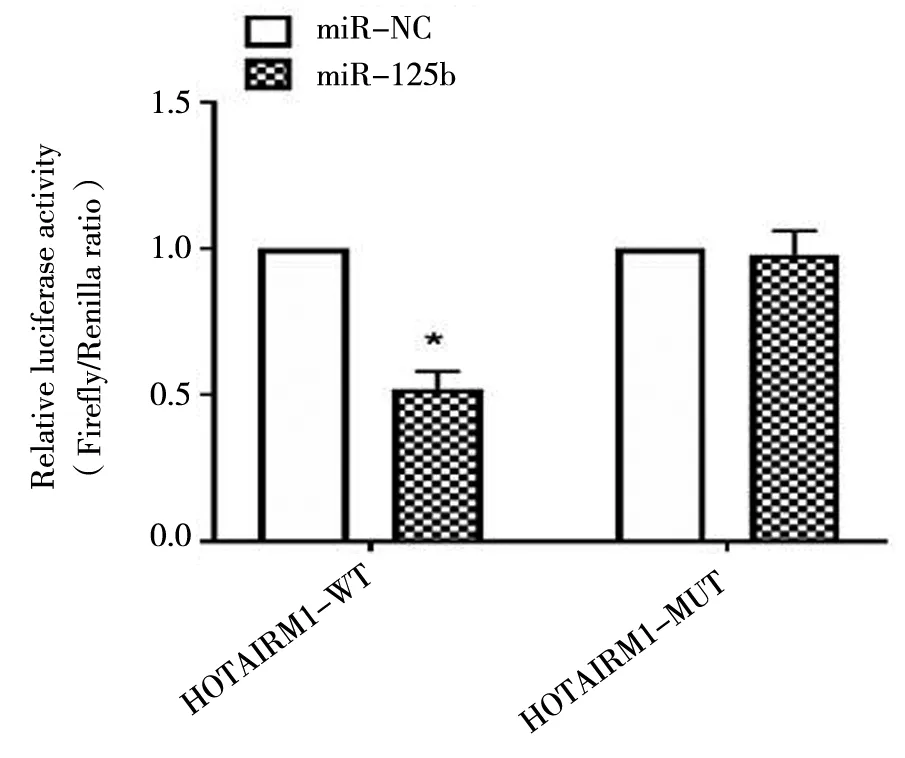
图2 荧光素酶法检测miR-125b对HOTAIRM1-WT和HOTAIRM1-MUT报告分子荧光素酶活性的影响
2.3 慢病毒对HEPG2和HCC-LM3细胞的感染MOI和最佳感染条件
2.3.1 LV-HOTAIRM1慢病毒感染的MOI和最佳感染条件
用LV-HOTAIRM1慢病毒转染HCC-LM3细胞,MOI=20,最佳感染条件为:LV-HOTAIRM1慢病毒+HiTransG P组,见图3。
图3 LV-HOTAIRM1慢病毒转染HCC-LM3细胞最佳感染组
2.3.2 LV-HOTAIRM1-RNAi慢病毒感染的MOI和最佳感染条件
用LV-HOTAIRM1-RNAi慢病毒转染HEPG2细胞,MOI=10,最佳感染条件为:LV-HOTAIRM1-RNAi慢病毒+HiTransG P组,见图4。
图4 LV-OTAIRM1-RNAi慢病毒转染HEPG2细胞最佳感染组
2.3.3 LV-hsa-mir-125b-1慢病毒感染的MOI和最佳感染条件
用LV-hsa-mir-125b-1慢病毒转染HEPG2和HCC-LM3细胞,HEPG2人肝癌细胞MOI=10,最佳感染条件为:LV-hsa-mir-125b-1慢病毒+HiTransGA组,见图5;HCC-LM3人高转移肝癌细胞MOI=20,最佳感染条件为:LV-hsa-mir-125b-1慢病毒+HiTransGA组,见图6。
图5 LV-hsa-mir-125b-1慢病毒转染HEPG2细胞最佳感染组
图6 LV-hsa-mir-125b-1慢病毒转染HCC-LM3细胞最佳感染组
2.3.4 LV-HOTAIGXRM1-RNAi+LV-hsa-mir-125b-1慢病毒共感染的MOI和最佳感染条件
用LV-HOTAIRM1-RNAi+LV-hsa-mir-125b-1慢病毒共转染HEPG2细胞MOI=10,最佳感染条件为:LV-HOTAIRM1-RNAi+LV-hsa-mir-125b-1慢病毒+HiTransGA组,见图7。
图7 LV-HOTAIRM1-RNAi+LV-hsa-mir-125b-1慢病毒共转染HEPG2细胞最佳感染组
2.3.5 LV-HOTAIRM1+LV-hsa-mir-125b-1慢病毒共感染的MOI和最佳感染条件
用LV-HOTAIRM1+LV-hsa-mir-125b-1慢病毒共转染HCC-LM3细胞MOI=20,最佳感染条件为:LV-HOTAIRM1+LV-hsa-mir-125b-1慢病毒+HiTransGP组,见图8。

图8 LV-HOTAIRM1 +LV-hsa-mir-125b-1慢病毒共转染HCC-LM3细胞最佳感染组
2.4 HOTAIRM1表达与miR-125b表达之间的关系
用LV-HOTAIRM1慢病毒转染HCC-LM3细胞或用LV-HOTAIRM1-RNAi慢病毒转染HEPG2细胞。结果表明,HOTAIRM1的过表达显着抑制了miR-125b的表达,而HOTAIRM1的下调则反向支持了肝细胞癌细胞中miR-125b的表达(*P<0.05),见图9~10。
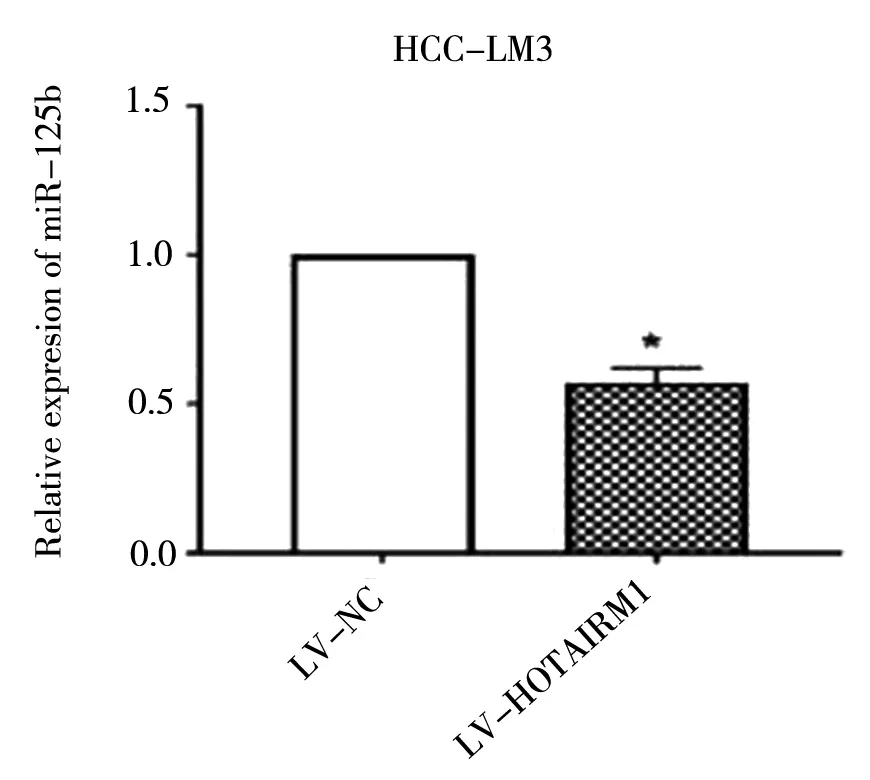
图9 LV-HOTAIRM1转染后miR-125b在HCC-LM3细胞中的表达水平
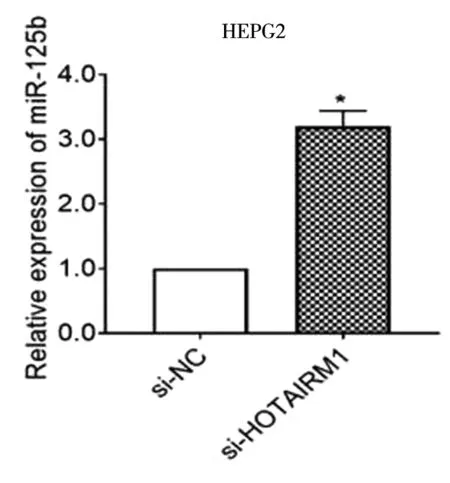
图10 LV-HOTAIRM1-RNAi慢病毒转染后miR-125b在HEPG2细胞中的表达水平
2.5 HOTAIRM1干扰和miR-125b过表达共同作用对肝细胞癌细胞增殖、侵袭和迁移的影响
LV-HOTAIRM1-RNAi+LV-hsa-mir-125b-1共转染HEPG2细胞,HOTAIRM1在HEPG2细胞中的下调表达,促进了细胞增殖,侵袭和迁移和miR-125b过表达共同作用进一步促进了HEPG2细胞增殖、侵袭、迁移(*P<0.05,**P<0.01),见图11~13。
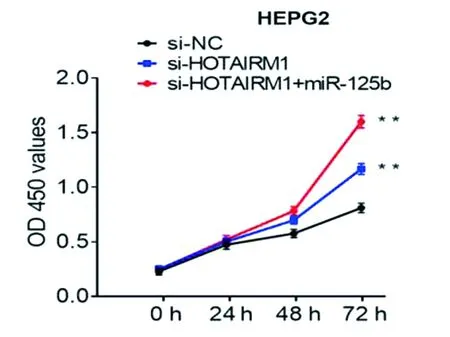
图11 LV-HOTAIRM1-RNAi+LV-hsa-mir-125b-1共转染HEPG2细胞后增殖情况
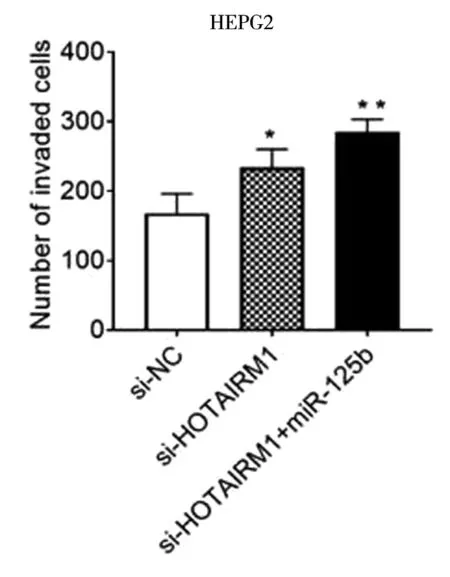
图12 LV-HOTAIRM1-RNAi+LV-hsa-mir-125b-1共转染HEPG2细胞后侵袭情况
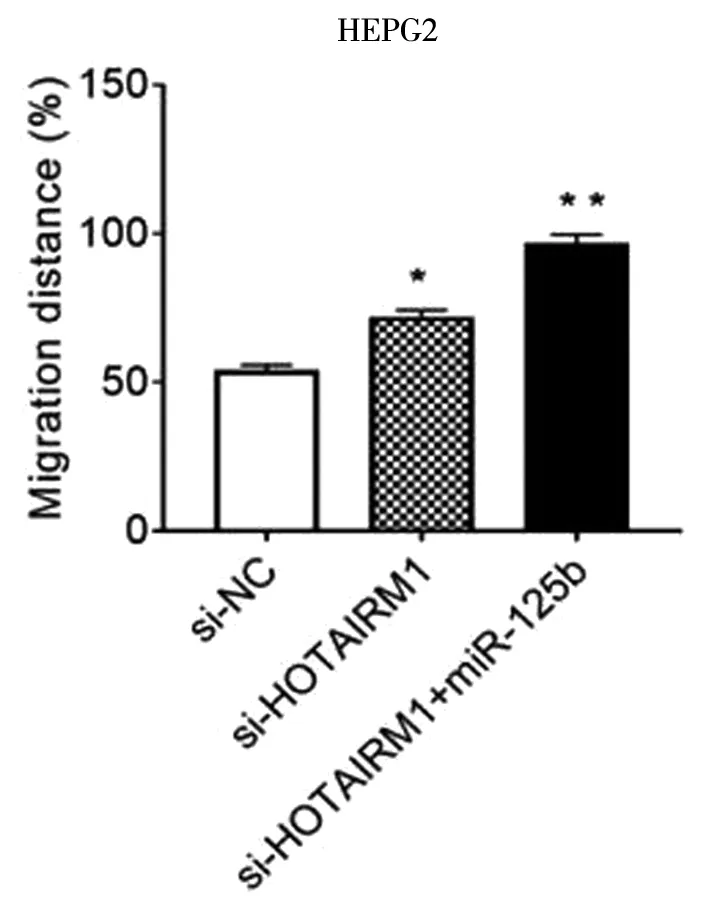
图13 LV-HOTAIRM1-RNAi+LV-hsa-mir-125b-1共转染HEPG2细胞后的迁移能力
2.6 HOTAIRM1过表达和miR-125b过表达共同作用对肝细胞癌细胞增殖、侵袭、和迁移的影响
LV-HOTAIRM1+miR-125b共转染HCC-LM3细胞,结果表明,HOTAIRM1的过表达,抑制了HCC-LM3细胞的增殖、侵袭和迁移,并且可以逆转过表达HOTAIRM1和miR-125b的共转染结果(*P<0.05,**P<0.01),见图14~16。
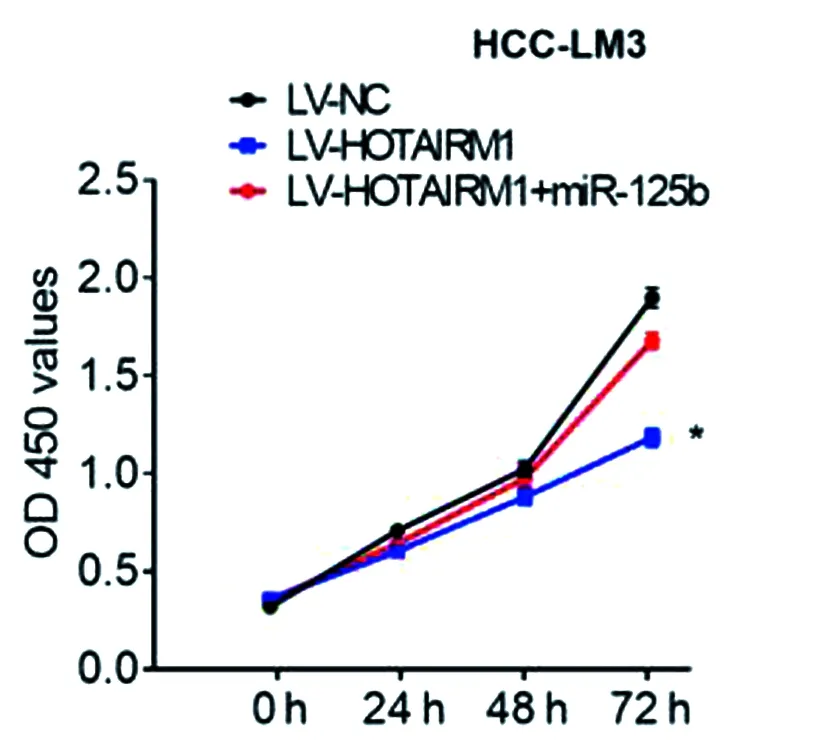
图14 LV-HOTAIRM1+LV-hsa-mir-125b-1共转染HCC-LM3细胞后增殖情况
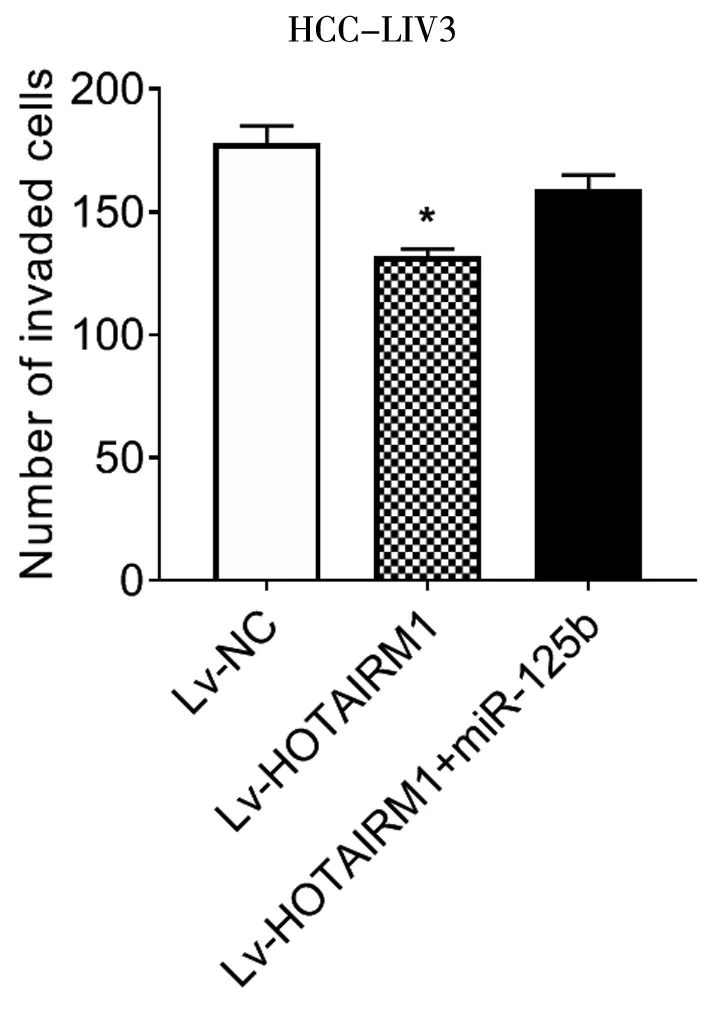
图15 LV-HOTAIRM1+LV-hsa-mir-125b-1共转染HCC-LM3细胞后侵袭情况
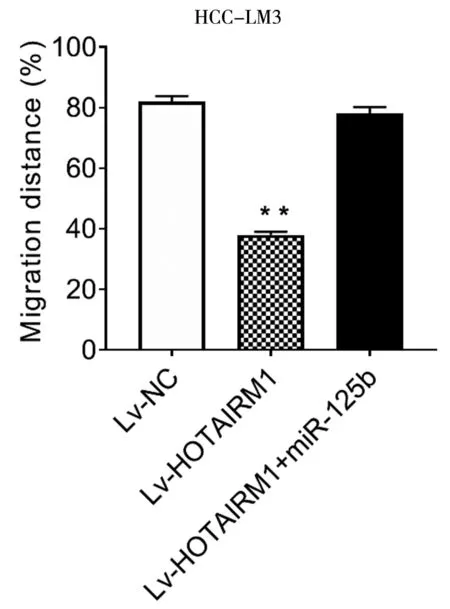
图16 LV-HOTAIRM1+LV-hsa-mir-125b-1共转染HCC-LM3细胞后的迁移情况
2.7 科室组织样本中HOTAIRM1和miR-125b在肝细胞癌组织、癌旁组织及正常组织中的表达情况
选择科室100例配对的肝细胞癌组织、癌旁组织及正常组织进行qRT-PCR结果采用2-△△Ct方法,将GAPDH 或U6作为参考基因,确定miR-125b和HOTAIRM1的相对表达量,并进行统计分析。发现HOTAIRM1在肝细胞癌组织中的表达水平明显低于癌旁和正常组织,而正常组织与癌旁组织相比差异不大(*P<0.05,**P<0.01),见图17。发现miR-125b在肝细胞癌组织中的表达水平明显高于癌旁和正常组织,而癌旁和正常组织之间无明显的差异,见图18。
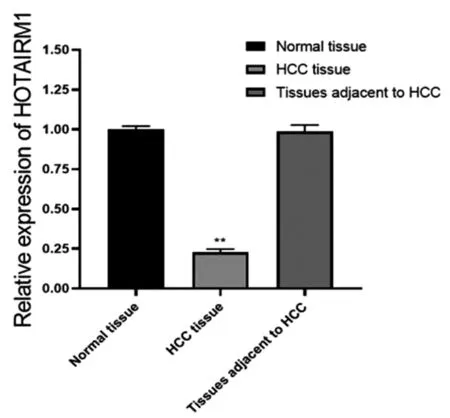
图17 HOTAIRM1在肝细胞癌组织样本中的表达情况
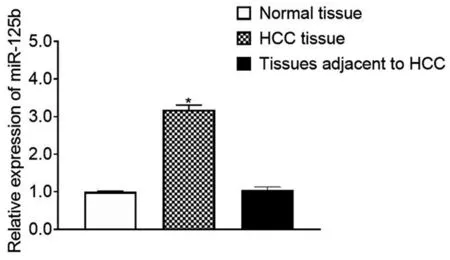
图18 miR-125b在肝细胞癌组织样本中的表达情况
2.8 科室血液样本中HOTAIRM1和miR-125b的表达情况
收集108例患者作为研究对象进行qRT-PCR采用2-△△Ct方法,确定HOTAIRM1和miR-125b的相对表达量,并进行统计分析。发现肝细胞癌患者血液样本中HOTAIRM1表达量比正常患者表达量低,miR-125b表达量比正常患者的表达量高(*P<0.05),见图19~20。
2.9 LO2、HEPG2和HCC-LM3细胞中HOTAIRM1和miR-125b的表达情况
研究结果表明HOTAIRM1在HCC-LM3和HEPG2细胞中的表达比LO2细胞低(*P<0.05),见图21;miR-125b在HCC-LM3和 HEGP2细胞中的表达比LO2细胞高(*P<0.05),见图22。
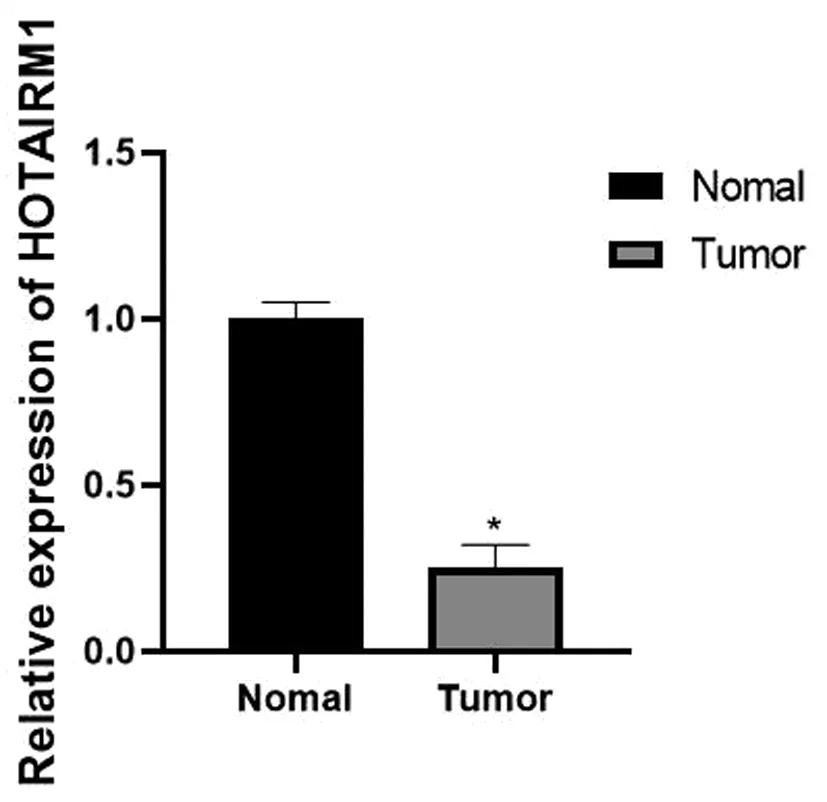
图19 血液样本中HOTAIRM1的表达情况
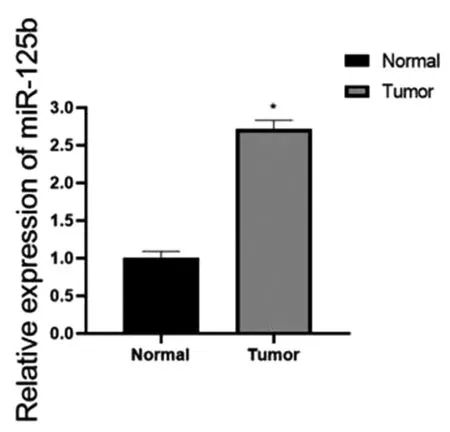
图20 血液样本中miR-125b的表达情况
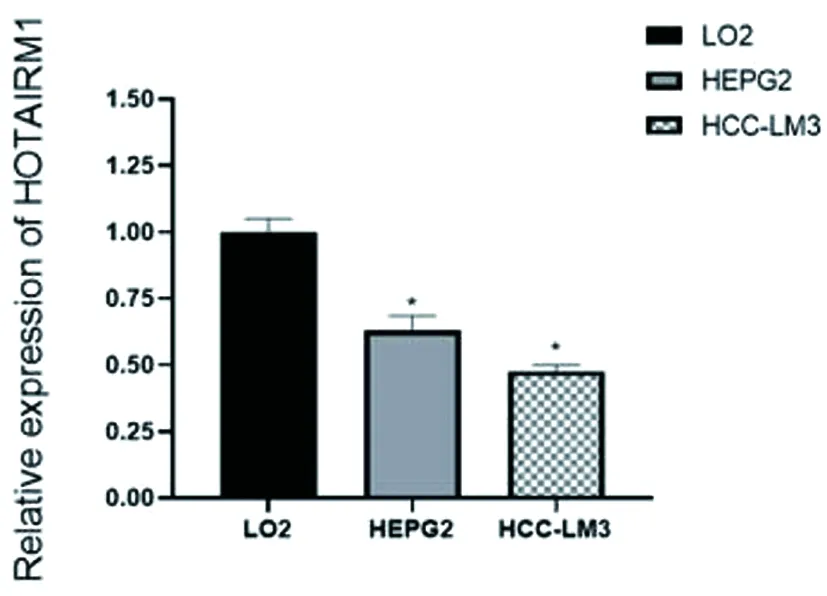
图21 LO2、HEPG2和HCC-LM3细胞中HOTAIRM1的表达情况
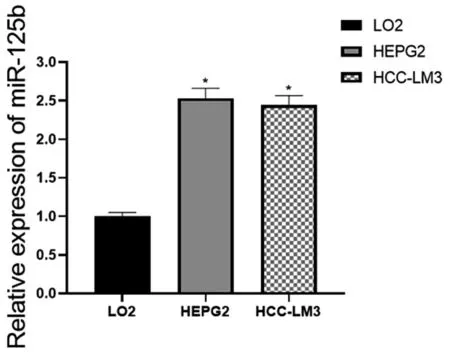
图22 miR-125b在 LO2、HEPG2、HCC-LM3细胞系中的表达情况
2.10 科室组织样本中HOTAIRM1和miR-125b的表达水平与临床病理学参数之间的关系
分析发现HOTAIRM1的表达情况与患者肿瘤大小及肿瘤数量密切相关,但其与患者年龄、性别、乙肝、肝硬化、AFP、门静脉癌栓、肿瘤分化程度及TNM分期等因素无明显相关性(*P<0.05),见表2。
分析发现miR-125b的表达情况与患者乙肝、肿瘤大小及肿瘤数量密切相关,但其与患者年龄、性别、肝硬化、AFP、门静脉癌栓、肿瘤分化程度及TNM分期等因素无明显相关(*P<0.05),见表3。
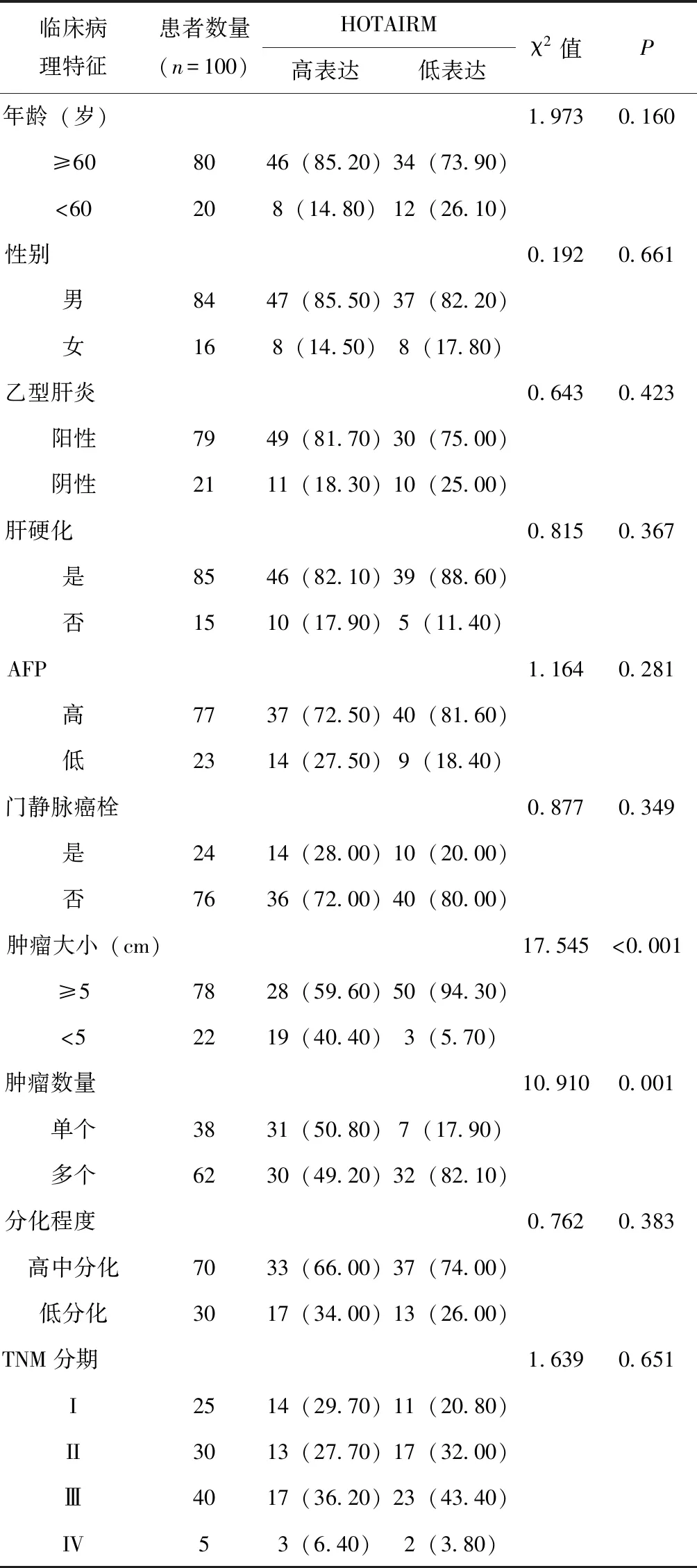
表2 利用科室组织样本分析HOTAIRM1表达水平与组织临床病理学参数的关系(n,%)
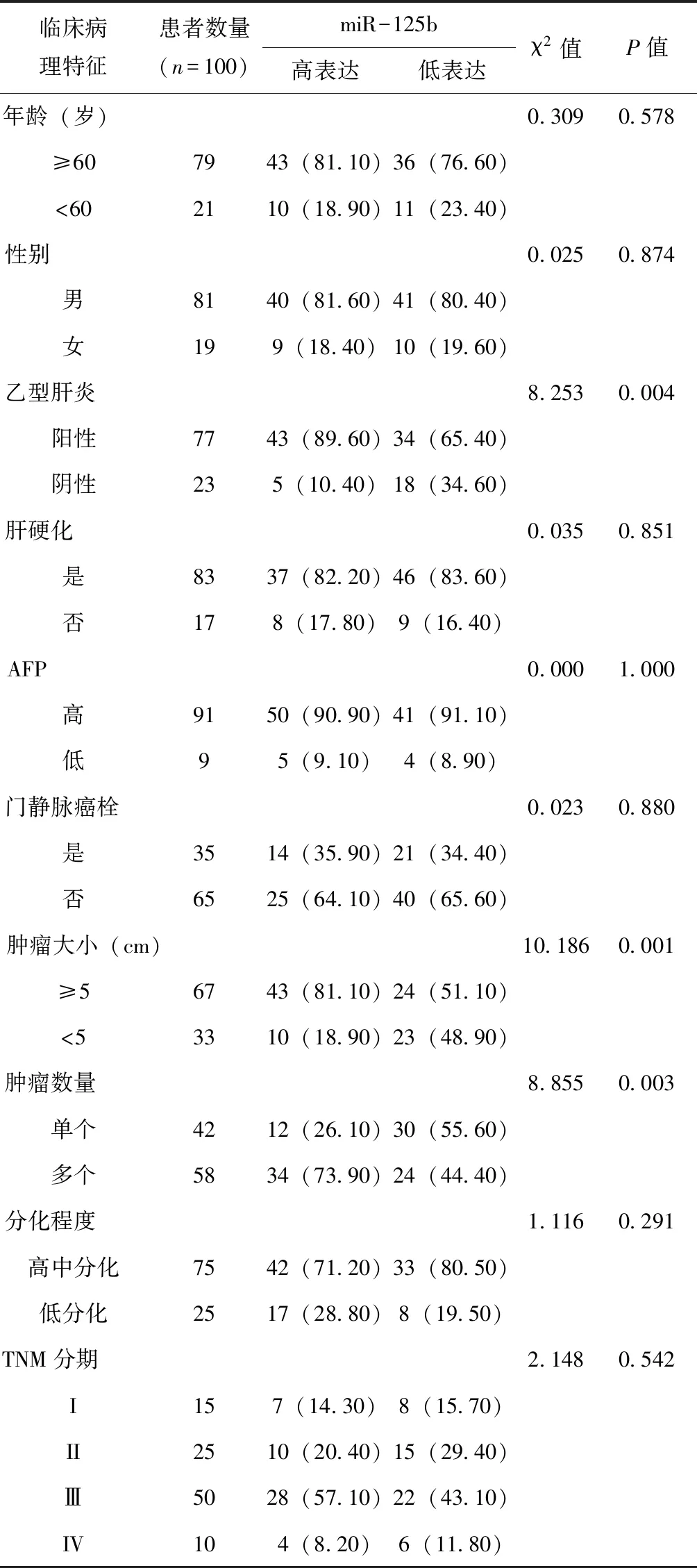
表3 利用科室组织样本分析miR-125b表达水平与组织临床病理学参数的关系(n,%)
3 讨 论
肝癌对人类健康和生命有严重的威胁。原发性肝细胞癌的临床表现极为不典型,症状通常不明显,尤其是在疾病的早期[12]。尽管近年来肝癌的生存率有所提高,但仍然不容乐观[13]。HOTAIRM1(HOTAIR myeloid specific 1)又可以称为HOXA-AS1,HOXA1-AS1,NCRNA00179,是从HOXA簇转录的一个483bp的lncRNA,在髓系中表达。lncRNA HOTAIRM1在乳腺癌、透明细胞肾细胞癌、神经胶质瘤恶性肿瘤、卵巢癌细胞、急性髓细胞性白血病、甲状腺乳头状癌细胞、骨关节炎、胰腺导管腺癌以及肝癌的发生发展中都起到了非常重要的作用[14-18]。miR-125b是致癌基因miRNA之一,与多种肿瘤有关,而HOTAIRM1是miR-125b的分子海绵,它调节肝癌细胞的生长和转移。
为了研究HOTAIRM1在肝癌进展中的详细机制,我们使用StarBase 2.0数据库预测HOTAIRM1的靶miRNA,发现miR-125b可能是HOTAIRM1的靶miRNA。然后,我们构建了HOTAIRM1-wt荧光素酶报告基因载体和HOTAIRM1-mut3’UTR荧光素酶报告基因载体,并进行了荧光素酶报告基因分析。结果表明,miR-125b过表达导致HOTAIRM1-WT的荧光素酶活性显着降低,而HOTAIRM1-MUT则没有。这些结果证明了miR-125b是HOTAIRM1的靶miRNA。此外,HOTAIRM1的过表达显着抑制了miR-125b的表达,而HOTAIRM1的下调则反向支持了肝癌细胞中miR-125b的表达。为了进一步验证HOTAIRM1在肝癌进展中的作用是否由miR-125b介导,我们使用LV-HOTAIRM1-RNAi+LV-hsa-mir-125b-1慢病毒共转染HEPG2细胞,HOTAIRM1在HEPG2细胞中的下调表达,促进了细胞增殖、侵袭和迁移,和miR-125b过表达共同作用进一步促进了HEPG2细胞增殖、侵袭和迁移。LV-HOTAIRM1+miR-125b慢病毒共转染HCC-LM3细胞,HOTAIRM1的过表达抑制了HCC-LM3细胞的增殖、侵袭和迁移,并且可以逆转了过表达HOTAIRM1和miR-125b的共转染结果。
我们利用科室收集的样本,通过研究发现HOTAIRM1在肝细胞癌患者癌组织样本、血液样本和HCC-LM3人高转移肝癌细胞中表达水平明显下降。我们分析了HOTAIRM1的表达与临床病理学参数之间的关系,分析发现HOTAIRM1的表达情况与患者肿瘤大小及肿瘤数量密切相关,即HOTAIRM1高表达与HOTAIRM1低表达的肝细胞癌组织相比,其肿瘤体积相对较小,肿瘤数目相对较少;但其与患者年龄、性别、乙肝、肝硬化、AFP、门静脉癌栓、肿瘤分化程度及TNM分期等因素无明显相关性。我们对本科室收集的组织样本分析表明,miR-125b在肝细胞癌组织中的表达水平明显高于癌旁和正常组织,而癌旁和正常组织之间无明显的差异。对本科室收集的血液样本分析表明,肝细胞癌患者血液样本中miR-125b表达量比正常患者的表达量高。分析发现miR-125b的表达情况与患者乙肝、肿瘤大小及肿瘤数量密切相关,即miR-125b高表达的肝细胞癌组织与miR-125b低表达的肝细胞癌组织相比,其肿瘤体积相对较大,肿瘤数目相对较多;乙肝阳性患者中miR-125b高表达的多,乙肝阴性患者中miR-125b低表达的多,但其与患者年龄、性别、肝硬化、AFP、门静脉癌栓、肿瘤分化程度及TNM分期等因素无明显相关。所有这些数据表明,HOTAIRM1通过下调miR-125b阻断了肝癌细胞的生长和转移。
总之,我们研究发现lncRNA HOTAIRM1可以通过靶向miR-125b来调节肝细胞癌的生长和转移,这可以进一步影响肝细胞癌的发生和发展。从而为肝癌的治疗提供新的靶标和思路。
