核糖核酸Ⅱ联合XELOX方案治疗转移性结直肠癌的临床观察
2022-03-25刘勇申音何华生潘清华李红卫王小毛
刘勇 申音 何华生 潘清华 李红卫 王小毛
【摘要】 目的:觀察转移性结直肠癌(metastatic colorectal cancer,mCRC)患者经核糖核酸Ⅱ(RA-Ⅱ)联合XELOX方案治疗的临床效果。方法:选取2018年1月-2021年2月赣州市肿瘤医院收治mCRC患者82例作为研究对象,随机分为观察组和对照组,每组41例。对照组予以XELOX方案治疗,观察组在对照组基础上予以RA-Ⅱ联合治疗。比较两组临床疗效、治疗前后血清肿瘤标志物水平、治疗后生活质量、治疗前后免疫细胞指标、治疗后不良反应发生情况、住院时长以及不良反应处理所需的费用。结果:治疗后,观察组疾病控制率明显高于对照组(P<0.05);糖类抗原19-9(CA19-9)与癌胚抗原(CEA)水平均显著低于对照组(P<0.01);Karnofsky评分及生活质量总改善率均显著高于对照组(P<0.05);不同组分T淋巴细胞亚群与NK细胞表达占比情况均显著优于对照组(P<0.01);≥Ⅲ级严重不良反应发生率、不良反应发生率及不良反应处理所需的中位人均费用均低于对照组(P<0.05)。观察组中位人均住院时长较对照组有所降低,但差异无统计学意义(P>0.05)。结论:RA-Ⅱ联合XELOX方案治疗mCRC患者,疾病控制率有所提高,在优化调节机体细胞免疫、减轻毒副反应及改善生活质量等多方面具有积极作用。
【关键词】 核糖核酸Ⅱ 转移性结直肠癌 XELOX方案 疾病控制率
Clinical Observation of Ribonucleic Acid Ⅱ Combined XELOX Regimen Treating Patients with Metastatic Colorectal Cancer/LIU Yong, SHEN Yin, HE Huasheng, PAN Qinghua, LI Hongwei, WANG Xiaomao. //Medical Innovation of China, 2022, 19(01): 00-006
[Abstract] Objective: To observe the clinical efficacy of metastatic colorectal cancer (mCRC) patients treated with Ribonucleic Acid Ⅱ (RA-Ⅱ) combined XELOX regimen. Method: A total of 82 patients with mCRC treated in Ganzhou Cancer Hospital from January 2018 to February 2021 were selected as the research subjects. They were randomly divided into observation group and control group, 41 cases in each group. The control group was treated with XELOX regimen, and the observation group was treated with RA-Ⅱ on the basis of the control group. The clinical efficacy, the levels of serum tumor markers before and after treatment, the quality of life after treatment, the indexes of immune cells before and after treatment, the incidence of adverse reactions after treatment, the length of hospitalization and the cost of adverse reaction treatment were compared between the two groups. Result: After treatment, the disease control rate in observation group was significant higher than that in control group (P<0.05); levels of CA19-9 and CEA in observation group were significant lower than those in control group (P<0.01); Karnofsky score and total improvement rate of quality of life in observation group were significant higher than those in control group (P<0.05); proportions of different T lymphocytes subsets and NK cells expressions were significant better in observation group than those in control group (P<0.01). The incidence of serious adverse reactions above grade Ⅲ, adverse reactions rate and the median cost of handling adverse reactions were significant lower in observation group than those in control group (P<0.05). The median hospitalization time was lower in observation group than that in control group, but it was not statistically significant (P>0.05). Conclusion: RA-Ⅱ combined with XELOX regimen can raise disease control rate for the treatment of mCRC, which have positive effects on optimal regulating the individual cellular immune function, reducing side effects and improving the life quality.6CC267AC-55A2-474F-A06E-6D9CD5BBF293
[Key words] Ribonucleic Acid Ⅱ Metastatic colorectal cancer XELOX regimen Disease control rate
First-authors address: Ganzhou Cancer Hospital, Jiangxi Province, Ganzhou 341000, China
doi:10.3969/j.issn.1674-4985.2022.01.001
我國结直肠癌(colorectal cancer,CRC)发病率和死亡率均位于消化道恶性肿瘤的前列,初诊时多已是转移性结直肠癌(metastatic colorectal cancer,mCRC),而全身化疗作为不可切除或潜在可切除mCRC治疗的重要手段[1-4]。其中XELOX(奥沙利铂+卡培他滨)方案是作为mCRC新辅助化疗或术后辅助化疗起始治疗方案之一[4-7]。目前化疗方案联合其他类型药物对于如何提高肿瘤控制率、机体耐受性以及降低并发症等的探讨具有十分重要的意义。
核糖核酸Ⅱ(Ribonucleic Acid Ⅱ,RA-Ⅱ)的活性成分是RNA;具有改善机体细胞免疫功能和抑制肿瘤作用,适用于多种实体恶性肿瘤的辅助治疗等方面[8-9]。多项研究显示,RA-Ⅱ可使肿瘤细胞发生变性和液化坏死,从而引发周围的巨噬细胞、淋巴细胞等增殖[10-13]。RA-Ⅱ联合XELOX方案治疗mCRC就疾病控制率、免疫调节与减轻毒副反应等方面的影响鲜有报道。本研究对初治mCRC患者经RA-Ⅱ联合XELOX方案治疗效果进行了初步探索,现将结果报道如下,以期为临床治疗提供参考依据。
1 资料与方法
1.1 一般资料 选取2018年1月-2021年2月赣州市肿瘤医院收治mCRC患者82例作为研究对象,男45例,女37例;年龄18~70岁,平均(51.89±11.85)岁;参考文献[14-15]Karnofsky(KPS)百分法,评分70~100分,平均(78.16±6.75)分。纳入标准:mCRC患者均经病理学确诊,分期为Ⅳ期(符合国际抗癌联盟和美国癌症联合会CRC TNM分期第8版),暂无手术指征且无化疗禁忌证,对XELOX方案治疗敏感并耐受,全身其他脏器功能基本正常,KPS评分≥70分,预计生存期不少于3个月。排除标准:对RA-Ⅱ不能耐受,存在急慢性感染未控制或应激性创伤、自行服药困难、严重自身免疫疾病如未控制的甲状腺功能亢进症、免疫性肝炎等,近3个月内曾参加过或正在参加其他临床试验者。脱落标准:治疗中出现意外或患者不能耐受,或中途自愿退出,或治疗不配合者。将研究对象随机分为观察组和对照组,每组41例。本研究符合《世界医学协会赫尔辛基宣言》相关要求,经赣州市肿瘤医院伦理委员会批准,且患者自愿参加本研究并签署知情同意书。
1.2 方法
1.2.1 对照组 采用XELOX方案(奥沙利铂+卡培他滨):奥沙利铂(生产厂家:山东新时代药业有限公司,批准文号:国药准字H20133247,规格:50 mg/支)130 mg/(m2·d)静脉滴注,第1天+卡培他滨(生产厂家:齐鲁制药有限公司,批准文号:国药准字H20133361,规格:0.5 g/片)1 000 mg/m2,2次/d,口服,第1~14天连续使用,休息1周,每3周为1个疗程,治疗2个疗程后评估临床疗效。
1.2.2 观察组 在对照组治疗基础上给予注射用RA-Ⅱ(生产厂家:吉林敖东药业集团延吉股份有限公司,批准文号:国药准字H22020007,规格:100 mg/支)200 mg,1次/d,静脉滴注,第1~7天连续使用,每3周为1个疗程,治疗2个疗程后评估临床疗效。禁止使用与RA-Ⅱ主要成分相似或药理作用相似(或作用拮抗)的其他相关治疗药物及产品。
1.3 观察指标及评价标准
1.3.1 评估临床治疗效果 比较两组治疗前后对应的肿瘤病灶CT或MRI或超声等影像学指标变化及肿瘤标志物如糖类抗原19-9(CA19-9)、癌胚抗原(CEA)改善程度,评估临床治疗效果。肿瘤负荷变化(如肿瘤病灶退缩和疾病进展)评估是临床评估肿瘤治疗方法有效应答的重要体现,mCRC等肿瘤负荷变化可以通过CT或MRI或超声等影像学技术手段来客观反映病灶大小,接受治疗的mCRC患者的应答情况可以将影像学资料作为其重要参考标准[16];且其评价疗效指标可参照实体肿瘤的疗效评价标准(RECIST 1.1)分为:完全缓解(CR),可见肿瘤病灶全部消失;部分缓解(PR),可测肿瘤病灶最长径(LD)总和较基线水平减少不低于30%;稳定(SD),可测肿瘤病灶LD总和较基线水平减少不足30%,或增加不足20%;疾病进展(PD),可测肿瘤病灶LD总和较基线水平增加不低于20%,或出现新发病灶[16]。客观缓解率(overall response rate,ORR)为CR+PR所占的比例;疾病控制率(disease control rate,DCR)为CR+PR+SD所占的比例。CA19-9、CEA是mCRC预后、治疗监测和复发最常用的肿瘤标志物[17]。
1.3.2 评估生活质量改善情况 比较两组治疗前后KPS评分,评分越高表明患者的生活质量越好,体能状态及疾病预后情况越好,分值范围0~100分[14];治疗后较治疗前KPS评分增加分值不少于10分者为有效,增加或减少分值在10分以内者为稳定,减少分值大于10分者为无效;总改善率=(有效例数+稳定例数)/总例数×100%。
1.3.3 评估机体细胞免疫功能 采用流式细胞仪检测患者治疗前后的外周静脉血不同组分T淋巴细胞亚群(如CD3+、CD4+等)与NK细胞表达占比,评估机体细胞免疫改善情况[18-19]。6CC267AC-55A2-474F-A06E-6D9CD5BBF293
1.3.4 評估治疗后不良反应发生及资源占用情况 比较两组治疗后不良反应(包括恶心呕吐、肝功能异常、骨髓抑制等)不良反应程度分级,Ⅰ级:轻度,无症状或轻微,无需治疗;Ⅱ级:中度,需要较小、局部或非侵入性治疗,工具性日常生活活动受限;Ⅲ级:严重但不会立即危及生命,导致住院或者延长住院时间,自理性日常生活活动受限;Ⅳ级:危及生命,需要紧急治疗等)的差异,并参照通用不良事件术语标准5.0版评价标准[20];采用中位人均住院时长及不良反应处理所需的中位人均费用评估医疗资源占用情况。
1.4 统计学处理 采用SPSS 23.0软件进行统计学分析。符合正态分布计量数据用(x±s)表示,组间比较行独立样本t检验,组内比较行配对t检验;非正态分布的计量数据用中位数表示,行秩和检验法(Mann-Whitney检验法);计数资料用[例(%)]表示,行χ2检验;P<0.05为差异有统计学意义。
2 结果
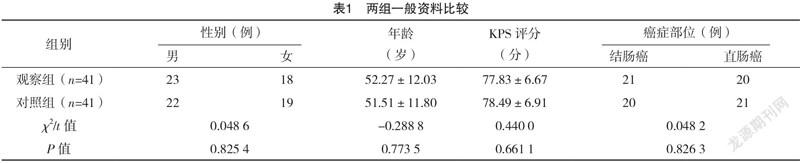
2.1 两组一般资料比较 两组性别、年龄、KPS评分、癌症部位等基本资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
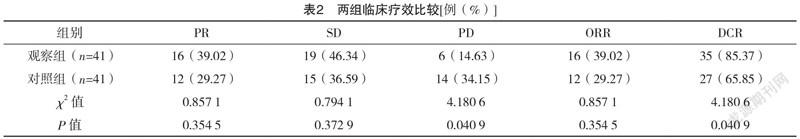
2.2 两组临床疗效比较 治疗后,观察组的DCR显著高于对照组(P<0.05),见表2。
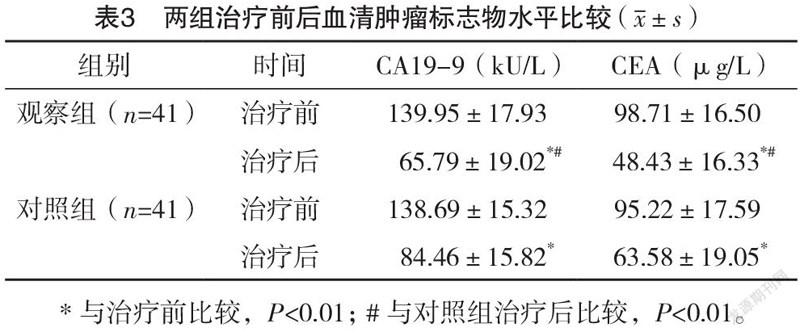
2.3 两组治疗前后血清肿瘤标志物水平比
较 治疗前,两组CA19-9与CEA水平比较,差异均无统计学意义(P>0.05);治疗后,两组内CA19-9与CEA水平均降低(P<0.01);组间比较,观察组下降更为显著(P<0.01)。见表3。
2.4 两组治疗后生活质量比较 治疗后,观察组患者KPS评分为(90.05±5.36)分,高于对照组的(82.07±7.23)分,生活质量总改善率高于对照组(P<0.05),见表4。
2.5 两组治疗前后免疫细胞指标比较 治疗前,组间的CD3+、CD4+、CD8+、NK细胞占比及CD4+/CD8+比较,差异均无统计学意义(P>0.05);治疗后,观察组的CD3+、CD4+、NK细胞占比及CD4+/CD8+均升高,CD8+细胞占比降低,差异均有统计学意义(P<0.05);且组间的CD3+、CD4+、CD8+、NK细胞占比及CD4+/CD8+比较,差异均有统计学意义(P<0.05)。见表5。
2.6 两组治疗后不良反应发生情况比较 观察组总不良反应发生率19.51%(8/41)与对照组的43.90%(18/41)比较,差异有统计学意义(χ2=5.563 2,P<0.05);且出现≥Ⅲ级严重不良反应发生率4.88%显著低于对照组的21.95%(χ2=5.081 9,P<0.05)。见表6。
2.7 两组住院时长比较 观察组中位人均住院时长为10.30 d,与对照组的10.80 d比较有所降低,但差异无统计学意义(Z=-1.768,P>0.05)。
2.8 两组不良反应处理所需的费用比较 观察组不良反应处理所需的中位人均费用为883.30元,与对照组的1 625.67元比较显著降低,差异有统计学意义(Z=-2.830,P<0.01)。
3 讨论
CRC是一发病率较高的消化道恶性肿瘤,每年新发病例高达40万,且逐年上升[2-4]。早期缺乏典型特异性的临床症状,患者健康与疾病筛查意识不够完善,以及基层尚缺乏肿瘤早期筛查策略和针对性的检测手段,导致大部分患者诊断时已经是mCRC,增加其治疗难度,并影响其预后。XELOX方案是潜在可切除及不可切除的mCRC全身系统药物治疗的主要起始治疗方案之一[4-7]。胃肠道反应、外周神经毒性等是mCRC经XELOX方案全身系统药物治疗期间最常见的副作用,也是限制XELOX方案剂量使用的主要原因之一。mCRC患者由于长期处于慢性消耗、炎症性病变、免疫功能差、肠道毒素不易排出等状况,以及患者使用XELOX方案后会有潜在的恶心呕吐、食欲改变、感觉异常、肝肾功能受损、骨髓抑制等不良反应的“叠加”效应,进一步造成营养不良、免疫抑制与疗效差恶性循环,进而加剧机体代谢、功能紊乱以及生存质量下降。因此,对于探索潜在药物以增强抗肿瘤药物防治mCRC患者的疗效,改善机体对治疗的耐受性是临床值得探讨的问题。
肿瘤微环境(tumor microenvironment,TME)是肿瘤组织/细胞生存和局部生长的内环境;肿瘤细胞与周围浸润间质细胞、免疫细胞、细胞因子等共同参与了TME的形成[19]。随着对mCRC发病机制的不断深入研究,免疫治疗也逐渐进入mCRC研究。mCRC的发生与进展涉及多种与免疫相关的细胞信号通路[18-19]。RA-Ⅱ具有提高机体细胞免疫功能和抑制肿瘤作用,适用于多种实体恶性肿瘤的辅助治疗,亦可用于其他免疫机能低下引起的各种疾病等方面[8-9]。且有研究报道,RA-Ⅱ具有刺激T淋巴细胞的增殖、成熟与分化的作用,也具有影响肿瘤细胞信号通路,促肿瘤细胞凋亡、抑制肿瘤细胞的增殖及其转移复发[10-13]。因此,RA-Ⅱ在增强机体对抗肿瘤药物的敏感性、刺激免疫细胞的增殖与转化、增强免疫力等方面具有潜在的优势。
肿瘤病灶CT或MRI或超声等影像学指标及肿瘤标志物改善情况等数据资料是评价mCRC等实体瘤治疗后临床获益较为客观、有效的指标[16-17]。浸润于TME中的免疫细胞主要有T淋巴细胞(CD3+、CD4+等)和NK细胞等,T淋巴细胞在体液免疫和细胞免疫过程中均发挥作用;因此,不同组分的机体免疫细胞表达水平,可以有效地反映机体细胞免疫状况,且与肿瘤的发生发展及免疫应答反应密切相关[18-19]。KPS评分反映了肿瘤患者的总体健康状况,是患者生活质量变化的重要体现[14-15]。治疗后不良反应发生率及其发生程度可以间接反映出mCRC对XELOX方案的耐受情况及RA-Ⅱ减轻毒副反应情况。本研究旨在评估两组患者治疗后的近期DCR临床获益情况、机体细胞免疫状况、KPS评分变化情况及不同程度的不良反应发生率等。结果发现,治疗后,观察组的DCR、CA19-9与CEA肿瘤标志物及KPS评分改善程度较对照组均更为显著,提示RA-Ⅱ联合化疗在一定程度上可以增强肿瘤组织或细胞对XELOX治疗方案的敏感性,增强该方案抗肿瘤治疗效果,并改善因XELOX方案治疗导致患者生活质量降低的情况发生;观察组不同组分的机体免疫细胞如CD细胞亚群、NK细胞表达占比情况较治疗前组内变化显著,且明显优于对照组,提示RA-Ⅱ在一定程度上能优化mCRC患者不同免疫细胞占比水平,对因XELOX方案治疗受损的机体细胞免疫功能起到恢复、调节作用,可能影响到TME,对机体的免疫功能起到调节作用。此外,观察组≥Ⅲ级严重不良反应总发生率、总不良反应发生率及不良反应处理所需的中位人均费用均显著低于对照组;提示RA-Ⅱ在一定程度上能降低mCRC患者经XELOX方案治疗后所致的不良反应发生率与严重程度,提高mCRC患者对XELOX方案治疗耐受情况,减少了其医疗支出,降低医疗负担。6CC267AC-55A2-474F-A06E-6D9CD5BBF293
綜上所述,RA-Ⅱ潜在作用于肿瘤细胞生长与转移所需TME的多个环节,与XELOX方案联合使用在治疗mCRC方面短期内DCR有所提高,可以增强肿瘤组织或细胞对XELOX方案治疗的敏感性,逆转肿瘤本身所带来的不良结局,提升XELOX方案抑制肿瘤的效果,并能明显降低XELOX方案治疗后引起的副反应,使得受到抑制的免疫功能得以部分恢复,有利于患者病情的转归及后续治疗。此外,考虑到本研究样本量小及疗效评价时间短的客观情况存在,对于治疗mCRC方面,RA-Ⅱ与XELOX方案联合长期使用最终获益情况需要更多的临床研究来验证,及两者如何发挥协同作用的可能机制有待进一步研究。
参考文献
[1] KEUM N,GIOVANNUCCI E.Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies[J].Nat Rev Gastroenterol Hepatol,2019,16(12):713-732.
[2] GAO Z Y,LI M,GU J.Sampling survey report on Chinese physicians cognition of the guidelines on diagnosis and treatment of colorectal cancer[J].Zhonghua Wei Chang Wai Ke Za Zhi,2020,23(11):1067-1073.
[3] ZENG H,CHEN W,ZHENG R,et al.Changing cancer survival in China during 2003-15: a pooledanalysis of 17 population-based cancer registries[J].Lancet Glob Health,2018,6(5):e555-e567.
[4]中华人民共和国国家卫生健康委员会医政医管局,中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2020年版)[J].中国实用外科杂志,2020,40(6):601-625.
[5] GENG R,WANG G,QIU L,et al.Metronomic capecitabine as maintenance treatment after first line induction with XELOX for metastatic colorectal cancer patients[J/OL].Medicine (Baltimore),2020,99(51):e23719.
[6] MESSERSMITH WA.NCCN Guidelines Updates: Management of Metastatic Colorectal Cancer[J].J Natl Compr Canc Netw,2019,17(5.5):599-601.
[7] LUO H Y,LI Y H,WANG W,et al.Single-agent capecitabine as maintenance therapy after induction of XELOX (or FOLFOX) in first-line treatment of metastatic colorectal cancer: randomized clinical trial of efficacy and safety[J].Ann Oncol,2016,27(6):1074-1081.
[8]陈亚丹,孙秀波,刘雅竹,等.注射用核糖核酸Ⅱ专项评价方法的构建与安全合理性[J].中国医院药学杂志,2018,38(11):1180-1182.
[9] Sweetman S.C.主编.马丁代尔药物大典[M].李大魁,金有豫,汤光,等,译.北京:化学工业出版社,2008:287.
[10]郭珮,李静,冉建华,等.注射用核糖核酸Ⅱ通过活性氧介导的PI3K/Akt信号通路诱导人白血病细胞KG1a凋亡[J].中国药理学通报,2019,35(8):1092-1098.
[11]单宇,白雪莲,杨淑贤,等.注射用核糖核酸Ⅱ对人横纹肌肉瘤细胞增殖和凋亡的调控作用[J].中国药理学通报,2018,34(11):1505-1511.
[12] SCHOLZOV E,MALk R,SEVCK J,et al.RNA regulation and cancer development[J].Cancer Lett,2007,246(1-2):12-23.
[13] YUAN Z,LIU X,WONG S,et al.MUC1 Knockdown With RNA Interference Inhibits Pancreatic Cancer Growth[J/OL].J Surg Res,2009,157(1):e39-e46.
[14] AZAM F,LATIF M F,FAROQ A,et al.Performance status assessment by using ECOG (Eastern Cooperative Oncology Group) score for cancer patients by oncology healthcare professionals[J].Case Rep Oncol,2019,12(3):728-736.
[15] HIRAMOTO S,TAMAKI T,NAGASHIMA K,et al.Prognostic factors in patients who received end-of-life chemotherapy for advanced cancer[J].Int J Clin Oncol,2019,24(4):454-459.6CC267AC-55A2-474F-A06E-6D9CD5BBF293
[16] SCHWARTZ L H,LITIèRE S,DE VRIES E,et al.RECIST 1.1-update and clarification: from the RECIST committee[J].Eur J Cancer,2016,62:132-137.
[17] COLLOCA G A,VENTURINO A,GUARNERI D.Carcinoembryonic antigen reduction after medical treatment in patients with metastatic colorectal cancer: a systematic review and meta-analysis[J].Int J Colorectal Dis,2019,34(4):657-666.
[18] SCURR M,PEMBROKE T,BLOOM A,et al.Low-Dose Cyclophosphamide Induces Antitumor T-Cell Responses, which Associate with Survival in Metastatic Colorectal Cancer[J]. Clin Cancer Res,2017,23(22):6771-6780.
[19] PEDROSA L,ESPOSITO F,THOMSON T M,et al.The Tumor Microenvironment in Colorectal Cancer Therapy[J].Cancers (Basel),2019,11(8):1172.
[20] FREITES-MARTINEZ A,SANTANA N,ARIAS-SANTIAGO S,et al.Using the Common Terminology Criteria for Adverse Events (CTCAE - Version 5.0) to Evaluate the Severity of Adverse Events of Anticancer Therapies[J].Actas Dermosifiliogr (Engl Ed),2021,112(1):90-92.
(收稿日期:2021-04-26) (本文編辑:占汇娟)6CC267AC-55A2-474F-A06E-6D9CD5BBF293
