EIAV Rev 核输出活性检测系统的建立
2022-03-22张萌萌张相敏王雪峰王晓钧
张萌萌,高 敏,张相敏,王雪峰*,王晓钧*
(1.吉林农业大学动物科学技术学院,吉林 长春 130118;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
马传染性贫血病毒(Equine infectious anemia virus,EIAV)是逆转录病毒科慢病毒属的成员之一,主要感染马属动物。EIAV 引起马属动物出现反复发热、消瘦、贫血和进行性衰弱为特征的传染性疾病称为马传染性贫血病(Equine infectious anemia,EIA)。EIAV 是基因组结构最简单的慢病毒,基因组全长约8.2 kb,可以编码3 个结构蛋白(Gag、Pol和Env)和3 个附属蛋白(tat、Rev 和S2)。病毒蛋白表达调节因子(Regulator of expression of viral proteins,Rev)是所有慢病毒属成员均具有的附属蛋白,其主要功能是介导未经剪切的病毒基因组RNA 和不完全剪切的病毒mRNA 从细胞核运输到细胞质,从而实现病毒结构蛋白表达和病毒粒子生成[1]。通常将Rev介导病毒mRNA 核质运输的生物学功能简称为核输出活性(Nuclear-export activity)。
EIAV Rev 蛋白包括3 个主要的功能域:分别为核输出信号(Nuelear export signal,NES)、核定位信号(Nuelear loaclization signal,NLS)以及RNA 结合区域(RNA-binding domain,RBD)[2]。Rev 通过RBD 与病毒mRNA的特定序列(Rev responsive element,RRE)结合,将病毒Gag-Pol或Env的mRNA运输至胞浆,实现病毒结构蛋白的表达[3]。EIAV 的RRE 长约555 nt,具有特定茎环结构,位于env基因的N 端,与Rev 编码基因的第一外显子重叠[4]。研究表明,EIAVrev基因具有高变异性,而且rev的变异与疾病转归相关[5]。为建立EIAV Rev 的核输出活性检测方法,本研究利用Gag-Pol 的表达依赖于Rev 与RRE 结合促进其mRNA 核输出的原理,克隆了EIAV 的Gag-pol 编码区序列以及RRE,构建了真核表达载体pGagpol-RRE。由于pGagpol-RRE 单独转染HEK293T 细胞不表达,仅在Rev 的作用下才能在HEK293T 细胞中表达。所以,将pGagpol-RRE 与Rev 表达载体(pcDNARevFDDV-HA)共转染HEK293T 细胞,利用western blot 在细胞裂解液中可检测到Gag 的表达,通过检测Gag 的表达来评估Rev 的核输出活性。
1 材料与方法
1.1 质粒、菌株和细胞pLGFD3-8、pcDNA-HA、pcDNA-RevFDDV-HA、pEGFP-N1 质粒、HEK293T 细胞均由本实验室保存;pcDNA-RevL36A-HA 是在pcDNARevFDDV-HA 的基础上获得的L36A 突变质粒;pcDNARevUK-HA、pcDNA-RevNewmarket-HA、pcDNA-RevCornwall-HA、pcDNA-RevF2-HA、pcDNA-RevSA-HA、pcDNA-RevDEHA、pcDNA-RevMiyazaki-HA、pcDNA-RevDevon-HA、pcDNA-RevPA-HA 等不同Rev 表达质粒均由苏州金唯智生物科技有限公司按照GenBank 中各EIAV 病毒株的rev基因序列(不同Rev 基因的Genbank 登录号分别是:UK,AF016316.1;Newmarket,MH580896.1;Cornwall,MH580898.1;F2,JX48063-1.1;SA,KM24 7555.2;DE,KM247554.1; Miyazaki,JX003263.1;Devon,MH580897.1;PA,GQ855756.1)合成后克隆于pcDNA-HA 载体。E. coilDH5α 感受态细胞购自北京天根生化科技有限公司。
1.2 主要试剂PolyJet DNA In Vitro Transfection Reagent购自SignaGen Laboratories公司;KOD高保真DNA聚合酶购自TOYOBO 公司;胶回收试剂盒购自Omega公司;新生牛血清(FBS)购自Wisent公司;EIAV p26单克隆抗体(MAb)由本实验室保存;鼠HA MAb 购自Sigma 公司;DyLightTM800 标记的IgG 羊抗鼠购自KPL公司;蛋白Marker 购自Thermo Fisher Scientific 公司;质粒大提试剂盒购自Thermo Fisher Scientific公司。
1.3 重组质粒的构建根据EIAV 驴胎皮肤细胞弱毒疫苗(EIAVFDDV)基因组序列(GU385361.1)设计特异性引物(Nhe-Gagpol-F:5'-CTAGCTAGCATTTG GTCGCTCAGATTCTGCGG-3'/xho-Gagpol-R:5'-GGCTC GAGCATACACCAAACCTTATAACAGA-3';xho-RREF:5'-AAACTCGAGATGGGATTATTTGGTAAAGGGGT-3'/Not-RRE-R:5'-AAAGCGGCCGCGTTACATTTATAT TTTTGACAGT-3'),以EIAV 感染性克隆pLGFD3-8为模板[6],利用PCR 方法分别扩增基因组204 bp~5 295 bp(包含Gag-Pol 编码区及其两侧序列)和5 296 bp~5 867 bp(包含RRE 及其两侧序列)的核苷酸序列,扩增的Gag-Pol 编码区及其两侧序列的片段预期为5 091 bp;扩增RRE 及其两侧序列的片段预期为571 bp,Gag-Pol片段经NheI和XhoI双酶切后克隆至真核表达载体pEGFP-N1,构建重组质粒pGagpol。将RRE 片段和pGagpol 分别经XhoI 和NotI 双酶切后连接,构建的重组质粒pGagpol-RRE。经酶切鉴定,阳性克隆由擎科(中国哈尔滨)公司测序鉴定。
1.4 Rev 介导Gag-Pol 表达的检测及其相关性分析37 ℃、 5%CO2条件下于细胞培养板中将HEK293T细胞培养至细胞密度80%左右时,采用PolyJet DNAIn VitroTransfection Reagent 将pGagpol-RRE(1 μg)分别与pcDNA-HA(1 μg)或pcDNA-RevFDDV-HA(1 μg)共转染HEK293T 细胞,转染6 h~8 h 后弃掉培养液更换新鲜培养液,继续培养至感染后36 h 时裂解细胞,分别采用抗EIAV p26 MAb(9H8)(1∶2 000)、鼠抗HA MAb(1∶2 000)或鼠抗β-actin MAb(1∶2 000)为一抗,DyLightTM800 标记的羊抗鼠IgG(1∶10 000)为二抗,通过western blot 检测Gag 的表达情况,分析其与Rev 的相关性。
按照上述转染方法将1 μg pGagpol-RRE 质粒分别与不同剂量(0.05 μg、0.1 μg、0.2 μg)的pcDNARevFDDV-HA 质粒和不同剂量(0.15 μg、0.1 μg、0)的pcDNA-HA 质粒共转染HEK293T 细胞,转染质粒的总剂量为1.2 μg,转染36 h后通过western blot检测Gag表达量的变化,并利用Image J进行灰度分析不同剂量的Rev对Gag-Pol表达的相关性。
此外,将pGagpol-RRE(1 μg)分别与pcDNA-HA(1 μg)、pcDNA-RevFDDV-HA(1 μg)和pcDNA-RevL36A-HA(1 μg)共转染HEK293T细胞,通过western blot检测Gag的表达情况,分析Rev介导Gag-Pol表达的特异性。
1.5 不同EIAV 毒株Rev 的序列特征及其核输出活性的检测 利用DNAStar 软件中的MegAlign 工具和GeneDoc 软件对不同毒株的EIAV Rev 序列间进行比对,分析各毒株间Rev 基因同源性。参照1.4 中转染方法将pGagpol-RRE(1 μg)分别与不同EIAV 毒株Rev表达载体(1 μg)(pcDNA-RevFDDV-HA、pcDNA-RevUKHA、pcDNA-RevNew-HA、pcDNA-RevCornwall-HA、pcDNA-RevF2-HA、pcDNA-RevSA-HA、pcDNA-RevDE-HA、pcDNA-RevMiyazaki-HA、pcDNA-RevDevon-HA、pcDNARevPA-HA)共转染HEK293T 细胞,通过western blot检测Gag 的表达情况,评价建立的检测系统对不同EIAV 毒株Rev 的核输出活性的可行性。
2 结果与讨论
2.1 EIAV Gag-Pol 表达载体的构建与鉴定结果构建的pGagpol-RRE 真核表达载体经XhoI 和NotI 双酶切鉴定,结果显示得到的片段约10 000 bp 和570 bp,与预期相符(图1);进一步测序结果显示目的基因与pLGFD3-8 相应基因序列完全一致,且读码框正确。表明重组质粒pGagpol-RRE正确构建。
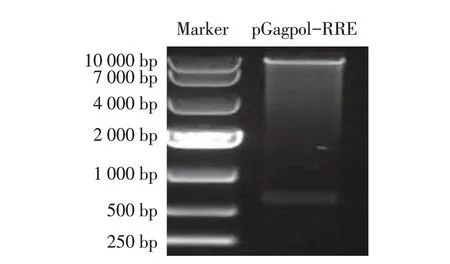
图1 重组质粒pGagpol-RRE的酶切鉴定结果Fig.1 Digestion analysis of of identification of recombinant plasmid pGagpol-RRE digestion
2.2 Rev 介导Gag-Pol 表达的检测慢病毒的主要结构蛋白Gag-pol 的表达依赖于Rev 的核输出活性[7]。EIAV Gag 前体蛋白p55 在病毒pol基因编码的蛋白酶作用下被切割成p15、p26、p11 和p9[8]。将重组质粒pGagpol 和pGagpol-RRE 分别与Rev 表达质粒pcDNA-RevFDDV-HA 共转染HEK293T 细胞。36 h 后进行western blot 检测,结果显示,pGagpol无论有无Rev均不表达,pGagpol-RRE 仅在Rev 存在的条件下表达(图2A),而且随着Rev 剂量的增加(0.05 μg、0.1 μg、0.2 μg),Gag55的表达量逐渐增加(图2B),表明Rev通过RRE 介导Gag-Pol 的表达。有研究显示,Rev L36A的突变会破坏其核输出活性[9]。为了验证pGagpol-RRE的表达特异性地依赖于Rev的核输出活性,在pcDNARevFDDV-HA 的基础上,本研究团队前期通过PCR 方法将36 位的L 突变成A,构建Rev 表达载体pcDNARevL36A-HA。将pGagpol-RRE 分别与pcDNA-RevFDDVHA或pcDNA-RevL36A-HA共转染HEK293T细胞,western blot 检测显示,Rev L36A 不能介导Gag-Pol 的表达(图2C),表明Rev介导pGagpol-RRE 的表达依赖于其核输出活性,进一步证明pGagpol-RRE 可用于评价Rev 核输出活性的研究,为研究Rev 的生物学活性奠定了基础。
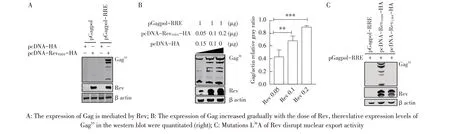
图2 Rev介导Gag-Pol表达的western blot鉴定结果Fig.2 Western blot analyisis for that the expression of Gag-Pol mediated by Rev
2.3 不同EIAV 病毒株Rev 核输出活性的检测结果对不同EIAV 病毒的Rev 氨基酸序列比对发现,尽管各毒株之间氨基酸序列差异较大,但是对Rev核输出活性有重要影响的关键位点高度保守(aa36、aa45、aa49、aa76、aa77、aa95、aa109)[10](图3A)。将不同病毒的Rev 表达质粒与pGagpol-RRE 共转染HEK293T 细胞,结果显示:除对照组pGagpol-RRE与pcDNA-HA 共转染检测不到Gag55的表达,其余各病毒株的Rev 均能有效地介导Gag55的表达(图3B)。实验结果提示不同毒株Rev 氨基酸序列的保守区可能对其核输出活性是至关重要的,同时也表明pGagpol-RRE 可用于评价EIAV 不同毒株的Rev 核输出活性,为深入研究Rev 基因变异对其生物学功能的影响提供了重要的方法。

图3 EIAV不同病毒株Rev的核输出活性比较Fig.3 Comparison analysis of nuclear export activities of Rev from different EIAV strains
研究表明,EIAV Rev 是病毒复制必须的附属蛋白,其不仅介导未完全剪切的病毒mRNA 的核输出活性,还可以增强病毒mRNA 的稳定性、促进mRNA 的集聚、调节mRNA 的选择性剪切[11]。最近的研究显示,EIAV 的Rev 还可以拮抗宿主限制因子SAMHD1 促进病毒复制[9]。在EIAV 和HIV-1 感染过程中,rev基因的变异与疾病发展密切相关[12-15]。其中一个重要的原因是Rev 的变异通过减弱其核输出活性,减少Gag 的表达水平,即Rev 可以改变病毒的复制并影响感染者的疾病临床转归。本研究利用Rev 与RRE 的结合介导Gag-Pol 表达的原理,构建了pGagpol-RRE 真核表达载体,将其与Rev 表达载体共转293T 细胞,通过western blot 比较Gag 表达量的变化可分析Rev 的核输出活性。该系统可用来评价EIAV 同源和异源毒株Rev 的核输出活性,为进一步研究EIAV 致病机制奠定了基础。
