miRNA-222靶向Smad2/7对牙周膜干细胞向成骨分化的影响
2022-03-17胡佳蓟钟香唐翠连张群慧
胡佳蓟 钟香 唐翠连 张群慧






[摘要]目的:探討miRNA-222靶向Smad2/7对牙周膜干细胞向成骨分化的影响。方法:采用流式细胞术鉴定人牙周膜干细胞表面标志物,采用油红O染色、茜素红染色和阿尔新蓝染色法验证成脂、成骨和软骨分化能力,同时验证miRNA-222、sh-Smad2和sh-Smad7对成骨分化的影响,RT-PCR检测miRNA-222在成骨分化中的表达,采用Western blot检测miRNA-222对ALP、Runx2、OCN、Smad2和Smad7蛋白的影响。结果:牙周膜干细胞表面呈阳性表达的有STRO1和CD146,阳性率分别为98.63%和99.16%。RT-PCR检测结果显示,在成骨分化过程中,人牙周膜干细胞中miRNA-222表达明显降低。茜素红染色结果显示,与空白组相比,miRNA-222模拟组中的红褐色矿化结节的数量明显降低(P<0.05),miRNA-222抑制组中的红褐色矿化结节的数量显著增多(P<0.05);与sh-NC相比,sh-Smad2组和sh-Smad7组红褐色矿化结节的数量显著减少(P<0.05)。Western blot检测结果显示,与空白组相比,miRNA-222模拟组的ALP、Runx2、OCN蛋白表达明显降低(P<0.05),与miRNA-222模拟组相比,miRNA-222抑制组的ALP、Runx2、OCN蛋白表达显著升高(P<0.05);与空白组相比,miRNA-222模拟组的Smad2和Smad7蛋白表达明显降低(P<0.05),与miRNA-222模拟组相比,miRNA-222抑制组的Smad2和Smad7蛋白表达显著升高(P<0.001)。结论:过表达miRNA-222可以减少Smad2和Smad7表达,从而抑制人牙周膜干细胞的成骨分化。
[关键词]miRNA-222;Smad2;Smad7;STRO1;CD146;成骨分化
[中图分类号]R781.4+2 [文献标志码]A [文章编号]1008-6455(2022)02-0095-05
Effect of miRNA-222 Targeting Smad2/7 on Osteogenic Differentiation of Periodontal Ligament Stem Cells
HU Jiaji1,ZHONG Xiang1,TANG Cuilian2,ZHANG Qunhui1
(1.Department of Stomatology; 2.Department of Laboratory,the Second Affiliated Hospital of Shaoyang University,Shaoyang 422000,Hunan,China)
Abstract: Objective To investigate the effect of miRNA-222 targeting Smad2/7 on the osteogenic differentiation of periodontal ligament stem cells (PDLSCs). Methods Flow cytometry was used to identify the surface markers of human periodontal ligament stem cells. Oil red O staining, alizarin red staining and alcian blue staining were used to verify the adipogenic, osteogenic and chondrogenic differentiation abilities. The effects of miRNA-222, sh-Smad2 and sh-Smad7 on osteogenic differentiation were also verified. The expression of miRNA-222 in osteogenic differentiation was detected by RT-PCR, Western blot was used to detect the effect of miRNA222 on the expression of ALP, Runx2, OCN, Smad2 and Smad7 proteins. Results STRO1 and CD146 were positively expressed on the surface of periodontal ligament stem cells, and the positive rates were 98.63% and 99.16%, respectively. RT-PCR results showed that during the process of osteogenic differentiation, the expression of miRNA-222 in human periodontal ligament stem cells was significantly reduced. The results of Alizarin Red staining showed that compared with the blank group, the number of red-brown mineralized nodules in the miRNA-222 simulation group was significantly reduced (P<0.05), and the red-brown mineralized nodules in the miRNA-222 inhibition group were significantly reduced. The number was significantly increased (P<0.05), compared with sh-NC, the number of red-brown mineralized nodules in the sh-Smad2 and sh-Smad7 groups was significantly reduced (P<0.05). Western blot detection results showed that compared with the blank group, the expression of ALP, Runx2, and OCN in the miRNA-222 simulation group was significantly reduced (P<0.05). Compared with the miRNA-222 simulation group, the ALP, Runx2, and OCN protein expressions in the miRNA-222 suppression group The protein expression of Runx2 and OCN was significantly increased (P<0.05), compared with the blank group, the expression of Smad2 and Smad7 protein in the miRNA-222 simulation group was significantly reduced (P<0.05). Compared with the miRNA-222 simulation group, the expression of The protein expression of Smad2 and Smad7 in the miRNA- 222 inhibition group was significantly increased (P<0.001). Conclusion Overexpression of miRNA-222 can reduce the expression of Smad2 and Smad7, thereby inhibiting the osteogenic differentiation of human periodontal ligament stem cells.
Key words: miRNA-222; Smad2; Smad7; STRO1; CD146; osteogenic differentiation
牙周炎是常见的牙周组织疾病,该病是由于牙菌斑中的细菌微生物及其代谢产物侵犯牙周组织而引起的慢性炎症[1],主要的病理改变是牙周袋的形成和牙槽骨的吸收。牙槽骨是人体骨骼中最活跃的代谢部分[2],当发生牙周炎时,牙槽骨处则同时发生着被破坏与修复性再生。在正常的生理状态下,只有当骨的吸收和修复性再生相平衡时才能保证牙槽骨代谢的稳定。临床上治疗牙周炎的传统方法是控制牙菌斑和消除牙周炎症,而这些方法却都无法获得理想的牙周组织修复和再生。不过令人欣慰的是,已有相关研究表明,牙周膜干细胞(PDLSCs)可以修复牙周组织缺损,维持牙周的动态平衡,促进牙周组织再生[3]。此外,又有文献报道,miRNAs参与多种细胞的成骨分化进程,并且可以通过调控相关信号通路,在间充质干细胞的成骨分化过程中起着重要的调控作用[4]。牙周膜干细胞就是存在于牙周膜中的一种未分化的间充质干细胞[5]。因此,为了进一步阐明miRNA-222调控人牙周膜干细胞成骨分化的机制,笔者进行了以下研究,以期为临床在治疗牙周炎方面提供一定的理论依据。
1 资料和方法
1.1 主要试剂:DMEM培养基(购自美国Hyclone公司);磷酸盐缓冲液(PBS)(购自中国Boster公司);青霉素/链霉素溶液(购自美国Sigma公司);STRO-1/CD146/CD45/C34/FITC(购自英国Abcam公司);4%多聚甲醛、茜素红、油红O(购自美国Invitrogen公司);ALP、Runx2、OCN、Smad2、Smad7抗体(购自中国Beyotime公司);RIPA裂解液、BCA试剂盒和阿利新蓝染色试剂盒(购自上海玉博生物科技有限公司);miRNA-222mimic和miRNA-222inhibitor(购自美国Biolegend公司);山羊抗兔IgG二抗(购自北京索莱宝科技有限公司)。
1.2 样本收集:收集笔者医院口腔科就诊的20例患者为研究对象。牙齿都是患者因为阻生或正畸原因需要拔除的完整、无龋且无牙周炎的前磨牙或第三磨牙;年龄20~36岁;经患者知情同意。
1.3 方法
1.3.1 人牙周膜干细胞的分离培养:拔除的新鲜牙齿放入含有链霉素和青霉素的预冷的a-MEM溶液中,用无菌镊取出,放置于含有PBS缓冲液的无菌培养皿中,使用PBS反复冲洗,再用手术刀刮取根中1/3的牙周膜组织,放入培养瓶中,加入10 ml 20%的DMEM培养基,盖好放入CO2培养箱内。一周后更换液体,去除未贴壁的漂浮组织,然后用显微镜观察是否有细胞出现。当有细胞出现后,每3 d更换1次液体,直至细胞覆盖瓶底80%。吸去培养基,PBS冲洗3次,用1 ml的0.25%胰酶消化,持续敲打,再加入10%的DMEM培养基终止消化,制成单细胞悬液,离心处理,12 000 rpm离心5 min,然后去上清,继续培养。
1.3.2 人牙周膜干细胞表面标志物的流式细胞术鉴定:胰蛋白酶消化后,对数生长期人牙周膜干细胞进行离心处理,1 200 rpm离心5 min,然后用PBS清洗3次,去上清。细胞密度稀释至1×106细胞/毫升,取5份细胞悬液,每份各100 μl,加入STRO-1、CD146、CD45和CD34抗体,阴性对照组加入等量的PBS,避光室温孵育20 min,1 200 rpm离心5 min,去上清,然后经流式细胞仪检测。
1.3.3 成骨、成脂和软骨分化实验:人牙周膜干细胞中加入10 mmol/Lβ-甘油磷酸、50 mg/L抗坏血酸和100 nmol/L地塞米松,在10%FBS的a-MEM完全培养基中进行成骨培养21 d,每2 d更换一次培养基。分别在第0、3、7、14、21天提取人牙周膜干细胞中总RNA。第21天,用油红O染色法检测人牙周膜干细胞的成脂分化能力;用茜素红染色观察人牙周膜干细胞的钙盐沉积和矿化结节情况;用阿尔新蓝染色法检测并评估人牙周膜干细胞的软骨分化能力。
1.3.4 茜素红染色结果:连续诱导培养成骨分化21 d后,取出原有的培养基,PBS清洗2~3次,常温下采用2 ml的4%多聚甲醛固定细胞15 min。
1.3.4.1 miRNA-222对成骨分化的影响:将固定后的细胞分为miRNA-222模拟组、miRNA-222抑制剂组和空白组,其中miRNA-222模拟组、miRNA-222抑制剂组和空白组分别转染miRNA-222mimic、miRNA-222inhibitor、miRNA-222-NC,参照Lipo-2000说明书分别进行转染。将干预后固定液用PBS缓冲液洗净,每孔加入2%的茜素红染色15 min,用PBS缓冲液洗去浮色,显微镜下观察矿化结节形成情况并拍照。
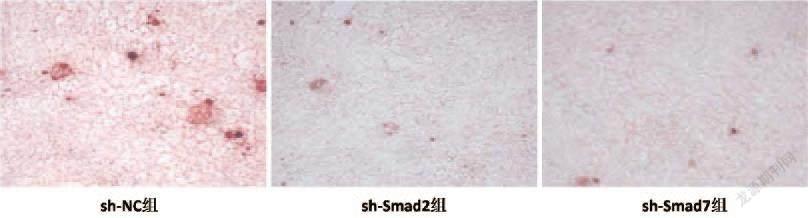
1.3.4.2 sh-Smad2和sh-Smad7对成骨分化的影响:取三代人牙周膜干细胞接种于24孔板中,分为sh-Smad2组、sh-Smad7组和sh-NC组,然后分别转染sh-Smad2、sh-Smad7、sh-NC。参照Lipo-2 000说明书分别对人牙周膜干细胞进行转染,待细胞融合度达到80%以上时,弃掉原液,无菌PBS洗2次,将实验更换为成骨培养基,诱导2周后,4%的多聚甲醛固定,PBS缓冲液洗净后,每孔加入2%的茜素红染色15 min,用PBS缓冲液洗去浮色后,显微镜下观察矿化結节形成情况并拍照。
1.3.5 RT-PCR检测:用Trizol法提取总RNA,逆转录cDNA,利用miRNA-222和GAPDH,miRNA-222引物序列上游为5′-GAGTCACGGGTCATCGGTCG-3',下游为5′-AGATAGATACCGCATCGCA-3';GAPDH引物序列上游为5′-TAAAGCAGGAGGGCCCTTCG-3',下游为5′-CATTGGCCACTTTCAAGGCGTC-3'。引物在生物系统7500实时PCR系统上进行了实时荧光定量PCR,mRNA的内参照物为GAPDH,反应条件为95 ℃,预变性5 min,95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸20 s,实验重复40次,数据分析采用2-ΔΔCt法,观察miRNA-222在人牙周膜干细胞成骨分化过程中的表达。
1.3.6 Western blot检测:PBS冲洗人牙周膜干细胞,用RIPA裂解液缓冲液裂解后得到蛋白,采用BCA试剂盒检测蛋白浓度,将相应体积的蛋白质与载入缓冲液混合。在沸水浴中加热3 min变性蛋白质,30 min后SDS-PAGE凝胶蛋白电泳,转膜、封闭,在室温或4 ℃过夜。然后加入GAPDH(稀释1:10 000)、Smad2(稀释1:10 000)、Smad7(稀释1:2 000)、Runx2(稀释1:10 000)、ALP(稀释1:10 000)、OCN(稀释1:10 000)一抗,孵育1 h,PBS洗涤3次,每次10 min。再加入山羊抗兔IgG二抗在室温下孵育1 h,洗涤3次,共30 min。然后加入显色剂显色,采用化学发光成像分析系统观察miRNA-222对Smad2、Smad7、ALP、Runx2、OCN蛋白表达的影响。
2 结果
2.1 人牙周膜干细胞表面标志物的流式细胞术鉴定:分离的牙周膜干细胞表面呈阳性表达的有STRO1和CD146,阳性率分别为98.63%和99.16%,见图1A和1B;CD45和CD34呈阴性表达,见图1C和1D。
2.2 成脂、成骨和软骨的分化能力:如图2A所示,细胞周围有大量的红色油脂状颗粒被染成红色,证明人牙周膜干细胞具有成脂分化的能力;如图2B所示,有红褐色的钙盐沉积和矿化结节,说明人牙周膜干细胞有较好的成骨分化能力;如图2C所示,人牙周膜干细胞具有较好的软骨分化能力,都具备干细胞特性。
2.3 miRNA-222在人牙周膜干细胞成骨分化过程中的表达:RT-PCR结果显示,随着时间的推移,牙周膜干细胞成骨分化过程中,miRNA-222水平逐渐降低,21 d,牙周膜干细胞成骨分化miRNA-222水平更低,与0 d相比,差异具有统计学意义(P<0.001),见图3。
2.4 miRNA-222表达对人牙周膜干细胞成骨分化的影响:茜素红染色结果显示,与空白组相比,miRNA-222模拟组中的红褐色矿化结节的数量明显降低,差异具有统计学意义(P<0.05),miRNA-222抑制组中的红褐色矿化结节的数量显著增多,差异具有统计学意义(P<0.05),见图4。
2.5 miRNA-222表达对ALP、Runx2、OCN蛋白的影响:Western blot检测结果显示,与空白组相比,miRNA-222模拟组的ALP、Runx2、OCN蛋白表达明显降低,差异具有统计学意义(P<0.05);与miRNA-222模拟组相比,miRNA-222抑制组的ALP、Runx2、OCN蛋白表达显著升高,差异具有统计学意义(P<0.05),见图5。
2.6 miRNA-222表达对Smad2和Smad7蛋白的影响:Western blot检测结果显示,与空白组相比,miRNA-222模拟组的Smad2和Smad7蛋白表达明显降低,差异具有统计学意义(P<0.05),与miRNA-222模拟组相比,miRNA-222抑制组的Smad2和Smad7蛋白表达显著升高,差异具有统计学意义(P<0.001),见图6。
2.7 sh-Smad2、sh-Smad7、sh-NC对成骨分化的影响:茜素红染色结果显示,与sh-NC相比,sh-Smad2组和sh-Smad7组红褐色矿化结节的数量显著减少,差异具有统计学意义(P<0.05),见图7。
3 讨论
牙周病通常是由于牙周支持组织受到厌氧菌感染而引起的慢性感染性疾病[6],成年人发病率较高,有将近20%的患者有重度牙周炎[7]。该疾病早期无明显症状,但是随着病程的逐渐延长,牙周膜以及骨组织就会出现不可逆性丧失,临床上常表现为牙龈出血、牙周袋形成、牙槽骨吸收和牙的松动移位。因此,牙周病是导致成年人牙齿缺失的主要原因之一。治疗牙周病的主要目的是停止牙周软组织和硬组织的破坏,修复牙周组织并促进牙周组织再生,但疗效一般。近年来,以干细胞为主的组织工程修复技术受到了广泛的关注,并且效果显著。牙周膜干细胞不仅具有维持牙周组织的动态平衡,还具有分化成骨细胞、脂肪细胞、成软骨细胞和神经元样细胞等多种细胞的多重分化和再生能力[8-9]。此外,牙周膜干细胞能够激活相关的信号轴促进破骨细胞分化和增殖,并在体内经过诱导可以形成牙骨质样结构及牙周膜,在正畸牙移动的骨改建过程中起主要作用,是治疗牙周病的热点。因此,本研究以它为切入点进行重点研究。
本研究采用流式细胞术检测发现,分离的牙周膜干细胞表面呈阳性表达的有STRO1和CD146,阳性率分别为98.63%和99.16%,CD45和CD34呈阴性表达。油红O染色法检测结果显示,细胞周围有大量的红色油脂状颗粒被染成红色,证明人牙周膜干细胞具有成脂分化的能力;茜素红染色结果显示,有红褐色的钙盐沉积和矿化结节,说明人牙周膜干细胞有较好的成骨分化能力;阿尔新蓝染色法结果显示,人牙周膜干细胞具有较好的软骨分化能力,都具备干细胞特性。以上的结果表明,分离和培养的细胞存在多向分化能力,与既往的相关报道具有一致性。本研究RT-PCR检测结果显示,在成骨分化过程中,人牙周膜干细胞中miRNA-222表達明显降低,而且通过茜素红染色发现,miRNA-222模拟组红褐色矿化结节的数量明显降低,miRNA-222抑制组红褐色矿化结节的数量显著增多。因此说明,下调miRNA-222的表达,有利于成骨分化。又通过Western blot检测结果发现,miRNA-222模拟组ALP、Runx2、OCN蛋白表达明显降低,miRNA-222抑制组ALP、Runx2、OCN蛋白表达显著升高,又一次印证了细胞学成骨分化的能力。
miRNA在生命的发展过程中起着重要的调控作用,参与生命的各种进程[10]。相关研究表明,miRNAs可激活并调控人来源的间充质干细胞潜在的多功能性,尤其是在间充质干细胞多向分化的能力中起着至关重要的作用[11]。最新研究发现,MicroRNA-54在人牙周膜源性干细胞中作为成骨促进剂发挥作用[12]。也有报道,沉默miRNA-132-3p表达通过促进小鼠骨髓间充质干细胞成骨分化和成骨修复[13],抑制microRNA-222上调TIMP3促进2型糖尿病骨折大鼠骨髓间充质干细胞成骨分化[14]。笔者通过Western blot检测验证miRNA-222对Smad2和Smad7的影响,结果显示,miRNA-222模拟组Smad2和Smad7蛋白表达明显降低,miRNA-222抑制组Smad2和Smad7蛋白表达显著升高。此处可以说明,miRNA-222的潜在靶基因为Smad2和Smad7。许多研究通过靶向Smad家族成员证明了miRNAs与成骨进展相关。相关研究表明,miR-24-3p可以靶向Smad5影响人牙周膜干细胞成骨分化[15]。另有研究表明,MiR-125a-3p通过靶向Smad4和Jak1负调控人脂肪间充质干细胞的成骨分化[16],miR-1323通过抑制BMP4/SMAD4信号传导抑制骨髓间充质干细胞成骨分化[17]。因此笔者推测Smad2和Smad7可能参与人牙周膜干细胞的成骨分化。为了验证它的准确性,笔者采用茜素红染色法进行实验,结果显示,沉默Smad2和Smad7,红褐色矿化结节的数量显著减少,从而说明,过表达miRNA-222可以降低Smad2和Smad7的表达,从而抑制人牙周膜干细胞的成骨分化。
综上所述,miRNA-222可以调节Smad2和Smad7的表达,揭示了人牙周膜干细胞的成骨分化机制,并为牙周组织再生的新治疗策略提供了基础。
[参考文献]
[1]叶婵娟.炎症介质介导牙周炎促进早产发生的研究进展[J].临床口腔医学杂志,2020,36(4):249-252.DOI:CNKI:SUN:LCKY.0.2020-04-018.
[2]臧文麗,刘俊超,潘亚萍.丁酸对牙周炎的影响机制研究进展[J].口腔医学研究,2020,36(4):15-17.DOI:CNKI:SUN:KQYZ.0.2020-04-003.
[3]Kim H Y,Park S Y,Choung S Y.Enhancing effects of myricetin on the osteogenic differentiation of human periodontal ligament stem cells via BMP-2/Smad and ERK/JNK/p38 mitogen-activated protein kinase signaling pathway[J].Eur J Pharmacol,2018,834:84-91.DOI:10.1016/j.ejphar.2018.07.012.
[4]Fang-Yi,Fan,Rui,et al.miR-203a-3p.1 is involved in the regulation of osteogenic differentiation by directly targeting Smad9 in MM-MSCs[J].Oncology letters,2019,18(6):6339-6346.DOI:10.3892/ol.2019.10994.
[5]Yasunaga M,Kajiya H,Toshimitsu T,et al.The early autophagic pathway contributes to osteogenic differentiation of human periodontal ligament stem cells[J].J Hard Tissue Bio,2019,28(1):63-70.DOI:10.2485/jhtb.28.63.
[6]Gomaa N,Glogauer M,Nicolau B,et al.Stressed-Out oral immunity:a gateway from socioeconomic adversity to periodontal disease[J].Psychosom Med,2020,82(2):1.DOI:10.1097/PSY.0000000000000774.
[7]陈斌,徐蓉蓉,张家鼎,等.重度牙周炎患牙的保存治疗[J].国际口腔医学杂志,2020,47(2):7-12.DOI:CNKI:SUN:GWKQ.0.2020-02-001.
[8]庞真贞,李硕,刘钦赞,等.人牙髓干细胞,牙周膜干细胞表型及生长特性分析[J].河北医药,2020,42(1):100-102+106.DOI:CNKI:SUN:HBYZ.0.2020-01-024.
[9]Wang H,Li J,Zhang X,et al.Priming integrin alpha 5 promotes the osteogenic differentiation of human periodontal ligament stem cells due to cytoskeleton and cell cycle changes[J].J Proteomics,2018,179(15):122-130.DOI:10.1016/j.jprot.2018.03.008.
[10]Yang S,Guo S,Tong S,et al.Promoting osteogenic differentiation of human adipose-derived stem cells by altering the expression of exosomal miRNA[J].Stem Cells Int,2019,19(3):1-15.DOI:10.1155/2019/1351860.
[11]Zhang Q,Chang B,Zheng G,et al.Quercetin stimulates osteogenic differentiation of bone marrow stromal cells through miRNA-206/connexin 43 pathway[J].Am J Trans Res,2020,12(5):2062-2070.
[12]Ge Y,Li J,Hao Y,et al.MicroRNA-543 functions as an osteogenesis promoter in human periodontal ligament-derived stem cells by inhibiting transducer of ERBB2,2[J].J periodontal res,2018,53(5):832-841.DOI:10.1111/jre.12572.
[13]Hu Z,Zhang L,Wang H,et al.Targeted silencing of miRNA-132-3p expression rescues disuse osteopenia by promoting mesenchymal stem cell osteogenic differentiation and osteogenesis in mice[J].Stem Cell Res Ther,2020,11(1):58-64.DOI:10.1186/s13287-020-1581-6.
[14]Chenyi J,Wenyang X,Tianyi W,et al.Inhibition of microRNA-222 up-regulates TIMP3 to promotes osteogenic differentiation of MSCs from fracture rats with type 2 diabetes mellitus[J].J cell mol med,2020,24(1):686-694.DOI:10.1111/jcmm.14777.
[15]Li Z,Sun Y,Cao S.et al.Downregulation of miR-24-3p promotes osteogenic differentiation of human periodontal ligament stem cells by targeting SMAD family member 5[J].J Cell Physiol,2019,234(5):7411-7419.DOI:10.1002/jcp.27499.
[16]Gu Z,Long J,Li Y,et al.miR-125a-3p negatively regulates osteoblastic differentiation of human adipose derived mesenchymal stem cells by targeting Smad4 and Jak1[J].Am J Transl Res,2019,11(4):5284-5291.
[17]Xie H,Liu M,Jin Y,et al.miR-1323 suppresses bone mesenchymal stromal cell osteogenesis and fracture healing via inhibiting BMP4/SMAD4 signaling[J].J Orthop Surg Res,2020,15(1):237-242.DOI:10.1186/s13018-020-01685-8.
[收稿日期]2021-01-05
本文引用格式:胡佳薊,钟香,唐翠连,等.miRNA-222靶向Smad2/7对牙周膜干细胞向成骨分化的影响[J].中国美容医学,2022,31(2):95-99.
3990500589240
