活性氧化铝吸附脱除模拟油中吡啶的研究
2022-03-14矫宝庆王聚财田鹏飞
矫宝庆,唐 克,洪 新,富 添,王聚财,田鹏飞
(辽宁工业大学化学与环境工程学院,辽宁 锦州 121001)
随着国内成品油需求量的不断增加,燃料油中的氮化物已成为目前主要的大气污染物来源之一。在油品的加工过程中,氮化物会导致催化剂中毒,并且对油品加氢脱硫(HDS)的抑制作用也很强[1-3],尤其是六元环的碱性杂环氮化物。此外,氮化物会对油品的性能、储存等造成不良影响[4]。目前,工业上主要采用加氢精制脱除油品中的氮化物[5],但加氢脱氮需要有足够的氢气供给和较大的资金投入。作为一种重要的非加氢精制脱氮方法,吸附脱氮因其具有工艺简单、脱氮效果较好且经济环保的特点而被日益关注。吸附脱氮对吸附剂的选择性和可再生性具有较高要求[6-7]。活性氧化铝是一种具有较高强度和化学稳定性、热稳定性良好的固态吸附剂。本课题以吡啶的正十二烷溶液作为模拟油,比较3种不同的氧化铝(碱性氧化铝、酸性氧化铝和中性氧化铝)对吡啶的吸附效果,确定吸附脱氮性能较好的氧化铝,考察其最佳吸附条件及再生性能,并对其吸附过程的热力学和动力学进行研究。
1 实 验
1.1 试验材料
吡啶,分析纯,天津市光复科技发展有限公司产品;正十二烷,分析纯,上海谱振生物科技有限公司产品;无水乙醇、冰醋酸、高氯酸、乙酸酐、吸附剂(碱性氧化铝、酸性氧化铝、中性氧化铝),均为分析纯,国药集团化学试剂有限公司产品。
1.2 吸附脱氮试验方法
以吡啶为溶质,正十二烷为溶剂,配制氮质量分数为1 732 μg/g的模拟油,用于吸附条件和吸附动力学的考察;配置氮质量分数分别为400,700,1 000,1 300,1 732,2 532,3 332,4 132,4 932,5 732,8 732,11 732,14 732,17 732,20 732 μg/g的模拟油,用于对吸附热力学的考察。
采取静态吸附法对模拟油中的吡啶进行吸附,具体步骤为:向盛有15 mL模拟油的锥形瓶中加入一定质量的氧化铝吸附剂,经恒温磁力搅拌并离心分离后,采用SH/T 0162—92方法对上层清液进行氮含量测试[8],然后计算模拟油的氮脱除率。
1.3 吸附剂再生方法
乙醇洗涤:将吸附吡啶后的氧化铝吸附剂在室温下静置风干后放入烘箱干燥,将经过干燥的吸附剂放入锥形瓶中,加入无水乙醇,没过吸附剂,在磁力搅拌下洗涤40 min后真空抽滤,边抽滤边用无水乙醇冲洗,直至滤液呈中性。
高温焙烧:将吸附吡啶后的氧化铝吸附剂风干后放入坩埚,然后置于马弗炉中在温度773 K下焙烧3 h,冷却至室温备用。
1.4 表征测试方法
采用德国布鲁克公司生产的D8 ADVANCE型X射线衍射(XRD)仪测定氧化铝的晶体结构,测定条件为:Cu Kα射线,管电压40 kV,管电流40 mA,以4(°)/min速率对2θ为5°~90°的范围进行扫描。
采用美国Perkin-Elmer公司生产的SpectrumTMGX型傅里叶变换红外光谱(FT-IR)仪测定氧化铝的结构,KBr压片,在波数为500~4 000 cm-1的范围内测定。
采用日本BEL公司生产的BelSorp-Max物理吸附仪对经573 K脱气12 h后的样品进行液氮温度下的N2吸附-脱附等温线测定。
2 结果与讨论
2.1 氧化铝的表征分析
2.1.1XRD、FT-IR分析
3种氧化铝的XRD图谱见图1。由图1可以看出,试验所用碱性氧化铝、酸性氧化铝和中性氧化铝的XRD图谱在2θ为19.44°,37.59°,39.47°,67.00°处均出现了不同强度的衍射峰,各主峰的出峰位置和强度都基本相同,且都为结晶度良好的物相峰。3种氧化铝的出峰位置都符合γ-Al2O3的特征峰,说明各样品均为多孔、高分散度的立方晶系固体。

图1 3种氧化铝的XRD图谱 —碱性氧化铝; —酸性氧化铝; —中性氧化铝
3种氧化铝的红外光谱见图2。由图2可以看出,3种氧化铝红外光谱特征峰的出峰位置基本一致,吸收峰强度也基本相同,进一步说明这3种氧化铝的物质组成和结构相同。

图2 3种氧化铝的红外光谱 —碱性氧化铝; —酸性氧化铝; —中性氧化铝
2.1.2孔结构分析
3种氧化铝的低温N2吸附-脱附等温线见图3,其BJH孔径分布曲线见图4。由图3可知,3种氧化铝的低温N2吸附-脱附等温线在相对压力p/p0为0.3~0.4时发生毛细凝聚现象,形成吸附-解吸滞后,产生滞后环,所以3种氧化铝的低温N2吸附-脱附等温线都符合BDDT分类中Ⅳ型吸附等温线[9]。采用BET法计算得出碱性、酸性、中性氧化铝样品的比表面积分别为178.70,145.34,154.54 m2/g,通过BJH法计算得出碱性、酸性、中性氧化铝的平均孔径分别为4.55,4.82,4.54 nm[10]。以上数据表明,3种氧化铝的平均孔径相差不大,而碱性氧化铝的比表面积明显大于其他两种氧化铝。
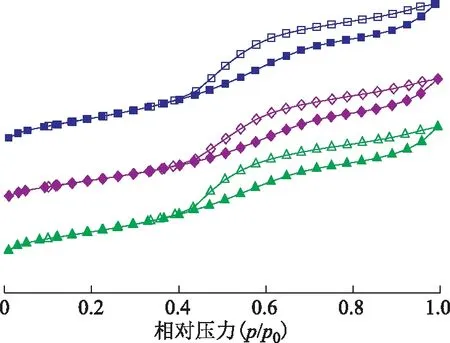
图3 3种氧化铝的低温N2吸附-脱附等温线■—碱性氧化铝吸附; □—碱性氧化铝脱附; ◆—酸性氧化铝吸附; ◇—酸性氧化铝脱附; ▲—中性氧化铝吸附; △—中性氧化铝脱附
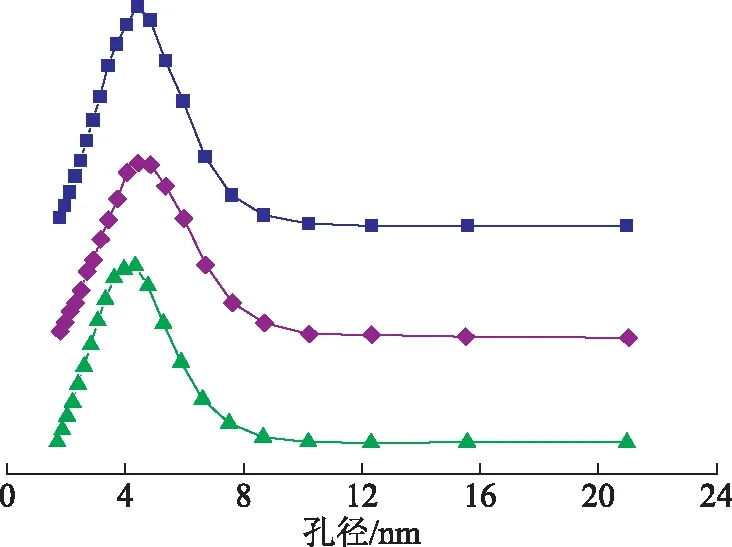
图4 3种氧化铝的BJH孔径分布曲线■—碱性氧化铝; ◆—酸性氧化铝; ▲—中性氧化铝
由图4可知:3种氧化铝的BJH孔径分布曲线的峰宽相近,说明其孔径分布在一程度上相近,3种氧化铝为孔径大小基本相同的介孔材料;碱性氧化铝的峰强最强,说明碱性氧化铝孔数量最多,又因为3种氧化铝平均孔径相差不大,所以碱性氧化铝的比表面积最大,该结果与BET法计算结果一致。吸附曲线在相对压力p/p0为0.4~0.9处呈现出了比较明显的H4型滞后环,说明孔道形状皆为较匀的狭缝状[11],吸附等温线在压力增大时均走向平直,说明没有大孔存在[12]。
2.2 氧化铝的吸附脱氮性能
2.2.1氧化铝用量对吸附脱氮性能的影响
以上述3种氧化铝为吸附剂,以氮质量分数为1 732 μg/g的模拟油为研究对象,在模拟油体积为15 mL、吸附温度为293 K、吸附时间为40 min的条件下,考察吸附剂用量对氧化铝吸附脱氮性能的影响。吸附剂用量对氧化铝的氮吸附容量的影响如图5所示,对模拟油的氮去除率的影响如图6所示。
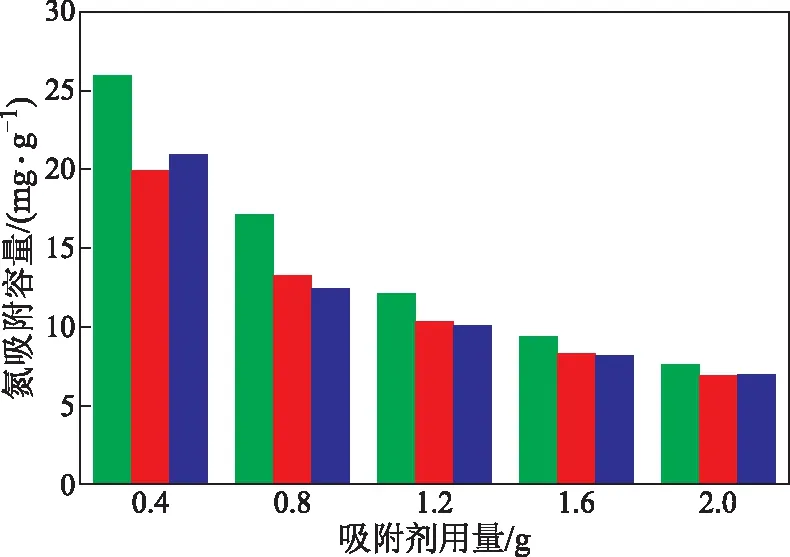
图5 吸附剂用量对氧化铝氮吸附容量的影响■—碱性氧化铝; ■—酸性氧化铝; ■—中性氧化铝
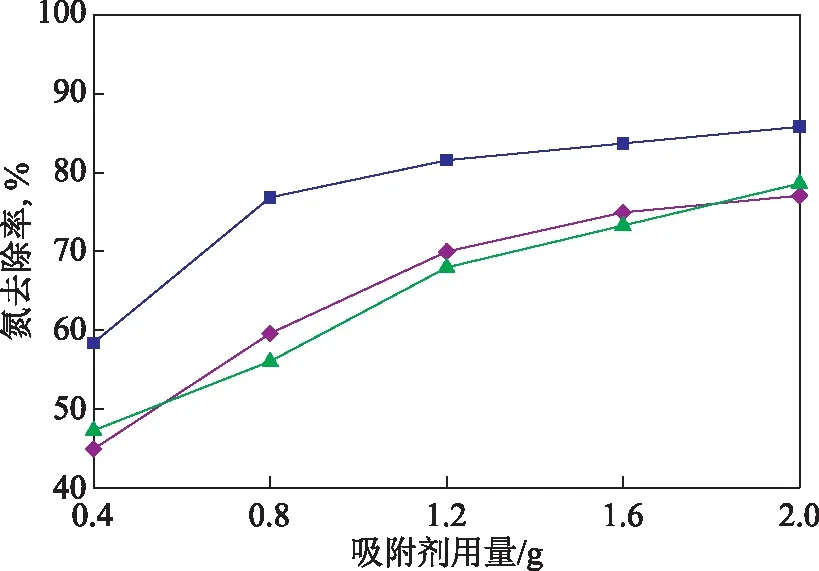
图6 吸附剂用量对模拟油氮去除率的影响■—碱性氧化铝; ◆—酸性氧化铝; ▲—中性氧化铝
由图5和图6可以看出:在不同吸附剂用量下,碱性氧化铝的吸附效果均明显优于酸性氧化铝和中性氧化铝,酸性氧化铝和中性氧化铝对吡啶的吸附脱除效果相近;吸附剂用量越大,3种氧化铝吸附剂对吡啶的脱除效果均越好,但也会使单位质量吸附剂的利用率降低,从而导致3种氧化铝的吸附容量逐渐变小;当吸附剂用量达到1.2 g后,继续增加吸附剂用量,氮去除率继续增大的趋势平缓。故确定优选吸附剂为碱性氧化铝,其最佳用量为1.2 g。比表面积是吸附剂吸附效果的重要影响因素之一,由2.1.2节中3种氧化铝的比表面积的大小关系可见,碱性氧化铝吸附脱除模拟油中吡啶的效果好于其他两种氧化铝的主要原因是其表面积较大。以下以碱性氧化铝为吸附剂进行研究。
2.2.2吸附温度对碱性氧化铝吸附脱氮性能的影响
吸附温度的改变会对氧化铝的吸附脱氮效果产生影响[4]。在模拟油体积为15 mL、吸附用量为1.2 g、吸附时间为40 min的条件下,考察了吸附温度对碱性氧化铝吸附脱氮性能的影响,结果见图7。由图7可知,吸附温度从293 K升高至303 K时,碱性氧化铝的氮去除率和吸附容量都逐渐增加,当温度超过303 K时,氮去除率和吸附容量随着温度的升高逐渐下降并趋于不变。温度从293 K升高至303 K时,温度接近室温,对物理吸附影响较小,但温度的升高为化学吸附提供了所需的活化能,从而使碱性氧化铝对吡啶的吸附性增强。由于温度的升高对物理吸附的脱附过程起促进作用,物理吸附逐渐减弱,所以当温度高于303 K时,随着温度升高吸附效果变差[13]。温度在293 K至313 K时,碱性氧化铝的氮去除率出现较大波动,说明该温度下主要发生物理吸附;当温度超过313 K时去除率几乎不受温度影响,说明此时主要发生化学吸附。综上可知,温度为303 K时碱性氧化铝对模拟油中吡啶的脱除效果最佳,故选择303 K进行后续因素的研究。
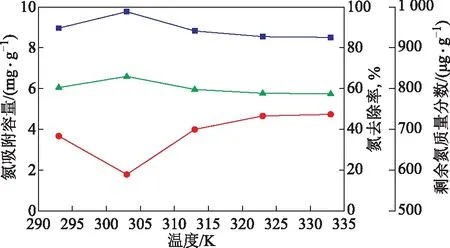
图7 吸附温度对碱性氧化铝吸附脱氮性能的影响▲—氮去除率; ■—吸附容量; ●—剩余氮质量分数
2.2.3吸附时间对碱性氧化铝吸附脱氮性能的影响
在模拟油体积为15 mL、吸附用量为1.2 g、吸附温度为303 K的条件下,考察了吸附时间对碱性氧化铝吸附脱氮性能的影响,结果见图8。由图8可知,吸附初始阶段的浓度推动力较强,吸附速率较快,此时吡啶主要被碱性氧化铝的外表面吸附,碱性氧化铝具有空余的活性位点较多,吡啶经外表面扩散进入吸附剂孔道,再通过颗粒内扩散被活性位点吸附。吸附30 min后,碱性氧化铝活性位点接近饱和,吸附能力逐渐减弱,氮去除率也随之下降并逐渐趋于不变。因此确定30 min为最佳吸附时间。
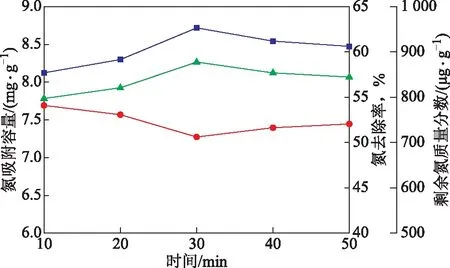
图8 吸附时间对碱性氧化铝吸附脱氮性能的影响▲—氮去除率; ■—吸附容量; ●—剩余氮质量分数
2.3 吸附热力学
Langmuir,Freundlich,Langmuir-Freundlich 3种等温吸附模型是热力学研究中较为常见的模型[14]。Langmuir方程拟合式见式(1),Freundlich方程拟合式见式(2),Langmuir-Freundlich方程拟合式见式(3)。
(1)

(2)
(3)
式中:Qe为达到吸附平衡时吸附剂对氮化物的吸附量(以氮元素计),mg/g;Ce为达到吸附平衡时模拟油的氮质量浓度,mg/L;qm为单分子层吸附的饱和吸附量(以氮元素计),mg/g;KL为亲和系数;KF为经验常数;r1为浓度常数;Ka和r2为经验常数。
在温度分别为303,323,343 K下,用1.2 g碱性氧化铝吸附脱除15 mL氮质量分数不同(分别为400,700,1 000,1 300,1 732,2 532,3 332,4 132,4 932,5 732,8 732,11 732,14 732,17 732,20 732 μg/g)的模拟油中的吡啶,吸附时间为30 min,得到的吸附等温数据和利用Langmuir,Freundlich,Langmuir-Freundlich等温吸附模型拟合的曲线分别见图9和图10。

图9 碱性氧化铝在3个温度下的吸附等温线■—303 K; ◆—323 K; ▲—343 K。图10同

图10 碱性氧化铝吸附模拟油中吡啶的等温吸附模型拟合曲线 —Langmuir拟合; —Freundlich拟合; —Langmuir-Freundlich拟合
由图9可知,随着吡啶初始浓度的增加,碱性氧化铝吸附容量的增量逐渐减小。碱性氧化铝吸附模拟油中吡啶的等温吸附模型的拟合参数见表1。由表1可知:在吸附温度分别为303,323,343 K下,碱性氧化铝吸附吡啶的3种等温吸附模型拟合曲线的决定系数(R2)基本无太大差别,Langmuir-Freundlich混合模型与Langmuir模型的R2几乎相等;当温度为323 K时,Langmuir-Freundlich混合模型的R2最大,故碱性氧化铝对模拟油中吡啶的吸附符合Langmuir-Freundlich混合模型。
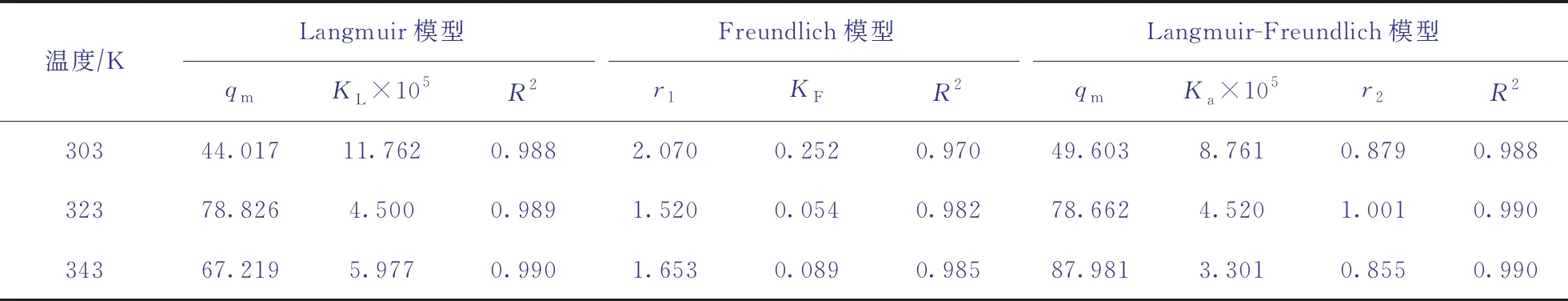
表1 碱性氧化铝吸附模拟油中吡啶的等温吸附模型的拟合参数
由表1还可以看出:Freundlich方程在303,323,343 K下的r1值都大于1,说明吡啶易被碱性氧化铝吸附;Langmuir等温吸附模型在303 K时的亲和系数KL较大,说明当温度高于303 K时,碱性氧化铝在较低温度对低浓度吡啶有较好的脱除效果。这一结果与图7中当温度超过303 K时,随着温度的升高去除率逐渐减小的试验结果相同。
为进一步探究该吸附过程的作用原理,对其热力学进行了研究,碱性氧化铝吸附模拟油中吡啶的热力学分析结果见表2。

表2 碱性氧化铝吸附模拟油中吡啶的热力学分析结果
由表2可知:在温度分别为303,323,343 K下,碱性氧化铝吸附吡啶的ΔG均小于0,其绝对值随着温度的升高而增大,说明该吸附行为可自发进行,且温度越高自发性越强;因为ΔH<0,且|ΔH|<40 kJ/mol,说明该吸附行为属于放热的物理吸附[15];ΔS>0,说明吸附时固液界面的无序性增加。|ΔH|>|TΔS|,所以碱性氧化铝表面的吸附为焓驱动过程,说明温度会影响该吸附过程的吸附效果,温度越高吸附效果越差,与图7中当温度高于303 K时,随着温度升高吸附效果变差的结论相同。
2.4 吸附动力学
为了对该吸附过程的动力学进行研究,试验用1.2 g碱性氧化铝分别在温度303,323,343 K下对氮质量分数为1 732 μg/g的模拟油中的吡啶进行时长递增吸附,所得吸附数据及用如式(4)和式(5)所示的准一级和准二级动力学模型对吸附数据进行拟合的拟合曲线分别见图11和图12。由图11可知:在温度分别为303,323,343K下,吸附初期,主要为碱性氧化铝的外表面对吡啶进行吸附,此时其活性位点空位较多,吸附速率较快;随着吸附过程的进行,吡啶逐渐向吸附剂内部扩散,吡啶主要被碱性氧化铝内表面吸附,扩散阻力增强,浓度推动力逐渐减小,吸附速率变慢;20 min后,吸附达到饱和。
Qt=Qe(1-e-k1t)
(4)
(5)
式中:Qt为吸附时间为t时吸附剂对氮化物的吸附量(以氮元素计),mg/g;k1和k2分别为准一级和准二级动力学模型的速率常数,min-1;t为吸附时间,min。
碱性氧化铝吸附模拟油中吡啶的准一级和准二级动力学模型拟合的相关参数见表3。由表3可知,碱性氧化铝在温度分别为303,323,343 K下吸附吡啶时,其通过准一级动力学方程拟合得到的R2明显大于准二级动力学方程,故该吸附过程更符合准一级动力学模型,说明该吸附过程主要受扩散步骤控制[16]。

图11 碱性氧化铝在不同吸附时间下的吸附数据■—303 K; ◆—323 K; ▲—343 K

图12 碱性氧化铝吸附模拟油中吡啶的准一级和准二级动力学模型的拟合曲线 —准一级动力学模型拟合; —准二级动力学模型拟合

表3 碱性氧化铝吸附模拟油中吡啶的准一级和准二级动力学模型拟合的相关参数
2.5 碱性氧化铝吸附剂的再生
通过对碱性氧化铝吸附吡啶的动力学和热力学的研究可知,该过程为放热的物理吸附过程。因为吡啶易溶于乙醇,所以分别使用高温焙烧和乙醇洗涤的方法对碱性氧化铝进行再生,并在吸附温度为303 K、吸附时间为30 min的条件下考察经两种方法再生的碱性氧化铝用量对吸附脱氮性能的影响。再生方法对碱性氧化铝的氮吸附容量的影响见图13,对碱性氧化铝的再生率和氮去除率的影响见图14。
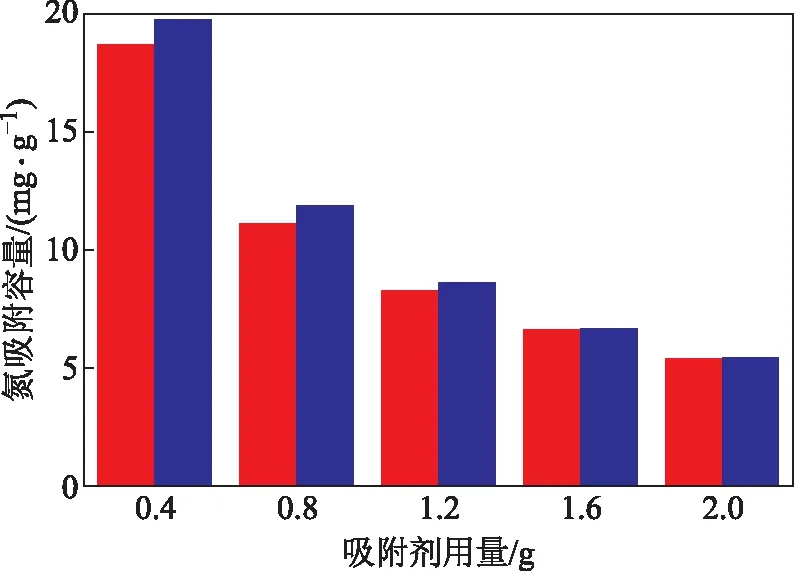
图13 再生方法对碱性氧化铝的氮吸附容量的影响■—乙醇洗涤; ■—高温焙烧
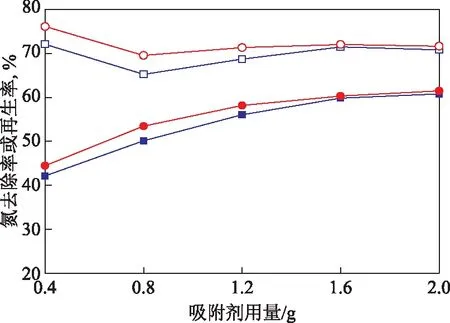
图14 再生方法对碱性氧化铝的再生率和氮去除率的影响■—乙醇洗涤氮去除率; ●—高温焙烧氮去除率; □—乙醇洗涤再生率; ○—高温焙烧再生率
由图13和图14可知,两种方法再生的碱性氧化铝在用量相等时的氮去除率和吸附容量相差不大。当用量超过1.6 g时,两种方法再生的碱性氧化铝对模型油的氮去除率几乎相同。因此,取1.6 g再生后的碱性氧化铝进行对比,经乙醇洗涤后碱性氧化铝的再生率为71.48%,经高温焙烧的再生率为72.04%。通过对比,发现两种再生方法得到的碱性氧化铝的再生率相差不大,且都具有较高的再生率,说明乙醇洗涤与高温焙烧都适用于碱性氧化铝的再生,表明氧化铝作为吸附剂有着较好的再生性能。
3 结 论
(1)相比于酸性和中性氧化铝,碱性氧化铝对模拟油中吡啶的吸附去除效果更好。对15 mL模拟油,当碱性氧化铝用量为1.2 g、温度为303 K、吸附时间为30 min时的吸附脱氮效果最佳。
(2)在温度为323 K下,碱性氧化铝吸附模拟油中吡啶符合Langmuir-Freundlich混合模型,且该吸附行为是可自发进行的放热物理吸附,符合准一级动力学模型。
(3)吸附后的碱性氧化铝经乙醇洗涤的再生率为71.48%,经高温焙烧的再生率为72.04%,说明碱性氧化铝具有良好的再生性能,乙醇洗涤与高温焙烧均适用于碱性氧化铝的再生。
