淡豆豉炮制中黄曲霉毒素产毒株的筛选鉴定和产毒能力测定
2022-03-03李春玲王立元李翠英翁美芝谢小梅
李春玲,贺 婧,王立元,李翠英,龙 凯,翁美芝,冯 驰,谢小梅*
淡豆豉炮制中黄曲霉毒素产毒株的筛选鉴定和产毒能力测定
李春玲1, 4,贺 婧2#,王立元1,李翠英1,龙 凯1,翁美芝1,冯 驰3*,谢小梅1*
1.江西中医药大学,江西 南昌 330004 2.南昌大学转化医学研究院,江西 南昌 330031 3.江西中医药大学附属医院,江西 南昌 330006 4.广州医科大学附属第六医院泌尿外科,广东 清远 511500
对淡豆豉炮制过程中产黄曲霉毒素(aflatoxins,AFTs)的微生物(简称产毒菌)进行筛选鉴定、定量分析和产毒能力测定。运用紫外荧光法初筛淡豆豉炮制中各样本的产毒菌并菌落计数;对初筛菌株的18S rDNA序列进行PCR扩增、测序,测序结果经NCBI同源性比对、MEGA 7.0软件构建系统发育树进行分子生物学鉴定;应用超高效液相色谱-串联质谱法(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)检测各产毒菌培养液中AFTs含量,确定各产毒菌的产毒能力。紫外荧光法结合分子生物学共筛选鉴定出15株产毒菌株,为黄曲霉和溜曲霉;“黄衣上遍”阶段产毒菌菌落数逐渐增多,至发酵第6天时最多,为1×106.30CFU/g,进入“再闷”阶段产毒菌数量逐渐减少,从再闷第9天开始至第15天均未检测到产毒菌;经UPLC-MS/MS法确定15株菌中有5株不产毒,10株产毒,且产毒能力各不相同并均低于5 ng/mL,远低于黄曲霉标准株(654.90 ng/mL)。淡豆豉炮制过程中存在产AFTs能力不同的黄曲霉、溜曲霉且产毒菌数量呈现先升后降,将为探讨淡豆豉炮制中AFTs消长机制奠定基础,并首次从安全性角度证实了淡豆豉“再闷”的重要性和“再闷”时间的合理性。
淡豆豉;炮制过程;黄曲霉毒素;产毒能力;超高效液相色谱-串联质谱技术;黄曲霉;溜曲霉
淡豆豉(SSP)为豆科大豆属植物大豆(L.) Merr.成熟种子的发酵加工品,以黑色种皮品系大豆为主料,桑叶、青蒿为辅料经自然发酵而成。被历代本草和历版《中国药典》收录,列入卫生部首批药食两用名单,其味苦、辛,性凉,归肺、胃经,具有解表、除烦、宣发郁热之功,在心血管疾病、糖尿病、骨质疏松、乳腺癌及女性更年期综合征、抑郁症等重大疾病的预防和控制中有广阔应用前景[1-3]。
黄曲霉毒素(aflatoxins,AFTs)是主要由黄曲霉、寄生曲霉、溜曲霉等曲霉产生的一类化学结构相似的次生代谢产物,目前发现AFTs有20多种,主要有黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2),其中以AFB1毒性最强。研究表明,人和牲畜长期暴露于AFTs会导致其免疫抑制、营养代谢不良、不孕、先天畸形、内分泌紊乱以及严重的肝细胞癌变等,并不是所有的黄曲霉、溜曲霉都产生AFTs,产毒黄曲霉占自然界中黄曲霉的30%~60%,非产毒黄曲霉常作为曲种应用于食品、中药等发酵工业中[4-5]。
淡豆豉炮制时间较长,一般20 d左右,经过“黄衣上遍”和“再闷”2个主要阶段,在完全开放的炮制中每个过程都有可能污染黄曲霉、溜曲霉并产生AFTs。本课题组前期已发现在淡豆豉炮制中AFTs含量呈动态变化,并存在黄曲霉和溜曲霉[6-8],但未对它们是否产毒及产毒能力进行研究,迄今仍无淡豆豉炮制中AFTs产毒菌的相关研究报道。本研究对淡豆豉炮制中7个不同时间点样本的产AFTs微生物进行筛选鉴定、菌落计数和产AFTs能力测定。研究结果将为揭示淡豆豉炮制过程中AFTs消长机制奠定基础,并对规范淡豆豉炮制工艺和保障其安全性有重要意义。
1 仪器与材料
1.1 仪器
MJ-150Ⅰ霉菌培养箱,上海一恒科技有限公司;PTC-200普通PCR仪,BIO-RAD公司;Nexera X2超快速液相色谱仪,日本岛津公司;AB Sciex QTRAP 4500三重四极杆线性离子肼串联质谱仪,美国AB Sciex公司。
1.2 材料
1.2.1 实验菌株 产毒黄曲霉标准株,购于中国普通微生物菌种保藏中心,编号CGMCC3.4408。
1.2.2 试剂 曲霉素琼脂培养基,批号20191026,青岛高科技海博生物技术有限公司;AFTs混合对照品(AFB1、AFB2、AFG1、AFG2),批号CRM46300,质量浓度分别为1.0、0.3、1.0、0.3 μg/mL,质量分数≥98.0%,Supelco公司;植物基因组DNA提取试剂盒、2×Taq PCR master Mix,批号Cat#DP305- 02、Cat.CW0632S,北京天根生化科技有限公司;2,6-二甲基-β-环糊精(批号402G021)、琼脂糖(批号1209B022),索莱宝生物科技有限公司;Hypersil Gold(100 mm×2.1 mm,1.7 μm),赛默飞世尔科技有限公司;甲醇、乙腈,批号2003191、20022221,上海易恩化学技术有限公司。
2 方法与结果
2.1 淡豆豉炮制过程中各时间点样本制备和取样
本课题组前期参照《中国药典》2010年版已建立规范的淡豆豉炮制工艺(历版《中国药典》记载的淡豆豉制法相同,含2020年版)[6-9]。淡豆豉炮制过程中每3天取样1次,“黄衣上遍”阶段分别记为发酵初始、发酵3 d、发酵6 d,“再闷”阶段分别记为再闷3 d、再闷6 d、再闷9 d、再闷12 d、再闷15 d和蒸后成品,编号分别为F0、F3、F6、Z3、Z6、Z9、Z12、Z15、SSP。成品性状和各项理化指标均符合《中国药典》2020年版要求。各样品尽快置于4 ℃保存,1周内完成检测。
2.2 淡豆豉炮制过程中AFTs产毒菌的筛选、菌落计数
2.2.1 含2,6-二甲基-β-环糊精的曲霉素琼脂培养基的配制 45.6 g曲霉素琼脂培养基加入2,6-二甲基- β-环糊精6 g,置1000 mL蒸馏水中加热溶解,121 ℃灭菌20 min。
2.2.2 AFTs产毒菌的筛选和菌落计数 整个过程无菌操作。定量称取淡豆豉炮制过程中不同时间点样本,研磨,取研磨后的各样品1 g加9 mL无菌生理盐水制成1∶10的稀释液,充分振荡30 min,取1 mL稀释液加入另1支装有9 mL无菌生理盐水的离心管中,依次进行10倍稀释,使之分别成为0.1、0.01、0.001、1×10−4、1×10−5、1×10−6、1×10−7稀释液,依据培养平板上的菌落数(肉眼可计数范围),选择合适的3个不同浓度稀释液,F3、Z3、Z6选择0.001、1×10−4、1×10−5稀释液,F6选择1×10−4、1×10−5、1×10−6稀释液,Z9、Z12、Z15选择0.1、0.01、0.001稀释液,分别吸取100 μL稀释液注入含2,6-二甲基-β-环糊精的曲霉素琼脂培养基平皿中,用涂布棒涂布均匀,每个稀释度重复3个平皿。于28 ℃霉菌培养箱培养5~8 d。
将长出菌落的平皿置紫外灯(波长365 nm)下观察,如菌落周围的培养基中出现蓝紫色或黄绿色荧光初步定为AFTs产毒菌,对产生蓝紫色或黄绿色荧光的菌落进行计数,挑取产荧光菌落再次划线分离、纯培养。用液体石蜡斜面保存初筛产毒菌株并编号,如在“黄衣上遍”阶段第3天初筛到的产毒菌株编号为F3-1、F3-2、F3-3等,第6天初筛到的产毒菌株编号为F6-1、F6-2、F6-3等;在“再闷”阶段第3天初筛到的产毒菌株编号为Z3-1、Z3-2、Z3-3等,第6天初筛到的产毒菌株编号为Z6-1、Z6-2、Z6-3等。
2.2.3 淡豆豉炮制中各样本产荧光菌的菌落计数结果 炮制过程中产荧光的菌落数呈现先上升后下降的趋势,“黄衣上遍”阶段的发酵第6天时(F6)菌落数最多,达1×106.30CFU/g,之后产荧光菌落数逐渐减少,至再闷第9天后已没有产荧光菌,表明产毒菌数量随炮制过程中生存环境的改变发生规律性变化;且都是蓝紫色荧光的菌落,可见产毒菌产生的AFTs以AFB1或AFB2为主,各菌产AFTs的种类和含量还需用UPLC-MS/MS法验证,结果见表1和图1。
2.3 产AFTs菌株的鉴定
按植物基因组DNA提取试剂盒说明书提取各菌株DNA,用18S rDNA通用引物ITS1/ITS4进行扩增,引物序列为ITS1:5’-CTTGGTCATTTAGAG- GAAGTAA-3’,ITS4:5’-TCCTCCGCTTATTGATAT- GC-3’。PCR反应体系:模板DNA 2 μL,上下游引物各1 μL(浓度10 μmol/L),2×Taq PCR master Mix 12.5 μL,补充ddH2O至25 μL。反应程序:94 ℃、1 min;94 ℃、30 s,56 ℃、30 s,72 ℃、1 min,
30个循环;72 ℃、10 min。扩增产物用1%琼脂糖凝胶电泳,将PCR产物送测序公司测序。测序结果在NCBI网站上比对、下载同源性高的序列及模式菌株的序列在MEGA 7.0软件上建系统发育树。

表1 淡豆豉炮制过程中不同时间点样本中产荧光的菌落数
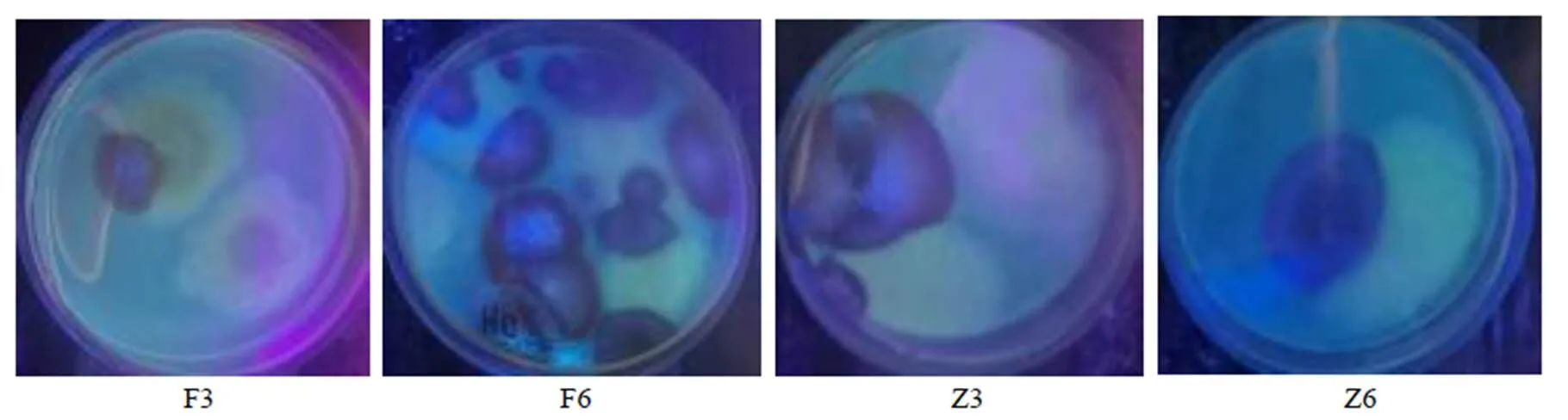
图1 各样本培养皿中产生荧光现象的菌落
扩增产物经测序、测序结果提交至NCBI的 GenBank数据中进行Blast比对发现,F6-1、F6-2、F6-3、F6-4、F6-5、F6-6、F3-1、Z6-1、Z3-2、Z3-5与黄曲霉的同源性达100%,Z3-1、Z3-3、Z3-4、Z3-6、Z3-7与溜曲霉的同源性达100%。选取同源性较高的模式菌株序列,采用MEGA 7软件中的NJ法构建系统发育树,F6-1、F6-2、F6-3、F6-4、F6-5、F6-6、F3-1、Z6-1、Z3-2、Z3-5与黄曲霉聚于一支,亲缘关系最近,鉴定为黄曲霉;Z3-1、Z3-3、Z3-4、Z3-6、Z3-7与溜曲霉聚于一支,亲缘关系最近,鉴定为溜曲霉。“黄衣上遍”阶段中发酵第3、6天为黄曲霉,“再闷”阶段为黄曲霉和溜曲霉,可见淡豆豉炮制过程中产AFTs菌以黄曲霉和溜曲霉为主。见表2和图2。
2.4 UPLC-MS/MS法测定产毒菌的产AFTs能力
2.4.1 色谱条件 Hypersil Gold(100 mm×2.1 mm,3 μm);柱温25 ℃;流动相为0.1%甲酸水溶液-乙腈;梯度洗脱:0~1.0 min,35%乙腈;1.0~2.5 min,35%~50%乙腈;2.5~3.0 min,50%~80%乙腈;3.0~3.1 min,80%~35%乙腈;3.1~5.0 min,35%乙腈;体积流量0.2 mL/min;进样量2 μL。
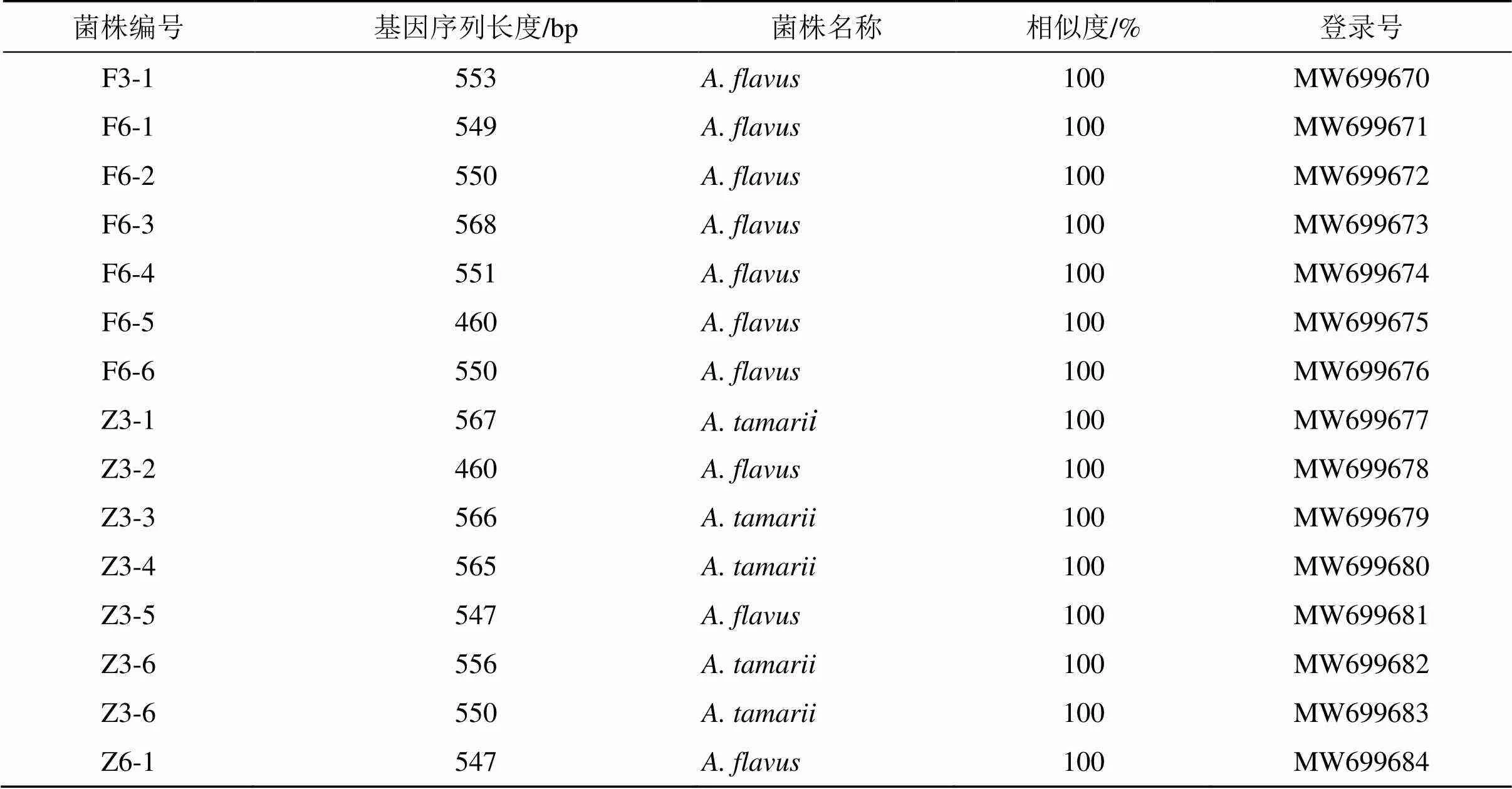
表2 产荧光现象微生物NCBI基因序列比对结果

图2 产荧光现象的曲霉菌系统发育树
2.4.2 质谱条件 电喷雾离子源(electrospray ionization,ESI),正离子模式;离子喷射电压(ion spray voltage,IS)4.5 kV;离子源温度(ion source temperature,TEM)500 ℃;雾化气(nebulizer gas,GS1)压力310.264 kPa(45 psi),加热气(heater gas,GS2)压力344.738 kPa(50 psi),气帘气体(curtain gas,N2),压力241.316 kPa(35 psi)。扫描方式为多重反应监测(multiple reaction monitoring,MRM)。4种黄曲霉毒素质谱分析参数见表3。

表3 4种AFTs的其他质谱分析参数
2.4.3 对照品溶液的制备 精密吸取AFTs混合对照品(AFB1、AFB2、AFG1、AFG2质量浓度分别为1.0、0.3、1.0、0.3 μg/mL)溶液0.5 mL 于1 mL棕色量瓶中,用甲醇稀释至刻度,作为储备液,于−20 ℃冰箱避光保存,备用。
2.4.4 供试品溶液的制备 将保存的产毒菌和黄曲霉标准株分别进行活化,28 ℃培养5 d,加入适量的无菌生理盐水洗脱孢子,无菌纱布滤过以滤除菌丝球,得到孢子悬浮液,血球计数板计数,调整孢子浓度为1×106.59CFU/mL。吸取2 mL 1×106.59CFU/mL各曲霉孢子悬浮液于25 mL液体发酵培养基中,置28 ℃、120 r/min摇床中培养5 d。分别吸取1.5 mL发酵液于2 mL离心管中,10 000×离心10 min,取1 mL各发酵上清液用氮气吹至近干,加甲醇复溶,12 000×离心10 min,取上清液经0.22 μm滤膜滤过,上机测定。
2.4.5 线性关系考察 从储备液中精密吸取0.1 mL于1 mL量瓶中,加甲醇稀释至刻度,作为工作液。精密量取工作液,用甲醇稀释成建立标准曲线所用系列质量浓度的对照品溶液,混匀,上机测定。将质量浓度作为横坐标(),各质量浓度对应的峰面积作纵坐标(),AFB1的标准曲线方程为=35 783+12 495,=0.999 6;AFB2的标准曲线方程为=38 106+3 381.7,=0.999 6;AFG1的标准曲线方程为=22 839+7 820.1,=0.999 5;AFG2的标准曲线方程为=9 212.8+1 372.9,=0.999 6。AFB1、AFG1在0.80~25.60 ng/mL线性关系良好,AFB2、AFG2在0.24~7.68 ng/mL线性关系良好。
2.4.6 精密度考察 配制AFTs混合对照品溶液(AFB1和AFG1质量浓度为5 ng/mL,AFB2和AFG2质量浓度为1.5 ng/mL),按“2.4.1”“2.4.2”项条件,连续重复进样6次,计算峰面积,结果AFB1、AFB2、AFG1、AFG2峰面积的RSD分别为1.58%、2.51%、1.07%、1.27%,表明仪器精密度良好。
2.4.7 稳定性考察 取无菌发酵液1份,加AFT混合对照品(AFB1和AFG1加入量为5 ng/mL,AFB2和AFG2加入量为1.5 ng/mL),按“2.4.4”项方法制备供试品溶液,按“2.4.1”“2.4.2”项条件,分别于0、4、8、12、16、20、24 h测定,以4种AFT含量来计算,RSD分别为1.64%、2.66%、1.16%、2.57%,表明供试品溶液在24 h内稳定性良好。
2.4.8 重复性考察 平行取无菌发酵液6份,精密加AFTs混合对照品(AFB1、AFG1为5 ng/mL,AFB2、AFG2为1.5 ng/mL)溶液,按“2.4.4”项方法制备供试品溶液,按“2.4.1”“2.4.2”项条件,分别进样2 μL进行测定,以4种AFTs质量分数来计算。AFB1、AFB2、AFG1、AFG2的RSD分别为2.08%、3.50%、1.18%、1.66%,表明该方法重复性良好。
2.4.9 加样回收率考察 平行取无菌发酵液6份,分别精密加入低、高2种质量浓度的AFTs混合对照品溶液(AFB1和AFG1分别添加2、5 ng/mL 2种质量浓度,AFB2和AFG2分别添加0.6、1.5 ng/mL 2种质量浓度),每种质量浓度各3份,按“2.4.4”项方法制备供试品溶液,按“2.4.1”“2.4.2”项条件测定,计算加样回收率,4种AFTs的加样回收率介于91.47%~94.87%,RSD在1.01%~2.47%。
2.4.10 各菌产AFTs能力 按“2.4.4”项方法制备供试品溶液,按“2.4.1”“2.4.2”项条件测定,计算各菌产AFTs的能力,结果表明有5株菌不产AFTs,其中3株为黄曲霉,2株为溜曲霉;有10株菌产AFTs,但它们产毒能力各不相同,均在5 ng/mL以下,远低于黄曲霉标准株(CGMCC3.4408)的产毒量(654.90 ng/mL),产毒菌仅产AFB1。结果见表4和图3,可见初筛的产毒菌其产毒能力各不相同。本实验初筛的15株产荧光菌经UPLC-MS/MS验证有5株菌未检测出AFTs。

表4 各菌产AFB1能力
3 讨论
检测产AFT微生物目前有免疫学方法、化学方法和生物学方法。本实验采用紫外荧光法初筛产毒菌。根据AFT在紫外光照射下可发出荧光的原理,将各样本接种于曲霉素琼脂培养基中,培养5~8 d,黄曲霉等菌产生的AFT便浸入培养基中,在紫外灯光照射下会产生特殊的荧光,AFB1、AFB2发蓝紫色荧光,AFG1、AFG2发绿色荧光。本实验在培养基加入了可增强荧光强度的化学物质环糊精,可提高辨识度。此法操作较简单、便捷,且成本低[4],可快速检测出大批量样品中是否有产AFTs的菌株。
通过紫外荧光检测法对7个不同炮制时间点样本中的产AFTs菌进行初筛并计数,结果显示产荧光现象的微生物数量在淡豆豉炮制过程中呈现先上升后下降的趋势,“黄衣上遍”阶段产荧光菌落数逐渐增加,至发酵第6天时(F6)达到最大值,为 1×106.30CFU/g,之后开始下降,至“再闷”第9天(Z9)后未检测到产荧光微生物。呈现这一趋势的原因可能是淡豆豉炮制过程中有多种微生物共同参与,不同炮制时间点存在不同的优势菌[6-8,10]。已有许多文献报道一些细菌和真菌具有抑制产AFTs菌生长繁殖的作用[11-13]。
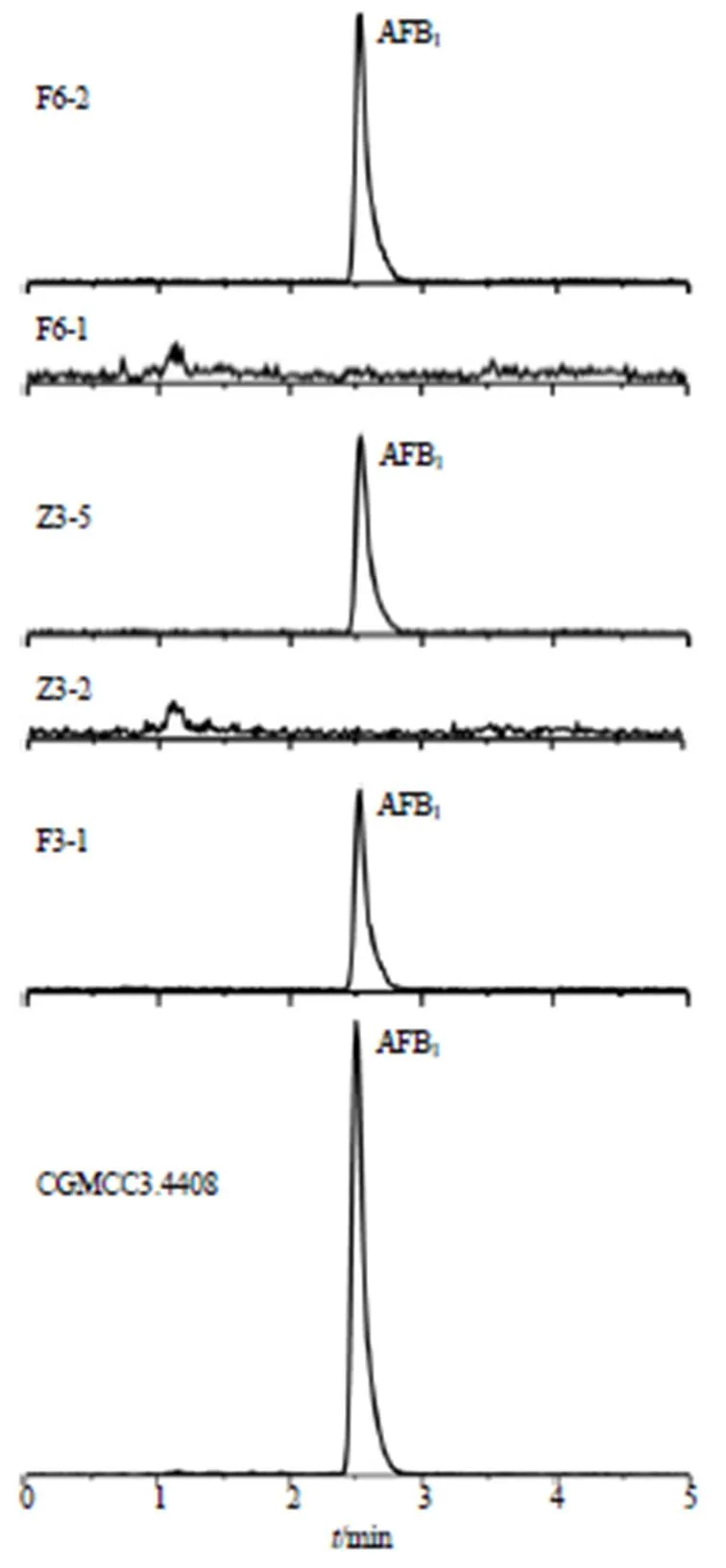
图3 各菌产AFB1能力液质色谱图
本实验室前期从淡豆豉炮制过程中分离的枯草芽孢杆菌、鲑色锁掷酵母菌、黑曲霉菌、屎肠球菌、鸟肠球菌对产AFTs黄曲霉的生长繁殖均有抑制作用,并对AFB1有降解作用,其中屎肠球菌、鸟肠球菌和枯草芽胞杆菌对产毒黄曲霉菌的抑制率均达30%以上,鲑色锁掷酵母菌对产毒黄曲霉菌生长抑制作用最强达64.29%,降解AFB1效果最好,达43.65%[10]。
紫外荧光法检测中发现只出现了产蓝紫色荧光的菌落,未出现产绿色荧光的菌落,推测在淡豆豉炮制过程中存在的产毒菌以产生AFB1或AFB2为主,而使用UPLC-MS/MS法检测初筛产毒菌的产毒能力的结果显示,筛选到的产毒菌只产生AFB1,这与AFB1在自然界中产量最高、分布最广泛相一致。通过紫外荧光法对产AFTs菌进行初筛,共筛选出15株菌,并鉴定为黄曲霉和溜曲霉,其中黄曲霉占大多数,与自然界产AFTs菌中以黄曲霉为主相吻合。因此,在淡豆豉AFTs污染防控上,可以以筛选抑制黄曲霉生长繁殖和降解AFB1的菌株为主。
本研究通过UPLC-MS/MS法检测初筛产毒菌的产毒能力,结果显示,15株初筛产毒菌中,有5株未检测到产AFTs,表明通过紫外荧光法初筛的产AFTs菌可能会出现错判,更精确的判断和定量还需要使用更精密的仪器检测,如液质联用技术等,紫外荧光检测法适合于大批量筛除非AFTs产毒菌。另外的10株产毒菌的产毒能力各不相同,均在5 ng/mL以下,远低于黄曲霉标准株CGMCC3.4408的产毒量654.90 ng/mL。各菌株产毒能力的不同,可能与它们的自身生理特性或不同的炮制环境等因素有关,这些因素会导致产毒相关基因突变和表达,AFTs生物合成至少包括21步酶促反应,有30多个基因共同参加[14]。研究发现,黄曲霉产毒基因簇有大片段基因缺少、重排等多种变异形式,使产毒能力降低或失去产毒能力[15-17]。本实验室后期将从生理生化和分子生物学等层面进一步研究它们的产毒或不产毒机制,为淡豆豉炮制过程中AFTs的防控提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S].一部. 2020: 342-343.
[2] 陈青峰, 贺婧, 谢小梅, 等.淡豆豉炮制中γ-氨基丁酸含量测定及其抗抑郁作用研究 [J].药物评价研究, 2021, 44(4): 688-694.
[3] 林王敏, 翁倩倩, 邓爱平, 等.淡豆豉的发酵工艺沿革及过程控制概述 [J].中国实验方剂学杂志, 2021, 27(11): 222-232.
[4] 孙素群.食品毒理学 [M].武汉: 武汉理工大学出版社, 2017: 202-203.
[5] 邢福国, 李旭, 张晨曦.黄曲霉毒素的产生机制及污染防控策略[J].食品科学技术学报, 2021, 39(1): 13-26,64.
[6] 熊京京, 任佳秀, 周姝含, 等.淡豆豉炮制过程中产γ-氨基丁酸微生物的筛选和鉴定 [J].中国中药杂志, 2019, 44(11): 2266-2273.
[7] 朱海针, 龙凯, 梁永红, 等.Biolog技术监测淡豆豉发酵炮制过程中微生物种类动态变化 [J].中国实验方剂学杂志, 2015, 21(17): 14-17.
[8] 朱海针, 谢卫华, 龙凯, 等.PCR-DGGE技术研究淡豆豉炮制过程中微生物菌群的动态变化 [J].中草药, 2017, 48(9): 1757-1765.
[9] 李刚, 梁永红, 龙凯, 等.再闷过程影响淡豆豉炮制工艺研究 [J].中草药, 2014, 45(8): 1083-1088.
[10] 李春玲, 贺婧, 王立元, 等.淡豆豉炮制过程中拮抗菌对黄曲霉毒素B1的拮抗能力考察 [J].中草药, 2021, 52(12): 3544-3551.
[11] 彭漪, 杨继鸿, 梁凤英, 等.豆瓣酱产毒黄曲霉高效拮抗菌筛选鉴定 [J].中国调味品, 2018, 43(2): 58-63.
[12] 饶胜其, 陈素雅, 高璐, 等.一株黄曲霉拮抗细菌F1的筛选、鉴定及其抑菌特性 [J].现代食品科技, 2015, 31(12): 99-105.
[13] Zhao Y, Zhang C, Folly Y M E,.Morphological and transcriptomic analysis of the inhibitory effects ofongrowth and aflatoxin production [J]., 2019, 11(11): 636.
[14] Caceres I, Khoury A A, Khoury R E,.Aflatoxin biosynthesis and genetic regulation: A review [J]., 2020, 12(3): 150.
[15] Bhatnagar D, Ehrlich K C, Cleveland T E.Molecular genetic analysis and regulation of aflatoxin biosynthesis [J]., 2003, 61(2): 83-93.
[16] Wei D D, Zhou L, Selvaraj J N,.Molecular characterization of atoxigenicisolates collected in China [J]., 2014, 52(7): 559-565.
[17] Donner M, Atehnkeng J, Sikora R A,.Molecular characterization of atoxigenic strains for biological control of aflatoxins in Nigeria [J].:, 2010, 27(5): 576-590.
Screening, identification and toxin-producing ability analysis of aflatoxin-producing strains in processing of
LI Chun-ling1, 4, HE Jing2, WANG Li-yuan1, LI Cui-ying1, LONG Kai1, WENG Mei-zhi1, FENG Chi3, XIE Xiao-mei1
1.Jiangxi University of Chinese Medicine, Nanchang 330004, China 2.Institute of Translational Medicine, Nanchang University, Nanchang 330031, China 3.The Affiliated Hospital of Jiangxi University of Chinese Medicine, Nanchang 330006, China 4.Department of Urology, The Sixth Affiliated Hospital of Guangzhou Medical University, Qingyuan 511500, China
Aflatoxins (AFTs) producing strains (referred to as toxin-producing microorganism) during the processing of(SSP) were screened, identified, quantitatively analyzed, and tested for their toxin-producing ability.Preliminary screening of various toxin-producing microorganism in SSP processing by ultraviolet fluorescence method, then count the colonies; Analyse the 18S rDNA of those strains by PCR amplification and sequencing.The sequences are compared by NCBI homology, and the phylogenetic tree be constructed by MEGA 7.0 for molecular biology identification; Ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) were used to detect the AFTs content in the culture solution of each strain to determine their toxin-producing ability.Fifteen toxin-producing strains were screened and identified by ultraviolet fluorescence & molecular biology analyze, which wereor; During the processing of SSP, the toxin-producing microorganism gradually increased during the ‘yellow cladding’ stage, and it became the maximum at the 6th day, which was 1×106.30CFU/g, then it gradually decreased in the ‘secondary fermentation’ stage, even no toxin-producing strains be found during day 9 to day 15; With UPLC-MS/MS, we found that five strains did not produce toxin, 10 strains produced toxin.Though they can make toxin, all the toxin the microorganism made below 5 ng/mL.It’s much lower thanstandard strain (654.90 ng/mL).In the processing of SSP, someandwith different toxin-producing ability were found, and these strains increased at first and decreased later.This study will lay the foundation for studying the law and mechanism of AFTs content changing in SSP processing.It also proved the importance of 'secondary fermentation' and the rationality of 'secondary fermentation' time, from the perspective of safety for the first time.
; processing; aflatoxins; toxin production capacity; ultra performance liquid chromatography-tandem mass spectrometry;;
R283.6
A
0253 - 2670(2022)05 - 1411 - 07
10.7501/j.issn.0253-2670.2022.05.016
2021-08-24
国家自然科学基金项目(82060709);国家自然科学基金项目(81660664);江西省重点研发计划一般项目(20192BBGL70051);江西省教育厅科技研究项目(GJJ190634);江西省科技计划项目(20203BAAW208025)
李春玲(1994—),女,广西桂平人,实习研究员,硕士,从事泌尿系统疾病防治研究。Tel: 19970044053 E-mail: 2084073573@qq.com
通信作者:谢小梅(1964—),女,江西永新人,教授,博士,研究生导师,从事微生物学研究。Tel: (0791)87118707 E-mail: jxxm1964@sina.com
冯 驰(1981—),男,江苏常州人,主治医师,硕士,从事泌尿外科临床工作。Tel: 13970006959 E-mail: 306583866@qq.com
#并列第一作者:贺 婧(1990—),女,江西南昌人,讲师,博士,从事微生物学研究。Tel: 15972204520 E-mail: 876401812@qq.com
[责任编辑 郑礼胜]
