两种磷素水平下小麦苗期对干旱胁迫的离子组和代谢组响应
2022-02-24李刚白阳贾子颖马正阳张祥池李春艳李诚
李刚,白阳,贾子颖,马正阳,张祥池,李春艳,李诚
石河子大学农学院/新疆生产建设兵团绿洲生态农业重点实验室,新疆石河子 832000
0 引言
【研究意义】小麦(Triticum aestivum L.)是主要的粮食作物,世界上约70%的小麦种植于干旱或半干旱区[1]。干旱造成的作物产量降低可能超过其他不利因素所导致的产量减少的总和。因此,在旱作农业中,植物营养最主要的目的是解决在水分胁迫条件下怎样合理使用肥料,提高作物对水分的利用率[2-3]。【前人研究进展】磷是小麦生长发育过程中必需的营养元素之一。磷营养和水分胁迫有显著的交互作用且影响结果不一致。庞春花等[4]认为在相同施磷水平下,作物的最大根长与根系总长在中度干旱可达到最大值,在低磷水平下,根系表面积在中度干旱大于正常灌水,表明低磷条件下,中度干旱有利于根系表面积的增大,以此吸收更多的水分及养分。张岁岐等[5]则认为,在土壤干旱条件下,适量施用磷肥可以显著改善植株水分状况,提高植物细胞膜稳定性,保持植株生长以及生理过程的正常进行。因此,不同磷肥水平施用对植物水分胁迫响应的影响亟需进行相关研究。根系是小麦吸收水分和矿质营养的主要器官,又是物质合成和转化的器官,因此根系的生长发育状况和活力直接影响小麦地上部分的生长[6]。研究表明,在缺磷环境中,根系对磷素的吸收能力往往是通过对根系的适应性反应来体现的[7]。磷在土壤中的扩散距离只有 1—2 mm,对于缺磷土壤扩散更加缓慢,而大部分作物仅可吸收距根表面1—4 mm的磷素,并且磷素在土壤中的扩散系数很低,当作物在高磷条件下可抵消根系对磷吸收的差异,当作物缺磷时,作物根系发育增强,增大吸收面积,以寻求更多磷素供作物正常生长[8-9]。同时也有研究表明,施磷可促进小麦次生根根毛的生长及根系直径增大,适当降低土壤水分并提高磷素含量有助于根系形态的发展[6]。李万春[10]对冬小麦水氮磷耦合的研究表明,干旱胁迫可以提高小麦的根系活力,从而提高小麦的水分调节特性。张岁岐等[5]研究表明,磷素对作物的生长有显著促进作用,一定程度上可以补偿干旱带来的不利影响。研究表明,细胞程序性死亡是研究作物抗性及其机理的重要手段[11],当作物遭到逆境胁迫时会加速细胞的衰亡,加剧细胞程序性死亡进程,细胞基因组 DNA降解,出现片段化[12]。近年来,代谢组学正迅速成为基因功能注释的关键工具,有助于全面理解细胞对生物条件变化的反应。在小麦中,已有研究分析了代谢物对盐胁迫[13]、温度[14]和干旱胁迫[15]的响应。作物对干旱胁迫的反应涉及的代谢途径包括光合作用、糖代谢、三羧酸循环、糖酵解及激素合成等[16-18]。代谢溶质,如脯氨酸、甜菜碱、果糖和蔗糖,有助于抗旱性的提高[19-21]。然而,有关磷和干旱胁迫相关的代谢组分的研究报道较少。干旱胁迫对植物代谢有诸多影响,如生长抑制、含水量降低、光合作用和呼吸速率降低、各种酶活性变化、生物大分子损伤、蛋白质降解、大量细胞内容物外渗等[22]。而所有这些过程都与金属离子密切相关[23],例如,Cu参与植物光合作用、电子传递、蛋白质合成等代谢活动并且是作物生长发育必需的微量营养元素[24],Mg参与植物酶活化、光合作用、N代谢、活性氧代谢等[25],Na+/K+含量的多少将会影响细胞内离子区隔化,影响细胞质和液泡内离子平衡,最后干扰酶促反应,使代谢紊乱[26]。并且该部分矿质营养元素是细胞结构物质重要的组成成分,参与调节部分酶的活动,并起到电化学作用。植物体内的离子平衡对维持作物的正常生长发育起着重要的作用,而离子平衡失调会阻碍植物的正常生长。因此,研究金属离子在干旱条件下的吸收、运输和分布,对于研究植物的干旱损伤机理以及金属离子在干旱损伤中的作用,提高作物的抗逆性具有重要意义。K可使得小麦的气孔密度增加,保卫细胞长度减小,宽度增加,提高小麦的水分利用效率,因此K在干旱胁迫下对水肥的高效利用有重要意义[27]。正常水分条件下生长的小麦幼苗叶绿体中含有少量的Ca2+,随着水分胁迫时间的延长,叶绿体中游离Ca2+含量逐渐增加,叶绿体超微结构损伤加剧。复水后,叶绿体中游离Ca2+含量逐渐降低,叶绿体结构逐渐恢复正常[15,28]。然而,关于冬小麦在磷和干旱复合胁迫下离子变化的研究却很少。【本研究切入点】新疆小麦生产面临干旱胁迫和土壤磷素缺乏的问题,大量施用磷肥已成为缓解土壤磷素胁迫、实现小麦高产稳产的重要措施之一。虽然,不同磷素供应下小麦应对干旱胁迫的适应性机制已有相关报道,但从组学的角度全面解析的研究却鲜见报道。【拟解决的关键问题】本研究选用新疆冬小麦主栽品种新冬23号为参试材料,解析两种磷素供应下小麦根系对干旱胁迫的适应性机制。研究结果将为揭示小麦水磷互作机制及培育抗逆、磷高效的小麦品种提供理论基础。
1 材料与方法
1.1 试验材料及设计
试验材料选用新疆主栽的冬小麦品种新冬 23号。种子由石河子大学麦类作物研究所提供。选取籽粒饱满度一致的小麦种子,用0.1%氯化汞溶液消毒15 min,蒸馏水漂洗3次,每次5 min,用滤纸吸干附着水。将种子均匀摆放在铺两层滤纸的灭菌发芽盒中,每盒种50粒,20℃暗培养。每天用蒸馏水浇灌,保持湿润。
试验于2020年6—9月在石河子大学农学院冬麦课题组实验室进行,当幼苗长到一叶一心时(约7 d,从播种开始算起),选择生长良好且一致的幼苗移入黑色塑料培养箱中进行水培试验。每箱含有相同容量的Hoagland营养液,常规磷水平为1.0 mmol·L-1(CP),低磷水平为0.05 mmol·L-1(LP)。在低磷条件下,用氯化钾代替部分磷酸二氢钾。在光照培养箱中培养,光照18 h,温度25℃;暗培养6 h,温度20℃。培养14 d后,分别移入含有15%(w/v)PEG-6000配制的CP和LP的Hoagland营养液中模拟干旱胁迫。干旱胁迫 7 d后,分别用不含 PEG-6000的两种磷水平Hoagland营养液复水3 d。由于胁迫对植物的伤害在复水后才可显现出来,因此,分别于干旱胁迫0、3、5、7 d和复水3 d取样观察根的生长情况并扫描拍照。
1.2 测定项目与方法
1.2.1 根系形态的扫描 用蒸馏水冲洗根样品,并用滤纸吸干表面水。为避免重叠,将根部完全展开。使用根系扫描仪(Wanshen LS-A,Phantom 9850XL PLUS,中国)进行根系相关数据的采集,具体使用方法参照仪器说明。采用 WinRHIZO-PRO2009软件对平均根直径和根系总体积进行分析。
1.2.2 根冠比的测定 植株鲜样经105℃杀青10 min,80°C烘干至恒重,分别测定小麦植株地上部分干重和根干重,计算其根冠比。
1.2.3 叶绿素含量的测定 取不同时期的小麦叶片剪成碎片,分别称取0.2 g,用95%乙醇,通过研磨和浸泡法提取叶绿素,以95%乙醇提取的样品作为对照。于波长649 nm、665 nm的分光光度计中分别测定其吸光度值,最后计算叶绿素浓度。Ca= 13.95A665-6.88A649;Cb=24.96A649-7.32A665;叶绿素含量=Ca+Cb。具体参照MAMRUTHA等[29]的方法。
1.2.4 根系DNA含量的测定 DNA含量测定参考朱广廉[30]的方法,称取 0.5g样品,用 CTAB法提取总DNA,并用紫外分光光度计测定DNA的含量。
1.2.5 离子组变化的测定 随机采集CP和LP处理长势均匀的幼苗(设5个生物学重复),分离地上部和根部,采用安捷伦等离子发射光谱仪(Agilent,ICP-OES-710,USA)进行元素含量分析。测定方法如下:测定元素标准溶液(1 000 μg·mL-1),用2%硝酸稀释,制备标准曲线。准确称取0.1 g干燥样品置于聚四氟乙烯烧杯中,添加10 mL硝酸。将混合物在热板上加热12 h,然后在150℃消化至剩余液为2—3 mL,将冷却后的剩余液转移至20 mL容量瓶中,用2%硝酸定容。同时进行空白试验。钙(Ca)、镁(Mg)、铁(Fe)、锰(Zn)、铜(Cu)、锌(Zn)、钠(Na)、硅(Si)、钾(K)和硫(S)含量采用硝酸-高氯酸消煮-ICP测定;磷(P)采用硫酸-双氧水消煮一钼锑抗比色法测定[31]。
1.2.6 代谢组测定 将小麦根系样品在 4℃冰箱中进行解冻,每个样品各取100 µL加入EP管中,并加入-20℃预冷的异丙醇300 µL,涡旋1 min使样品混匀,再将样品置于-20℃冰箱中沉淀24 h后,4℃,14 000×g离心20 min,慢慢将EP管从离心机中拿出,按照样品编号顺序将样品放置在离心管架上,同时每个样品上清液各取10 µL并混匀,作为质控样本(quality contral,QC)。
代谢组分析在华大基因生物技术公司完成。采用液相色谱-质谱联用技术(LC-MS/MS)进行代谢物分析,每个样本设5个生物学重复。主要参数如下:流动相A为0.1%乙腈/水(60∶40),流动相B为异丙醇/乙腈(90∶10),进样量 10 μL,流速 0.4mL·min-1,柱温40℃。梯度洗脱程序为:0—2 min,60%A,40%B相;2—2.1 min,57%A,43%B 相;2.1—6 min,50%A,50%B相;6—6.1 min,46%A,54%B相;6.1—8 min,30%A,70%B相;8—8.1 min,1%A,99%B相;8.1—10 min,60%A,40%B相。质谱分析采用电喷雾电离(ESI+/ESI-)模式,扫描模式分别为正离子模式和负离子模式。毛细管电压为0.25Kv(+)/2Kv(-)。
1.3 数据处理
数据分析使用Excel和 SPSS 24.0软件,所有数据至少3次重复,两个样本的显著性检验采用配对t-检验。统计图表的绘制采用 Excel 和 Origin 软件。
利用SIMCAP 13.0软件对数据进行Pareto Scaling和可视化,利用主成分分析PCA、正交偏最小二乘法分析(OPLS-DA)等多元统计分析和T检验筛选组间的差异代谢物。
2 结果
2.1 不同磷素水平下干旱胁迫对根系形态的影响
根系形态是所有内在生物学过程的综合表现。如图1所示,干旱0 d,LP处理的根系较CP处理浓密,说明低磷水平可促进小麦根系生长。干旱胁迫3 d至复水3 d,LP处理下根系形态仍比CP处理茂密,不同处理下根系均呈现淡黄色,各根尖均有明显的膨大现象,但CP处理的根尖膨大更为明显(图1)。

图1 两种磷水平下干旱胁迫及复水对根系形态的影响Fig.1 The morphology of wheat roots cultured by CP and LP under drought stress and rehydration
2.2 不同磷素水平下干旱胁迫对小麦地上部和根系生理指标的影响
由图2-A和图2-C看出,地上部和整株干物质量在干旱胁迫和复水条件下的变化趋势一致,但两种磷水平下存在差异。从干旱胁迫0—7 d再到复水3 d,CP处理的地上部和整株干重呈先升后降的趋势,但LP处理则呈现先升高后降低再升高的趋势。其中,干旱0—3 d,地上部干重LP处理增加66.7%,CP处理增加41.0%;干旱7 d到复水3 d,LP处理增加32.5%;而CP处理则下降14.6%。两种磷水平下根干重(图2-B)均呈现先升高后降低的趋势。其中干旱0—3 d,根干重LP处理增加126.0%,CP处理增加57.9%;干旱7 d到复水3 d,LP处理降低39.5%;而CP处理则下降40.5%。
干旱胁迫及复水对两种磷水平下根系总体积(图2-D)影响一致,均为先升高后降低再升高的趋势。干旱胁迫5 d,CP处理的根系总体积显著高于LP处理,其余时期差异不显著。干旱7 d到复水3 d,LP处理增加42.2%,CP处理增加24.0%。
LP和CP处理下干旱胁迫及复水条件下根系平均直径(图2-E)变化一致,均为先降低再升高的趋势。干旱胁迫3—5 d CP处理下根系直径大幅上升,之后保持相对稳定;而LP处理则是小幅下降,之后逐渐上升。
胁迫对植物的伤害在复水后才可显现出来。图 2-F显示,干旱胁迫0、3和5 d两种磷素水平下根系DNA含量差异不显著。干旱7 d,CP处理的DNA含量大幅上升,复水后下降,均极显著高于LP处理。然而,干旱7 d到复水3 d,CP处理的DNA含量下降31.3%,LP处理则下降21.7%。说明,LP处理对干旱胁迫的敏感性降低。
图2-G显示,干旱胁迫0—7 d,LP处理下小麦植株根冠比呈现逐渐增加的趋势,而 CP处理变化幅度相对较小。其中干旱胁迫5 d和7 d时,LP处理的根冠比显著高于CP处理。

图2 两种磷素水平下干旱胁迫对小麦地上部和根系生理指标的影响Fig.2 The changes of plant weight and physiological characteristics of wheat plants cultured by CP and LP under drought stress
2.3 两种磷素水平下干旱胁迫对小麦地上部叶绿素含量的影响
如图3所示,干旱胁迫0—5 d,CP处理的叶绿素含量逐渐降低,之后变化不大;而 LP处理下干旱5—7 d叶绿素含量迅速下降,复水后迅速上升。干旱胁迫5 d,LP处理下叶绿素含量反而较高,显著高于CP处理。干旱胁迫7 d至复水3 d,LP处理下叶绿素含量上升87.5%。此阶段LP处理下叶绿素含量大幅上升的趋势和地上部干重的变化趋势一致。
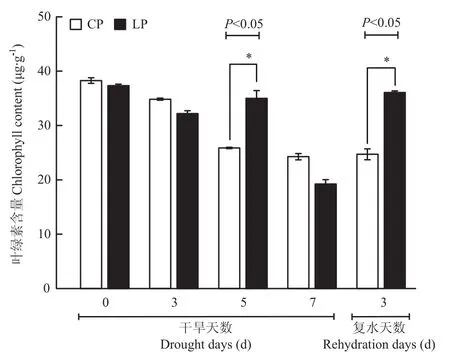
图3 两种磷素水平下干旱胁迫对小麦叶绿素含量的影响Fig.3 The changes of chlorophyll content of wheat plants cultured by CP and LP under drought stress
2.4 两种磷素水平下干旱胁迫对小麦离子组的影响
为探索不同磷素水平下小麦应对干旱胁迫的响应,通过质谱测定了根系和地上部干旱胁迫7 d和复水3 d的11种元素的变化情况。
如表1所示,根系中离子变化情况如下:干旱胁迫7 d,与CP处理相比,LP处理有6种元素含量显著下降,分别为 Ca、Na、Mn、Cu 、Zn、Fe;而 Si、P、S、K含量显著增加,分别增加301.9%、275.7%、90.8%、24.0%;Mg含量变化不显著。复水 3 d,LP处理根系仍有6种元素含量显著低于CP处理,分别是 Ca、Na、Mn、Cu、Zn、Fe;而 K、P、Si、Mg、S含量显著高于CP处理。
LP处理下,复水3 d与干旱胁迫7 d相比,根系中Na和Si含量显著上升,分别增加405.3%、28.2%;Mn、Zn、P含量显著下降,分别下降71.6%、41.9%、33.7%;K、Ca、Mg、Cu、Fe、S含量变化不显著。CP处理下,复水3 d与干旱胁迫7 d相比,根系中Si、Mn、Cu、S含量显著升高,上升幅度分别达34.6%、22.2%、102.1%和29.8%;K和Ca含量显著下降,分别为 26.3%和 51.7%;P、Na、Mg、Zn和 Fe含量变化不显著。
如表1所示,地上部中离子变化情况如下:干旱胁迫7 d,与CP处理相比,LP处理有3种元素含量显著下降,分别为K、Si、Mg;7种元素显著增加,其中 Cu含量增加幅度高达 707.7%,Fe含量增加583.4%,Na含量增加297.3%,Mn增加293.8%,Ca含量变化不显著。复水3 d,与CP处理相比,LP处理仍有3种元素含量显著下降,分别是K、Si、Mg;7种显著增加,其中Mn含量增加幅度高达992.8%;Ca含量基本保持不变。

表1 新冬23号小麦根系和地上部元素含量变化Table 1 The changes of elements content in the roots and shoots of wheat Xindong 23
LP处理下,复水3 d与干旱胁迫7 d相比,地上部 Mn、Si、Ca含量显著上升,分别增加 198.0%、128.6%、20.4%;K、P、Na、Mg、Cu、Zn、Fe和 S 含量变化不显著。CP处理下,复水3d与干旱胁迫7d相比,地上部Na和Cu元素含量显著增加;K含量显著下降;Ca、P、Si、Mn、Mg、Zn、Fe和 S含量变化不显著。
2.5 两种磷素水平下干旱胁迫对小麦代谢组的影响
为了更加详细地了解两种磷素水平下小麦应对干旱胁迫的差异,对新冬23号小麦地上部和根系组织的代谢物进行了LC-MS/MS检测。在QC样品中RSD<30%的特征离子用于下一步分析。结果表明,LP和CP对比组中,干旱胁迫3 d根系共有24个差异离子,其中12个上调,差异离子涉及4条差异通路(表2),分别为代谢途径、植物信号转导、次级代谢物的生物合成和类胡萝卜素生物合成代谢通路,4条差异代谢通路的差异代谢产物均为脱落酸,且含量均为显著下调。

表2 新冬23号小麦LP和CP对比下干旱胁迫3 d根系差异代谢通路及差异代谢物Table 2 Differential metabolic pathways and metabolites in roots of wheat Xindong 23 under drought stress for 3 days compared with LP and CP
LP和CP对比组中,干旱胁迫7 d,根系共有8个差异离子,分别涉及8条差异代谢通路(表3),分别为叶酸生物合成、硫代葡萄糖苷生物合成、2-氧代羧酸代谢通路、嘧啶代谢、代谢途径、嘌呤代谢、次生代谢物的生物合成通路、硫磺中继系统通路,各通路的差异代谢物含量均为显著下调。此外,干旱胁迫3、7 d的LP和CP对比组中地上部均未检测到差异代谢通路。

表3 新冬23号小麦LP和CP对比下干旱胁迫7 d根系差异代谢通路及差异代谢物Table 3 Differential metabolic pathways and metabolites in roots of wheat Xindong 23 under drought stress for 7 days compared with LP and CP
两种磷素供应下干旱胁迫诱导小麦根系与地上部的代谢物种类和含量存在显著差异。如表4—5所示,地上部干旱胁迫3 d与干旱胁迫7 d相比较CP处理涉及57条差异代谢通路,包含509种差异代谢物,涉及的前5位差异代谢通路分别为次级代谢物合成通路、代谢途径、萜类生物合成通路、类胡萝卜素生物合成通路和异喹啉生物碱生物合成通路,包含的差异代谢物分别为129、109、52、32和18种(表4)。其中萜类化合物是作物生长发育中重要的次级生长代谢物,直接或间接参与植物激素合成、细胞膜稳定性及光合作用等一系列生物过程。植物营养素的水平与萜类代谢的调节有关[32]。萜类化合物的变化有助于植物的自我保护和防御反应。本研究中 CP处理地上部干旱胁迫3 d的相关萜类物质含量显著高于7 d,且地上部差异代谢物中涉及萜类物质多于根系组织。

表4 新冬23号小麦旱胁迫3 d和7 d对比下CP处理地上部差异代谢通路及差异代谢物Table 4 Differential metabolic pathways and metabolites in the shoot of CP treatment compared to 3 d and 7 d of drought stress in wheat Xindong 23

续表4 Continued table 4
干旱胁迫3 d/7 d,CP处理根系涉及18条差异代谢通路,包含57种差异代谢物(表5);而在LP处理下未检测到差异代谢物。表明新冬23号小麦在两种磷素供应下,干旱胁迫对CP处理的影响大于LP处理;其中 CP处理地上部差异代谢物数量多于根系,说明地上部对干旱胁迫更加敏感。
干旱胁迫3 d/7 d根系涉及的差异代谢物最多的通路为亚油酸代谢。赖氨酸合成中(2R,3R)-3-甲基谷氨酰-5-半醛-N6-赖氨酸含量上升高达8.775倍,其次是氨基糖和核苷酸糖代谢差异物升高3.135倍。而色氨酸代谢、不饱和脂肪酸合成以及二萜和单萜生物合成均呈下降趋势(表5)。

表5 新冬23号小麦干旱胁迫3 d和7 d对比下CP处理根系差异代谢通路及差异代谢物Table 5 Differential metabolic pathways and metabolites in the root of CP treatment compared to 3 d and 7 d of drought stress in wheat Xindong 23
3 讨论
3.1 两种供磷水平下干旱胁迫对小麦根系形态及生理指标的影响
外界胁迫环境下小麦植株的表型是所有内在生物学过程的综合体现。在两种施磷条件下,小麦植株干重差异不明显。干旱胁迫3 d LP处理的根干重显著高于CP处理,干旱胁迫5 d地上部干重、整株干重、根系体积和根系平均直径均为 LP处理显著低于 CP处理。然而,干旱胁迫7 d到复水3 d两种磷水平下植株的表现不尽相同,CP处理下地上部和整株干物质量呈下降趋势,而 LP处理则呈上升趋势;对于根系总体积,LP处理上升42.2%,CP处理增加24.0%;CP处理的根系 DNA含量下降 31.3%,LP处理则下降21.7%。VAN DOORN W G[12]研究认为,胁迫环境下植物细胞程序性死亡是作物对胁迫产生预警后发生的抵抗,随着干旱胁迫程度的增加,细胞死亡的程度逐渐加剧,最终导致DNA含量降低。而本试验LP处理DNA含量下降率在干旱胁迫后期至复水后均显著低于CP处理。综上说明,LP处理的小麦植株对干旱胁迫的适应性增强,复水后恢复能力相对较强。前人研究表明,磷素缺乏的植物会产生一系列类似于适应水分胁迫的性状[10]。如,王燕云等[33]从植物外部形态、生理生化与酶诱导等多方面阐述了植物缺磷时发生的变化;李春俭[34]指出,植物在应对磷素缺乏时,在形态学方面最典型的是侧根数量增加、根毛变细变长、形成明显的排根、根冠比变大,而在生理学方面最重要的生理变化之一是有机酸的代谢分泌。因此,当磷素缺乏的植物遇到水分胁迫时,由于有了对干旱的适应性,对水分胁迫的敏感性降低[4]。这和本研究的结果相一致。
从干旱胁迫0 d至7 d根系平均直径降低,体积增加,主要与根毛的生长发育有关。李万春[10]的土壤栽培试验表明胁迫环境对小麦根毛生长发育有促进作用。本研究中,干旱胁迫3 d,根体积较干旱0 d大幅上升,说明干旱胁迫对根系的生长有一定的刺激作用;但CP处理的根体积上升幅度较LP处理大,而根平均直径的下降幅度则大于LP处理,说明干旱初期CP处理可通过增加根体积应对干旱胁迫,而 LP处理对干旱胁迫的敏感性较低。本研究中,干旱胁迫下 CP处理的根尖膨大现象较 LP处理明显。小麦根尖皮层细胞起着转运和贮藏水分的作用,皮层细胞形状的改变是植物对水分亏缺环境的一种适应性改变,体积变大和相对细胞表面积的增大,可增强根的吸水和保水能力,同时也表明根尖伸长受阻,变粗膨大[10]。本研究中,干旱7 d和复水3 d CP处理的根系DNA含量极显著高于LP处理,基于根尖膨大和DNA含量增加,推测 CP处理的根尖细胞内倍性水平可能高于 LP处理。内多倍体是指一个个体内的细胞具有不同倍性细胞核的现象,这种现象是由于DNA量随着DNA的复制以2n形式增长,但不进行染色体的分配和细胞分裂而产生,与植物对环境胁迫的适应性密切相关[35]。以往研究表明,在低磷胁迫下,大麦植株主根成熟区和侧根多倍体水平均显著下降,侧根多倍体水平下降幅度大于主根[35]。内倍性的降低有助于减少水分和矿质养分有效利用过程中碳源等营养元素的输入,并增加光合面积。光合作用受到较大影响,但更多的光合产物被输送到根部[36],这对于磷胁迫等非生物胁迫下的植物尤其重要。可能也是本研究中 LP处理下叶绿素含量和根系干重与CP处理差异不显著或高于CP处理的重要原因。此外,基于磷素在碳、氮等代谢途径中的重要作用,即使在磷饥饿条件下,植物细胞仍然需要将磷素浓度维持在一定范围内[37]。因此,在磷素含量有限的情况下,节约磷素的消耗对植物的生存至关重要。研究表明,在低磷条件下生长的植物根系中,总磷含量的59%至64%来自核酸物质[38]。高的内多倍体水平增加了rRNA的数量,rRNA是核酸的主要成分之一。因此,在磷素有限的条件下,侧根多倍性水平的降低有助于减少基因组DNA、RNA等磷酸化代谢产物合成过程中的磷素消耗,最终有助于植物更好地适应环境。本课题应在此基础上进一步研究根系的内倍性变化,探索其与磷素和水分胁迫的关系。
对普通豆类的研究表明,与磷充足的植株相比,磷饥饿的植株的根冠比增加[39],这和本研究的结果一致。此外,对拟南芥的研究也表明,磷饥饿可以诱导主根的发育[40]。目前已鉴定出与大豆磷获取相关的根系构型性状的数量性状位点,进一步表明了根系结构对大豆低磷适应的重要性[41]。缺磷条件下根系构型的变化是生长素、细胞分裂素和乙烯内部平衡的结果[42-43]。在本研究中,笔者发现了一些与植物激素合成和磷反应有关的代谢途径和代谢产物含量发生显著变化,如植物激素信号转导、生物碱合成和脱落酸等。随着侧根生长量的增加,细胞壁合成和生长相关基因对磷的响应加快。例如,万东莉等[44]对磷响应相关基因表达分析表明,不同器官组织对磷胁迫响应的模式不同,并筛选出3个表达较为稳定的内参基因。
3.2 两种供磷水平下干旱胁迫对小麦植株离子组的影响
干旱胁迫下,植物水分代谢受到严重影响,与水分代谢密切相关的离子代谢也受到影响。在干旱胁迫和复水条件下,不同供磷量对矿质元素含量影响较大。在干旱胁迫7 d和复水3 d,与CP处理相比,LP处理下根系中Ca、Na、Mn、Cu、Zn、Fe含量均显著降低,而K、P、Si、S和Mg(仅复水3 d)的含量显著增加。钙离子作为细胞内第二信使在众多细胞功能中具有调节作用。缺钙或低钙介质将会终止细胞周期的正常运转,这可能也是胁迫下小麦根尖膨大的重要原因之一。前人研究表明,磷饥饿会影响矿质元素在作物体内的分布及积累情况[45]。隋方功等[46]发现,夏谷幼苗缺磷时显著降低了对Mg的吸收;都韶婷[47]发现饭豆低磷处理下根系铁浓度显著低于中磷和高磷处理。本研究中,干旱胁迫7 d和复水3 d LP处理根系中所测元素大部分较 CP处理显著减少,而地上部却截然相反,大部分元素呈显著上升或差异不显著的趋势。胁迫环境下植物根系表皮细胞壁上疏水物质的积累可能影响根胞外体对矿质元素的吸收和跨膜转运[48]。同时本试验在磷素胁迫基础上还设置了干旱胁迫,如前所述,磷素缺乏的植物会产生一系列类似于适应水分胁迫的性状[10]。推测由于双重胁迫,小麦幼苗失水,蒸腾张力增大,因此,运输速率增加,植株中金属元素含量增加[49]。胁迫也可能导致地上部生长受到抑制,光合产物库减少,增加了累积同化物向根系的转运,增强了根系的渗透调节。随后,根细胞扩大,根系比例增加[50],最终提高了根系的吸收能力,植物体内金属含量增加。
李仰锐等[51]研究表明,干旱使植株各部位 Cu含量降低(除轻度干旱处理茎部高于对照),且干旱程度越大降低越多;而植株各部位Mn含量干旱条件下均增加,且干旱程度越大增加越多。谭晓荣等[52]研究表明,轻度干旱使小麦幼苗体内的Cu和Mn含量升高,重度干旱使Cu和Mn含量降低。本研究中干旱7 d和复水3 d根系中LP处理Cu含量均显著下降,而地上部中则显著上升,说明磷素和干旱的叠加胁迫下对小麦不同部位Cu的吸收和积累能力影响不同。
本研究中,LP处理下根系复水3 d与干旱7 d相比,Si和Na元素含量显著上升,而CP处理的Si、Mn、Cu和S元素显著上升。硅含量的大幅上升,对复水后促进根系的生长,提高植物根系的活力,促进植物对水分和养分的吸收有重要作用[53]。硫可以调节植物对主要营养元素的吸收,植物体内的一些含硫化合物(如谷胱甘肽)可通过一些生化反应途径淬灭游离基团,从而提高植物体的抗逆性[54]。此外,值得注意的是,复水后 LP处理的根系 Na离子含量上升405.3%。而过量的 Na+离子浓度可能会诱导一系列的信号转导事件,最终促进有机酸的合成,这也可能是小麦植株适应磷素和干旱双重胁迫,实现细胞内离子浓度平衡和控制高pH所必需的潜在因素。
3.3 两种供磷水平下干旱胁迫对小麦植株代谢组的影响
本研究采用代谢组学方法,分别研究了干旱胁迫3 d和7 d两种磷水平下小麦根系和地上部代谢产物的差异。正如上文所述,LP处理由于对干旱胁迫的敏感性降低,干旱3 d和7 d的对比组中地上部和根系均未检测到差异代谢通路。而干旱胁迫对 CP处理的影响大于LP处理,其中对CP处理地上部的影响大于对根系的影响。前人研究表明,胁迫环境对植物体内糖代谢影响较大,特别是蔗糖、果糖、葡萄糖、甘露糖等在受胁迫的植株体内积累水平较高,参与渗透调节,保护膜和蛋白质免受ROS的损害[39]。然而本研究中,新冬 23号小麦体内涉及糖代谢显著变化的物质并不多。在地上部差异代谢物中,干旱胁迫3 d涉及的大量氨基酸合成与代谢的物质含量显著高于干旱胁迫7 d。随着干旱胁迫时间的延长,氨基酸的合成受到了明显抑制,说明对于新冬23号小麦更多的是氨基酸参与渗透调节,地上部中氨基酸的活性对胁迫环境的耐受性至关重要。然而,干旱实质上是抑制了氮代谢水平、糖酵解和氨基酸的生产。此外,与干旱胁迫 3 d相比,脂肪酸的含量在干旱7 d显著下降,而类胡萝卜素的含量显著上升。类胡萝卜素是植物体内一种重要的烯萜类化合物,在植物的光合作用中可保护叶绿素分子免遭光氧化的损伤,起到辅助吸收光能并保护光合作用的细胞器的重要功能[55]。同时,类胡萝卜素也是一种强氧化剂,在清除细胞内活性氧,维持细胞膜结构的稳定性方面均发挥作用,另外,它还是ABA合成的前体物质[56]。由此推断,干旱 7 d,类胡萝卜素含量的显著上升与维持叶片叶绿素含量以及根系ABA含量上升有重要关系。
如上文所述,磷素和干旱胁迫可能会影响小麦细胞的内多倍化进程,虽然本研究未涉及细胞周期的相关研究,但是研究表明磷酸盐饥饿和干旱胁迫均会改变植物根系和茎的多倍化水平[35]。特别是玉米素可以导致细胞周期蛋白合成在性质上的改变。本研究中CP处理干旱胁迫3 d/7 d样本的玉米素代谢通路中S-腺苷-L-甲硫氨酸增加2倍,暗示对小麦地上部的内多倍性有重要影响,也是小麦植株对胁迫环境的一种反应。
多数萜类化合物参与了地上部的不同代谢活动。萜类化合物是植物生长发育过程中重要的次生代谢产物,直接或间接参与植物激素合成、细胞膜稳定性和光合作用等一系列生物过程。植物营养素的水平与萜烯代谢的调节有关[32]。萜类化合物的变化有助于植物的自我保护和防御反应。在本研究中,CP处理干旱胁迫3 d样本中相关萜类化合物的含量显著高于干旱7 d。此外,萜类化合物在地上部差异代谢产物中的参与程度高于根系,说明 CP处理下干旱胁迫对地上部萜类化合物合成的影响大于根系,且受早期干旱的影响更大。
本研究中,CP处理根系与地上部响应干旱胁迫的代谢物差异很大,地上部中随着干旱时间延长,氨基酸、脂肪酸和萜类物质合成显著下降;类胡萝卜素显著上升;而根系中赖氨酸、氨基糖和大部分脂肪酸合成显著下降,萜类物质合成显著上升。说明对干旱的胁迫反应存在着不同的机制。
干旱胁迫3 d,与CP处理相比,新冬23号小麦LP处理的 4条差异代谢通路的差异代谢产物均为脱落酸,且含量均为显著下调。前人研究表明,在缺水胁迫下,根部 ABA的浓度会上升,根尖分生组织停止分裂[57]。本研究中结果与此相反,干旱3 d根部ABA含量下降。这可能是 LP处理下根系长期处于缺磷状态,对干旱胁迫的耐受性升高,ABA含量不升反降,进而促进了根系的生长发育,增加了根冠比。
磷素参与核酸的合成与代谢。同时磷素与氮素存在互作,LP处理下磷素的缺乏可能会影响小麦植株氮营养状况。在氮素供应不足时,游离氨基酸和核酸含量降低,导致蛋白质合成受阻,细胞分裂就会受到抑制。本研究中,干旱胁迫7 d,与CP处理相比,LP处理中嘧啶代谢和嘌呤代谢通路的差异代谢物含量均为显著下调。这可能也是干旱7 d时LP处理的根系DNA含量极显著低于CP处理的原因之一。
4 结论
两种磷素水平下小麦对干旱胁迫的适应机制不同。主要表现如下:(1)LP(0.05 mmol·L-1)处理下根系浓密,对干旱胁迫适应性增强,复水后 LP处理根系总体积上升率显著高于正常磷处理,而根系DNA含量下降率低于CP(1.0 mmol·L-1)处理。根尖膨大现象和相关代谢物变化暗示 LP处理下根系细胞内多倍性降低,有助于有效利用水分和矿质营养。(2)离子组分析表明,与CP处理相比,LP处理中根系Ca、Na、Mn、Cu、Zn、Fe含量下降,地上部P、Na、Mn、Cu、Zn、Fe、S含量上升。LP处理下根系比例增加,提高了根系的吸收能力,植物体内矿质元素含量增加。(3)代谢组分析表明,CP处理对干旱胁迫更加敏感,其中干旱胁迫对CP处理地上部影响大于根系。随着干旱胁迫时间的延长,对氨基酸、脂肪酸和萜类物质的代谢影响更大。CP处理小麦根系与地上部响应干旱胁迫的机制不同。LP处理小麦植株对干旱胁迫的敏感性降低,适应性更强,复水后恢复能力强于CP处理,其主要原因是根系形态的改变、离子平衡的重排以及氨基酸和脱落酸代谢的改变,以调节渗透平衡,维持细胞内离子稳态,增强了对干旱胁迫的耐性。
