基于证据建构模型的教学实践与反思
2022-02-20叶跃娟



【摘 要】文章通过对课标、学情的分析,在单元整体规划的基础上,基于客观事实、实验现象、科技成果等各种证据,从定性到定量、静态到动态、特殊到一般,建构离子键认知模型,探究氯化钠结构模型,自主达成模型表征和模型应用,让学习真正发生。
【关键词】证据;模型;离子键;学科核心素养
【作者简介】叶跃娟,南浔高级中学副校长,高级教师,浙派名师培养人,曾荣获全国竞赛园丁奖、浙江省竞赛园丁奖、全国优质课一等奖等。
证据推理与模型认知是化学学科核心素养之一,是化学学科中的重要思想和方法。《普通高中化学课程标准(2017年版2020年修订)》(以下简称课标)要求学生具有证据意识,能基于证据对物质组成、结构及其变化提出假设,通过分析推理加以证实或证伪;通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律[1]。化学键作为中学化学核心概念之一,是体现物质内部结构和决定物质性质的重要因素。构成离子键的微粒看不见摸不着,大部分教师只习惯于让学生记忆概念和知识,然后再利用习题巩固知识并强化记忆,导致学生缺乏对离子键概念的建构和深度理解,不能关注概念的认识功能和价值。基于此,笔者通过对课标与学情的分析,在单元整体规划基础上充分挖掘和应用客观事实、实验现象、科技成果等证据,设计和实践了人教版必修第一册第四章第三节化学键中的第一课时“离子键”教学,深度建构离子键的认知模型,探究氯化钠结构模型,让学生自主达成模型表征和模型应用。
一、课标分析
課标中化学键属于必修课程主题3 物质结构基础与化学反应规律中的第2节内容。其内容要求(即学生应知什么)是认识构成物质的微粒之间存在相互作用,结合典型实例认识离子键和共价键的形成过程,建立化学键概念;认识化学键的断裂和形成是化学反应中物质变化的实质及能量变化的主要原因。对应的学业要求(即学生学完本单元学习后能做什么)是能判断简单离子化合物和共价化合物中的化学键类型,能基于化学键解释某些化学反应的热效应。由此可知,化学键之于高中化学教学的重要性,不仅在于要求学生掌握离子键、离子化合物、化学键、共价键、共价化合物等概念,会用电子式表征这些物质及物质的形成过程,更重要的是能用化学键这一微观视角解释或预测物质的某些性质,解释物质发生化学反应的本质以及化学反应伴随能量变化的内在原因,增加对物质转化与化学反应的理解,发展微粒观、变化观、守恒观等学科观念,形成结构决定性质、性质体现结构的学科思想。另外,必修课程中化学键对应的学业质量水平是2-1,因此,教学中重点要落实的学科核心素养是宏观辨识与微观探析、证据推理与模型认知。
二、学习目标
在学习化学键之前,学生已经知道分子、原子、离子是构成物质的基本粒子,知道化学变化是原子的重新组合,知道物质发生化学变化时伴随着能量变化。在“氧化还原反应”的学习中,学生已知道氧化还原反应的本质是反应中有电子转移,知道原子之间的重新组合与原子的最外层电子有关。在教学中,教师需要突破的是根据各种证据深度建构和发展原子或离子是怎样结合形成分子或物质的,化学变化中原子重新组合的实质和原因是什么,化学变化中为什么会伴随能量变化等。从化学键的角度看物质及其变化,综合地认识化学键与物质结构、性质的关系以及化学键与化学反应的关系。在符号表征方面也要从化学式转向电子式。结合教材内容,化学键单元教学安排2个课时,第1课时重点是从离子键角度认识物质性质及物质转化,通过各种证据帮助学生构建离子键的认知模型,促进学生从能量的角度认识离子键的形成过程及其符号表征;第2课时重点是从共价键角度认识化学反应,形成化学键、共价键、共价化合物等概念,促进学生进一步将化学键知识作为分析和解决问题的工具,从化学键的微观视角认识化学反应及物质的转化的本质。结合以上分析,可确定第1课时“离子键”的学习目标为以下几个方面。
1.通过实验现象、科学数据、科技成果等证据感受离子键的存在,分析氯化钠中阴、阳离子间的相互作用,能从静电本质,定性到定量、物质变化到能量变化的角度认识离子键,并能从微观视角分析宏观的现象。
2.通过动手搭建氯化钠晶体结构模型,并与X射线衍射实验模型进行比较,从而达到微观结构宏观化,隐性思维显性化。
3.通过寻找更科学、简洁的符号表示氯化钠的形成过程,实现化学式到电子式的表征方式的转变,感受化学用语的魅力。
4.通过对氯化钠的某些性质和现象的原因分析等活动,感受离子键的功能价值,进一步强化结构决定性质,性质体现结构的学科观念。
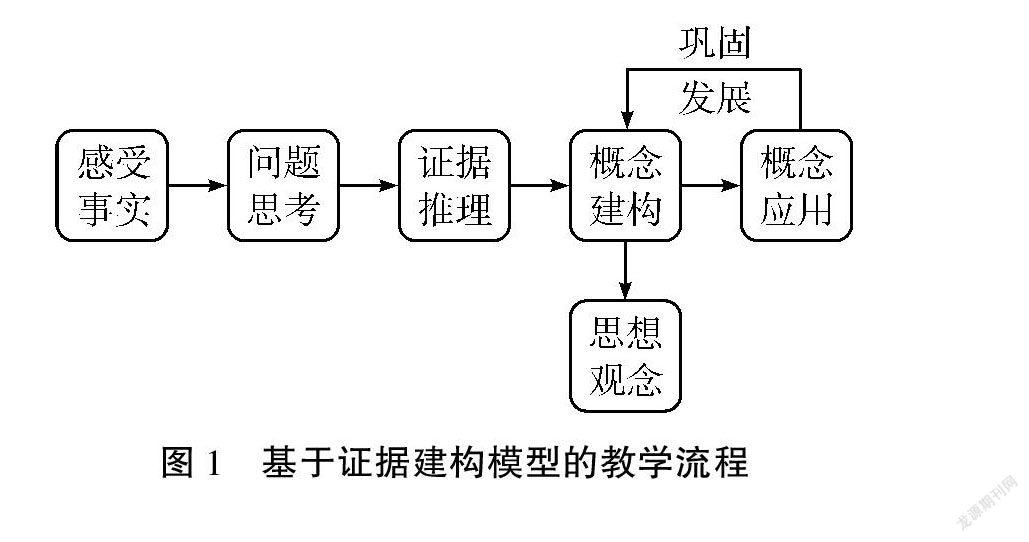
三、教学流程
基于证据建构模型的教学设计,往往离不开科学探究,需要以具体的客观事实为载体。在客观事实中发现化学问题,通过实验、数据、科学技术等证据推理论证,从而建构新的认知模型,并运用模型解决实际问题。然而学生对于概念的认识不是一步到位的,在应用模型的过程中,需要我们不断提供新的证据来巩固、发展模型。在整个教学过程中凸显“结构决定性质”的学科观念,实现认知的突破,能力的提升,素养的落实。基于证据建构模型的教学流程,如图1所示。
四、教学过程
环节一:建构离子键认知模型
演示实验1——氯化钠导电实验
思考:为什么固体氯化钠固体不导电而在熔融状态下能导电?
生1:因为氯化钠固体中Na+和Cl-不能自由移动,加热融化后才产生自由移动的Na+和Cl-。
生2:说明Na+和Cl-之间存在作用力,破坏这种作用力需要很大的能量。
演示实验2——钠在氯气中燃烧
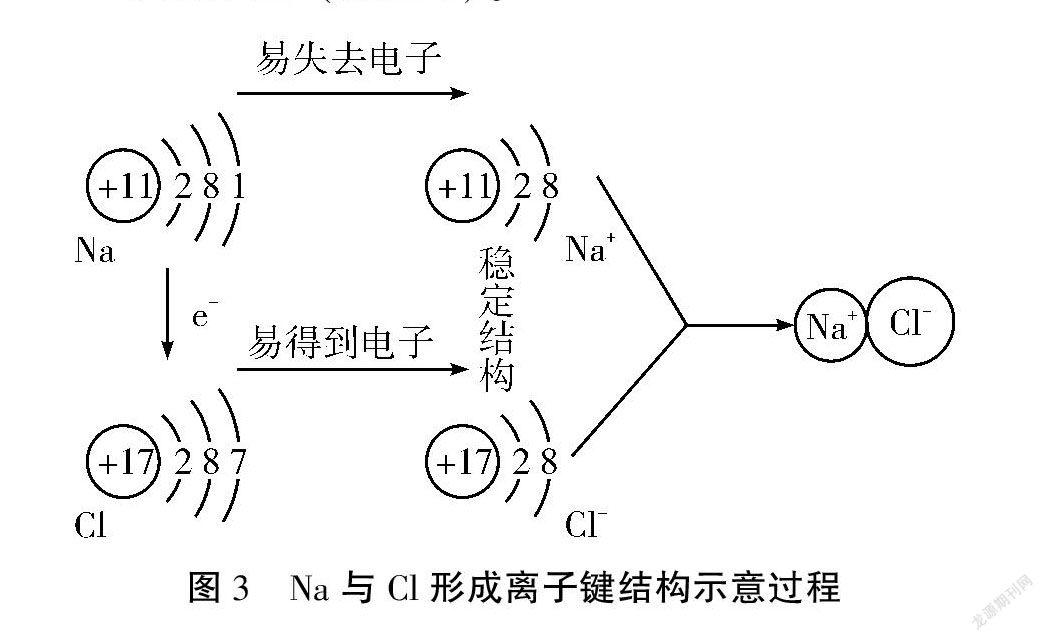
思考:为什么钠可以在氯气中剧烈燃烧并放出大量的热?请用结构示意图表示氯化钠的形成过程。
学生作图(如图3)。
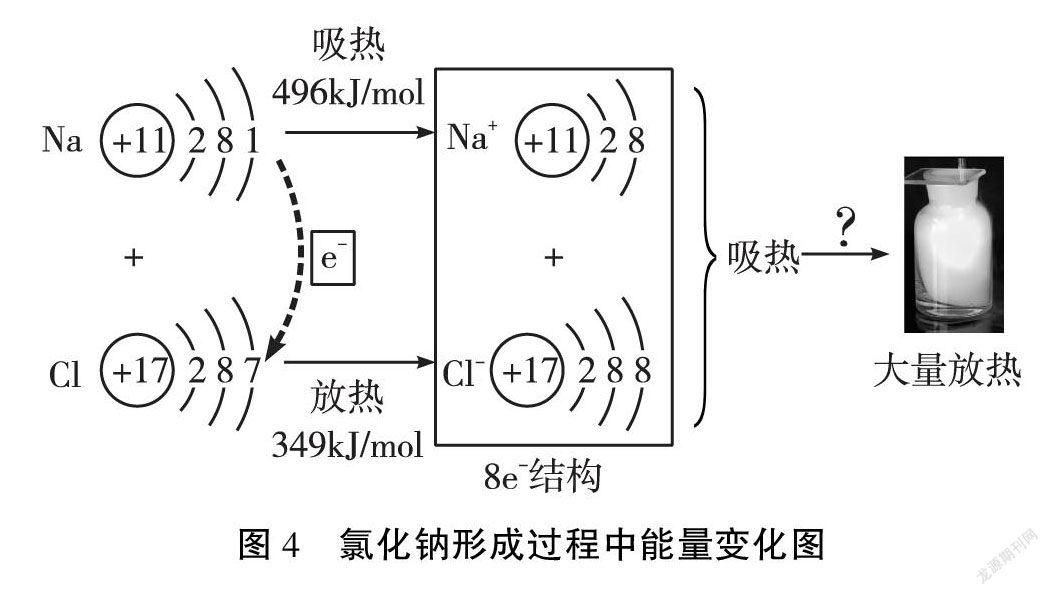
教师在教学中展示以下资料:如图4,1mol气态钠原子形成1mol气态钠离子要吸收496kJ能量,1mol气态氯原子形成1mol气态氯离子要放出348.7kJ能量。
思考:根据1mol气态钠原子形成1mol气态Na+时吸收的能量比1mol气态氯原子形成1mol气态Cl-放出的能量多147.3kJ,该过程是吸热的,但为什么钠和氯气反应会放热呢?
生:Na+带正电荷,Cl-带负电荷,相反电荷的离子间具有静电引力,阴、阳离子靠近时会释放出能量。
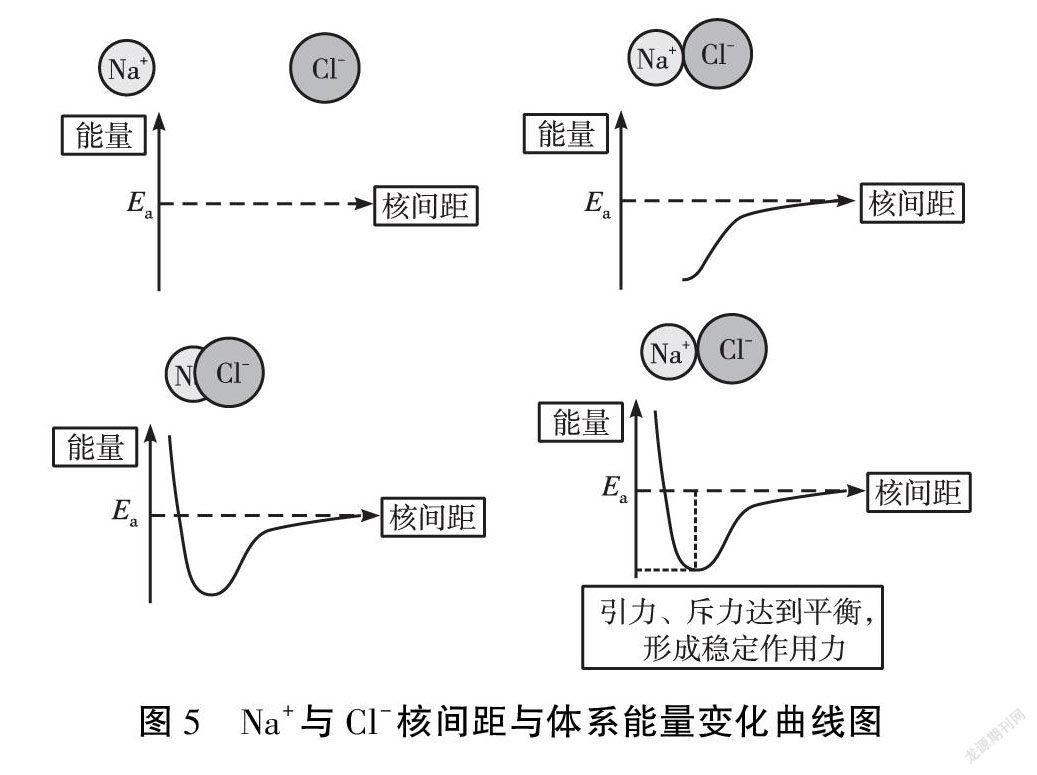
资料展示:如图5为Na+与Cl-之间的核间距与体系能量变化曲线图。
思考:科学家研究发现,带相反电荷的阴、阳离子相互接近时,因电性相反会存在静电引力,距离越近,能量越低。为什么Na+和Cl-靠近到一定程度后体系能量又会升高呢?
生:Na+和Cl-之间还存在静电斥力。随着阴、阳离子的靠近,原子核与原子核、电子与电子之间的斥力逐渐增大,当静电引力等于静电斥力时,整个体系的能量最低,相互间形成了稳定的化合物。
师:这种稳定的化合物就是离子化合物,构成离子化合之间的相互作用力就是离子键。大家能给离子键和离子化合物下定义吗?
生1:阴、阳离子之间的相互作用就是离子键。
生2:这种相互作用包含静电引力和静电斥力,而且作用力比较大。
生3:通过离子键构成的化合物叫作离子化合物。
【设计意图】通过实验事实、科学数据等证据素材,引导学生开展概括关联、分析推理等活动,从宏观到微观,从定性到定量,从静态到动态,分析离子键的成键过程,深刻认识离子键本质,自主形成离子键、离子化合物等概念。同时帮助学生转变阴、阳离子间只有静电引力的认知偏差,促进学生深度学习。
环节二:建构氯化钠晶体结构模型
教师出示氯化钠晶体实物,并用绿球代表氯离子(Cl-)、橙球代表钠离子(Na+),教师请各小组尝试合作拼出氯化钠晶体的微观结构模型,并请各小组代表发言。
生1:一个钠离子和一个氯离子通过离子键形成氯化钠晶体。如图6(1)。
生2:不对,一个钠离子的上、下、左、右、前、后都可以與氯离子形成离子键,所以氯化钠晶体结构应该是如图6(2)。
生3:一个氯离子的上、下、左、右、前、后也都可以与钠离子形成离子键,所以氯化钠晶体结构也可以是如图6(3)。
生4:氯化钠晶体呈电中性,而且离子的半径大约只有10-12m,氯化钠晶体应该由许许多多的钠离子和氯离子通过许许多多离子键结合而成,所以我们可以把许多个图6(2)和图6(3)叠加成图6(4)。
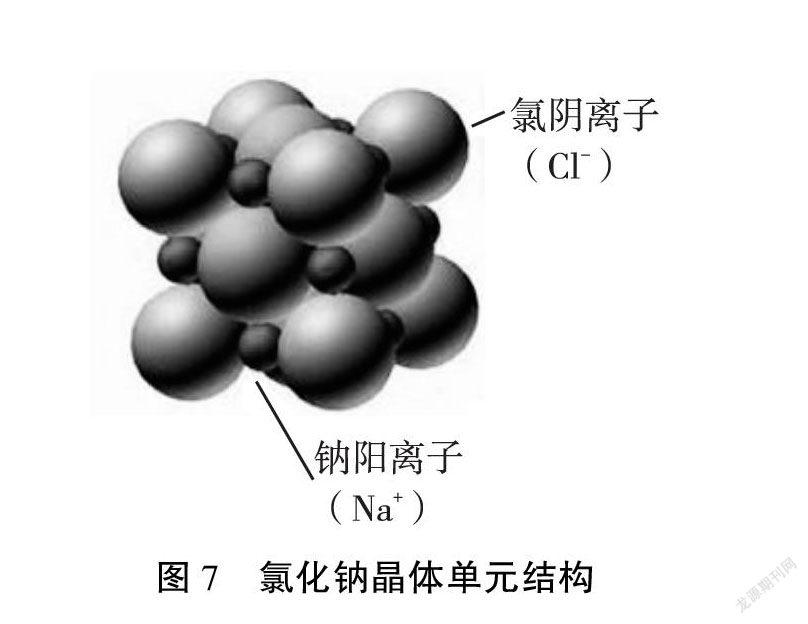
资料展示:科学家通过X-射线衍射实验,得到氯化钠晶体单元结构如图7。
【设计意图】应用离子键认知模型,动手搭建氯化钠晶体结构模型,将微观结构宏观化,隐性思维显性化,最后通过科学技术证实,从而形成新的离子化合物的结构模型。
环节三:表征离子键的形成过程
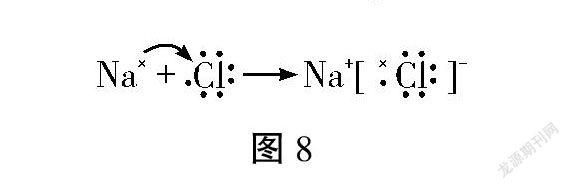
问题思考:用原子结构示意图(如图3)表示离子键的形成过程清晰、直观,但比较烦琐,你能用更简洁的符号表示氯化钠的形成过程吗?
通过以上问题思考,教师组织学生进行如下教学活动。
1.交流讨论原子、阳离子、阴离子、离子化合物、离子化合物形成过程的电子式表示方法。
2.练习钠原子、氯原子、钠离子、氯离子、氯化钠的电子式书写,并用电子式表示氯化钠的形成过程。
生:如图8,用点和叉表示原子最外层电子,因为化学反应只与原子的最外层电子有关。弯剪头表示钠原子把电子给了氯原子。
【设计意图】通过自学和交流讨论,学生自主发现电子式在表达离子化合物及离子化合物形成过程中的优点,自觉转变化学式表征到电子式表征,培养符号表征的能力,感受化学用语的魅力和意义。
环节四:运用模型解决问题
教师引导学生运用模型解决以下问题。
1.为什么氯化钠晶体硬度较大,难以粉碎?为什么氯化钠的熔沸点较高?已知AlCl3的熔点为190℃,178℃升华,AlCl3是离子化合物吗?
2.工业冶炼钠、镁、铝三种金属的原料选择有何不同?结合以下资料卡分析。
资料卡:
①工业冶炼钠的原理:2NaCl(熔融)电解2Na+Cl2↑,NaCl的熔点为801℃,Na2O的熔点为1275℃。
②工业冶炼镁的原理:MgCl2(熔融)电解Mg+Cl2↑,MgCl2的熔点为712℃,MgO的熔点为2852℃。
③工业冶炼铝的原理:2Al2O3(熔融)电解4Al+3O2↑,AlCl3的熔点为190℃,178℃升华,Al2O3的熔点为2054℃。
生1:氯化钠中存在离子键,硬度大、熔沸点高;氯化铝中应该不存在离子键,不属于离子化合物,所以熔点低,易升华。
生2:NaCl、Na2O、MgCl2、MgO、Al2O3都是离子化合物,在熔融状态下能导电,可以通过电解制备其单质,但考虑到熔点越高成本越大,所以选择熔点较低的NaCl、MgCl2。AlCl3不是离子化合物,故只能选择Al2O3。
【设计意图】运用离子键模型对氯化钠等离子化合物的熔点高、硬度大的特点,制备钠、镁、铝等活泼金属反应物,解决生产生活中的实际问题,让学生感受离子键在解释和预测物质某些性质的功能价值,帮助学生进一步形成微观结构决定宏观性质、宏观性质体现微观结构的学科思想和观念。
五、教学反思
1.让学生经历知识产生的过程与方法,发展关键能力
科学探究的核心是科学知识的生成和论证,让学生经历科学知识产生的过程与方法是“证据推理与模型认知”的前提条件。本节课,教师让学生自主经历、建构概念的过程,让学生“自己教育自己”、建立“学习共同体环境”[2]。教学中学生展示自己建模的过程,表达自己的模型优劣,不断激活学生自我教育的潜能,这也是核心素养背景下关键能力发展的必然要求。
2.设计逻辑合理的教学环节,让证据推理富有层次
科学探索的过程从来都不是一蹴而就的,而是由点到面,由局部到整体的过程,认知过程也是这样。
在教学实践中,证据往往是不完善的,许多的证据只能体现化学原理一部分的“面貌”,能实现教学环节的部分功能。这就要求教师在设计教学时,要充分考虑这些环节和证据之间的逻辑关系,让学生体验科学发现的过程,在对证据抽丝剥茧的分析中认知规律,在证据推理中形成模型,在应用模型中完善模型,在完善模型的过程中寻找更多的证据,从而形成教学的螺旋式发展。
3.基于证据建构模型的教学,体现学科价值
课标要求基于证据建构模型的教学,实现学科思想和方法。其最高水平为要求学生能够迁移、分析和评价化学知识,要揭示更高层次的价值追求。在形成、应用模型的过程中要注重体现结构决定性质的学科观念来解释化学现象、应用化学规律。在解决问题的过程中,逐步提升“证据推理与模型认知”的水平等级,在巩固模型的同时也要牢固确立知识的学习要服务于学生思维的发展[3]。
参考文献:
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[M].北京:人民教育出版社,2020.
[2]布兰斯福特,等.人是如何学习的:大脑、心理、经验及学校(扩展版)[M].程可拉,孙亚玲,王旭卿,译.上海:华东师范大学出版社,2013.
[3]王利国.基于“证据推理与模型认知”的高三复习教学:以“洗涤剂的选择”为例[J].中学化学教学参考,2019(5):31-34.
(责任编辑:陆顺演)
