生物菌剂对土壤微生物群落结构和功能的影响
2022-02-18沙月霞黄泽阳李云翔赵沛
沙月霞,黄泽阳,李云翔,赵沛
(宁夏农林科学院植物保护研究所,银川 750011)
玉米是世界上重要的粮食作物、饲料作物和工业原料,高密度种植、化肥农药过量施用以及土壤盐渍化等导致玉米土壤中病原菌数量连年积累,致使根系生长的微生态环境失衡[1-2]。茎基腐病是由多种病原菌复合侵染的系统性土传病害,也是危害玉米产量和品质的主要病害之一,一般可使玉米减产10%~25%,危害严重时玉米产量损失可超过80%[3-4]。种植抗病品种和施用化学农药是生产上最常用的防治措施。随着生态环境保护和粮食安全日益受到重视,玉米茎基腐病的生物防治越来越受到学者们的关注。五谷丰素是由链霉菌(Streptomycessp.)NEAU6代谢产物研制出的生物制剂,能促进种苗生长和提高抗倒伏能力[5-6],是防治玉米茎基腐病的种衣剂。程星凯[7]研究发现甲基营养型芽孢杆菌(Bacillus methylotrophicus)TA-1浸种可以有效预防玉米茎基腐病,并具有显著的促生作用。
土传病害常与土壤中病原菌数量积累较多、土壤生态环境失衡和气候因子有关,因此,改善植株根系生长的土壤微生态环境、恢复土壤生态服务功能是防治土传病害的途径之一[8]。CHEN 等[9]研发的棘孢木霉菌(Trichoderma asperellum)颗粒剂与化肥混合后于播种前施用可以改善土壤质量,有效预防玉米茎基腐病。土壤微生物参与物质循环,而微生物群落结构的变化会影响土壤健康状况。冯帅[10]分离的施氏假单胞菌(Pseudomonas stutzeri)A1501 可以改变玉米根际土壤细菌群落和固氮菌群落结构组成,优化土壤微生态环境。沙月霞等[11]研制的微生物菌剂撒施可显著影响土壤细菌群落结构及多样性,降低pH值,增加有机质、全氮、速效钾含量,改善玉米农田土壤健康状况,有效预防玉米茎基腐病。
采用宏基因测序技术探究生物菌剂对土壤微生物群落结构的影响报道较多。侯景清等[12]发现乳酸菌复合制剂对盐碱地土壤微生物群落结构影响较大,可增加碳水化合物活性酶基因序列数目,降低土壤中毒素的基因序列数目。王启全[13]研究了多环芳烃降解菌剂对参与土壤碳、氮、磷及硫元素循环过程的微生物酶功能基因的调控作用。目前利用宏基因组测序技术探索生物制剂对玉米田土壤微生物群落结构及功能基因的影响研究还未见报道。本课题组前期已探明了五谷丰素浸种联合微生物菌剂防治玉米茎基腐病的田间效果、促生增产效果,以及对土壤微生物量、生物酶活性的改善作用。本研究采用宏基因组测序技术,一方面研究五谷丰素浸种联合微生物菌剂撒施后宁夏玉米田土壤微生物群落的物种组成,特别明确其对土壤真菌、细菌和古菌类群的门和属水平丰度的影响,另一方面研究五谷丰素浸种联合微生物菌剂撒施后宁夏玉米土壤微生物功能注释及多样性,主要探明其对碳水化合物活性酶(Carbohydrate-active enzymes,CAZy)、抗生素抗性基因(Antibiotic resistant genes,ARGs)和硝化功能微生物基因的影响,为改善农田土壤微生态环境提供科学参考。
1 材料与方法
1.1 试验药剂及地点
试验药剂:微生物菌剂M1 和M2 是由枯草芽孢杆菌HR15、萎缩芽孢杆菌HR37 和贝莱斯芽孢杆菌HR55 等混合发酵粉剂(30%)、腐植酸(5%)、土壤调节剂(0.4%)、微量元素(0.6%)以及载体(64%)而成的微生物菌剂,其中M1 载体为腐熟烘干羊粪,M2 载体为鸡粪有机肥(包含有机碳25.5%、氮1.63%、磷1.54%、钾0.85%),该菌剂由宁夏农林科学院植物保护研究所研发;五谷丰素粉剂是由放线菌代谢产物制成的微生物菌剂(用于浸种或拌种),由中国农业科学院植物保护研究所提供;20%噁霉灵可湿性粉剂由深圳诺普信生物技术有限公司生产;微生物菌剂MCK由雷邦斯生物技术(北京)有限公司生产。
试验材料为玉米,品种为粒隆915,由北京粒隆种业科技有限公司生产。
试验地点:2020 年在宁夏回族自治区惠农区(106°45'57″E,39°07'31″ N)进行田间试验。试验土壤为草甸土,pH 8.71,碱解氮为96.1 mg·kg-1,有机质为15.9 g·kg-1,有效磷为33.7 mg·kg-1,速效钾为173.7 mg·kg-1,水溶性盐为9.24 g·kg-1,Na+为3.97 cmol·kg-1,Ca2+为2.22 cmol·kg-1,Mg2+为2.51 cmol·kg-1,Cl-为7.28 cmol·kg-1,SO42-为5.51 cmol·kg-1。
1.2 试验设计
试验设置5个处理:EES,20%噁霉灵可湿性粉剂浸种24 h 和土壤表面喷雾(EES-1、EES-2、EES-3);CMCK,五谷丰素浸种24 h和微生物菌剂MCK在土壤表面撒施(CMCK-1、CMCK-2、CMCK-3);CM2,五谷丰素浸种24 h 和微生物菌剂M2 在土壤表面撒施(CM2-1、CM2-2、CM2-3);CM1,五谷丰素浸种24 h和微生物菌剂M1 在土壤表面撒施(CM1-1、CM1-2、CM1-3);CK,清水浸种24 h 和土壤未采用任何药剂处理(CK-1、CK-2、CK-3)。
用4 L 有效浓度为50 mg·L-1的五谷丰素(纯度为58%)菌剂浸泡4 kg 玉米种子,浸种24 h 后晾干。20%噁霉灵可湿性粉剂按照推荐剂量浸种24 h 后种子晾干备用。种植玉米前,将微生物菌剂M1、M2、MCK(600 kg·hm-2)均匀撒施于农田土壤表面,20%噁霉灵可湿性粉剂(推荐剂量)均匀喷施于土壤表面。然后将所有试验小区进行旋耕,深度约20 cm。每个处理4 个重复小区,每个小区面积约70 m2,小区之间用宽度为1 m 的田埂隔开。试验期间进行正常水肥管理和杀虫,不施用任何杀菌剂。
1.3 样本采集
2020 年9 月9 日玉米蜡熟期采集田间土壤,每个小区按照对角线法采集5 点样本,土样混合后装入自封袋;每个处理采集4份样本,然后将相同处理的4份样本混合均匀,分成3 份,自封袋上作好标记。所有样本放入控温采样箱内(内有干冰)带回实验室,保存于-80 ℃冰箱待测。取土器直径为6 cm、长度为20 cm,采集的土壤样本距离玉米根茎部约15 cm,采样深度为0~20 cm。
1.4 DNA提取、建库与宏基因组测序
利用E.Z.N.A.®Soil DNA Kit(Omega Bio-tek,美国)试剂盒进行样品DNA 抽提。完成基因组DNA 抽提后,利用TBS-380 检测DNA 浓度,利用Nano-Drop200 检测DNA 纯度,利用1%琼脂糖凝胶电泳检测DNA完整性。通过Covaris M220(Gene基因有限公司,中国)将DNA 片段化,筛选约400 bp 的片段,用于构建PE 文库。使用NEXTFLEX®Rapid DNA-Seq(Bioo Scientific,美国)建库,由上海美吉生物医药科技有限公司利用Illumina NovaSeq PE150(Illumina,美国)测序平台进行宏基因组测序。
1.5 数据处理与分析
运用fastp(https://github.com/OpenGene/fastp)剪切reads 3'端和5'端的adapter 序列,然后去除质量剪切长度小于50 bp、平均质量低于20 和含N 碱基的reads,保留高质量single-end reads 与pair-end reads[14]。利 用Megahit(https://github.com/voutcn/megahit)软件对测序序列进行拼接,最短contig 长度≥300 bp。采用MetaGene(http://metagene.cb.k.u-tokyo.ac.jp/)软件对拼接contigs 进行ORF 预测,将长度≥100 bp的基因序列翻译为氨基酸序列,获得样本基因预测结果。使用CD-HIT 软件(http://www.bioinformatics.org/cd-hit/)进行聚类(默认参数为90% identity、90%coverage),建立非冗余基因集,选取每类最长基因作为代表序列[15]。运用SOAPaligner(http://soap.genomics.org.cn/)比对样品的高质量reads与非冗余基因集(默认参数为95% identity),获得对应样品的基因丰度信息[16]。
利用Diamond(http://www.diamondsearch.org/index.php,Version 0.8.35)(BLASTP 比对参数设置期望值e-value为1e-5)统计物种分类学信息[17]。运用CAZy数据库的对应工具hmmscan(http://hmmer.janelia.org/search/hmmscan)(比对参数设置期望值e-value 为1e-5)统计碳水化合物活性酶注释信息。采用Diamond(http://www.diamondsearch.org/ index.php)(BLASTP 比对参数设置期望值e-value 为1e-5)统计ARGs抗性功能注释信息。
使用Excel 2016 计算土壤微生物群落门和属水平的物种组成,统计碳水化合物酶类和ARGs 的比例。利用DPS 18.1 进行统计分析,计算平均值±标准误(SE),显著性分析采用最小显著差数法(Least significant ranges,LSD)。
2 结果与分析
2.1 序列组装
对15 个样品的reads 进行过滤处理,共获得1 356 052 816 条clean reads,每个样品的reads 数目范围为83 928 522~107 437 926。对contigs 进行评估发现,contigs 长度的平均N50 及平均N90 分别为566 bp 与399 bp。共获得19 251 162 个ORFs,每个样本的ORFs平均长度为403 bp。样本的序列组装和基因预测结果说明测序结果较好,序列长度可以用于下一步分析。对15 个玉米土壤微生物群落样本的contigs进行物种注释,共获得15 632 个物种,其中细菌占主导地位的95.21%,古菌和病毒分别占4.24% 和0.04%,真核生物(包括真菌)的比例只有0.32%,没有分类注释信息的占比为0.19%。
2.2 生物菌剂施用对玉米田土壤微生物群落多样性及结构的影响
2.2.1 对土壤微生物群落多样性的影响
通过主坐标(PCoA)分析,发现不同处理的土壤微生物群落多样性在门水平上差异较明显(图1)。PCoA的前3个主成分共解释了88.98%的群落差异,其中轴Ⅰ、轴Ⅱ和轴Ⅲ分别为66.50%、16.80%和5.68%,5 个处理的微生物群落在门水平上分布比较分散。Beta分析结果说明施用生物菌剂对玉米土壤微生物群落门水平影响较大。

图1 生物菌剂对玉米田土壤微生物群落β-多样性的影响(门水平)Figure 1 Impact of microbial agents on β-diversity of soil bacterial groups in maize field(phylum level)
图2 显示了生物菌剂施用对属水平的玉米田土壤微生物群落β-多样性的影响。PCoA的前3个主成分共解释了83.53%的群落差异,其中轴Ⅰ、轴Ⅱ和轴Ⅲ分别为57.68%、16.26%和9.59%,属水平上的不同处理微生物群落分布在不同象限,表明生物菌剂施用对属水平的玉米土壤微生物群落多样性影响较大。

图2 生物菌剂对玉米田土壤微生物群落β-多样性的影响(属水平)Figure 2 Impact of microbial agents on β-diversity of soil bacterial groups in maize field(genus level)
2.2.2 对土壤微生物群落门水平的影响
土壤细菌在土壤微生物群落中占据主导地位,玉米田土壤细菌群落中相对丰度>5%的优势菌门主要包括变形菌门(Proteobacteria,32.59%)、放线菌门(Actinobacteria,20.91%)、酸杆菌门(Acidobacteria,10.82%)和芽单胞菌门(Gemmatimonadetes,6.45%)。图3 表明,与CK 相比,4 组处理对相对丰度>1%的土壤细菌门丰度的影响主要表现在变形菌门、放线菌门、拟杆菌门(Bacteriodetes)、厚壁菌门(Fimicutes)、疣微菌门(Verrucomicrobia)的相对丰度增加。生物菌剂(CM1和CM2)处理下变形菌门、放线菌门和厚壁菌门丰度平均分别增加2.58%、4.84%和39.90%,酸杆菌门、芽单胞菌门、绿弯菌门(Chloroflexi)和Candidatus Rokubacteria 丰度平均分别下降9.97%、7.71%、13.53%和3.60%。土壤微生物群落中有2.71%的细菌无法分类。

图3 生物菌剂对玉米田土壤细菌类群门丰度的影响(相对丰度>1%)Figure 3 Impact of microbial agents on phylum abundance of soil bacterial groups in maize field(Relative abundance above 1%)
古菌在土壤微生物群落中的比例为4.24%,奇古菌门(Thaumarchaeota)在土壤微生物群落中的比例为3.43%,广古菌门(Euryarchaeota)的比例为0.55%,泉古菌门(Crenarchaeota)的比例为0.09%,深古菌门(Candidatus_Bathyarchaeota)的占比<0.01%。CM1、CM2、CMCK和EES处理后,土壤中的奇古菌门丰度分别增加了16.28%、36.54%、8.31%和9.06%;CM1 和CM2 处理使广古菌门丰度降低9.09%,CMCK 和EES处理的广古菌门丰度没有变化;泉古菌门和深古菌门丰度没有变化。比较15 个样本的古菌类群(图4)发现,奇古菌门基因拷贝数量在古菌类群中占据主导地位,达到80.74%,其中亚硝化球菌(Nitrososphaera)是最优势菌群,在古菌类群中占比为70.14%,其次为氨氧化古菌(Candidatus_Nitrosocosmicus,21.07%)。广古菌门(Euryarchaeota,13.20%)、泉古菌门(Crenarchaeota,2.08%)和深古菌门(Candidatus_Bathyarchaeota,1.54%)也是古菌类群的优势菌门,洛基古菌门(Candidatus_Lokiarchaeota)占古菌类群约0.09%,未分类古菌的占比为2.04%。

图4 生物菌剂对玉米田土壤古菌类群门丰度的影响Figure 4 Impact of microbial agents on phylum abundance of soil archaeal groups in maize field
土壤真菌在土壤微生物群落中所占的比例非常低,15 组样本检测到9 个真菌门,1 个未分类(图5)。子囊菌门(Ascomycota)占真菌类群主导地位,为64.54%,CM1、CM2、CMCK 和EES 处理后土壤中子囊菌门丰度分别下降2.77%、1.52%、4.76%和1.73%;担子菌门(Basidiomycota)在真菌类群中的占比为20.36%,CM1 和CM2 处理后土壤中担子菌门丰度分别降低2.68%和2.20%,CMCK 和EES 处理后担子菌门丰度分别增加16.53%和3.26%。壶菌门(Chytridiomycota)占真菌类群的比例为4.47%,CM1、CM2 和EES 处理后丰度下降约6.21%,CMCK 处理后丰度不变。球囊菌门(Glomeromycota)的占比为2.08%,4 个处理的丰度均较CK 增加。大约有6.17%的真菌无法分类。

图5 生物菌剂对玉米田土壤真菌类群门丰度的影响Figure 5 Impact of microbial agents on phylum abundance of soil fungal groups in maize field
2.2.3 对土壤微生物群落属水平的影响
所有样本的土壤微生物群落中相对丰度>1%的属有13 个(图6),主要包括芽单胞菌属(Gemmatimona,3.45%)、Gemmatirosa(2.99%)、土壤红杆菌属(Sollrubrobacter,2.57%)、亚硝化球菌属(Nitrososphaera,2.45%)、类诺卡氏菌属(Nocardioides,2.40%)、Pyrinomonas(1.92%)、链霉菌属(Streptomyces,1.57%)、Conexibacter(1.19%)、硝化螺菌属(Nitrospira,1.18%)、鞘氨醇单胞菌属(Sphingomonas,1.16%)、念珠菌固体杆菌属(Candidatus-Solibacter,1.15%)、慢生根瘤菌(Bradyrhizobium,1.10%)和Candidatus-Entotheonella(1.14%),有14.35%的微生物属无法分类,氨氧化古菌属(Candidatus-Nitrosocosmicus,0.75%)、芽孢杆菌属(Bacillus,0.42%)和假单胞菌属(Pseudomonas,0.37%)在土壤微生物群落中的占比较低。
图6 表明生物菌剂施用对玉米田土壤微生物群落属水平的组成影响比较大,CM1、CM2、CMCK 和EES 处理使芽单胞菌属丰度降低了6.50%,但增加了土壤红杆菌属、亚硝化球菌属、类诺卡氏菌属、Pyrinomonas、链霉菌属、硝化螺菌属、鞘氨醇单胞菌属、氨氧化古菌属、芽孢杆菌属和假单胞菌属的丰度。CM1、CM2 和CMCK 处理后土壤中芽孢杆菌属丰度分别是CK 的1.77、1.86 倍和0.86 倍,EES 处理后的丰度没有变化;CM1、CM2 和EES 处理后假单胞菌属丰度分别增加了8.57%、11.43%和2.86%;CM1 和CM2 处理后链霉菌属丰度增加了14.44%,类诺卡氏菌属丰度增加了6.87%。结果说明生物菌剂施用可以增加生防菌的丰度,且效果优于化学农药处理。
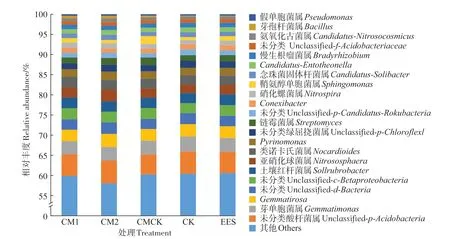
图6 生物菌剂对玉米田土壤微生物群落属水平丰度的影响Figure 6 Impact of microbial agents on genus abundance of soil microbial community in maize field
2.3 生物菌剂施用对玉米田土壤微生物物种功能基因的影响
所有样品的contigs通过基因预测,获得非冗余开放阅读框(ORFs)7 383 980 个,其中228 171 个ORFs预测为CAZy,997个ORFs预测为ARGs。
CAZy 可以降解、修饰及生产糖苷键。图7 显示,CM1 和CM2 处理后土壤微生物的多糖裂解酶(Polysaccharide lyases,PLs)和碳水化合物绑定结构(Carbohydrate-binding modules,CBMs)基因丰度增加,CMCK和EES处理组2种酶的基因丰度下降。样本中不同CAZy 的占比发生较大变化,糖基转移酶(Glycosyl transferases,GTs)和辅助氧化还原酶类(Auxiliary activities,AAs)的占比下降,糖苷水解酶(Glycoside hydrolases,GHs)、碳水化合物酯酶(Carbohydrate esterases,CEs)和碳水化合物绑定结构的占比增加,多糖裂解酶的占比没有发生变化(P>0.05)。

图7 生物菌剂对玉米田土壤微生物CAZy功能基因的影响Figure 7 Impact of microbial agents on the CAZy composition of soil microorganisms in maize field
土壤微生物拥有丰富多样的抗药性和ARGs,微生物的抗药性和ARGs 对公共健康的威胁已成为全球亟待解决的难题。图8 显示,5 组样本的玉米农田土壤中ARGs 基因丰度的变化较大;CM1、CM2、CMCK 和EES 处理后的杆菌肽(Bacitracin)基因丰度较CK 分别下降了5.43%、2.22%、4.76%和2.96%;氟喹诺酮(Fluoroquinolone)、氯霉素(Chloramphenicol)、氨基糖苷(Aminoglycoside)和β-内酰胺(Beta-lactam)类ARGs基因丰度增加。

图8 生物菌剂对玉米田土壤微生物中ARGs组成的影响Figure 8 Impact of microbial agents on the ARGs composition of soil microorganisms in maize field
硝化微生物包括氨氧化微生物(AOA 和AOB)和亚硝酸盐氧化微生物(NOB)。表1 表明,样本土壤中硝化微生物占总体微生物的比例为3.845%~4.701%;不同处理的AOA 硝化细菌基因丰度增加;3个生物菌剂处理增加了AOB 和NOB 的硝化细菌基因丰度,而化学农药EES处理降低了AOB 和NOB 的硝化细菌基因丰度。CM1 和CM2 处理的硝化微生物分别增加了10.61%和21.95%。结果说明生物菌剂处理可以提高土壤硝化微生物参与氮素循环的能力,增加土壤氮营养水平,而化学农药则会降低氮素营养水平。

表1 生物菌剂对玉米田土壤硝化微生物基因丰度的影响(%)Table 1 Impact of microbial agents on the gene abundance of nitrifying microorganisms in maize field(%)
2.4 生物菌剂施用后玉米田土壤微生物群落的主成分分析(PCA)
在纲水平下,PCA 分析前两个主成分解释了98.78%的样本CAZy 差异,其中PC1 和PC2 分别解释了95.61%和3.17%(图9)。通过NMDS 分析发现,5组样本土壤中CAZy 分布差异比较明显(tress:0.001)。ANOSIM 分析表明,CAZy的组间有较大差异(R=0.26,P=0.02)。

图9 玉米田土壤微生物CAZy的主成分分析Figure 9 The principal components analysis of CAZy of soil microorganisms in maize field
PCA 分析中前两个主成分解释了59.33%的样本ARGs 差异,其中PC1 和PC2 分别解释了41.13%和18.20%(图10)。通过NMDS 分析发现,5 组样本土壤中ARGs 呈现明显的分布差异(tress:0.029)。ANOSIM 分析表明,5 组ARGs 抗性基因之间差异明显(R=0.15,P=0.012)。

图10 玉米田土壤微生物ARGs的主成分分析Figure 10 The principal components analysis of ARGs of soil microorganisms in maize field
3 讨论
土壤微生物具有矿化有机质、形成腐殖质、促进土壤养分循环、修复污染土壤等生态服务功能[18-19],是衡量土壤肥力和土壤质量健康的指标之一[20]。土壤微生物常受到肥料、化学农药、种植物种及模式、土壤养分状况等因子影响[21-22]。土壤细菌群落优势菌门主要是变形菌门、放线菌门和酸杆菌门[23]。变形菌门属于富营养菌群,在营养丰富的土壤中会迅速繁殖;绿弯菌门的耐胁迫能力较强,适宜在养分贫瘠的土壤环境中繁殖[24]。溶磷菌肥施用可以显著降低玉米土壤厚壁菌门丰度[25]。单凯等[26]和许艳蕊等[27]的研究发现使它隆处理的玉米非根际土壤中酸杆菌门和绿弯菌门丰度增加,变形菌门和放线菌门丰度降低。本研究的五谷丰素浸种联合微生物菌剂M1 或M2 撒施增加了玉米土壤中变形菌门、放线菌门和厚壁菌门丰度,降低了酸杆菌门、芽单胞菌门、绿弯菌门丰度。这一研究结果与溶磷菌肥的研究结果有相似之处,而与除草剂使它隆的研究结果差异较大。这可能是由于溶磷菌肥与生物菌剂都属于微生物产品,一方面促进了土壤中部分有益微生物生长、抑制了有害微生物的生长,另一方面改善了土壤理化性质、土壤酶活性,提高了土壤微生物量[11]和土壤肥力,适合富营养菌群(变形菌门)生长,而不利于耐胁迫菌群(绿弯菌门)生长。另外,生物菌剂的功能菌株是芽孢杆菌,其施入土壤后直接影响了土壤中芽孢杆菌的相对丰度和基因功能。微生物菌剂M1 和M2 载体的营养成分存在差异,因此也会引起2 个处理的细菌门和属组成结构发生变化。CM1 和CM2 处理增加了土壤红杆菌属、类诺卡氏菌属、链霉菌、鞘氨醇单胞菌属、芽孢杆菌和假单胞菌的丰度。研究报道显示,鞘氨醇单胞菌属常用于有机磷农药污染和石油污染土壤的生物修复[28],类诺卡氏菌属[29]、链霉菌[30]、芽孢杆菌[31]和假单胞菌[32]中很多微生物具有生防和促生效果。芽孢杆菌可以分解土壤有机质,其分解过程中产生的有机酸能够中和土壤中的盐碱,从而降低盐渍化的危害[33-34]。因此,CM1 和CM2 处理可以增强玉米田土壤微生物的生态服务功能,有利于玉米根系土壤健康。
土壤古菌参与土壤元素转化,特别是在氮和碳的地球化学循环中发挥重要作用,对陆地生态系统的影响至关重要[35-37]。厌氧条件下的有机物通过产甲烷古菌产生甲烷气体,硝化作用的氨氧化过程则需要氨氧化古菌[38-39]。亚硝化球菌、硝化螺菌属和氨氧化古菌是促进土壤氮素转化的重要微生物,五谷丰素浸种联合微生物菌剂M1 或M2 撒施增加了玉米田土壤中氨氧化微生物(AOA 和AOB)和亚硝酸盐氧化微生物(NOB)的基因丰度,特别是亚硝化球菌、硝化螺菌属和氨氧化古菌的基因丰度,从而可增加土壤全氮和硝态氮含量[9],提高土壤肥力,改善土壤质量。
土壤微生物群落之间因为争夺营养而存在一定的竞争关系,某些菌群会优先占据营养或生殖位点等资源,那些无法竞争到营养的菌群的生长会受到抑制[40]。生物菌剂施用后可能增强了土壤细菌和古菌对碳、氮等养分的竞争,从而促进了细菌和古菌的生长,降低了部分真菌对养分的竞争,使此类真菌的生长受到了抑制。土壤真菌群落优势菌门为子囊菌门,外源投入物可以显著影响真菌门丰度[41]。由于有机肥比秸秆更易被降解,子囊菌门对配施有机肥的环境喜好性更强,故在配施有机肥模式中子囊菌门的相对丰度更高。施用菌渣有机肥显著增加了土壤中毛霉门丰度,降低了子囊菌门、担子菌门、被孢霉门和壶菌门丰度[42]。木霉菌施用可以降低盐碱地玉米土壤中子囊菌门和球菌门丰度,增加接合菌门和担子菌门丰度[43]。五谷丰素浸种联合微生物菌剂M1 或M2 撒施后,玉米土壤中子囊菌门、担子菌门和壶菌门丰度下降,腐生物质的分解增加,促进了土壤养分循环。微生物菌剂M1 或M2 对镰刀菌、立枯丝核菌等多种植物病原菌有显著拮抗作用,可以抑制土壤中致病菌的丰度,降低土传病害的危害[44]。
CAZy在细菌和真菌等生物体生命活动过程中均具有重要作用[45-46],其参与糖类物质的合成和降解过程,具有维持自然界物质循环的生态功能[47]。微生物的CAZy 可降解植物细胞壁,进而可降解木质纤维素[48]。DAI 等[49]采用宏基因组技术研究发现,在牦牛瘤胃木质纤维素降解过程中,具有水解酶酶活力的蛋白质来自GH5、GH9、GH10等糖苷水解酶家族。五谷丰素浸种联合微生物菌剂M1 或M2 撒施处理后土壤微生物的多糖裂解酶和碳水化合物绑定结构丰度增加,不同CAZy的占比发生较大变化。CAZy基因丰度增加有利于加速玉米田土壤中木质纤维素的降解过程并改善土壤生物酶活性。土壤生物酶检测也证实这一结论,五谷丰素浸种联合菌剂M1 或M2 撒施显著增加土壤中碱性磷酸酶、脲酶、蛋白酶、多酚氧化酶活性(待发表)。ARGs引起的微生物耐药性是人类面临的最紧迫的问题之一,粪肥施用等举措加速了土壤环境中ARGs 的扩散和传播[50-51]。土壤中ARGs 的分布与微生物群落结构密切相关,土壤细菌群落结构对土壤ARGs 组成的影响最大,其中拟杆菌门和厚壁菌门之间关系最为密切[52]。土壤养分和土壤中基因水平转移也是主要影响因素[53]。谷丰素浸种联合微生物菌剂M1 或M2 撒施处理后土壤中杆菌肽和四环素基因丰度下降。由此推测,生物菌剂处理土壤可以降低土壤中杆菌肽和四环素的污染,有利于土壤健康。
4 结论
(1)五谷丰素浸种联合微生物菌剂M1 和M2 增加玉米田土壤细菌的变形菌门、放线菌门和厚壁菌门丰度,降低酸杆菌门、芽单胞菌门、绿弯菌门丰度,增加土壤古菌的奇古菌门和广古菌门丰度,降低土壤真菌的子囊菌门、担子菌门和壶菌门丰度。
(2)五谷丰素浸种联合微生物菌剂M1 和M2 降低玉米田土壤的芽单胞菌属丰度,增加芽孢杆菌属、假单胞菌属、类诺卡氏菌属、链霉菌属、亚硝化球菌属、硝化螺菌属和氨氧化古菌属丰度。
(3)生物菌剂施用增加玉米田土壤微生物的多糖裂解酶和碳水化合物绑定结构基因丰度,降低杆菌肽和四环素基因丰度,增加氟喹诺酮、氯霉素、氨基糖苷和β-内酰胺类等抗生素抗性基因丰度。
(4)生物菌剂施用可以增加玉米田土壤中氨氧化微生物(AOA 和AOB)和亚硝酸盐氧化微生物(NOB)的基因丰度,提高土壤硝化微生物参与氮素循环的能力,增加土壤氮营养水平。
