NLRC3低表达对人肺正常上皮细胞BEAS-2b侵袭迁移的影响
2022-02-14李杰刘裬黄铀新卢洪飞罗耀玲
李杰,刘裬,黄铀新,卢洪飞,罗耀玲
(1.赣南医学院第一附属医院;2.赣南医学院,赣州 341000)
肺癌(lung cancer)是世界上最常见的恶性肿瘤之一,其病死率占恶性肿瘤的第一位,被认为是对人类生命和健康威胁最大的肿瘤[1]。尽管现在肺癌在诊断、分期和治疗方法上有了很大进步,前景并没大幅度改变,在过去的十年里总的5年生存率只有轻微的增加(从15.7%到17.4%)[2]。NLRC3是NLR家族一员,它能够抑制NF-κB控制的主要炎性通路[3-5]。近年来研究发现,NLRC3有潜在的抑癌作用[6-8],有望成为人类癌症的预防和治疗的新靶点。课题组前期研究发现NLRC3在肺癌组织中的表达明显低于癌旁组织。该课题进一步从细胞和分子水平研究NLRC3与肺癌发生发展的关系,通过小RNA干扰技术,使NLRC3在BEAS-2b细胞内低表达,观察低表达NLRC3对细胞侵袭和转移的影响和初步机制。
1 材料与方法
1.1 材料 人肺正常上皮细胞株BEAS-2b细胞购自中科院上海细胞生物研究所细胞库;RPMI-1640培养基、胎牛血清(GIBCO);青链霉素溶液(索莱宝);Lipofectamine 2000;RIPA裂解液(上海碧云天);TRIZOL(Invitrogen);荧光定量PCR试剂盒(bio-rad);Matrigel(BD);Transwell小室(costa);Ecadherin、MMP-2、MMP-9抗体购自Abcam公司,β-actin一抗及相关二抗购自中杉金桥公司;干扰片段si NLRC3、阴性对照序列(siNC)由生工生物(上海)股份有限公司设计合成。
1.2 方法
1.2.1 细胞培养 人肺正常上皮细胞BEAS-2b培养于RPMI-1640培养液(含10%胎牛血清和1%青链霉素溶液);于37℃、5%CO2饱和湿度的细胞培养箱中培养。细胞贴壁生长覆盖达80-90%左右时将细胞进行传代培养。后续实验所用细胞均是取处于对数生长期的细胞,活细胞数达95%以上。
1.2.2 BEAS-2b细胞的si RNA转染方法的确定 取对数生长期的BEAS-2b细胞,胰酶消化、计数,按1.5×105cells/孔来接种于6孔培养板,每孔加入2mL完全培养基。待融合度达50%左右进行转染,将LipofectamineTM2000与荧光FAM标记的阴性siRNA片段(FAM-siNC)按照不同比例进行转染,转染4 h后荧光显微镜下观察转染效率,以确定最佳转染方法(参照siRNA转染说明书进行)。
1.2.3 荧光定量PCR验证干扰效果 转染方法同前。实验分为3组:未转染组(UT)、siNC组、siNLRC3组,每组做2个平行孔。未转染组用等量PBS代替转染试剂,转染4 h后更换成完全培养基继续培养24 h,然后用Trizol提取每孔总RNA,逆转录cDNA后进行荧光定量PCR:NLRC3上游引物:5” -GACATGAAGGCGTTTGGTGT-3” ,下游引物:5” -GCCATAGTAATACGCGGCTG-3” ,长度为153bp;内参β-actin上游引物:5” -TATCCAGGCTGTGCTATCCC-3” ,下 游 引 物:5” -CCATCTCTTGCTCGAAGTCC-3” ,长度为320bp。qRT-PCR条件为:94℃预变性10min;94℃变性15s,60℃退火30s并收集荧光,共40个循环。数据采用相对定量法,以2-△△Ct来进行分析,△Ct=Ct目的-Ct内参,△△Ct=△Ct实验组-△Ct对照组。
1.2.4 Transwell检测低表达NLRC3对BEAS-2b迁移能力的影响 细胞分组、接种及转染方法同前,转染4 h后更换成完全培养基继续培养24 h。然后收集各组的细胞,计数,用含0.1%BSA的无血清培养基重悬,调节细胞浓度为1×106个/mL。吸取各组细胞悬液200μL加入水化后的Transwell小室中,再通过间隙向下腔加入600μL含5%FBS的培养基,将培养板置于37℃、5%CO2培养箱继续培养24h;随后取出Transwell小室,用无菌棉签擦去小室中的细胞,PBS洗3遍再放回原孔中,下腔加入60μL 5 g/L的MTT,继续培养4 h后,弃上清,加DMSO 600μL,振荡10min充分溶解结晶,测A570nm值。
1.2.5 Matrigel检测低表达NLRC3对BEAS-2b侵袭能力的影响按迁移实验方法分组及转染细胞。将基质胶Matrigel进行1:8稀释,取80μL Matrigel包被Transwell小室,置于培养箱内2 h使Matrigel聚集成凝胶。将转染24 h的BEAS-2b细胞,消化、离心收集细胞,用0.1%BSA无血清培养基重悬,计数,调整细胞密度为1×106个/mL,每组细胞悬液分别取200μL接种到小室,另将600μL含10%FBS的1640培养液加到下室;继续常规培养24 h。待培养结束后取出Transwell小室,无菌棉签拭去小室内未发生侵袭转移的细胞并用PBS洗涤3遍,甲醇固定20 min,0.1%结晶紫溶液染色15 min,PBS缓冲液轻轻洗3次。显微镜下随机取5个视野计数侵袭转移细胞数量,重复3次取均数。
1.2.6 Western blot检测低表达NLRC3对E-cadherin、MMP-2和MMP-9蛋白表达的影响 按迁移实验方法分组及转染细胞。转染48h后弃上清,并用PBS洗涤2遍,6孔板中每孔加入500μL蛋白裂解液,置冰上作用30min,期间用移液器反复吹打,以便细胞充分裂解。然后将裂解液全部转移到1.5 mL离心管中,以4℃12000 rpm离心5 min,上清液即为含总蛋白的溶液。蛋白定量(以便统一上样量)后,煮沸,上样(总蛋白约30μg);然后经电泳、切胶、转膜、封闭、一抗孵育、洗膜、二抗孵育、洗膜等过程。最后用ECL发光并在bio-rad凝胶成像仪上成像,并对条带进行灰度值分析。
1.3 统计学分析 运用SPSS18.0软件对数据进行统计分析,结果以(±s)表示;多组数据间的比较采用单因素方差分析(One-Way ANOVA),组间两两比较若方差齐采用LSD法,方差不齐采用Tamhanes” T2(M)。P<0.05为差异有统计学意义。
2 结果
2.1 荧光显微镜筛选转染效率FAM-siNC转染4h后于荧光显微镜下观察转染效果。结果比例为100 pmol∶5μL组的细胞在荧光镜下激发出绿色荧光的细胞约占观察视野下细胞总数的90%以上,且细胞生长状态良好,后续实验均以此转染比例进行细胞转染。结果见图1。
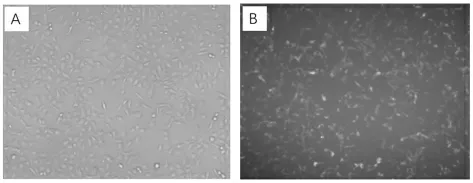
图1 荧光显微镜下观察转染效果Figure 1 Transfection effect under fluorescent microscope
2.2 荧光定量PCR检测干扰效果 荧光定量PCR结果显示:与未转染组(UT)比较,siNC组NLRC3基因表达水平略微降低,无统计学意义(P>0.05);siNLRC3组NLRC3基因表达水平显著降低(P<0.01)。siNLRC3干扰片段干扰效率为77%(相对于阴性片段转染组siNC)。见表1。
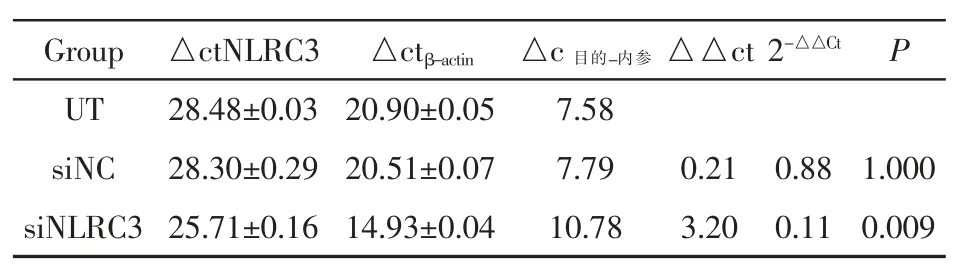
表1 s i NLRC3片段干扰效率(x±s,n=3)Ta b l e 1 s i NLRC3 f r a g me n t i n t e r f e r e n c e e f f i c i e n c y
2.3 NLRC3低表达后对BEAS-2b细胞迁移能力的变化Transwell迁移实验结果表明,siNLRC3低表达组穿过膜的细胞数比未转染组UT和阴性干扰组siNC明显增多(P<0.05)。结果见表2和图4。
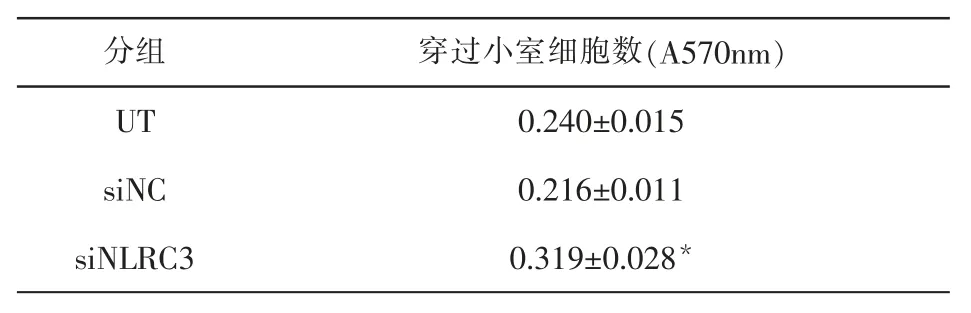
表2 NLRC3低表达后对BEAS-2B细胞迁移能力的影响(x±s,n=3)Table2 The Effectsof silencing NLRC3 on migration of BEAS-2b
2.4 NLRC3低表达后对BEAS-2b细胞侵袭能力的影响Matrigel基质胶检测BEAS-2b细胞侵袭能力变化,镜下观察拍照(10×)见图5A。计数穿膜细胞数:UT组(266.33±15.63)、si NC组(296.0±27.22)、siNLRC3组(436.33±31.01)。统计分析显示:与UT组和siNC组相比,siNLRC3组穿过基质胶的细胞数量明显增多,差异有统计学意义(P<0.05),如图5B所示。
2.5 Western blot检测低表达NLRC3对E-cadherin、MMP-2、MMP-9蛋白表达的影响 Western blot结果显示,与未转染组(UT)和阴性转染组(si NC)相比,NLRC3低表达组(si NLRC3)中E-cadherin蛋白表达水平下调(P<0.01),MMP-2、MMP-9蛋白表达水平上调(P<0.05)。结果如图6所示。
3 讨论
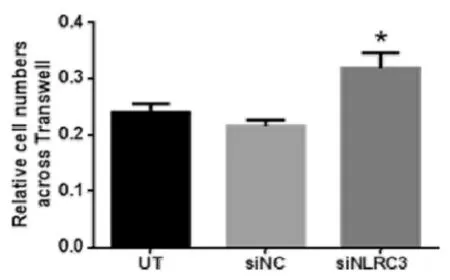
图2 NLRC3对BEAS-2B细胞迁移能力的影响Figure 2 The effect of NLRC3 on the migration ability of BEAS-2b cells.*P<0.05 compared with UT group.
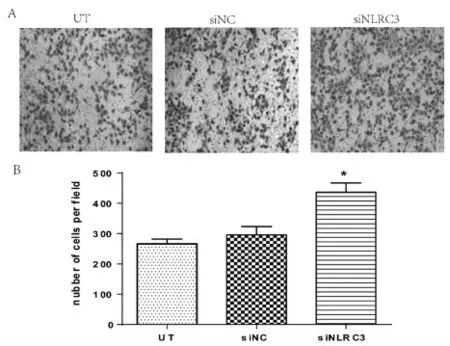
图3 NLRC3表达降低后对BEAS-2B细胞侵袭能力的影响Figure 3 Effect of reduced expression of NLRC3 on the invasive ability of BEAS-2B cells.P<0.05 compared with UT group(n=3).
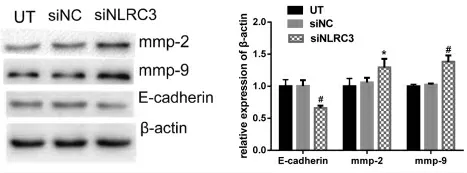
图4 NLRC3表达降低后对E-caherin、mmp-2、mmp-9蛋白表达水平的影响Figure 4 Effect of NLRC3 expression on the expression levels of E-caherin,mmp-2,and mmp-9 proteins.*P<0.05、#P<0.01 compared with UT group(n=3).
NLRC3(又称CLR16.2,NOD3)是2005年才鉴定出来的、属于NLR家族中的一员[9]。2012年Schneider等首次发现NLRC3的特殊抗炎症作用,随后的研究进一步证实它具有负调控固有免疫应答的作用[3]。直至2015年才首次发现NLRC3在肿瘤发生中的重要作用[6]。Liu R等研究发现NLRC3在临床结肠癌组织中的表达量显著低于健康组织[10]。Karki等[6]课题组研究发现NLRC3-/-小鼠易患结肠炎和结直肠癌,研究发现NLRC3可通过抑制PI3K-mTOR信号通路的激活而抑制结肠癌的发生。禚映辰等[11]研究发现NLRC3在肺腺癌和肺鳞癌中的表达与正常组织相比显著降低,NLRC3的表达促进了免疫细胞的浸润。课题组前期在临床标本分析中发现NLRC3在肺癌中表达显著低于癌旁组织。为进一步证明NLRC3作用及功能,实验选用上皮肺正常细胞株BEAS-2b为细胞模型,通过转染干扰片段siNLRC3以干扰NLRC3的表达,检测NLRC3低表达后对细胞侵袭和迁移的影响。实验首先设计合成NLRC3的小干扰片段siNLRC3,并通过荧光定量PCR检测干扰效果,结果表明siNLRC3片段干扰效率为77%,说明干扰有效。
肿瘤的侵袭转移是肿瘤恶性进展的重要因素[12]。NLRC3基因与侵袭转移是否有关联呢?利用Transwell实验进行验证,在Transwell迁移实验中,因细胞穿过Transwell小室的细胞相对较多且分布不均匀,故传统显微镜拍照计数法误差相对较大;本实验改进方法使检测结果误差较小,即利用穿过小室的细胞(均是活细胞)使MTT还原为水不溶性的蓝紫色结晶甲臢,DMSO溶解甲瓒,并在570nm处有最大光吸收。根据测得的吸光度值间接反映穿过小室的细胞数量。Transwell迁移实验结果表明siNLRC3低表达后穿过小室进入下室的细胞明显增多,说明细胞的迁移能力增加。Matrigel基质胶检测结果表明细胞的侵袭能力增强。该结果与程乐达等[13]研究结果一致。
肿瘤的侵袭转移是肿瘤细胞与宿主细胞之间相互作用的连续过程,该过程是复杂多步骤的[14]。首先是肿瘤细胞降低粘附力,才能从肿瘤母体脱落;目前认为钙粘蛋白(E-cadherin)与肿瘤细胞粘附力降低关系最密切的,其表达降低或缺失常与侵袭转移有重要联系。本实验结果表明降低NLRC3表达后,E-cadherin蛋白表达降低(P<0.05),提示细胞粘附能力下降,利于细胞的侵袭迁移。其次是细胞外基质和基底膜的降解,这是肿瘤侵袭转移的一关键环节,基质金属蛋白酶是目前已知能降解细胞外基质的唯一酶类[15]。MMP-2(又名明胶酶A)和MMP-9(又名明胶酶B),可降解IV型胶原和明胶基质;这两种酶与肿瘤扩散和侵袭强度相关[16-17]。蛋白检测结果表明NLRC3低表达后MMP-2、MMP-9蛋白表达水平上调,可降解细胞外基质,利于细胞的侵袭转移。
综上,NLRC3基因低表达后可引起E-cadherin蛋白表达降低,而MMP-2、MMP-9蛋白表达升高,促进BEAS-2b细胞的侵袭和转移。
