血清ICAM-1、hs-CRP及MCP-1与急性脑梗死病人颈动脉斑块性质的相关性
2022-01-12刘爱菊冯肖亚陈兴旺吕涌涛赵修敏
刘爱菊,刘 磊,冯肖亚,陈兴旺,吕涌涛,赵修敏
急性脑梗死(acute cerebral infarction,ACI)是中老年人常见疾病,随着社会老龄化的逐步加剧,ACI发病率、病残率、病死率逐渐增高,严重威胁病人生命安全,降低病人生活质量[1]。颈动脉狭窄是ACI的危险因素之一,动脉粥样硬化斑块不稳定引起的破裂、糜烂、脱落导致血管堵塞是ACI的主要发病机制[2-3]。过度表达炎性细胞因子在ACI发生发展中起重要作用[4]。超敏C反应蛋白(hypersensitive C reactive protein,hs-CRP)[5]、细胞间黏附分子(intercellular cell adhesion molecule,ICAM-1)均参与动脉粥样硬化斑块形成过程[6]。而核细胞趋化蛋白-1(monocyte chemotaxis protein-1,MCP-1)是动脉粥样硬化斑块炎症反应和单核细胞募集的标志物[7]。目前ICAM-1、hs-CRP、MCP-1与ACI病人颈动脉斑块性质是否存在关联尚不完全明确,ICAM-1、hs-CRP、MCP-1能否为颈动脉斑块性质鉴别提供有效信息亦尚不清楚,鉴于此,本研究选择105例ACI病人检测血清ICAM-1、hs-CRP、MCP-1水平和颈动脉斑块性质,分析其间相关性,旨在为临床诊疗提供理论依据。
1 资料与方法
1.1 一般资料 选择2017年5月至2019年10月我院神经内科收治的105例ACI病人,纳入标准:(1)经颅脑CT或MRI证实且符合2014年中国急性缺血性脑卒中诊断标准[8];(2)年龄50~70周岁,性别不限;(3)无颈动脉畸形、颈动脉瘤。排除标准:(1)出血性脑卒中、颅脑创伤、脑出血病人;(2)合并恶性肿瘤、颅脑肿瘤病人;(3)急慢性感染、血液疾病、免疫疾病;(4)临床资料不完整。收集病人临床资料,包括一般情况(年龄、性别、体质量等),血压、既往病史(高血压、糖尿病、高脂血症、冠心病、ACI家族史等)、吸烟史、饮酒史。本研究获得我院伦理会批准,所有入组者均知情同意,签署同意书。
1.2 血清ICAM-1、hs-CRP、MCP-1及相关生化指标检测 所有受试者均由我院经标准化培训医务人员采集清晨空腹12 h以上静脉血5~10 mL,室温静置待血液凝固后取上清液于离心管(排除乳糜血标本),置于TDZ4-WS低速自动平衡离心机(长沙湘智离心机仪器有限公司)4 ℃ 3 000 r/min离心15 min(离心半径10 cm),取血清保存于-80 ℃超低温冰箱(Thermo Fisher公司),48 h内完成待检。运用意大利BIOBASE2000型全自动酶免分析仪酶联免疫吸附试验测定hs-CRP水平,试剂为美国Epitope Diagnostics公司。双抗体夹心酶联免疫吸附试验检测血清ICAM-1水平,试剂盒购自碧云天生物技术研究所。酶联免疫吸附试验测定MCP-1水平,试剂盒购自北京健乃喜生物技术有限公司。西门子ADVIA2400型全自动生化分析仪检测总胆固醇(total cholesterol,TC)、三酰甘油(total triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)。
1.3 颈动脉超声检查 HD7XE 彩色多普勒超声波诊断仪(美国飞利浦公司),11L-D 线阵探头(频率5~12 MHz),病人平卧颈部垫一软枕,头稍后仰充分暴露颈部,二维灰阶超声沿着锁骨内侧→锁骨上→枕后→胸锁乳突肌前缘顺序依次扫查颈总动脉、颈内动脉、颈外动脉分支,观察血管走行、管腔有无狭窄、扩张、扭曲等,测量颈动脉内-中膜厚度(intima-media thickness,IMT),选取3次测量平均值。IMT定义为动脉管腔内膜交界至中膜、外膜交界垂直距离。根据IMT值将病人分为0.9 mm
1.4 统计学方法 采用单因素方差分析和q检验、t检验、χ2检验、Pearson相关分析、多元logistic回归分析和受试者工作特征曲线(receiver operating characteristic curve,ROC)分析。
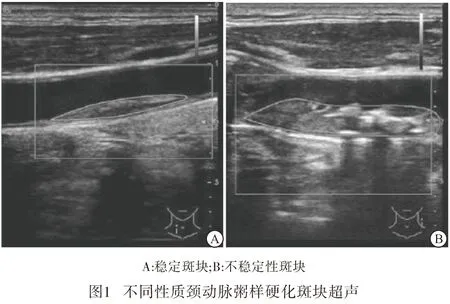
2 结果
2.1 基线资料及血清ICAM-1、hs-CRP及MCP-1水平比较 易损斑块组合并高血压比例、合并高血脂比例、合并糖尿病比例、收缩压、吸烟史比例、TC、LDL-C、IMT、血清ICAM-1、hs-CRP及MCP-1水平均高于稳定斑块组(P<0.01)。2组性别、年龄、体质量、舒张压、冠心病比例、饮酒史比例、ACI家族史比例、TG、HDL-C差异均无统计学意义(P>0.05)(见表1)。
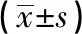
表1 基线资料、血清ICAM-1、hs-CRP及MCP-1水平比较
2.2 不同IMT值AIC病人血清ICAM-1、hs-CRP及MCP-1水平比较 血清ICAM-1、hs-CRP、MCP-1水平在0.9 mm
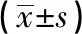
表2 不同IMT值AIC病人血清ICAM-1、hs-CRP及MCP-1水平比较
2.3 ACI病人颈动脉粥样硬化斑块不稳定的危险因素分析 以ACI病人颈动脉斑块性质(1=不稳性,0=稳定)为因变量,以高血压(赋值:1=是,0=否)、高血脂(赋值:1=是,0=否)、糖尿病(赋值:1=是,0=否)、收缩压(连续性变量)、吸烟史(赋值:1=是,0=否)、TC(连续性变量)、LDL-C(连续性变量)、IMT(连续性变量)、ICAM-1(连续性变量)、hs-CRP(连续性变量)、MCP-1(连续性变量)为自变量,建立logistic回归模型。校正了年龄、性别混杂因素,合并糖尿病、LDL-C、ICAM-1、hs-CRP、MCP-1均是ACI病人颈动脉粥样硬化斑块不稳定的危险因素(P<0.05~P<0.01)(见表3)。
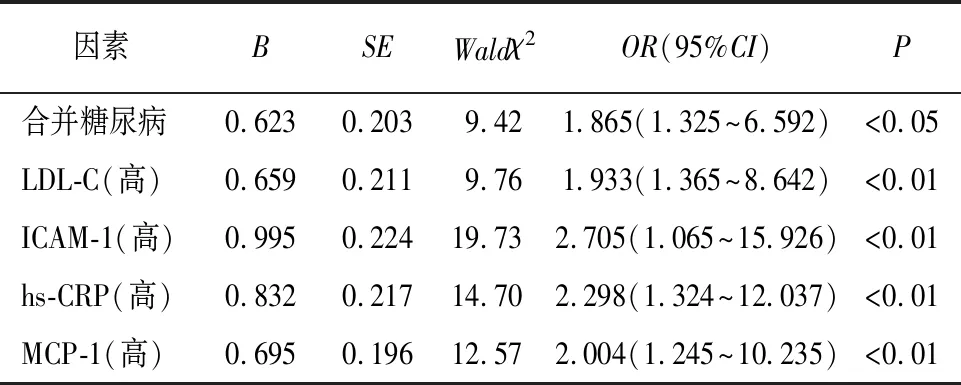
表3 影响ACI病人颈动脉粥样硬化斑块不稳定的logistic回归分析
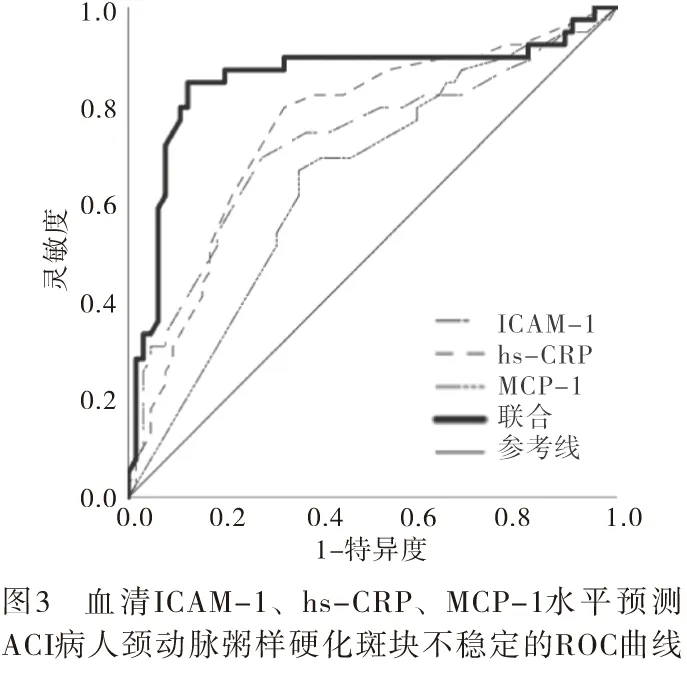
2.4 ACI病人颈动脉粥样硬化斑块不稳定的ROC分析 血清ICAM-1、hs-CRP、MCP-1、ICAM-1+hs-CRP+MCP-1水平预测ACI病人颈动脉粥样硬化斑块不稳定的曲线下面积(AUC)分别为0.722(95%CI:0.615~0.829,P<0.01)、0.753(95%CI:0.655~0.852,P<0.01)、0.646(95%CI:0.537~0.755,P<0.05)、0.852(95%CI:0.761~0.942,P<0.01)(见图3)。ICAM-1+hs-CRP+MCP-1高于单独ICAM-1、hs-CRP、MCP-1预测价值(z=2.35、2.01、2.99,P<0.05),ICAM-1、hs-CRP、MCP-1、ICAM-1+hs-CRP+MCP-1水平预测ACI病人颈动脉粥样硬化斑块不稳定的界值、灵敏度、特异度、阳性预测值、阴性预测值见表4。
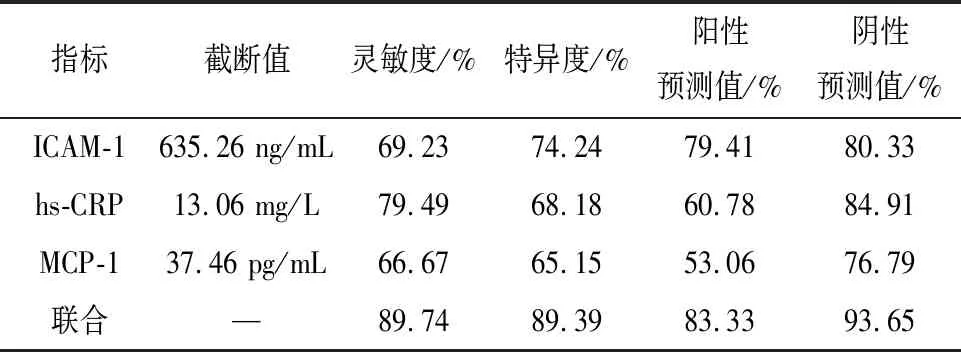
表4 ICAM-1、hs-CRP、MCP-1、ICAM-1+hs-CRP+MCP-1预测ACI病人颈动脉粥样硬化斑块不稳定的效能
3 讨论
颅外段动脉疾病是ACI发病的基础,常见动脉疾病包括颈动脉粥样硬化斑块形成引起的颈动脉狭窄或阻塞、斑块破裂和糜烂[11]。颈动脉斑块形成、IMT值、稳定性等是ACI最常见和最重要的危险因素[12],斑块不稳定性增加了ACI发病风险。斑块不稳定是由纤维帽厚度和固定程度等决定,随着对ACI发病机制的不断深入研究,发现炎症系统过度反应在颈动脉斑块不稳定性中发挥促进作用[13-14]。探讨与颈动脉斑块不稳性相关生物学指标有助于评估病情、危险分层和预后预测。
CRP由巨噬细胞活化后分泌的白细胞介素-6(interleukin-6,IL-6)刺激肝细胞产生的急性时相反应蛋白,被认为血管炎症标志物[15]。局部脑组织缺血缺氧后,炎性介质IL-6大量释放,诱导CRP 产生,诱发内皮细胞表达黏附因子和趋化因子,激活单核细胞释放炎性细胞因子,导致动脉粥样硬化血栓形成[16]。MCP-1由内皮细胞、血管平滑肌细胞、成纤维细胞等释放,是炎症反应的始动因子[17]。动脉粥样硬化斑块的形成是炎性因子和黏附分子相互作用的结果[18],ICAM-1是一类位于细胞表面介导细胞与细胞、细胞与细胞外基质黏附相互作用的糖蛋白,表达于内皮细胞、单核细胞和淋巴细胞等。ACI发生后脑梗死区域缺血缺氧刺激下,内皮细胞、单核细胞等大量释放MCP-1,激活炎症反应,炎性介质释放诱导hs-CRP产生,hs-CRP可进一步够诱导单核/巨噬细胞的炎症反应,促使MCP-1释放,在炎性因子共同作用下内皮细胞产生ICAM-1,介导各种白细胞、单核细胞、巨噬细胞、T淋巴细胞、血小板与血管壁黏附,加剧ACI病情进展。
本研究发现ACI病人斑块不稳定组血清hs-CRP、ICAM-1、MCP-1水平均高于斑块稳定组,hs-CRP、ICAM-1、MCP-1随着IMT值增加而升高,回归分析结果显示hs-CRP、ICAM-1、MCP-1升高是颈动脉斑块不稳定性的危险因素,说明hs-CRP、ICAM-1、MCP-1参与颈动脉斑块形成和斑块不稳定性进展过程。XU等[19]研究显示CRP与ACI病人颈动脉斑块易损性相关,可用于颈动脉斑块危险分层。刘春苗等[20]研究显示,合并糖尿病ACI病人血清ICAM-1水平明显升高,血清ICAM-1水平随着颈动脉斑块严重程度的加重而升高。HOKE等[21]研究显示,ICAM-1参与动脉粥样硬化斑块的不稳定过程,是颈动脉粥样硬化病人全因死亡和心血管疾病死亡的强有力预测因子。颈动脉粥样硬化斑块内MCP-1表达明显升高,血清MCP-1水平随着斑块临床分级的增高而升高[22]。HE等[23]同样发现血清MCP-1水平与脑梗死病人动脉粥样硬化及斑块稳定性相关。
hs-CRP参与斑块不稳定性进展的机制为:中性粒细胞、巨噬细胞和淋巴细胞过度释放炎性因子IL-6,促使hs-CRP过度合成,导致炎症级联反应加重血管损伤,其次hs-CRP可介导巨噬细胞吞噬LDL促使泡沫细胞形成,导致不稳定斑块形成。ICAM-1参与ACI病人颈动脉斑块不稳定性的机制尚不十分清楚,可能的机制为:白细胞黏附及其跨内皮细胞迁移在动脉粥样硬化形成阶段起着重要作用,ICAM-1由内皮细胞在炎症反应中产生,并调节单核细胞、巨噬细胞、T淋巴细胞、血小板与血管壁的黏附反应,ACI病人过度炎症反应和ICAM-1高度表达加速动脉粥样硬化进程[18,24]。ICAM-1通过白细胞整合蛋白受体使白细胞与内皮细胞结合,并在内膜中跨内膜迁移,使白细胞在血管壁中积聚[25]。MCP-1参与ACI颈动脉斑块不稳定的机制为:MCP-1与其受体CCR-2结合趋化诱导单核细/巨噬细胞向血管内皮受损部位迁移,大量吞噬脂质形成泡沫细胞,导致动脉粥样硬化斑块形成。随着粥样硬化斑块形成和进展,进一步促使MCP-1释放,加剧动脉粥样硬化进程,同时巨噬细胞表达血管生长因子,激活并促使单核细胞/巨噬细胞向斑块内部迁移,削弱斑块纤维帽屏障功能,最终导致斑块不稳定增加、破裂脱落[26]。
本研究进一步构建ICAM-1、hs-CRP、MCP-1水平预测ACI病人颈动脉粥样硬化斑块不稳定模型,发现ICAM-1、hs-CRP、MCP-1对ACI病人颈动脉斑块不稳定预测均具有一定价值,且联合三项指标可提高预测准确性,说明ICAM-1、hs-CRP、MCP-1可作为评估ACI颈动脉斑块破裂、脱落,引发血栓的风险。提示临床对于ICAM-1、hs-CRP、MCP-1水平升高的病人应积极给予抗动脉粥样硬化治疗,以降低脑血管疾病的发生和进程。
综上,ACI不稳定颈动脉斑块病人血清ICAM-1、hs-CRP、MCP-1水平明显升高,其水平与颈动脉IMT厚度、斑块稳定性密切相关,可作为颈动脉斑块破裂脱落的预测因子。鉴于ICAM-1、hs-CRP、MCP-1在ACI不稳定颈动脉斑块形成过程中的作用,ICAM-1、hs-CRP、MCP-1可能作为治疗ACI的新靶点。
