牦牛CEBPα基因克隆及在脂肪细胞中的表达模式
2022-01-10岳永起华永琳贾逸格熊显荣
岳永起,华永琳,贾逸格,李 键,熊 燕,熊显荣
(1.西南民族大学,青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;2.西南民族大学 畜牧兽医学院,四川 成都 610041;3.青藏高原动物遗传资源保护与利用四川省重点实验室,四川 成都 610041)
牦牛生活在高寒低氧地区、具有重要文化和生产意义,被称为高原上的生命之舟。牦牛肉营养价值丰富,是符合现代市场需求的绿色食品[1-2]。脂肪组织的生长发育是影响牦牛肉品质的关键因素之一。脂肪组织的沉积能力与脂肪细胞分化的过程密切相关,该过程是一个系统且复杂的过程,受多个转录因子相互协同作用[3]。
增强子结合蛋白α(CCAAT/Enhancer binding protein alpha,CEBPα)是碱性亮氨酸拉链蛋白家族的一个亚家族(增强子结合蛋白家族:CCAAT Enhancer binding protein,C/EBPs)中最早被发现的成员[4]。早期研究显示,CEBPα基因在骨髓组织细胞分化和机体免疫等过程中发挥重要作用[5-7]。随后有研究报道了CEBPα在脂肪细胞分化过程中的作用[8-9],CEBPα受CEBPβ、KLFs家族等转录调控因子调控,同时它还可以调控PPARγ、胆固醇调节元件结合蛋白(Sterol-regulatory element binding proteins, SREBPs)等来调控脂肪细胞的分化[3, 10]。牟彦双等[11]通过添加油酸来探究鸡前体脂肪细胞分化过程中CEBPα基因的表达,发现在脂肪细胞分化过程中表达较晚。张萌萌等[12]研究发现,CEBPα基因在牛肌内前体脂肪细胞分化早期开始表达,分化后期表达量明显增加,说明CEBPα基因在不同物种脂肪细胞的表达模式存在差异。上述研究结果表明,CEBPα基因对于调控畜禽脂肪沉积有重要作用,但目前尚未有研究报道CEBPα基因在牦牛脂肪组织中的作用。
因此,本试验以牦牛为研究对象,克隆了牦牛CEBPα基因的整个CDS区并预测了蛋白结构和功能。通过qRT-PCR检测了CEBPα基因在牦牛各组织中的表达及牦牛脂肪细胞中的表达模式,为深入研究CEBPα基因在牦牛脂肪组织中的功能研究提供基础数据。
1 材料和方法
1.1 样本采集
试验所用动物为4岁左右的金川公牦牛和麦洼公牦牛各4头,均由四川阿坝羌族藏族自治州金川县庆林乡牦牛养殖场提供。采集牦牛的心、肝、脾、肾、胃、小肠、皮下脂肪、内脏脂肪和肌肉组织。采集的组织样品用高温灭菌的PBS清洗后,放入2 mL冻存管置于液氮罐带回实验室。采集的皮下脂肪组织用PBS清洗后,放入含有5×双抗(PS)的DMEM培养基中,迅速带回实验室分离牦牛原代皮下脂肪细胞。
1.2 主要试剂
TRIzol购自成都擎科梓熙生物技术有限公司,PrimeScriptRTMaster Mix购自TaKaRa,SYBR Real-time PCR mixture试剂购自BioTeke,Gel Extraction Kit(100)胶回收试剂盒购自上海索莱宝生物科技有限公司。细胞培养所用试剂耗材均购自成都鹏世达有限公司。氯仿、无水乙醇均为国产分析纯,购自成都鹏世达有限公司。
1.3 细胞培养
采用经典的胶原酶消化法分离牦牛原代皮下脂肪细胞。即将脂肪组织剪碎,加入适量1 mg/mL Ⅰ型胶原酶,37 ℃水浴锅消化1 h,之后加入细胞培养液(含10%的FBS和1% PS的DMEM培养基)终止消化,1 700 r/min离心5 min,后将沉淀重悬,接种在10 cm培养皿中,放入37 ℃、5% CO2的细胞培养箱中培养。第2天用PBS清洗2~3次,每2 d更换1次培养液,待细胞融合至80%时诱导分化,收集0,3,6,9 d的细胞样品用于提取RNA。
1.4 RNA提取及cDNA合成
使用TRIzol法提取组织和细胞样品总RNA,RNA的质量和浓度通过核酸浓度测定仪进行评估,OD260/280在1.8~2.0被用于合成cDNA。按PrimeScriptRTMaster Mix试剂盒的说明书合成cDNA。
1.5 引物设计
根据NCBI公布的牦牛预测序列(XM_005893918.2)设计基因序列,利用Primer premier 5.0软件设计引物,引物由成都擎科梓熙生物技术有限公司合成。引物信息见表1。
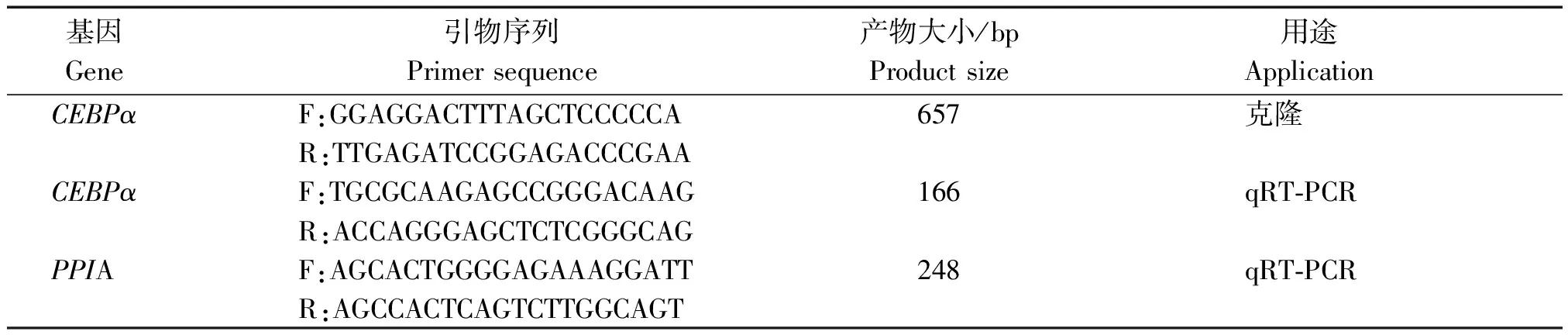
表1 PCR引物序列Tab.1 PCR primer sequences
1.6 PCR扩增及克隆
以牦牛皮下脂肪的cDNA为模板,利用聚合酶链式反应进行目的基因的扩增。PCR反应体系如下:上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,cDNA模板(1 000 ng/μL)1 μL,ddH2O 5.5 μL,PCR Mix 7.5 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,61 ℃ 40 s,72 ℃ 1 min,35个循环;72 ℃ 5 min。对PCR产物进行凝胶电泳。电泳完成后,将凝胶在紫外下照胶,将目的片段进行切割置于1.5 mL离心管中。参照胶回收试剂盒对目的片段进行胶回收。回收产物与pGM-T载体进行过夜连接,其中使用抗生素为氨苄(浓度100 mg/mL)。将连接产物转化入大肠杆菌DH5α感受态细胞,在37 ℃恒温培养箱中培养12~16 h,挑选3个阳性菌落做菌液PCR。将阳性菌液送至成都擎科梓熙生物技术有限公司进行双向测序。
1.7 实时荧光定量PCR
将反转录后的各组织和细胞样品cDNA为模板,以PPIA为内参基因,检测CEBPα的表达量。qRT-PCR反应体系15 μL:模板cDNA (100 ng/μL)3 μL,上、下游引物(10 μmol/L)各0.5 μL,SYBR®Premix Ex TaqTMⅡ 7.5 μL,ddH2O 3.5 μL。反应条件:94 ℃ 2 min;94 ℃ 15 s,60 ℃ 15 s,72 ℃ 30 s,共45个循环。每个样本重复3次。
1.8 Bodipy染色
收集诱导分化9 d的细胞样品,用PBS洗3次,4%多聚甲醛固定30 min;PBS洗3次,用终浓度2 μmol/L的Bodipy染色液染色30 min;PBS洗3次,加入DAPI染色10 min,荧光显微镜下拍照。
1.9 生物信息学分析
根据获得的牦牛CEBPα的CDS序列分别做以下几个方面的生物信息学分析:①通过NCBI在线网站的 ORF Finder ( https:/ /www.ncbi.nlm.nih.gov /orffinder/) 寻找开放阅读框,获得氨基酸序列。②用DNAMAN软件进行同源性比对,然后利用MEGA 5软件构建系统发育树。③ProtParam 软件分析牦牛CEBPα蛋白的理化性质。④用ProtScale 软件在线分析牦牛CEBPα蛋白的亲疏水性。⑤用Tmpred、NetPhos 2.0 Server在线软件分析CEBPΑ蛋白的跨膜结构和磷酸化位点。⑥用HNN和Phyre2在线软件分析CEBPα蛋白的二级、三级结构。
1.10 数据分析
数据表示为平均值±标准误。使用GraphPad Prism 8.0 软件进行显著性分析,其中每组数据3个重复(n=3),P<0.05表示差异显著。
2 结果与分析
2.1 牦牛CEBPα基因克隆及同源性分析
以牦牛皮下脂肪组织的cDNA为模板,利用PCR扩增获得牦牛CEBPα基因全长为657 bp,与预测序列一致(图1)。NCBI ORF Finder在线网站进行开放阅读框分析,发现开放阅读框大小为645 bp,编码214个氨基酸。
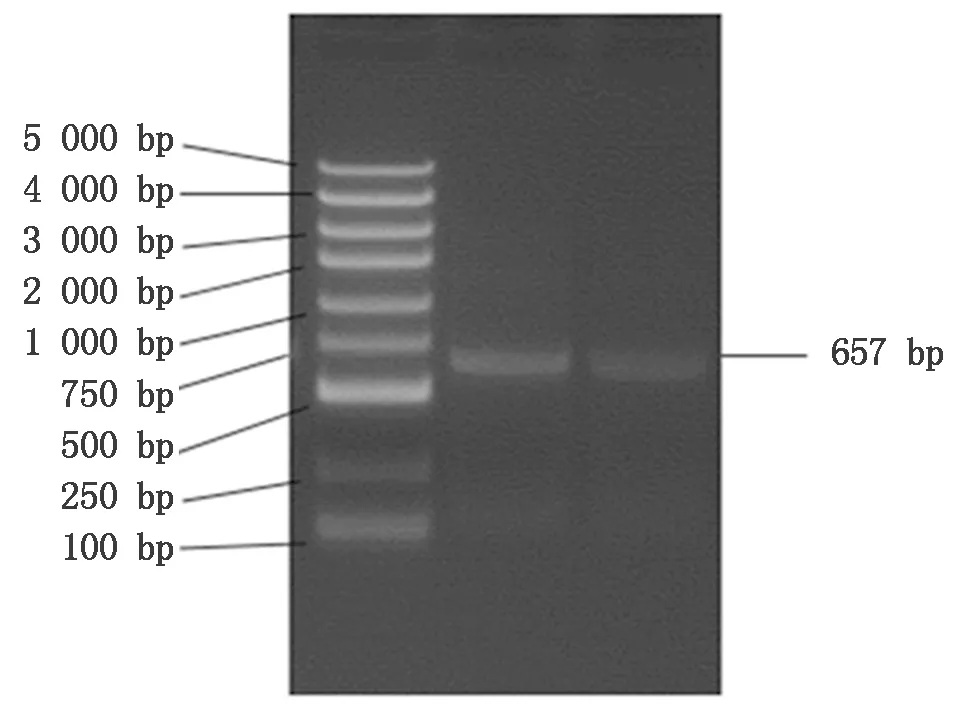
图1 牦牛CEBPα基因PCR扩增产物Fig.1 PCR amplification products of CEBPα gene in yak
牦牛与大西洋鲑、普通牛、大鼠、鸡、绵羊、小鼠、猕猴、人的CEBPα基因核苷酸和氨基酸序列进行同源比对(表2)。可知牦牛与普通牛的核苷酸同源性最高,为99.73%,与大西洋鲑的核苷酸同源性最低,为73.86%;牦牛与小鼠和大鼠的氨基酸同源性相对较高,为100%,与普通牛的氨基酸同源性为99.19%,与大西洋鲑的氨基酸同源性低,为75.58%。以核苷酸序列构建系统进化树,聚类结果表明(图2),牦牛与普通牛和绵羊亲缘关系较近,与大西洋鲑的亲缘关系最远。
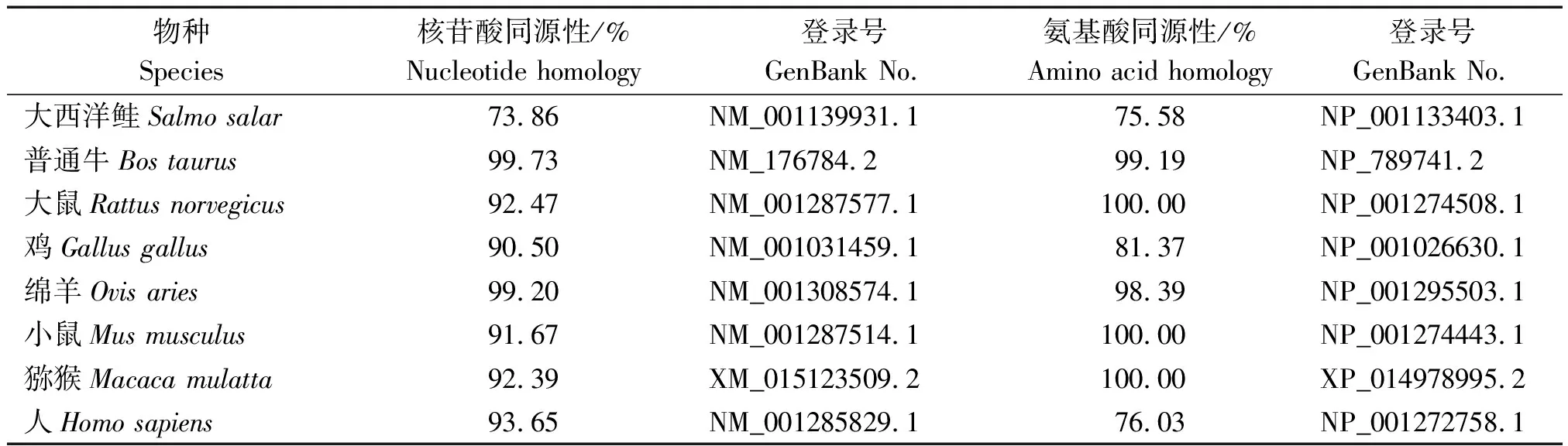
表2 牦牛CEBPα基因与其他已知物种的核苷酸、氨基酸序列对比结果Tab.2 Comparison results of nucleotide and amino acid sequences of CEBPα gene of yaks and other known species

图2 牦牛与其他物种的CEBPα基因系统进化树Fig.2 Genetic phylogenetic tree of CEBPα in yaks and other species
2.2 牦牛CEBPα蛋白结构及功能预测
牦牛CEBPα蛋白分子质量为23.267 73 ku,分子式为C1004H1574N302O325S6,氨基酸数为213,含19种氨基酸,其中Ala和Pro含量较高,所占比例分别为11.2%,9.8%,Cys含量较低,所占比例为0.9%(表3)。CEBPα蛋白理论等电点(pI)为5.59,带正电荷的残基总数(Arg+Lys)为27,带负电荷的残基总数(Asp+Glu)为32。其在哺乳动物的尚未成熟的红细胞中半衰期为30 h,不稳性定指数(Ⅱ)为57.23,属于不稳定蛋白,脂溶指数为57.57,亲水性的平均值(GRAVY)为-0.844,为亲水蛋白。
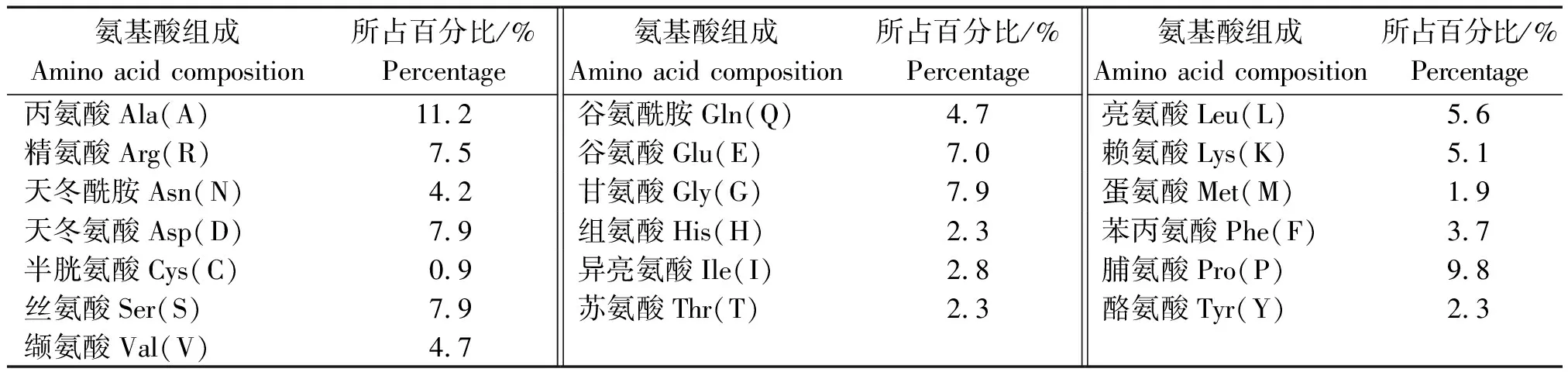
表3 牦牛CEBPα基因氨基酸组成Tab.3 Amino acid composition of CEBPα gene in yak
CEBPα蛋白 19个磷酸化位点,包括Ser(3、17、21、27、40、61、65、125、130、147、180、197),Thr(158、166、185),Tyr(7、67、106、208),其中红色、绿色、蓝色分别代表丝氨酸、苏氨酸、酪氨酸的磷酸化位点(图3)。
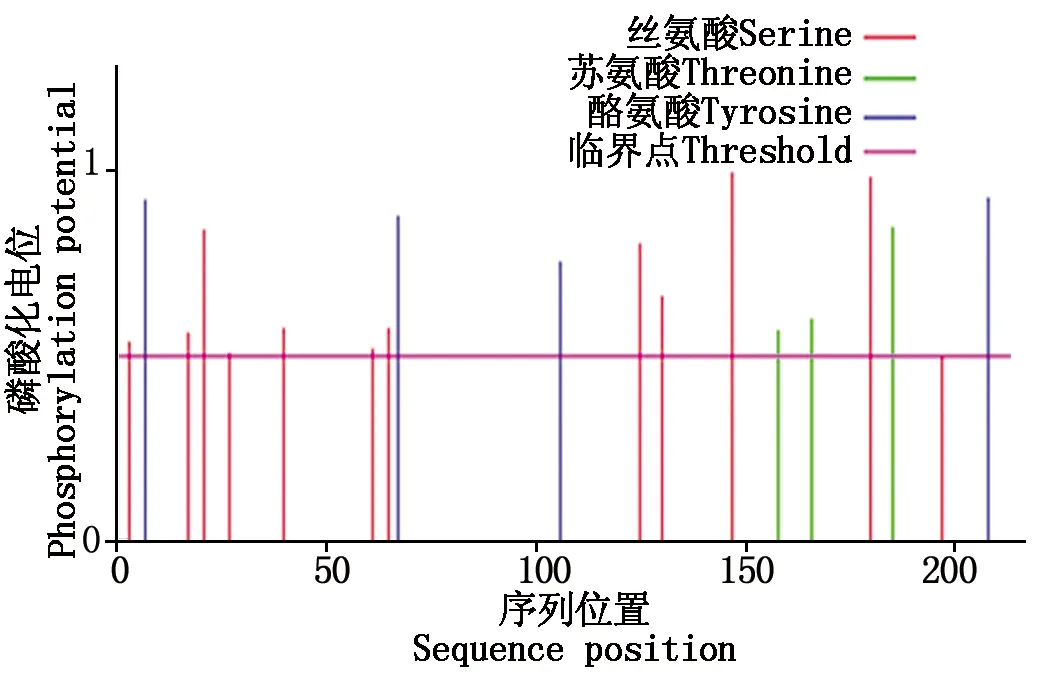
图3 牦牛CEBPα蛋白磷酸化位点分析Fig.3 The phosphorylation site analysis of yak CEBPα protein
CEBPα蛋白的二级结构主要为α螺旋(蓝色)和无规则卷曲(紫色),分别占27.10%,67.29%,β转角和延伸链(红色)占比为0和5.61%(图4)。三级结构预测结果与二级结构一致(图5)。
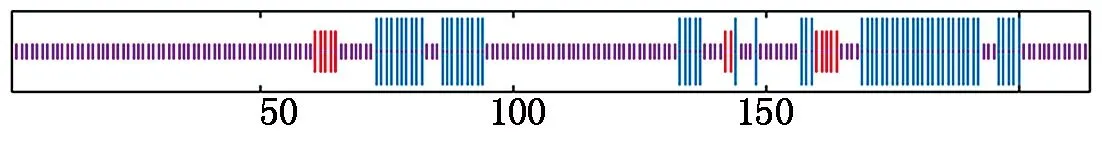
图4 牦牛CEBPα蛋白二级结构预测Fig.4 Secondary structure prediction of CEBPα protein in yaks
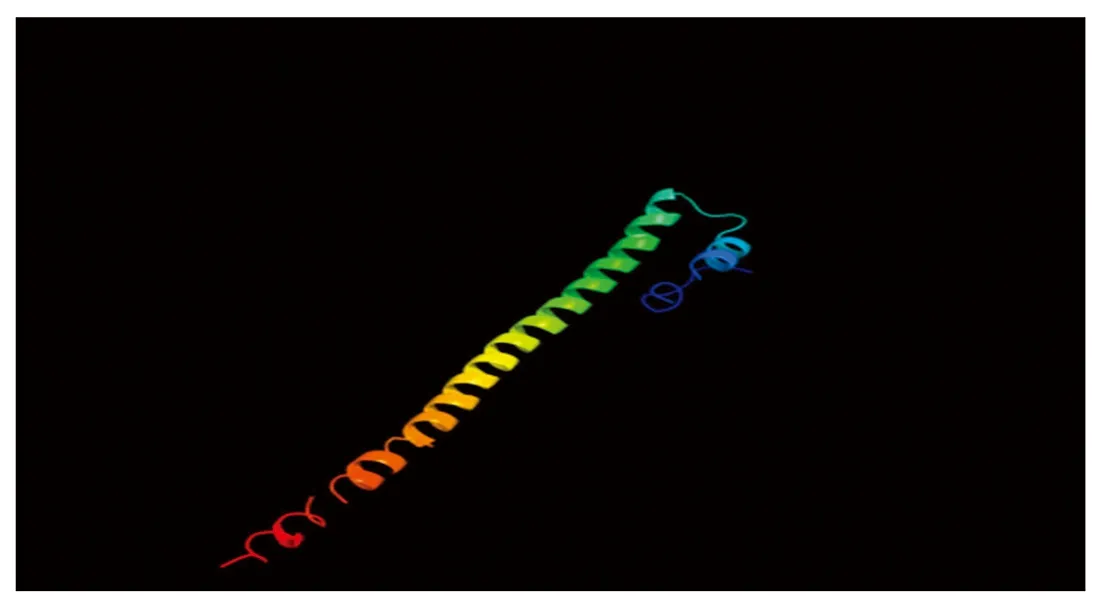
图5 牦牛CEBPα蛋白三级结构预测Fig.5 Prediction of tertiary structure of CEBPα protein in yaks
2.3 牦牛CEBPα基因组织表达谱
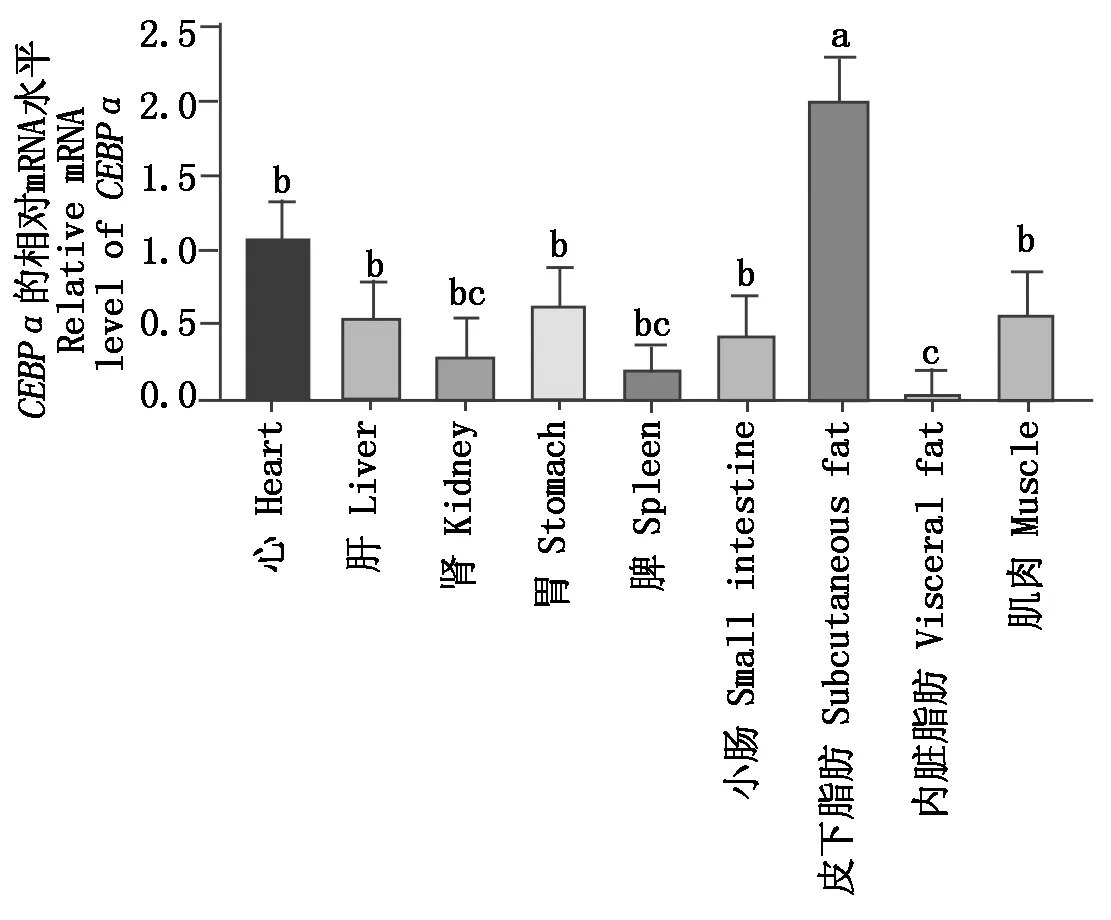
以心为参照,通过qRT-PCR检测牦牛组织中CEBPαmRNA的表达,结果表明,CEBPα在牦牛各组织中广泛表达(图6),在皮下脂肪组织的表达显著高于其他组织(P<0.05),在肾、脾和内脏脂肪组织中表达量相对较低。
2.4 CEBPα在牦牛皮下脂肪细胞诱导分化过程中的表达
从牦牛皮下脂肪组织中分离得到的原代脂肪细胞进行诱导分化,观察细胞形态的变化。分离得到的牦牛前体脂肪细胞类似于成纤维细胞,细胞形态呈梭形或三角形(图7-A)。当细胞密度达到100%融合时进行诱导分化(图7-B)。诱导分化9 d,细胞形态发生变化,由梭形变为不规则形态或圆形,细胞内充满大量脂滴(图7-C)。Bodipy染色结果表明(图8),分化9 d,有明显的脂滴积累。
不同小写字母表示差异显著(P<0.05)。The different lowercase letters indicate significant difference(P<0.05) .

A.牦牛前体脂肪细胞(Preadipocyte,Pre)的形态;B.诱导分化第0天的细胞形态图;C.诱导分化第9天的细胞形态图。A.The morphology of yak preadipocytes (Preadipocyte, Pre);B.The morphology of cells at day 0 of induced differentiation;C.The morphology of cells on the 9th day of induced differentiation.
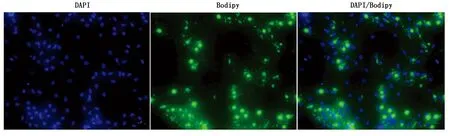
图8 Bodipy染色(100×)Fig.8 Bodipy stain (100×)
在诱导分化第0,3,6,9天收集牦牛脂肪细胞样品,采用qPCR技术对CEBPαmRNA的表达量进行相对定量分析(图9)。研究结果表明,CEBPα在分化的第3,6,9天与第 0 天相比,均极显著上升(P<0.01),在分化过程中呈现上升的趋势。
3 讨论与结论
研究表明,在构建体外培养的牛成肌细胞体系中,CEBPα能诱导成肌细胞向脂肪细胞转化[13]。在牛肌肉的干细胞(MSCs)中过表达CEBPα能诱导LPL、PPARγ、C/EBPβ和C/EBPδ基因的表达,表明CEBPα基因在脂肪细胞分化过程可能具有重要作用[14]。此外Wang等[15]研究指出,牛CEBPα基因可以调控ABHD5基因(alpha/beta hydrolase 5,ABHD5),间接调控细胞脂质代谢。因此,本研究采用金川牦牛和麦洼牦牛为研究对象,获得牦牛CEBPα的基因序列及其在牦牛脂肪组织中的表达特性,为后续研究CEBPα基因对牦牛脂肪沉积的具体作用机制提供了依据和参考。
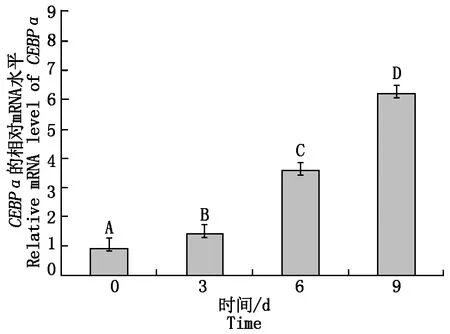
不同大写字母表示差异极显著(P<0.01)。The different capital letters indicate extremely significant difference(P<0.01) .
通过PCR成功获得牦牛CEBPα基因,其CDS区全长645 bp,编码214个氨基酸,该蛋白为不稳定亲水性蛋白。同源性分析结果表明,牦牛CEBPα基因与普通牛的同源性相对较高,核酸同源性为99.73%,氨基酸同源性为99.19%,构建系统进化树的结果显示,牦牛与普通牛和绵羊的相似性较高。系统发育树与同源性比对结果一致,说明CEBPα基因的编码区在进化过程中相对保守。
组织表达结果发现,CEBPα在牦牛不同组织中均有表达,其中皮下脂肪表达水平最高,内脏脂肪表达量最低。说明CEBPα可能在调控牦牛皮下脂肪的发育中具有重要作用。有研究报道,CEBPα在小鼠脂肪组织、肺、胎盘和肝脏中高表达[15-16]。池永东等[17]研究发现,CEBPα在皮下脂肪组织中表达量最高,这与本研究的结果相一致,推测该基因可能在反刍动物中相对保守,在其他物种中存在物种特异性。
分离到的牦牛皮下脂肪细胞呈梭形或三角形,在经过诱导成脂,细胞形态变为不规则形态或圆形,并伴随着脂滴的产生和积聚。刘敏等[18]分离得到猪皮下前体脂肪细胞,细胞形态呈不规则梭形。这与本试验分离的得到的前体脂肪细胞形态相一致。表明成功分离了牦牛前提脂肪细胞。CEBPα在牦牛脂肪细胞分化过程中随着分化的进行,其表达量逐渐上升。笔者推测CEBPα可能在牦牛脂肪细胞分化早期发挥作用。有研究报道,在3T3-L1脂肪细胞中,CEBPα的表达量随着分化的进行,表达量逐渐升高,在第6天达到顶峰[19]。这与笔者的研究结果相一致。王家麒等[20]研究表明,在绵羊前体脂肪细胞中。随着诱导分化的进行CEBPα表达量呈现先上升后下降。这与笔者的研究结果存在差异,推测其可能的原因,是由于物种之间的差异造成的。
本研究克隆了牦牛的CEBPα基因,其CDS区全长645 bp,编码214个氨基酸,该蛋白的不稳定系数为57.23,表明该蛋白具有不稳定性,亲水性占比大于疏水性,为亲水性蛋白。CEBPα在皮下脂肪组织中高表达,在内脏脂肪组织中低表达。在牦牛前体脂肪细胞诱导分化过程中,其表达量逐渐升高。以上结果为牦牛CEBPα基因在牦牛脂肪组织中的功能研究提供基础数据。
