铜钼硫化矿浮选分离中H2O2的作用机理研究
2022-01-07李育彪段婉青李万青刘瑞庆
李育彪 段婉青 杨 旭 李万青 刘瑞庆
(武汉理工大学资源与环境工程学院,湖北 武汉 430070)
钼具有熔点高、密度小、热胀系数小等优良性能,被广泛应用于航空航天、船舶、石油、纺织等行业,是不可替代的战略资源[1-2]。辉钼矿作为钼的主要原料矿物,主要通过浮选富集。但辉钼矿常与黄铜矿伴生,两者可浮性相近,分离效率较低[3]。因此,对辉钼矿与黄铜矿进行高效浮选分离具有重要现实意义。
抑铜浮钼是目前最主要的铜钼分离方法,常采用硫化矿整体浮选,再加入抑制剂(如硫化钠、巯基乙酸钠、硫氢化钠、Nokes试剂等)选择性作用于黄铜矿表面,增加其亲水性,阻碍捕收剂与黄铜矿作用,降低其可浮性,从而达到铜钼分离的目的[4]。但存在抑制剂用量大、毒性强、成本高、污染环境等问题[5]。为解决这些问题,研究人员将氧化剂作为潜在的抑制剂展开研究,部分文章报道使用次氯酸钠、臭氧和二氧化锰等氧化物作为抑制剂[6-8],而H2O2是一种绿色清洁的强氧化剂,其使用过程无污染,其分解产物也对环境无害。例如,HIRAJIMA等[9]采用表面氧化法在无捕收剂条件下对黄铜矿和辉钼矿进行选择性分离,结果表明,H2O2比O3有更高选择性。CHIMONYO等通过加入不同浓度H2O2,调控溶液Eh来研究硫化矿浮选回收率变化。结果表明,加入0.001 mol/L的H2O2可以提高黄铜矿与磁黄铁矿浮选回收率,但添加0.1 mol/L的H2O2则会降低两者浮选回收率[8]。
此外,部分浮选药剂与矿物表面既发生化学吸附,也存在物理吸附,常规测试方法难以得到浮选过程中药剂与矿物颗粒吸附的有效信息[9],且有关热动力学变化规律研究报道较少[10-14]。微量热法[15-16]是近年来发展起来的研究热动力学规律的方法,不仅可进行静态热力学研究,也可连续记录反应热动力学数据,在生化、材料等领域应用较广泛。在选矿领域,微量热法可提供药剂与矿物作用过程的热力学信息,例如,赵翠华等利用微量热法测定了H2O在硫化矿表面的吸附热,探究了硫化矿亲水性与吸附热之间的关系[17]。严华山等对黄铜矿活化与抑制过程也进行了热动力学研究[18],但H2O2在铜钼分离的热动力学理论研究少见报道。
本研究在碱性条件下(pH=10)以H2O2为氧化剂,通过对铜钼硫化矿进行H2O2氧化处理,研究其对黄铜矿和辉钼矿可浮性的影响,并通过光电子能谱(XPS)与微量热法研究氧化处理后的样品表面性质变化,揭示铜钼硫化矿浮选分离中氧化剂的热动力学规律,建立铜钼硫化矿绿色浮选分离新方法。
1 试验材料与研究方法
1.1 试验样品和试剂
黄铜矿与辉钼矿原矿分别来自湖北大冶和广西桂林,经破碎、三头研磨机(RK/XPM,武汉洛克粉磨设备制造有限公司)磨矿后湿筛,获得150~75µm样品,随后进行乙醇超声清洗、烘干,密封于塑料管中,储存在冰箱里待用。化学成分分析可知黄铜矿纯度为99.85%,辉钼矿纯度为95.30%,均符合试验要求。所有试验均采用电阻率为18.2 MΩ·cm的Millipore®超纯水。采用分析级H2O2(质量分数为30%)对样品表面进行氧化处理,以分析纯NaOH溶液为pH调整剂、丁基黄药为捕收剂进行浮选试验。
1.2 浮选试验
浮选试验均使用XFG-Ⅱ型机械搅拌式浮选机(武汉探矿机械厂)。称取1 g黄铜矿或0.25 g辉钼矿样品(粒度均为150~75µm)于40 mL浮选槽中,加入25 mL超纯水,设置浮选机主轴转速为1 200 r/min,充气量为0.1 L/min。然后用NaOH在6 min内调节pH到指定值稳定不变,再加入浓度分别为0、0.01%、0.1%、1%的H2O2(H2O2浓度以H2O2体积与矿浆体积比表示)。反应6 min后加入200 g/t丁基黄药,待反应4 min后开始充气并在1、3、5、8和10 min分批刮泡。最后将浮选所得精矿产品和浮选槽内尾矿分别进行过滤,再放入干燥箱中烘干,将烘干产品称重并计算回收率。每次浮选试验重复3次,取平均值。
1.3 微量热法测试
采用RD496 2000微量热仪(绵阳中物热分析有限公司)测定pH=10、温度30℃条件下不同浓度H2O2在黄铜矿和辉钼矿表面的吸附热力学曲线。将0.1 g粒度为150~75µm的黄铜矿或辉钼矿样品与1.0 mL不同浓度的H2O2分别转移到量热反应池(图1(a)内管与外管中,图1(b)为参考反应池,其内管中为捕收剂溶液,外管中不加入矿物)。

将准备好的量热反应池与参考反应池放入量热炉体,并调节量热基线稳定后开始测量。通过反应热动力曲线计算出反应速率常数k和反应级数n。计算公式(1)如下:

式中,H∞为反应结束时的总放热量;Hi为反应第i秒时的累积放热量;t为时间;k为反应速率常数;n为反应级数。
1.4 X射线光电子能谱(XPS)测试
每次称取1 g黄铜矿或0.25 g辉钼矿置于50 mL烧杯中,加入一定量溶液与药剂后,放置于磁力搅拌器上搅拌10 min,将固体样品用超纯水清洗、过滤3次,放入冷冻干燥箱干燥24 h,利用配有单色器的铝靶X射线源光电子能谱仪(ESCALAB 250Xi,美国赛默飞世尔科技有限公司)测试黄铜矿和辉钼矿表面。
2 试验结果与讨论
2.1 浮选试验
图2为pH=10时不同浓度H2O2对黄铜矿和辉钼矿浮选回收率的影响。

由图2可知,不加入H2O2时,黄铜矿与辉钼矿浮选回收率分别为88.6%和88.7%,说明黄铜矿与辉钼矿都具有良好天然可浮性,与文献报道一致[9,19-21]。当加入浓度为0.01%的H2O2时,黄铜矿浮选回收率从88.6%降低到83.3%,说明黄铜矿氧化并不明显;当H2O2浓度增加到0.1%时,黄铜矿浮选回收率降低至31.8%,表明黄铜矿被强烈氧化;当H2O2浓度增加至1%时,黄铜矿浮选回收率显著降低至6.8%,说明H2O2浓度增加可以促进黄铜矿氧化反应的进行,生成了更多亲水氧化物及氢氧化物,降低其浮选回收率[22]。当H2O2浓度为0.01%时,辉钼矿浮选回收率降低并不明显,说明低浓度H2O2对辉钼矿浮选抑制作用较弱;继续增加H2O2浓度至0.1%,回收率由88.6%降至77.2%;进一步增加H2O2浓度到1%时,浮选回收率基本不变,表明H2O2浓度增加并未进一步氧化辉钼矿表面。
2.2 微量热试验
pH=10、303.15 K时H2O2在黄铜矿和辉钼矿表面的反应热如图3所示。H2O2在黄铜矿与辉钼矿表面均为放热过程,其中H2O2浓度为0.01%时,黄铜矿与辉钼矿反应热为2 228.9 mJ和521.6 mJ,当H2O2浓度增加到1%时,两者反应热分别增加至101 328.6 mJ和24 496.6 mJ,说明不同浓度H2O2对两种矿物表面具有显著氧化差异。值得注意的是,H2O2浓度从0.01%增加到1%后,黄铜矿热力学曲线峰值向右移动,说明较高H2O2浓度时,发生了剧烈化学反应;辉钼矿热力学曲线峰值则向左移动(反应时间缩短),但峰面积增大,说明浓度为1%的H2O2与辉钼矿反应速率上升。值得注意的是,黄铜矿热力学曲线峰面积增加幅度更大,说明其与浓度为1%的H2O2反应更剧烈。

基于最小二乘法,通过式(1)可求得不同浓度H2O2与黄铜矿、辉钼矿反应的热力学参数,见表1。由表1可知,浓度为1%的H2O2与黄铜矿反应速率常数k、反应级数n均最大,分别为0.37×10-3s-1和1.56,说明此浓度下,H2O2与黄铜矿表面反应最剧烈。即使H2O2与黄铜矿反应时间延长,其反应速率并未减慢。然而,辉钼矿反应速率常数与反应级数随H2O2浓度变化仅出现小幅度变化,与浮选结果相符。

?
2.3 XPS测试分析
2.3.1 全谱分析
黄铜矿和辉钼矿经不同浓度H2O2氧化处理10 min,其表面元素相对含量的变化可以利用XPS测得,结果见图4。各元素相对含量见表2、表3。


?

?
由表2、表3可知,黄铜矿表面Cu 2p、S 2p相对含量随H2O2浓度增加而降低,可能是黄铜矿表面O 1s、Fe 2p相对含量增加导致。相比未氧化处理的黄铜矿,经过浓度为0.01%的H2O2处理后黄铜矿表面O 1s含量上升至29%,证明黄铜矿表面氧化作用显著。H2O2浓度为0.01%时,辉钼矿表面S 2p相对含量由58%降低至56%,O 1s相对含量由8%增加至12%,Mo 3d由34%降低至32%,说明辉钼矿被氧化;当H2O2浓度为1%时,O 1s相对含量由12%上升至16%,但Mo 3d含量由32%下降至30%,说明H2O2浓度的增加会对辉钼矿产生一定程度的氧化,但并未对辉钼矿的浮选回收率造成不利影响。
2.3.2 黄铜矿窄谱分析
表4为不同浓度H2O2处理后黄铜矿表面S存在形式及相对含量。S 2p光谱由于存在能级分裂,被高斯-洛伦兹带分割,每个S 2p有S 2p3/2和S 2p1/2两个特征峰,其结合能距离和强度与前文所述一致[23-24]。S2-、S22-、Sn2-、S0、SO32-、SO42-和能量损耗特征峰在S 2p光谱图中分别位于161.1~161.4 eV、161.8~162.0 eV、162.9~163.1 eV、164.1~164.3 eV、166.1~166.4 eV、168.4~168.8 eV 和164.8~165.0 eV[25-26]。

?
由表4可知,黄铜矿原矿表面S2-、S22-、Sn2-相对含量分别为49%、24%和14%,及少量S0、SO2-和SO2-,34这些产物可能是研磨过程中氧化所致。H2O2浓度为0.01% 时,S2-和 S22-相对含量分别降至46%和21%,Sn2-相对含量增加至16%。当加入的H2O2浓度为1%时,Sn2-、S0和 SO42-相对含量分别增加至23%、11%、18%,SO42-为S氧化最终产物,说明黄铜矿表面发生了进一步氧化。证明H2O2浓度越高,其氧化作用越强,生成更多SO42-,从而降低黄铜矿可浮性。
表5显示了不同浓度H2O2处理后黄铜矿表面O 1s存在形式。O2-、OH-/SO42-、化学吸附H2O和物理吸附H2O的特征峰范围为529.5~530.4 eV、530.9~531.5 eV、531.9~532.6 eV 和 532.9~533.6 eV[24-25]。未加入H2O2时黄铜矿表面存在大量化学吸附H2O和物理吸附H2O,加入H2O2后化学吸附H2O和物理吸附H2O含量显著下降,而黄铜矿表面O2-和OH-/SO42-含量急剧上升。在H2O2浓度为0.01%和1%时,黄铜矿表面OH-/SO42-相对含量从12%分别增加到34%和37%,O2-含量同样也显著增长,分别为20%和33%,证明加入H2O2后,黄铜矿表面发生了显著氧化反应,产生更多OH-,这些OH-在浮选过程中与黄药在黄铜矿表面形成竞争吸附,并取代黄原酸根离子吸附在黄铜矿表面,降低黄铜矿回收率。

?
图5为H2O2不同浓度下黄铜矿表面Fe 2p光谱图。随着H2O2浓度增加,黄铜矿结合能峰平缓,其表面Fe-O/OH/OS结合能峰变得陡峭。黄铜矿中Fe被溶解导致CuFeS2结合能峰趋近于平缓,溶解Fe在黄铜矿表面生成了Fe-O/OH/OS等亲水物质,证明H2O2浓度越高,对黄铜矿氧化作用越强。

2.3.3 辉钼矿窄谱分析
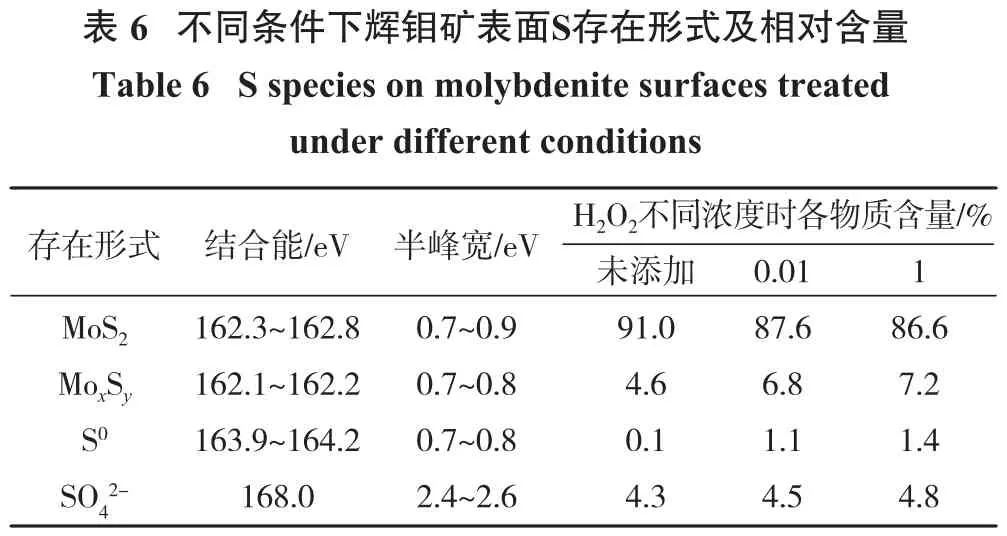
在 S 2p光谱中,MoS2、MoxSy、S0和 SO42-特征峰位于162.3~162.8 eV、162.1~162.2、163.9~164.2和172.7 eV[26-28]。辉钼矿表面S存在形式及相对含量见表6。由表6可知,辉钼矿表面S0,MoxSy及SO42-随 H2O2浓度增加呈上升趋势,说明H2O2对辉钼矿表面具有一定氧化作用,但并没有产生强烈氧化。
?
表7显示了不同浓度H2O2处理后辉钼矿表面O存在形式及相对含量。MoO3特征峰在531.9~532.6 eV,而吸附在辉钼矿表面的OH-与SO42-峰值位于530.9~531.5 eV。原矿中OH-/SO42-含量较低,当H2O2处理后,OH-/SO42-含量小幅度上升,说明生成OH-/SO42-覆盖在辉钼矿表面,辉钼矿受到一定程度的氧化;H2O2浓度增加到1%,其氧化程度并没有大幅度增加。随着H2O2浓度增加,MoO3相对含量平缓上升,结合前面的试验,H2O2对辉钼矿氧化作用弱,其浓度增加并没有使辉钼矿表面产生剧烈氧化。

?
辉钼矿表面Mo存在形式相对含量见表8。未处理的辉钼矿中MoO3相对含量为3.8%,浓度为0.01%的H2O2处理后含量增加至3.9%,MoO3变化不明显,H2O2浓度为1%时,MoO3相对含量增加到4.4%,表明生成了微量MoO3,与前文中辉钼矿表面O物种的相对含量相符,说明H2O2对辉钼矿氧化作用较弱。

?
3 结论
(1)基于绿色无污染的H2O2进行黄铜矿与辉钼矿的浮选分离试验,取得了较好的分离效果,为铜钼硫化矿的绿色浮选分离提供了新思路。
(2)H2O2浓度为1%时,黄铜矿浮选回收率从未添加H2O2时的88.64%显著降至6.81%,而辉钼矿回收率从未添加H2O2时的88.61%下降至78.47%,说明H2O2对两者具有良好的选择性分离效果。XPS分析结果表明,黄铜矿表面产生了大量亲水物质,但辉钼矿表面生成的氧化产物相对较少,仍保持较好疏水状态。
(3)H2O2在黄铜矿与辉钼矿表面的反应为放热过程,浓度为0.01%的H2O2与黄铜矿和辉钼矿反应时,反应热较小,分别为2 228.9 mJ和521.6 mJ;H2O2浓度上升至1%后,分别增加至101 328.6 mJ和24 496.6 mJ,表明1% H2O2对辉钼矿与黄铜矿的氧化存在较大差异。
(4)黄铜矿表面可能生成Fe-O/OH/OS、Sn2-、S0和SO42-等亲水物质,使黄铜矿可浮性降低,浮选回收率下降,但H2O2对辉钼矿氧化作用不显著。
