第三代TKIs在EGFR突变非小细胞肺癌中的应用
2022-01-06许雯雯朱宇熹
许雯雯,朱宇熹
0 引言
铂类药物为主的化疗治疗晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的有效率仅20%左右,患者的中位总生存期也仅为7~10月。伴随着EGFR突变的发现,受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)的靶向精准治疗逐渐成为研究热点。NSCLC中总人群EGFR突变率为10%~28%,而亚洲人群EGFR突变率可达50%。一代EGFR-TKI(吉非替尼、厄洛替尼)与二代EGFR-TKI(阿法替尼、达克替尼)无进展生存期长达9~14月,然后出现耐药与疾病进展,50%~60%为EGFR的20外显子T790M阳性突变耐药,且T790M的继发突变率远远超过其0.5%~1%的原发突变率[1-2]。在我国陆续上市的三代EGFRTKIs,包括奥希替尼、阿美替尼及伏美替尼,均为高选择性、不可逆的靶向药物。三代EGFRTKIs对EGFR敏感性突变和T790M耐药突变同时具有高效选择性,因此在临床上可用于EGFR敏感突变的NSCLC一线治疗,也可用于继发T790M耐药突变的治疗。本文拟对三代TKIs治疗EGFR突变及T790M耐药突变的作用机制、临床研究以及真实世界数据进行简要综述。
1 三代TKIs治疗EGFR突变及T790M耐药突变的作用机制
EGFR是跨膜受体ErbB家族成员之一,当配体与受体结合后,EGFR发生自身磷酸化,激活下游多种信号转导通路,最终导致细胞增殖。一代/二代EGFR-TKI通过与ATP竞争性结合EGFR酪氨酸激酶位点,阻断信号向胞内的传递,抑制肿瘤细胞生长并诱导其凋亡。经过一代/二代EGFRTKI治疗后进展的NSCLC患者中,超过50%发生T790M耐药突变。T790M突变是发生在EGFR基因上的二次突变,空间位阻效应造成酪氨酸激酶与EGFR-TKI的结合困难。同时在L858R/T790M双重突变中,EGFR对ATP的亲和力显著增强,可逆性EGFR-TKI抑制效价降低而耐药。三代TKIs均具不可逆性,通过与EGFR催化域ATP结合位点边缘的CYS-797共价结合,从而克服T790M突变空间位阻的影响以及与ATP竞争结合的两个局限,最终实现对EGFR敏感度突变和T790M突变的高效选择。
2 三代TKIs的临床应用
2.1 三代TKIs在晚期非小细胞肺癌的疗效
2.1.1 二线及以上治疗AURA2及AURAextension两项Ⅱ期临床研究和AURA3[3]Ⅲ期临床试验展现了奥希替尼的良好疗效。AURA3对比了二线奥希替尼与铂类联合培美曲塞双药化疗治疗携带EGFR T790M阳性突变的局部晚期或转移性NSCLC。结果显示,与化疗组相比,奥希替尼组的客观缓解率(objective response rate,ORR)显著提高(71%vs.31%,P<0.001),同时显示出较好的无进展生存获益(中位无进展生存期(median progression free survival,mPFS):10.1月vs.4.4月,P<0.001)。但由于化疗进展后交叉奥希替尼治疗的原因,奥希替尼PFS获益并未能在数据上转化为总生存获益(中位总生存期(median overall survival,mOS):26.8月vs.22.5月,P=0.277)[4]。Ⅱ期APOLLO研究显示在EGFR T790M阳性的晚期NSCLC中国人群中,阿美替尼的ORR和疾病控制率(disease control rate,DCR)分别为68.9%和93.4%,同时其mPFS达12.3月,成为首个二线无进展生存突破1年的三代TKI。近期伏美替尼的Ⅱb期临床研究[5]数据揭晓,同样对于EGFR T790M阳性晚期NSCLC的中国人群,ORR和DCR分别高达74%和94%,mPFS为9.6月。三种三代TKIs均体现了对T790M突变耐药的优势,阿美替尼及伏美替尼更加侧重中国人群,颇具前景。
2.1.2 一线治疗 奥希替尼在EGFR突变晚期NSCLC后线治疗的良好疗效促进了一线治疗的研究,见表1。FLAURA研究[6]是一项双盲、随机对照的Ⅲ期试验,研究对于EGFR突变阳性的局部晚期和晚期NSCLC患者,奥希替尼与一代EGFR-TKI(吉非替尼或厄洛替尼)一线治疗的临床疗效差异。结果奥希替尼的ORR并无显著提高(80%vs.76%,P=0.24),但其DCR达97%,优于一代EGFR-TKI组的92%(P=0.01)。同时奥希替尼组mPFS为18.9月,标准EGFR-TKI组为10.2月(P<0.001)。总生存期分析显示奥希替尼组和对照组的mOS分别为38.6月和31.8月(P=0.046)[7]。研究结果提示奥希替尼较一代EGFR-TKI明显延长了PFS和OS。因此,2020年中国临床肿瘤学会(CSCO)指南将奥希替尼应用于EGFR突变晚期NSCLC的一线治疗推荐级别上调为Ⅰ级。阿美替尼对比吉非替尼应用于EGFR突变晚期NSCLC患者一线治疗的Ⅲ期AENEAS研究于2021年美国临床肿瘤学会(ASCO)年会公布初步结果,阿美替尼组mPFS较吉非替尼组差异显著(19.3月vs.9.9月,P<0.0001),因此总生存备受瞩目。伏美替尼的一线应用目前处于Ⅲ期研究阶段,一线获益尚待研究结果论证。
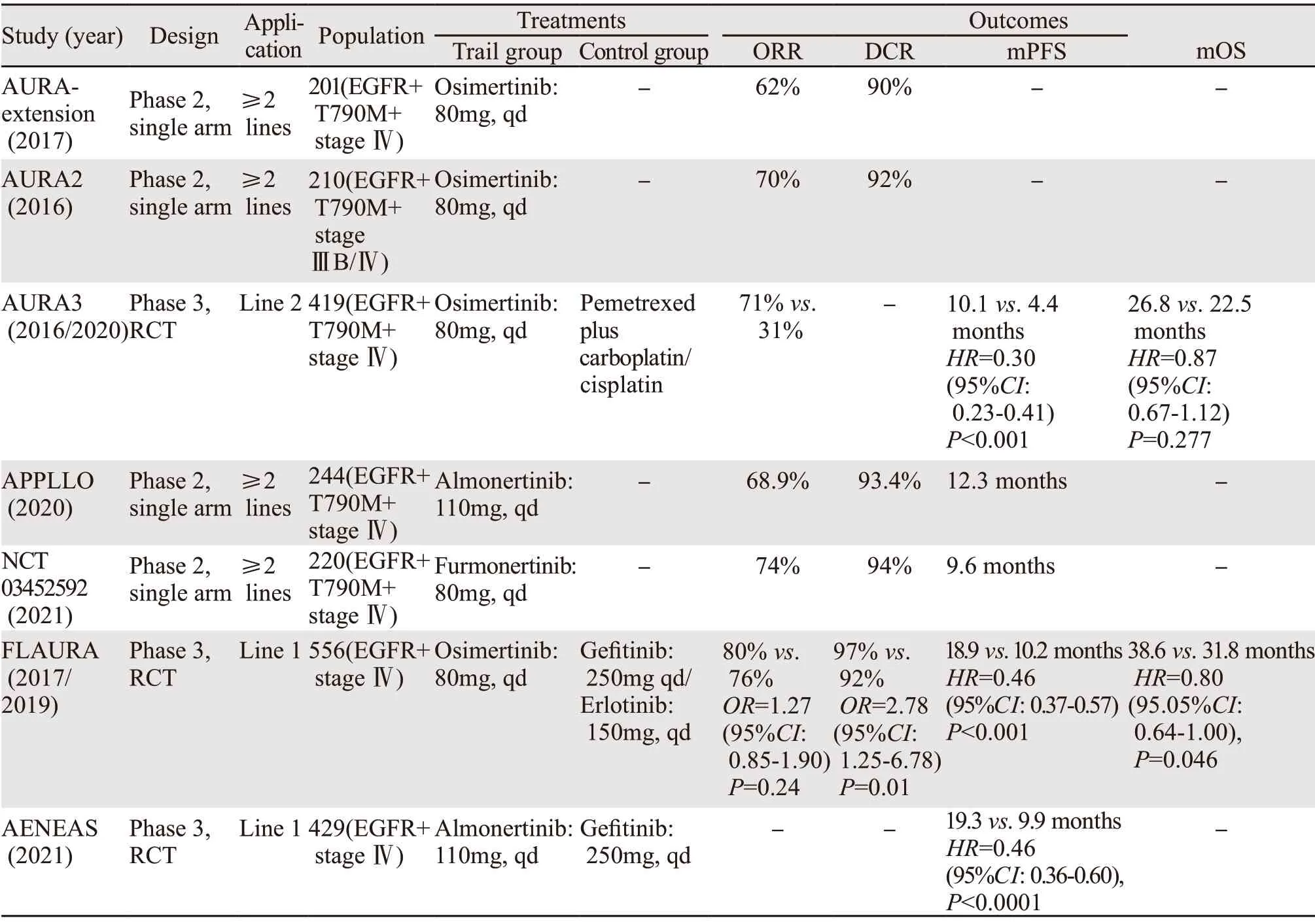
表1 三代TKIs应用于晚期非小细胞肺癌的相关研究(疗效)Table 1 Studies about third-generation TKIs on NSCLC (efficacy)
2.1.3 一线及二线治疗对比 三代TKI奥希替尼在一线及二线治疗均被推荐,但从前述研究数据看,疗效间存在差异。为进一步明确差异,Yi等的一项meta分析[8]显示奥希替尼在一线治疗中,其ORR和DCR均优于后线治疗(ORR:79%vs.58%;DCR:97%vs.80%)。奥希替尼一线治疗mPFS同样具有优势(19.17月vs.10.58月)。同时一线治疗1年PFS率达64%,而后线治疗仅32%。此疗效差异为EGFR-TKI治疗带来挑战,是先一线一代或二代TKI治疗发生T790M耐药后序贯奥希替尼,还是直接奥希替尼一线治疗,仍然缺乏“头对头”疗效评价,亟待更多临床研究提供依据[9-10]。
2.2 三代TKIs对晚期非小细胞肺癌中枢神经系统转移病变的疗效
三代TKIs在动物实验中证实具有较好的血脑屏障扩散能力,提示在EGFR突变NSCLC脑转移的治疗中有巨大的潜力。AURA3试验[11]中对于中枢神经系统(central nervous system,CNS)转移病灶,奥希替尼组与双药化疗组的ORR分别为40%和17%(P=0.014),奥希替尼组mPFS成倍增加(11.7月vs.5.6月,P=0.004)。尤其对于影像学可测量的CNS转移病灶(CNS evaluable-for-response,cEFR),奥希替尼的ORR有显著优势(70%vs.31%,P=0.015)。FLAURA试验的CNS疗效分析中[12],在观察截止时奥希替尼组的mPFS虽未达到,但已展现出对比一代EGFR-TKI组的明显优势(13.9月vs.NR(未达到),P=0.014)。为进一步提高奥希替尼疗效,Yu等[13]研究了奥希替尼联合贝伐珠单抗在合并EGFR突变的转移性肺癌中的疗效,其中对于可测量CNS病灶的有效率为100%,但FLUARA研究奥希替尼单药对CNS可测量病灶的有效率也高达91%[12],因此联合奥希替尼的方案能否展现显著优势目前尚难以定论。APOLLO试验中,阿美替尼二线治疗的ORR为61.5%;伏美替尼Ⅱb期研究中,对于可测量CNS病灶,伏美替尼的ORR为65.5%,DCR可达100%,三代TKIs均展现了良好的CNS转移控制能力。
2.3 三代TKIs在早期和局部晚期EGFR突变NSCLC中的应用
ADAURA试验[14-15]是一项Ⅲ期双盲全球性临床试验,主要研究奥希替尼作为早期和局部晚期EGFR突变NSCLC完全手术切除后的辅助治疗疗效。在Ⅱ~Ⅲ期患者中,奥希替尼组的2年DFS显著高于安慰剂组(90%vs.44%,HR=0.17;P<0.001),降低了高达83%的疾病复发或死亡风险。奥希替尼用于早期和局部晚期EGFR突变NSCLC术后辅助治疗有DFS优势,显著降低了疾病复发风险,提高了无病生存率,但能否最终转化为总生存优势还有待观察。阿美替尼及伏美替尼应用于可切除早期及局部晚期EGFR突变NSCLC辅助治疗的数项临床研究正在进行。总的来说,三代TKIs辅助靶向治疗对比化疗能否提高DFS和OS有待进一步数据分析。
2.4 三代TKIs联合放疗
对于不可手术的Ⅲ期NSCLC,根治性同步放化疗后度伐利尤单抗巩固治疗对EGFR突变患者获益较差。在局部晚期及晚期NSCLC中,EGFR-TKI联合放疗可能进一步提高EGFR突变患者的疗效。2020年美国临床肿瘤学会(ASCO)会议报道了一项中国多中心、回顾性研究,放疗联合EGFR-TKI治疗局部晚期NSCLC的PFS(21.6月)和OS(67.4月)均有较大获益。目前,LAURA试验正在探索根治性放化疗后序贯奥希替尼维持治疗对不可切除EGFR突变局部晚期NSCLC患者的治疗价值[16]。放疗在寡转移NSCLC的治疗中占据重要地位,对于EGFR突变阳性的此类患者,EGFR-TKI联合放疗有望进一步提高疗效和生存。2020年ASCO会议公布了中国临床Ⅲ期SINDAS研究数据,一线EGFR-TKI联合放疗对比单独EGFR-TKI治疗能显著延长寡转移患者PFS(20.2月vs.12.5月,P<0.001)和OS(25.5月vs.17.4月,P<0.001)。但用于研究的EGFR-TKI多局限于一代和(或)二代,三代TKIs联合放疗的研究还在开展中,有研究[17]显示奥希替尼治疗后寡转移耐药,不停药联合转移部位姑息放疗有改善生存的趋势,对比未接受放疗的患者再次出现疾病进展的时间为15.5月vs.8.2月,P=0.05。另一项研究[18]表明奥希替尼耐药进展后,接受立体定向放射治疗(stereotactic body radiotherapy,SBRT)的寡转移患者对比无法放疗的患者有更长的mPFS(17.2月vs.11.3月,P=0.002)。值得注意的是,在所有进展患者中,寡进展的发生率高达70%,意味着奥希替尼耐药后有很大机会接受SBRT并从中得到生存获益。胸部放疗相关放射性肺炎(radiation pneumonitis,RP)和EGFR-TKI肺毒性是限制两者联合应用的重要原因。朱慧教授团队[19]首次揭示了胸部放疗同步奥希替尼靶向治疗极高的RP发生率,入组的全部11名患者均出现了不同程度的RP,其中二级及以上RP发生率达63.6%,潜在的安全风险值得高度警惕。阿美替尼应用于经含铂根治性放化疗后EGFR突变NSCLC尚处于临床招募阶段,能否进一步提高局部晚期NSCLC的疗效并降低肺毒性备受瞩目。
2.5 三代TKIs的突变亚型疗效差异
在EGFR突变中,19位外显子缺失(19缺失)和21位L858R点突变(21点突变)是最常见的突变类型,占所有突变的90%。在FLAURA试验中奥希替尼组与对照组19缺失和21点突变PFS的HR分别为0.43和0.51,OS的HR分别为0.68和1.00;AURA3试验中,奥希替尼组和双药化疗组19缺失和21点突变PFS的HR分别为0.34和0.46,结果与FLUARA试验相一致,提示19缺失对奥希替尼获益更多,也证明了19缺失和21点突变是两种不同的疾病。与奥希替尼结果相似,APOLLO研究亚组分析中,阿美替尼在19缺失和21点突变的ORR分别为72.3%和62.4%,三代TKIs表现出对于19缺失更强的治疗作用。此外,有研究证实,在NSCLC软脑膜转移患者中,脑脊液EGFR突变分型不同,奥希替尼同样具有疗效差异[20]。19缺失组显示出较21点突变组更长的中位颅内PFS(intracranial PFS,iPFS),分别为11.9月和2.8月。值得关注的是,脑脊液T790M阳性组的中位iPFS(15.6月vs.7.0月,P=0.04)及中位总PFS(12.5月vs.5.8月,P=0.04)均较T790M阴性组有显著优势,但血浆T790M阳性组与阴性组无iPFS和总PFS的差异,因此,脑脊液基因检测对于软脑膜转移NSCLC可能有更强的疗效预测价值。
2.6 三代TKIs的安全性
AURA-extension[21]和AURA2均报道了奥希替尼治疗晚期NSCLC最常见不良反应为:腹泻、皮疹、甲沟炎和皮肤干燥,见表2。奥希替尼在AURA3研究和FLUARA研究中的三级以上不良反应发生率均显著低于对照组。阿美替尼在APOLLO研究和AENEAS研究中常见不良反应主要为皮疹、腹泻、瘙痒和ALT/AST升高等。伏美替尼Ⅱb期研究中,三级以上不良反应发生率26%。三代TKIs总体呈现出较好的耐受性和安全性。EGFR-TKI肺毒性是临床重点关注的相关不良反应之一,多项荟萃分析显示一代/二代EGFRTKI的间质性肺病总体发生率在1.2%~1.6%,3级以上不良反应发生率虽低于1%,但病死率高达22.8%。APOLLO研究中阿美替尼未出现相关间质性肺病,但见个案报道[22];AURA系列研究及FLUARA研究显示奥希替尼的间质性肺病发生率在2%~4%,较一代和(或)二代TKI稍高,虽然未出现致命的不良反应,但三代TKIs所致的肺损伤仍是临床应用中不容忽视的潜在风险之一[23]。
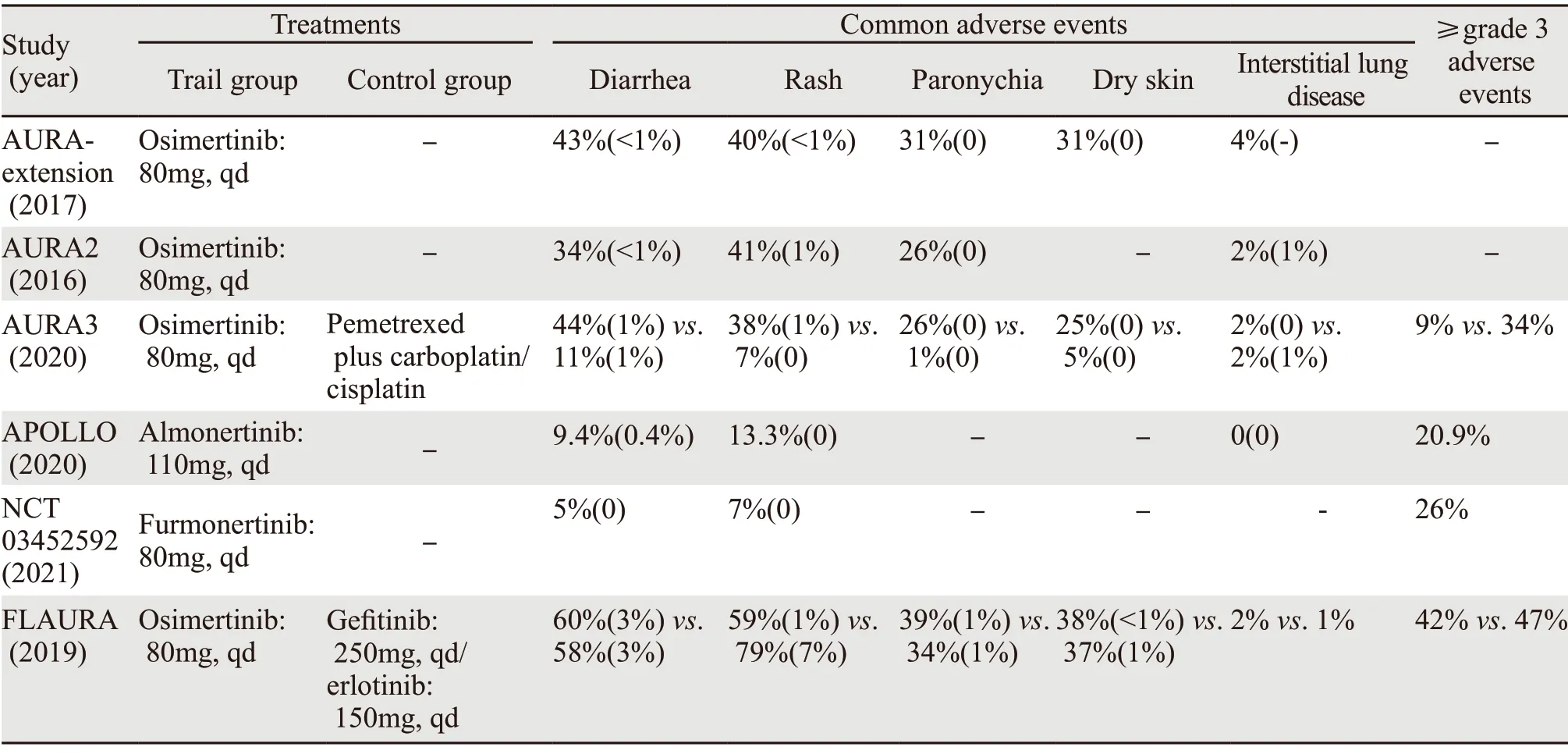
表2 三代TKIs应用于晚期非小细胞肺癌的不良反应相关研究Table 2 Studies about third-generation TKIs on NSCLC adverse events
2.7 三代TKIs应用于晚期NSCLC的真实世界数据观察
Gio Tag[24-25]是一项回顾性、观察性的非盲真实世界研究,结果显示EGFR T790M突变NSCLC一线阿法替尼序贯奥希替尼中位治疗时间为27.6月,mOS达41.3月,2年总生存率为80%,且19缺失组较21点突变组及亚洲患者组较非亚洲患者组均具有显著优势,中位治疗时间分别为:29.9月vs.18.8月和46.7月vs.26.7月。ASTRIS[26]是一项超过3 000名患者的全球性真实世界研究,在EGFRm+T790M突变患者中,57.1%对奥希替尼有治疗反应,mPFS为11.1月。Mu等[27]的一项回顾性的国内真实世界数据显示,奥希替尼应用于经治EGFRm+T790M突变NSCLC患者的ORR为47.3%,DCR为90.1%,总体人群mPFS为8.6月,同样19缺失组较21点突变组有更长的mPFS(17.9月vs.7.3月,P<0.001)。奥希替尼在真实世界数据中表现出疗效优势,尤其19缺失突变患者对奥希替尼有更优异的疗效反应,但目前数据仅局限于晚期后线治疗,一线治疗仍待进一步探究。伴随阿美替尼及伏美替尼临床应用的推进,真实世界疗效将逐步揭晓。
2.8 三代TKIs耐药及耐药后策略
三代TKIs耐药机制可分为EGFR依赖型和EGFR非依赖型[28-29]。约10%~25%的耐药突变发生在EGFR基因,EGFR 20外显子T790M丢失、C797S突变为最常见的EGFR依赖型突变。EGFR非依赖型耐药包括MET基因异常、HER2、NRAS和PI3KCA突变,主要通过激活下游PI3K/AKT和MAPK通路造成耐药。近年来发现的肿瘤小细胞或鳞状细胞转化的EGFR非依赖型耐药,通过回避EGFR抑制而造成快速增殖。奥希替尼一线或后线治疗及EGFR突变亚型均影响其分子学耐药模式[30]。针对三代TKIs治疗后耐药,多种治疗选择仍在探索,包括靶向特定突变的药物(如MET/MEK抑制剂)、EGFRTKI联合VEGF抑制剂、免疫单药治疗及EGFR-TKI联合免疫治疗[31],但目前疗效及安全性尚缺乏明确临床研究证据支持,化疗仍是耐药后的标准治疗选择。
3 结语与展望
综上所述,临床试验及真实世界数据观察均证实了以奥希替尼为主的三代TKIs在EGFR突变晚期NSCLC治疗中的确切疗效及良好的安全性,尤其在CNS转移和19缺失突变的患者中具有显著优势,同样三代TKIs作为术后辅助治疗表现出优异的DFS获益,同时三代TKIs联合放疗应用于EGFR突变的局部晚期或晚期寡转移的构思开始进入临床探索阶段,初步结果令人期待。但随着三代TKIs在临床的逐步应用,耐药率不断增加,因此,积极寻找三代TKIs耐药机制及后续治疗方案,有助于三代TKIs在临床治疗上的获益最大化。
