欧前胡素对酪氨酸酶的抑制作用及机制
2021-12-16张国文石文丽
张国文,石文丽,朱 苗
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
酪氨酸酶(Tyrosinase,TY)又称多酚氧化酶,是黑色素合成和果蔬褐变的关键酶[1],广泛存在于动物、植物和微生物中。在哺乳动物体内,TY常见于黑色素细胞中,能催化产生黑色素,黑色素可以被分泌到表皮和毛发的角质细胞中,使其着色[2]。在人体内TY代谢异常则会引起部分色素沉着性皮肤病,如黄褐斑、雀斑、老年斑等,同时,还与人类的帕金森症、黑色素瘤和白化病等疾病的发生与治疗有直接关联。
欧前胡素(Imperatorin,图1)属于6,7-呋喃香豆素类,在含有欧前胡素的植物中,伞形科植物的种类最多,包括蛇床子、白芷、防风等[3]。欧前胡素安全范围较大、毒性较易控制[4],主要代谢途径为氧化代谢[5],具有抗炎、抗菌、抗病毒、抗肿瘤及逆转肿瘤细胞耐药性、治疗心血管及神经系统疾病等药理作用[6]。
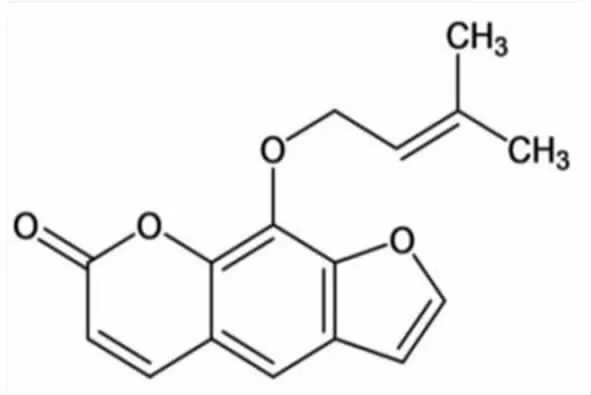
图1 欧前胡素分子结构
20世纪80年代末以来,已发现大量自然来源的TY抑制剂,但大部分抑制剂由于安全性及稳定性问题,而限制了其应用[7],寻找天然、高效、安全的TY抑制剂在生物、医学、农学、药学等多个学科和领域都具有重大意义。目前对欧前胡素药理作用的研究大部分只停留在药效层面或仅关注其对一个或某几个信号通路的影响,在作用机制方面的研究尚不够深入[6]。随着对欧前胡素提取分离方法以及作用机制研究的深入,对于以欧前胡素为主要成分中药的药效的阐明以及新药的研发将具有重要的意义[8]。胡大强等人[9]报道白芷提取物中主要含有欧前胡素,其对TY有抑制作用,而且其对TY的抑制活性较熊果苷更强。吴迪等[10]证明欧前胡素可以直接导致黑素瘤细胞凋亡、抑制TY活性或阻断黑素合成,从而治疗或预防黄褐斑。本文通过多种光谱学方法(紫外、荧光及圆二色光谱)并结合分子模拟技术,研究了欧前胡素体外抑制TY活性的分子机制,以期为欧前胡素作为食品功能因子研发提供一定的理论基础和实验依据。
1 实验部分
1.1 仪器与试剂
UV-2450型紫外-可见分光光度计(日本,岛津公司);F-7000型荧光光度计(日本,日立公司);MOS-450型圆二光谱仪(法国,Bio-Logic公司);Millipore Simplicity水纯化系统(法国,密理博司);pHS-3C型PH酸度计(上海,雷磁)。
欧前胡素(上海安谱实验科技股份有限公司,纯度99.8%);TY(Worthington Biochemical Corporation);左旋多巴(南京奥多福尼生物科技有限公司;纯度>98.0%);欧前胡素用无水乙醇配成浓度为6.67×10-3mol·L-1的储备液,TY、左旋多巴(L-dopa)和曲酸用磷酸盐缓冲溶液(pH 6.8,0.05 mol·L-1)分别配制成浓度为1.25×10-5mol·L-1,5.0×10-3mol·L-1(现配现用)和2.73×10-3mol·L-1的储备液。其余试剂均为分析纯,实验用水为超纯水。
1.2 实验方法
1.2.1 欧前胡素对酪氨酸酶的抑制活性测定
在总体积为2 mL,磷酸盐(pH 6.8,0.05 mol·L-1)溶液为缓冲液的体系中,固定TY的浓度为1.25×10-7mol·L-1,加入一系列不同浓度梯度的欧前胡素,在30 ℃的条件下孵化1 h。孵化完成后,加入底物L-dopa(5.0×10-3mol·L-1),用紫外-可见分光光度计的时间动力学模块测定反应体系在200s内475 nm处的吸光度值,再通过公式(1)计算出不同浓度欧前胡素存在下TY的相对活性,并计算欧前胡素的半抑制浓度(IC50)。曲酸作为阳性对照。R0、R分别表示无抑制剂和含有不同浓度抑制剂反应体系的吸光度变化率。
相对酶活性(%)=(R/R0)×100%
(1)
1.2.2 欧前胡素对酪氨酸酶的抑制可逆性测定
固定底物L-dopa的浓度为5.0×10-4mol·L-1,进行4组实验,测定在不同浓度欧前胡素的体系中,酶促反应速率(ΔOD)随TY浓度增大的变化趋势,再根据实验数据作出ΔOD与TY浓度的关系图,从而分析欧前胡素对TY的抑制作用是否可逆。若四条直线均交于原点,则说明抑制作用可逆;若四条直线互相平行,说明抑制作用不可逆。
1.2.3 判断欧前胡素对酪氨酸酶的抑制类型
在与1.2.2相同的实验条件下,另设4组实验,固定TY的浓度为1.25×10-7mol·L-1,分别加入不同浓度的欧前胡素,测定反应体系中ΔOD随底物L-dopa浓度增加的变化趋势,再根据Lineweaver-Burk双倒数方程作图,分析欧前胡素对TY的抑制类型。
1.2.4 荧光光谱的测定
(1) 荧光猝灭实验
将荧光光谱的实验条件设置为:激发波长280 nm,激发和发射的狭缝宽度均为2.5 nm,扫描范围300~450 nm。在1 cm的荧光池中,加入3.0×10-6mol·L-1的TY溶液3 mL,测定其荧光光谱后,再逐次加入3.0×10-4mol·L-1的欧前胡素,每次20 μL,混合均匀后静置2 min,分别扫描25 ℃,31 ℃和37 ℃ 3个温度下反应体系的荧光光谱。为了扣除“内滤光效应”的影响,本实验的荧光数据均要经过公式(2)进行校正[11]。Fm和Fc分别是校正前后的荧光强度;A1、A2分别表示欧前胡素在激发和发射波长处的紫外吸收值。
FC=Fme(A1+A2)/2
(2)
(2) 同步荧光光谱的测定
在25 ℃的条件下,设置实验激发和发射波长的差值(Δλ=λem-λex)分别为15和60 nm,与荧光猝灭实验一样,逐次加入20 μL的欧前胡素,测定反应体系在230~350 nm的同步荧光光谱,分析欧前胡素对TY中酪氨酸(Tyr)和色氨酸(Trp)残基微环境的影响。
(3) 三光维荧光谱的测定
设置三维荧光光谱的实验条件为:激发波长280 nm,激发和发射狭缝宽度均为2.5 nm,扫描范围200~600 nm。固定反应体系的总体积为2 mL,TY的浓度为2.0×10-5mol·L-1,欧前胡素的浓度为3.0×10-3mol·L-1,再分别扫描TY和欧前胡素-TY复合物的三维荧光光谱。
1.2.5 圆二色(CD)光谱实验
设置实验扫描范围为190~250 nm,扫描速度为60 nm min-1,并固定体系中TY的浓度为2.0×10-6mol·L-1,扫描欧前胡素与TY摩尔比分别为0:1、4:1和8:1时体系的CD光谱,再根据在线程序软件计算得出TY二级结构(α-螺旋、β-折叠、β-转角和无规则卷曲)的含量,从而分析欧前胡素对TY二级结构的影响[12]。
1.2.6 分子模拟
运用Discovery Studio 4.5软件中的LibDock对接程序进行欧前胡素与TY的分子对接模拟。TY的晶体结构从RCSB蛋白数据库(PDB,http://www.rcsb.org/,ID:2Y9X)获得。根据TY特殊的四聚体结构,选择A链进行对接仿真优化,然后进行氢化和极性加成操作。欧前胡素的结构从PubChem数据库中检索。欧前胡素系统的分子对接采用CDOCKER程序,运行次数为100次,选取最优的欧前胡素-TY配合物的结合姿态进行对接分析。
2 结果与讨论
2.1 欧前胡素对酪氨酸酶的抑制活性的测定
由图2可知,随着欧前胡素浓度的增加,TY的相对活性逐渐下降,当欧前胡素的浓度达到1.5×10-4mol·L-1,TY的相对活性降为31.16%,表明欧前胡素明显抑制了TY的活性,且属于浓度依赖型。同时,由图可求出欧前胡素的IC50为7.90×10-5mol·L-1,阳性对照(曲酸)的IC50为4.03×10-5mol·L-1,说明欧前胡素对TY活性有较好的抑制效果。

[I]/(10-5 mol·L-1)
2.2 欧前胡素对酪氨酸酶的抑制可逆性分析
由图3可知,随着欧前胡素浓度的增加,ΔOD与TY浓度关系拟合直线的斜率不断减小,且四条拟合直线均交于原点,说明欧前胡素能使TY催化速率下降,但不能使TY失活,由此判断出欧前胡素对TY的抑制作用是可逆的。

[Tyrosinase]/(10-8 mol·L-1)
2.3 欧前胡素对酪氨酸酶的抑制类型分析
由图4可知,通过Lineweaver-Burk双倒数方程作图,可以得到一组线性关系良好的拟合直线,该组直线交于第二象限,且随着欧前胡素浓度不断增大,Km值不断增大,Vmax值不断减小,由此推测出欧前胡素对TY的抑制类型为混合型抑制[13],其双倒数方程[14]如下:
(3)
(4)
(5)
式中,ν为酶促反应速率,Km为米氏常数,Vmax为最大酶促反应速率,[I]表示欧前胡素的浓度,[S]表示底物L-dopa的浓度,Ki为抑制常数,α为表观系数。
用直线斜率和截距分别对欧前胡素浓度作图,线性关系良好(R2(Y-intercept)=0.987 9,R2(slope)=0.997 3),表明欧前胡素与TY有一个结合位点,再通过计算得出欧前胡素对TY的Ki为7.54×10-5mol·L-1,α为2.88,α>1,说明欧前胡素与游离TY的结合亲和力较强[15]。

c(TY)=1.25×10-7 mol·L-1,c(Imperatorin)=0,3.75,7.5 and 11.25×10-5 mol·L-1for curve a→d,respectively.
2.4 欧前胡素对酪氨酸酶荧光光谱的影响分析
2.4.1 猝灭机制、结合常数、结合位点数以及热力学分析
如图5(A)所示,随着欧前胡素浓度的增大,TY的荧光强度不断下降,说明欧前胡素猝灭了TY的内源荧光,此外,欧前胡素的加入还引起了TY的荧光峰位红移,表明欧前胡素与TY发生了相互作用。再根据Stern-Volmer方程[16]进一步分析欧前胡素对TY的荧光猝灭机制;
(6)
式中,F0和F分别为欧前胡素加入前后TY的荧光强度;[Q]为欧前胡素的浓度;Ksv为猝灭常数;Kq为猝灭过程中的速率常数;τ0代表无猝灭剂时荧光分子的平均寿命,其值约为10-8s[17]。

λ/nm

[Imperatorin]/(10-6 moL·L-1)
通过F0/F对[Q]作图,得出3个温度(25 ℃,31 ℃和37 ℃)下的猝灭常数Ksv(表1),虽然随着温度升高,Ksv值增大,但是Kq远大于2×1010L·mol-1·s-1(最大扩散碰撞猝灭速率常数),表明欧前胡素对TY的荧光猝灭机制属于静态型。
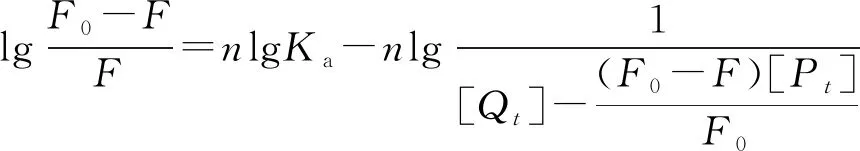
(7)
[Qt]为欧前胡素的浓度,[Pt]为TY的浓度。由表1可知,Ka在104数量级,说明欧前胡素对TY有中等强度的结合亲和力。在25 ℃,31 ℃,37 ℃ 3个温度下,n值均约等于1,说明TY中仅有一个供欧前胡素结合的位点。热力学参数可以通过van’t Hoff方程求出:
(8)
ΔG°=ΔH°-TΔS°
(9)
R是气体常数(8.314 J·mol-1·K-1),Ka为结合常数。从表1中可以看出,ΔG°<0,说明欧前胡素与TY的结合是自发进行的,ΔH°>0,ΔS°>0,说明疏水作用力在欧前胡素与TY结合的过程发挥了主要作用[19]。
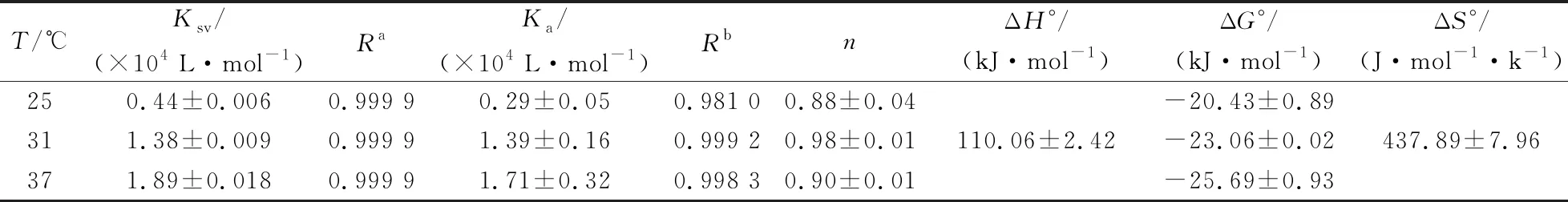
表1 不同温度下欧前胡素与TY作用的猝灭常数、结合常数、结合位点数与热力学参数值
2.4.2 欧前胡素对酪氨酸酶的同步荧光光谱的影响分析
图6分别表示Δλ为15和60 nm时欧前胡素与TY反应的同步荧光光谱。随着加入的欧前胡素浓度的不断增大,Tyr残基(图6A)和Trp残基(图6B)的荧光发射峰强度不断降低,峰位无明显的移动,说明欧前胡素的加入对Tyr和Trp残基周围微环境几乎不造成影响[20]。由同步荧光猝灭比率(RSFQ=1-F/F0)与欧前胡素浓度关系图(图6C)可知,Δλ=15 nm时欧前胡素的RSFQ值始终大于其在Δλ=60 nm时的值,说明Tyr对TY的荧光猝灭贡献更大,并且Tyr残基更靠近结合位点。
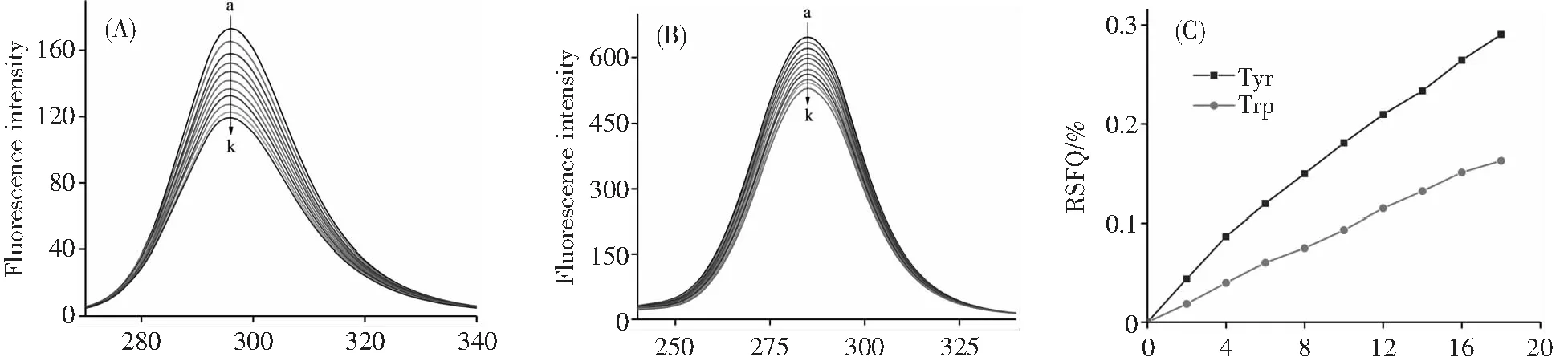
λ/nm λ/nm[Imperatorin]/(10-6 moL·L-1)
2.4.3 三维荧光光谱分析
图7(A)是TY的三维荧光光谱,Peak a和Peak b分别表示瑞利散射峰(λex=λem)和二阶散射峰(λex=2λem),Peak 1(λex/λem=280 nm/340 nm)表示Tyr和Trp残基的荧光特征峰,Peak 2(λex/λem=230 nm/335 nm)是TY多肽主链结构n→π*跃迁引起的。与荧光光谱图(A)相比,添加欧前胡素后,荧光光谱图(B)中Peak a荧光强度明显增加,Peak b荧光强度稍有减弱,表明欧前胡素与TY结合形成欧前胡素-TY复合物,从而增强了瑞利散射。Peak 1的荧光强度下降了12.09%,峰位未改变,表明Tyr和Trp残基的微环境几乎没有受到欧前胡素的干扰,这与同步荧光的结果一致。Peak 2的荧光强度下降了21.82%,表明欧前胡素-TY复合物的形成改变了TY的多肽主链结构,详细数据列于表2中。
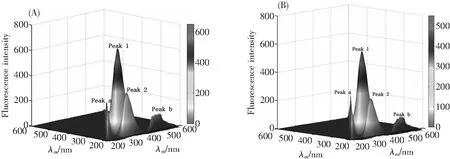
图7 游离TY(A)和TY-欧前胡素体系(B)的三维荧光光谱

表2 游离TY和TY-欧前胡素体系的三维荧光光谱值
2.5 欧前胡素对TY的CD光谱的影响分析
图8为不同浓度的欧前胡素与TY作用的CD光谱,由图可知,TY在210~230 nm内可以依稀辨认出两个负峰,但是欧前胡素在此范围内无明显的特征光谱峰,且随着欧前胡素浓度增大,CD特征光谱有一定的变化。通过在线软件计算出TY的二级结构含量,结果列于表3中,与游离的TY二级结构相比,加入欧前胡素后([欧前胡素:TY]=4:1和8:1),TY的α-螺旋含量有明显的降低,从43.6%降至34.7%,而β-折叠、β-转角和无规则卷曲含量有一定程度上升,表明欧前胡素使TY的结构变得松散且更不稳定。

λ/nm图8 欧前胡素对TY的CD光谱的影响
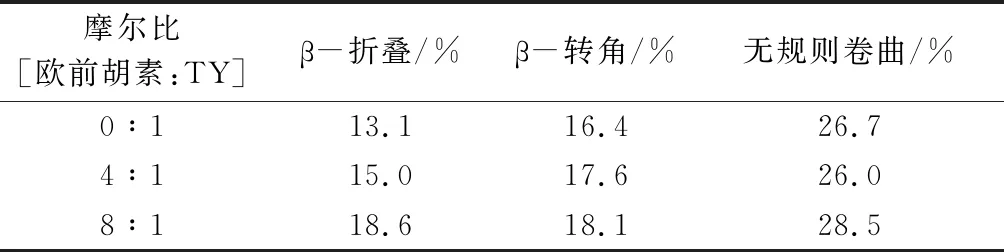
表3 TY和TY-欧前胡素体系的二级结构含量
2.6 分子模拟分析
图9(A)展示了欧前胡素与TY对接后的最佳结合位置,欧前胡素插入了TY的活性中心,并与周围的氨基酸残基发生了相互作用。由图(B)可知,欧前胡素通过疏水作用力与氨基酸残基His244、Val283、Val286、His263相互作用,并通过范德华力与Val248、Phe264、Gly281等氨基酸残基相互作用,表明欧前胡素与TY的结合除了受疏水相互作用
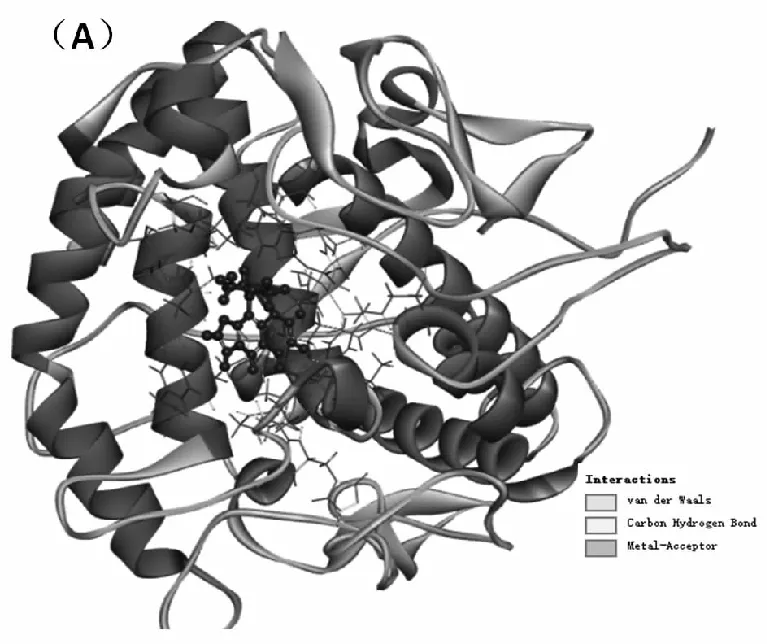
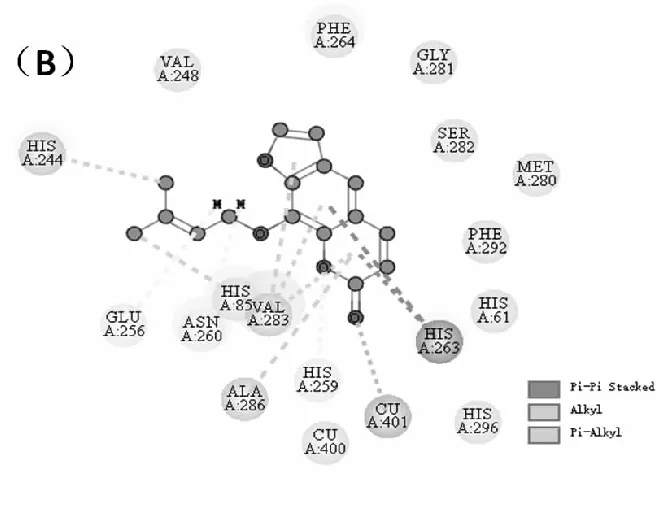
图9 (A)欧前胡素与TY最佳结合姿态的空间结构图(B)TY中与欧前胡素相互作用的氨基酸残基的2D结构图
驱动外,还存在一定程度的范德华力,这与热力学实验结果一致。通过分子模拟结果推测欧前胡素对TY的抑制作用可能是因为欧前胡素占据了TY的活性位点,阻止了底物与活性中心结合,从而导致TY催化活性下降。
3 结论
欧前胡素对TY有良好的抑制作用,是一种可逆的混合型TY抑制剂,且更倾向于与游离的TY结合。欧前胡素对TY是静态型猝灭,两者有一个结合位点。结合过程是自发进行的,主要驱动力为疏水作用力。欧前胡素的加入对Tyr和Trp残基周围的微环境基本上不造成影响,但使TY的二级结构变得松散,主要表现在α-螺旋含量明显下降,而β-折叠、β-转角、无规则卷曲含量有一定程度上升。分子模拟结果显示欧前胡素插入到TY的活性中心,通过疏水力与氨基酸残基His244、Val283、Val286、His263相互作用。因此推测欧前胡素对TY的抑制作用可能是因为欧前胡素占据了TY的活性中心位点,阻止底物与活性中心结合,从而抑制了TY催化活性。
