HPLC法同时测定不同基原崖桑皮和桑白皮中7种活性成分含量
2021-12-10黎海灵黄艳萍陈旭冰谷文超周游张德全周浓
黎海灵 黄艳萍 陈旭冰 谷文超 周游 张德全 周浓

摘 要 目的:建立同時测定重庆地区不同基原崖桑皮和桑白皮中7种活性成分含量的方法,为完善崖桑皮和桑白皮的质量控制标准以及比较两者质量等同性提供参考。方法:采用高效液相色谱(HPLC)法测定58批崖桑皮和桑白皮药材中新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素和异槲皮素的含量,色谱柱为Diamonsil C18,流动相为0.1%甲酸溶液-乙腈(梯度洗脱),流速为1.0 mL/min,检测波长为280 nm,柱温为30 ℃,进样量为10 μL。利用SPSS 22.0软件,采用独立样本t检验、主成分分析和聚类分析方法分析58批崖桑皮和桑白皮药材中上述7种活性成分的含量差异。结果:上述7种活性成分在各自质量浓度范围内与峰面积的线性关系良好(r≥0.999 0),精密度、稳定性(24 h)、重复性、耐用性和加样回收率试验的RSD均小于3%。崖桑皮中新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素和异槲皮素的平均含量分别为0.304、22.462、1.730、1.308、1.593、2.842、0.657 mg/g,而桑白皮中上述7种活性成分的平均含量分别为0.305、22.995、2.486、2.438、2.916、4.158、1.264 mg/g。独立样本t检验结果显示,崖桑皮和桑白皮的上述7种活性成分中只有山柰酚的含量差异具有统计学意义(P<0.05);主成分分析和聚类分析结果均显示崖桑皮中上述7种活性成分的含量与桑白皮无明显差别。结论:所建HPLC法简便、灵敏、准确度高,可为完善崖桑皮和桑白皮的质量控制标准提供参考。崖桑皮和桑白皮在主要活性成分上具有一定的质量等同性,以华桑和鸡桑为来源的崖桑皮可作为桑白皮的代替品使用。
关键词 崖桑皮;桑白皮;新绿原酸;桑皮苷A;绿原酸;紫云英苷;山柰酚;桑辛素;异槲皮素;含量;基原
ABSTRACT OBJECTIVE: To establish a method for the simultaneous determination of 7 active components in Mori Australis Cortex and Mori Cortex from different sources in Chongqing area, so as to provide reference for improving the quality control standards of Mori Australis Cortex and Mori Cortex and comparing the equivalence of their quality. METHODS: HPLC method was used to determine the contents of neochlorogenic acid, mulberroside A, chlorogenic acid, astragalin, kaempferol, morusin and isoquercetin in 58 batches of Mori Australis Cortex and Mori Cortex. The chromatographic column was Diamonsil C18 with mobile phase consisted of 0.1% formic acid solution-acetonitrile (gradient elution) at the flow rate of 1.0 mL/min. The detection wavelength was 280 nm, column temperature was 30 ℃, and the injection volume was 10 μL. Using SPSS 22.0 software, independent sample t-test, principal component analysis and cluster analysis were used to analyze the content difference of the above-mentioned 7 active components in Mori Australis Cortex and Mori Cortex. RESULTS: There was a good linear relationship between the peak area and the concentration of the above 7 active components (r≥0.999 0). The RSDs of precision, stability (24 h), repeatability, durability and recovery were less than 3%. The average contents of neochlorogenic acid, mulberroside A, chlorogenic acid, astragalin, kaempferol, morusin and isoquercetin in Mori Australis Cortex were 0.304, 22.462, 1.730, 1.308, 1.593, 2.842 and 0.657 mg/g, respectively. Those of Mori Cortex were 0.305, 22.995, 2.486, 2.438, 2.916, 4.158 and 1.264 mg/g, respectively. The results of independent sample t-test showed that only the content of kaempferol in the above 7 active components of Mori Australis Cortex and Mori Cortex had significant difference (P<0.05). The results of principal component analysis and cluster analysis showed that there was no significant difference in the contents of above 7 active components between Mori Australis Cortex and Mori Cortex. CONCLUSIONS: The established HPLC method is simple, sensitive and accurate, which can provide a reference for improving the quality control standard of Mori Australis Cortex and Mori Cortex. Mori Australis Cortex and Mori Cortex have certain quality equivalence in main active components, and the Mori Australis Cortex from M. australis and M. cathayana can be used as a substitute for the Mori Cortex.
KEYWORDS Mori Australis Cortex; Mori Cortex; Neochlorogenic acid; Mulberroside A; Chlorogenic acid; Astragalin; Kaempferol; Morusin; Isoquercitrin; Content; Source
桑白皮为桑科植物桑Morus alba L.的干燥根皮,始载于《神农本草经》,用药历史悠久。据2020年版《中国药典》(一部)记载,桑白皮性味甘、寒,归肺经,入药可用于治疗肺热喘咳、水肿胀满、尿少、面目肌肤浮肿等疾病[1-2]。崖桑皮为桑科植物鸡桑M.australis Poir.或华桑M.cathayana Hemsl.的干燥根皮,入药具有与桑白皮相似的功效,主要在重庆、四川、贵州、广西等地作为地方习用品使用,收载于2010年版《四川省中药材标准》[3]。随着中药材产业的发展和市场对中药材需求的日益扩大,中药材多基原利用在一定时期内对扩大药源、保障临床用药需求具有重要意义。但不同基原的药材往往成分不同、品质参差不齐,难以用统一的标准来控制其质量和保证临床疗效,严重影响了中药材的安全性、有效性和可控性。
桑属植物的根皮主要含有黄酮类、芪类、生物碱类和香豆素类等化学成分[4-6]。其中,黄酮类化合物是桑白皮的药效物质基础,芪类化合物被认为是植物抗毒素物质[7-9]。在2020年版《中国药典》和2010年版《四川省中药材标准》中,仅以外观性状、显微鉴别和薄层鉴别作为桑白皮和崖桑皮的质量控制标准,未对其有效成分含量测定项进行相关规定。陈志永等[10]对桑白皮有效成分新绿原酸、桑皮苷A、绿原酸、紫云英苷、桑根酮C和桑辛素进行了含量测定;魏敏等[11]测定了桑白皮中桑皮苷A、氧化白藜芦醇、桑色素、桑根酮D、桑黄酮G、桑皮酮H和桑辛素的含量;袁婷等[12]利用高效液相色谱法(HPLC)测定了桑白皮中绿原酸、二氢桑色素、氧化白藜芦醇、桑辛素O、桑根酮C的含量。本研究在前人研究基础上,采用HPLC法同时测定重庆地区不同基原桑白皮和崖桑皮中新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素和异槲皮素等7种活性成分的含量(其中崖桑皮中活性成分的含量测定是首次报道);同时,采用独立样本t检验、主成分分析和聚类分析方法对桑白皮和崖桑皮中7种活性成分的含量进行评价,比较其含量差异性,以期为完善桑白皮和崖桑皮的质量控制标准及讨论其入药质量等同性提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有LC-20AT型HPLC仪(日本Shimadzu公司)、SB-5200DTN型超声波清洗机(宁波新芝生物科技股份有限公司)、TDZ5-WS型多管架自动平衡离心机(湖南赛特湘仪离心机仪器有限公司)、ML204型电子分析天平[梅特勒-托利多仪器(上海)有限公司,精度0.000 1 g]、CP225D型电子天平(德国Sartorius公司,精度0.000 01 g)、DZF-6050MBE型电热恒温真空干燥箱(上海博讯实业有限公司)。
1.2 主要试剂
本研究所用的主要试剂有新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素、异槲皮素对照品(成都德斯特生物技术有限公司,批号分别为DST190124- 015、DST190408-068、DST180504-21、DST190312-001、DST160928-056、DST180729-069、DST180108-006,纯度均大于98%),乙腈(色譜纯,德国Merck公司);其他试剂均为分析纯,水为娃哈哈牌纯净水。
1.3 药材
1.3.1 样品药材 53批崖桑皮和桑白皮样品药材于2018年10月采集于重庆市部分区县(表1中编号Y1~Y44、S2~S10,其中Y代表崖桑皮样品、S代表桑白皮样品),经重庆三峡学院生物与食品工程学院周浓教授鉴定分别为桑科植物鸡桑M. australis Poir.、华桑M. cathayana Hemsl.或桑M. alba L.的干燥根皮。另有3批崖桑皮样品药材(编号Y45~Y47)于2018年10月购于成都、重庆的药材市场,经周浓教授鉴定为桑科植物鸡桑M. australis Poir.或华桑M. cathayana Hemsl.的干燥根皮。将上述药材于45 ℃烘干至恒质量,粉碎,过80目筛,密封储存于4 ℃环境中,待用。
1.3.2 对照药材 桑白皮对照药材(编号S1,批号DST181226-004)、崖桑皮对照药材(编号Y48,批号DST190115-135)均购自成都德斯特生物技术有限公司。
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品溶液 精密称取新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素和异槲皮素对照品各适量,置于同一量瓶中,用70%甲醇溶液溶解并配制成上述成分质量浓度分别为0.287、0.466、0.148、0.118、0.058、0.328、0.185 mg/mL的混合对照品溶液,用0.22 ?m微孔滤膜滤过,备用。
2.1.2 供试品溶液 精密称取药材粉末0.5 g,置于具塞锥形瓶中,精密加入70%甲醇溶液25 mL,混匀,称定质量,在室温条件下超声(功率300 W,频率40 kHz,下同)提取30 min,冷却至室温,用70%甲醇溶液补足减失的质量,以4 000 r/min离心10 min,取上清液,用0.22 ?m微孔滤膜滤过,即得供试品溶液。
2.1.3 阴性样品溶液 精密量取70%甲醇溶液25 mL,置于具塞锥形瓶中,按“2.1.2”项下“称定质量……用0.22 ?m微孔滤膜滤过”步骤操作,制得阴性样品溶液。
2.2 色谱条件
色谱柱为Diamonsil C18(250 mm×4.6 mm,5 μm),流动相为0.1%甲酸溶液(A)-乙腈(B),梯度洗脱(洗脱程序如表2所示),流速为1.0 mL/min,检测波长为280 nm,柱温为30 ℃,进样量为10 μL。
2.3 方法学考察
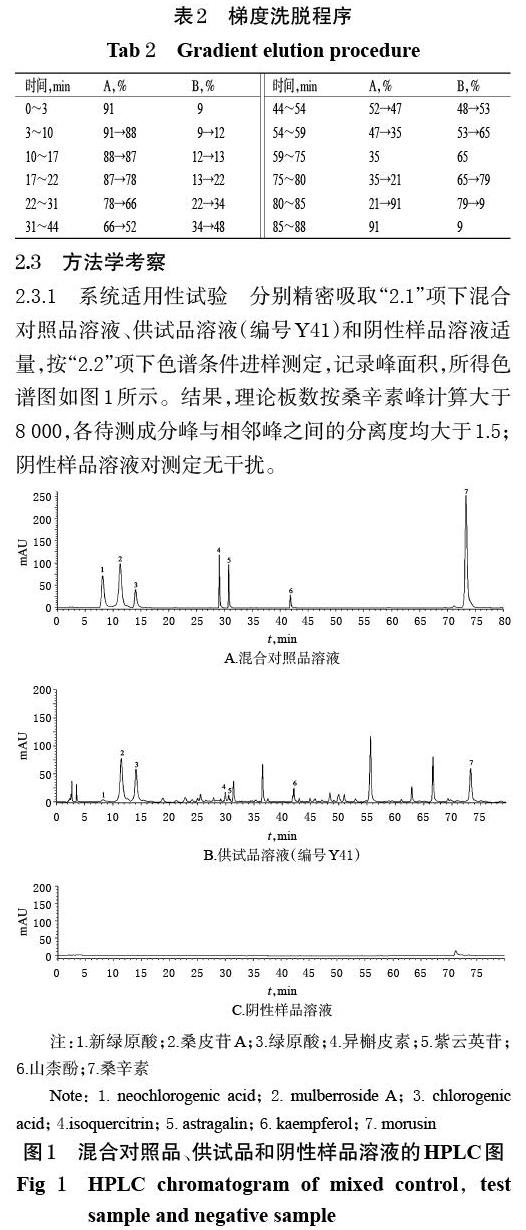
2.3.1 系统适用性试验 分别精密吸取“2.1”项下混合对照品溶液、供试品溶液(编号Y41)和阴性样品溶液适量,按“2.2”项下色谱条件进样测定,记录峰面积,所得色谱图如图1所示。结果,理论板数按桑辛素峰计算大于8 000,各待测成分峰与相邻峰之间的分离度均大于1.5;阴性样品溶液对测定无干扰。
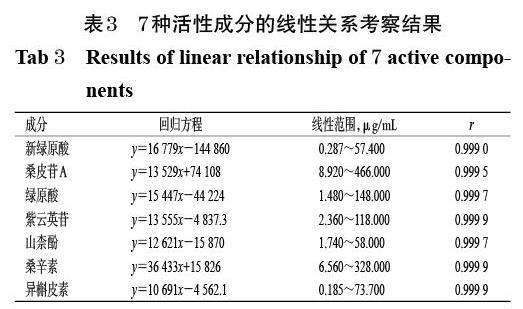
2.3.2 线性关系考察 分别精密吸取“2.1.1”项下混合对照品溶液适量,用70%甲醇溶液稀释得到系列对照品溶液,按“2.2”项下色谱条件依次进样测定,记录峰面积。以各对照品峰面积(y)与其相应的质量浓度(x)进行线性回归,结果如表3所示。由表3可知,7种活性成分的r均不小于0.999 0,表明线性关系良好。
2.3.3 精密度试验 取同一混合对照品溶液适量,按“2.2”项下色谱条件连续进样测定6次,记录峰面积。结果,新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素和异槲皮素峰面积的RSD分别为2.81%、2.78%、2.33%、2.50%、2.79%、2.52%和0.77%(n=6),表明仪器精密度良好。
2.3.4 稳定性试验 取同一供试品溶液(编号Y41)适量,分别在室温下放置0、2、4、8、12、16、24 h时按“2.2”项下色谱条件进样测定,记录峰面积。结果,新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素和异槲皮素峰面积的RSD分别为1.61%、1.89%、2.80%、2.14%、2.39%、0.74%和1.01%(n=7),表明供试品溶液在室温下放置24 h内的稳定性良好。
2.3.5 重复性试验 精密称取样品(编号Y41)粉末0.5 g,平行6份,分别按“2.1.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并按外标法计算样品中7种活性成分的含量。结果,新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素和异槲皮素含量的RSD分别为2.92%、1.82%、2.62%、2.73%、1.06%、2.18%和2.69%(n=6),表明该方法重复性良好。
2.3.6 加样回收率试验 取“2.3.5”项下已知含量的样品(编号Y41)粉末0.25 g,精密称定,加入混合对照品溶液1 mL,平行6份,分别按“2.1.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,计算加样回收率。结果,新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素和异槲皮素的平均加样回收率分别为100.56%、101.36%、101.31%、103.85%、104.38%、104.43%和101.46%,RSD分别为2.13%、2.79%、2.34%、2.80%、1.86%、2.90%和2.23%(n=6),表明该方法准确度良好。
2.3.7 耐用性试验 精密称取样品(编号Y41)粉末适量,按“2.1.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件分别以不同色谱仪(Shimadzu LC-20AT、Agilent 1260)、不同色谱柱(Diamonsil C18、Venusil ASB C18、Inertsustain C18)、不同流速(0.8、1.0、1.2 mL/min)、不同柱温(25、30、35 ℃)进行测定,各条件平行操作3次,记录峰面积并按外标法计算样品中7种活性成分的含量,结果如表4所示。由表4可知,7种活性成分含量的RSD均小于3.0%,表明该方法耐用性良好。
2.4 样品测定
取58批崖桑皮和桑白皮药材粉末各适量,分别按“2.1.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并按外标法计算药材中7种活性成分的含量,每批药材平行测定3次。采用SPSS 20.0软件对含量结果进行单因素方差分析,比较不同基原崖桑皮和桑白皮药材中7种活性成分的含量差异性,结果如表5、表6所示。
由表5、表6可知:(1)不同批次崖桑皮或不同批次桑白皮中7种活性成分的含量差异有统计学意义(P<0.05)。(2)崖桑皮中新绿原酸、桑皮苷A、绿原酸、紫云英苷、山柰酚、桑辛素和异槲皮素的平均含量分别为0.304、22.462、1.730、1.308、1.593、2.842、0.657 mg/g,平均總含量为30.896 mg/g;桑白皮中上述7种活性成分的平均含量分别为0.305、22.995、2.486、2.438、2.916、4.158、1.264 mg/g,平均总含量为36.562 mg/g。无论是单一成分含量还是总含量,桑白皮均高于崖桑皮。编号为S5的桑白皮的总含量最高(达到64.144 mg/g),编号为Y45的崖桑皮的总含量最低(仅为2.272 mg/g)。(3)从总体上看,大部分崖桑皮样品药材中新绿原酸、桑皮苷A、绿原酸和桑辛素的含量高于其对照药材,而紫云英苷(编号Y36样品除外)、山柰酚、异槲皮素的含量均低于其对照药材。桑白皮样品药材中新绿原酸、绿原酸和桑辛素(编号S2样品除外)的含量高于其对照药材,而桑皮苷A(编号S5样品除外)、紫云英苷(编号S2样品除外)、山柰酚(编号S4样品除外)和异槲皮素的含量低于其对照药材。
2.5 独立样本t检验
采用SPSS 22.0软件对崖桑皮和桑白皮药材中7种活性成分的含量数据进行独立样本t检验,分析崖桑皮与桑白皮之间7种活性成分含量的差异性。结果表明,崖桑皮与桑白皮中山柰酚的含量差异具有统计学意义(P<0.05),而其他6种活性成分的含量差异无统计学意义(P>0.05),如表7所示。
2.6 主成分分析
采用SPSS 22.0软件对崖桑皮和桑白皮药材中7种活性成分进行主成分分析,结果提取到了3个特征值>1的主成分。其中,主成分1的特征值为2.443,特征贡献率为34.906%;主成分2的特征值为1.499,特征贡献率为21.416%;主成分3的特征值为1.004,特征贡献率为14.349%;3个主成分的累计贡献率为70.671%。主成分1主要反映了紫云英苷、山柰酚、桑辛素、异槲皮素的信息;主成分2主要反映了新绿原酸、桑皮苷A、绿原酸的信息;主成分3主要反映了桑辛素的信息。
对提取的主成分1、2、3分别计算得分和排序,计算公式为:
F1=0.104X1-0.041X2+0.136X3+0.337X4+0.357X5+0.035X6+0.369X7
F2=0.422X1+0.418X2+0.434X3-0.950X4-0.640X5+0.316X6-0.114X7
F3=-0.375X1+0.349X2-0.440X3+0.135X4+0.610X5+0.717X6+0.570X7
上式中,F1、F2、F3分别表示第1、2、3个主成分得分,X1~X7分别表示7种活性成分的标准化数据。再以3个主成分所对应的特征贡献率和累计贡献率的比值为权重,进行综合得分计算和排序,计算公式为F综=0.494F1+0.303F2+0.203F3,可得出:编号Y48药材的主成分1得分最高,为2.908;编号S5药材的主成分2得分最高,为3.309;编号S4药材的主成分3得分最高,为3.754。此外,编号S4药材的综合得分最高,为1.555,表明该药材样品的品质较其他药材样品的品质更高[13]。
根据3个主成分的得分绘制散点图,可将58批药材分成5组(图2),其中编号Y48药材为第1组,编号S5药材为第2组,编号Y14药材为第3组,编号Y41药材为第4组,其余54组药材聚在一起归为一大组,即第5组。此结果说明主成分分析未能将崖桑皮与桑白皮药材区分开来。
2.7 聚类分析
以崖桑皮和桑白皮药材中7种活性成分的含量为依据,采用SPSS 22.0软件以欧氏距离法进行聚类分析,结果如图3所示。由图3可知,当欧氏距离小于15时,58批药材可分为5大类——第Ⅰ类:Y48、S1;第Ⅱ类:S5;第Ⅲ类:S4;第Ⅳ类:Y12、Y14;第Ⅴ类:剩余批次药材。同时,7种活性成分含量相近或相同的崖桑皮和桑白皮的距离大多比较接近,因此不能将崖桑皮和桑白皮进行区分。此结果与主成分分析结果大体一致。崖桑皮中7种活性成分的含量与桑白皮无明显差别,这一结论为崖桑皮代替桑白皮使用提供了理论支持。
3 讨论
3.1 所测指标成分的选择
桑属植物中主要活性成分为黄酮类和芪类物质,本研究结合崖桑皮和桑白皮的临床药效以及前人研究内容,最终选择了黄酮类化合物异槲皮素、紫云英苷、山柰酚、桑辛素,苯丙素类化合物绿原酸、新绿原酸和芪类化合物桑皮苷A作为桑白皮和崖桑皮的有效成分含量测定指标。其中,绿原酸和新绿原酸具有抗病毒、抗肿瘤、抗菌、解热、抗血栓等功效[12,14-16];桑皮苷A在体内可以转化为氧化白藜芦醇,发挥降糖作用[17-18];紫云英苷和异槲皮素具有消炎、镇痛、抗菌、抗过敏、抗肝毒等药理作用[19-21];桑辛素具有抑制血小板聚集、抗超氧化自由基形成、降血糖等作用[22-23];山柰酚对脑缺血、中风、肿瘤等有明显的治疗作用[24-25]。
3.2 提取方法的选择
在供试品溶液的制备过程中,本研究分别考察了不同提取方式(超声、回流)、提取溶剂(体积分数分别为30%、50%、70%、80%、100%的甲醇和乙醇溶液)、提取时间(15、30、45、60 min)、料液比[1 ∶ 30、1 ∶ 50、1 ∶ 70、1 ∶ 200 (g/mL)]和提取次数(1、2、3次)对崖桑皮和桑白皮中7种活性成分含量的影响。结果显示,提取方式为超声提取、提取溶剂为70%甲醇溶液、提取时间为30 min、料液比为1 ∶ 50(g/mL)、提取1次的提取效果最佳。
3.3 活性成分测定结果分析
虽然从整体上看,上述7种活性成分无论是单一成分含量还是总含量,桑白皮均高于崖桑皮,但独立样本t检验结果显示,7种活性成分中只有山柰酚的含量差异具有统计学意义(P<0.05);主成分分析和聚类分析结果也表明,崖桑皮与桑白皮中7种活性成分的含量无明显差别。以上结果显示,除山柰酚外,崖桑皮和桑白皮在主要活性成分上具有一定的质量等同性,因此在抗病毒、抗菌、解热等药理活性方面,以华桑和鸡桑为来源的崖桑皮可作为桑白皮的代替品使用。
對照药材是一种中药标准物质,具有高度均匀性、量值准确性以及良好的稳定性[26]。本研究以崖桑皮和桑白皮对照药材的含量为参考标准,发现大部分崖桑皮样品中新绿原酸、桑皮苷A、绿原酸和桑辛素的含量均高于其对照药材,但紫云英苷(编号Y36样品除外)、山柰酚、异槲皮素的含量均低于其对照药材;而桑白皮样品中仅有新绿原酸、绿原酸和桑辛素(编号S2样品除外)的含量高于其对照药材。这表明所采集的重庆地区不同来源崖桑皮和桑白皮的药材样品低于对照药材的含量标准,入药需结合各有效成分的药效学做进一步深入研究。
综上所述,本研究采用HPLC法对重庆地区不同基原崖桑皮和桑白皮中7种活性成分的含量进行了测定,测定指标涵盖了上述2种药材的主要有效成分。该方法简便、灵敏、准确度高,可为完善上述2种药材的质量控制标准提供参考。测定结果显示,崖桑皮和桑白皮在主要活性成分上具有一定的质量等同性,以华桑和鸡桑为来源的崖桑皮可作为桑白皮的代替品使用。此外,本研究存在一些不足,首先是药材的采集产地比较单一,仅能反映重庆地区崖桑皮和桑白皮中7种有效成分的质量等同性;其次是测定的芪类成分较少。因此,为了全面评价崖桑皮和桑白皮的质量,下一步将采集其他地区的样品,测定包括黄酮类、芪类、核苷类、三萜酸类、多糖类等多种活性成分的含量,以期进一步对不同基原崖桑皮和桑白皮的药材品质进行综合评价。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:311.
[ 2 ] 候宝林,施洋,赵俊芳,等.桑白皮化学成分及药理作用研究进展[J].辽宁中医杂志,2020,47(8):212-214.
[ 3 ] 四川省食品药品监督管理局.四川省中药材标准[S]. 2010年版.成都:四川科学技术出版社,2010:541-543.
[ 4 ] 张庆建.鸡桑、华桑化学成分及生物活性研究[D].北京:中国协和医科大学,2007.
[ 5 ] 宋小地,翟西峰,冯家星,等.桑白皮和桑叶中α-葡萄糖苷酶抑制剂的虚拟筛选[J].中国药房,2017,28(4):508- 511.
[ 6 ] 董德刚,张秀英,刘小雪.桑白皮有效成分分离纯化的工艺研究[J].中国药房,2015,26(28):3960-3963.
[ 7 ] 党院霞,梁丹灵,周欣欣,等.基于分子对接技术的桑白皮总黄酮对高脂血症并高尿酸血症大鼠肾保护作用研究[J].中草药,2019,50(5):1175-1181.
[ 8 ] 刘芬,党院霞,邢菊玲,等.基于分子对接的方法探讨桑根酮C对MC3T3-E1细胞的药理作用[J].中国实验方剂学杂志,2020,26(10):44-50.
[ 9 ] 王甜.二萜和芪类化合物抗慢性阻塞性肺疾病研究[D].青岛:山东大学,2020.
[10] 陈志永,蒙麦侠,杨媛媛,等.HPLC法同时测定桑白皮中6种活性成分的含量[J].中国药房,2018,29(7):911-914.
[11] 魏敏,陀扬凌,杜晓月,等.不同产地桑白皮中7种成分的含量测定及化学计量学评价[J].中药材,2020,43(1):125-129.
[12] 袁婷,鄭甜碧,谢鲁灵枫,等. HPLC法同时测定桑白皮中5种成分[J].中成药,2019,41(7):1606-1611.
[13] 张露荷,黄华梨,张广忠,等.基于主成分分析法的鲜食枣品种综合评价[J].南方农业学报,2018,49(4):727-734.
[14] 樊荣,羿国娟,鲁兰,等.绿原酸及其13种体内主要代谢物的体外抗菌作用研究[J].中草药,2020,51(24):6239- 6245.
[15] 徐小昆,陈志永,廖立平,等.丁公藤属植物中东莨菪苷、绿原酸、东莨菪素、异绿原酸A、异绿原酸B和异绿原酸C的含量测定[J].中国中药杂志,2015,40(6):1119-1122.
[16] 普天磊,邓红山,廖承飞,等. HPLC法测定不同种源辣木叶花茎中异槲皮苷和新绿原酸的含量[J].食品研究与开发,2020,41(10):178-183.
[17] 景王慧,吴文进,燕茹,等.归肺经中药桑白皮的化学、药理与药代动力学研究进展[J].世界中医药,2014,9(1):109-112.
[18] 郑云翀.桑活性成分促胰岛素分泌效果和机制的比较研究[D].上海:华东理工大学,2017.
[19] 陈金川.紫云英苷的酶法合成及其抗氧化活性[D].扬州:扬州大学,2016.
[20] 夏伯候,周亚敏,皮胜玲,等. UPLC测定桑叶中抗氧化活性成分异槲皮苷、芦丁和紫云英苷的含量[J].中药材,2016,39(3):586-589.
[21] 辛国华.异槲皮苷葡萄糖基水解酶的纯化及酶学性质[D].大连:大连工业大学,2014.
[22] 陈辰,许子寒,王力.桑辛素对喉癌干细胞干性表型调控的作用研究[J].四川大学学报:医学版,2020,51(5):650-657.
[23] 钟芳芳,严鸣光,杨芳,等.桑辛素对D-半乳糖致小鼠老年性痴呆模型的保护作用及机制研究[J].天津中医药,2020,37(1):104-108.
[24] 程笑,杨滢霖,李伟瀚,等.山柰酚对LPS诱导小鼠急性肾损伤作用及机制探讨[J].中国药学杂志,2020,55(17):1439-1443.
[25] 张炜,全昆,宋祖琪,等.山柰酚抑制EMT阻断神经胶质瘤细胞侵袭和转移[J].时珍国医国药,2020,31(5):1097-1101.
[26] 戴宇,邓赟,宋川霞,等.对照提取物的国内外发展研究概况[J].中药与临床,2015,6(4):49-53.
(收稿日期:2020-12-23 修回日期:2021-06-10)
(编辑:胡晓霖)
