两种精原干细胞高效能纯化方法的比较研究*
2021-12-10白音巴图于泊洋任向宇刘陶迪
张 岩, 白音巴图, 于泊洋, 杨 铮, 云 霞, 任向宇, 刘陶迪△
(1. 内蒙古医科大学基础医学院, 2. 内蒙古医科大学心身医学研究室, 呼和浩特 010110)
精子发生是指从精原干细胞(spermatogonial stem cells, SSCs)发育到成熟精子的过程,该过程发生在成年雄性哺乳动物的睾丸内,SSCs的自我更新与分化是正常精子发生的基础[1]。SSCs作为一种成体干细胞需要与曲细精管内的体细胞(如支持细胞和睾丸间质细胞)配合来平衡其自我更新与分化,既能够避免干细胞的枯竭又能够为雄性哺乳动物一生源源不断的提供精子发生[2]。自2003年Kanatsu-Shinohara研究组[3]成功建立了小鼠SSCs的体外长期培养体系以来,经过十余年的发展,体外培养的SSCs得到了广泛而深入的研究和发展,既可以用来制备转基因动物[3,4],也可在体外诱导为多能干细胞[5,6]及用来在人类进行自体移植(主要是未成年患者)恢复生育能力[7]。然而SSCs在雄性哺乳动物睾丸内的数量极为稀少,约占成年小鼠睾丸生殖细胞总数的0.03%[8]。因此采用一个高效的分离方法,得到稳定的SSCs,对于SSCs的体外操作是极为重要的前提保障。目前,SSCs的分离纯化采用最多的就是免疫磁珠法[9-11]和差异贴壁法[12-14]。本实验以小鼠SSCs (mSSCs)为研究对象,分别采用这两种方法进行分离纯化,并详细比较两种方法的纯化效果,并对这两种方法在实践应用中的优缺点和适用性进行分析和总结,为SSCs进一步的深入研究奠定基础,同时也为人SSCs的体外研究和将来的临床应用提供理论依据。
1 材料与方法
1.1 材料
MEMα培养液、DMEM/F12培养液和双抗(Pen Strep)均购于Gibco公司。β巯基乙醇、Laminin,牛血清白蛋白(BSA)和马血清购于Sigma公司。 生长因子GDNF,GFRa1和bFGF均购于R&D公司。Collagenase Ⅳ(Worthington),Trypsin(Amresco), EDTA和DNase Ⅰ(上海生工)。thy-1抗体偶联的免疫磁珠(Miltenyi Biotec),胎牛血清(TBD),其他化学试剂均为国产分析纯制品。实验所用一抗有:兔抗鼠CDH1 IgG一抗和山羊抗鼠GFRα1 IgG一抗(Santa Cruz)。实验所用二抗和Hochest33342均购自武汉博士德生物工程有限公司,二抗有:cy3偶联的抗小鼠IgG,FITC偶联的抗兔IgG。
1.2 曲细精管单细胞悬液的制备
曲细精管单细胞悬液的制备采用已报道的“两步酶消化法”[15],具体过程如下。将10只12~15日龄的雄性C57BL/6小鼠颈椎脱臼法处死,无菌条件下摘出睾丸。将睾丸置于无菌培养皿并去掉白膜暴露出曲细精管,收集所有的曲细精管置于事先准备好的装有DMEM/F12培养液的小瓶中。在瓶中加入Collagenase Ⅳ和DNase Ⅰ,37℃水浴摇床孵育15 min。离心弃上清,并用DPBS清洗两次。加入Trypsin/EDTA溶液,37℃水浴摇床孵育5 min,反复吹打使其形成单细胞悬液。当绝大多数细胞已吹散时,立刻加入含10% FBS的DMEM/F12培养液终止反应。去除肉眼可见的大组织块,将上述培养液分别通过200目和300目的尼龙膜过滤,将细胞滤液以2 000 r/min离心5 min,DMEM/F12 培养液重悬,得到曲细精管单细胞悬液,血球计数板计数。
1.3 差异贴壁法纯化精原干细胞
差异贴壁法是利用曲细精管单细胞悬液中各种不同细胞表面的贴壁能力不同而进行分离[15]。具体过程(图1A)如下:将得到的单细胞悬液接种在4~6个明胶处理过的100 mm细胞培养皿中,接种浓度约为2×106个细胞/皿,32.5℃,5.5% CO2细胞培养箱中培养65 h。65 h后拿出培养皿,弃培养液,每个培养皿中加入8 ml DMEM/F12培养液,在培养皿表面温和地反复吹打,收集悬浮细胞。由于不同的表面粘附力,悬浮细胞中绝大多数为生殖细胞,体细胞仍然贴壁在培养皿底部。为了尽可能的收集生殖细胞,重复该步骤两次。将收集到的生殖细胞悬液转移到50 ml离心管中,2 000 r/min离心5 min。DMEF/F12培养液重悬细胞。提前一夜用鼠尾胶原包被两个100 mm培养皿,将细胞悬液加到鼠尾胶原包被过的培养皿中,32.5℃,5.5% CO2培养4 h。4 h后,取出培养皿,收集未贴壁细胞到一个50 ml离心管中,2 000 r/min离心5 min。DMEF/F12培养液重悬细胞,把细胞悬液接种到至少提前4 h准备好的铺有laminin的12孔板中,32.5℃,5.5% CO2培养45 min。45 min后弃培养液,加入PBS-BSA溶液使Laminin粘着的未分化精原细胞脱壁。收集所有浮起的细胞到一个50 ml离心管中,2 000 r/min离心5 min,弃上清,精原干细胞培养液重悬细胞,并计数。
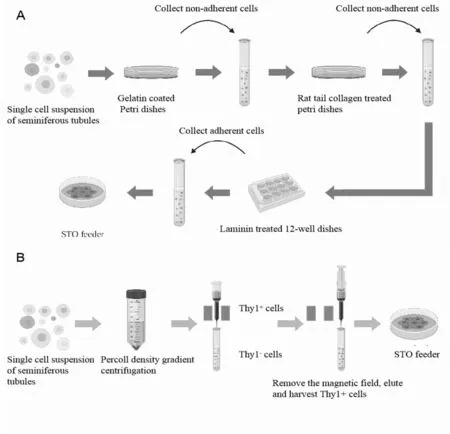
Fig. 1 Purification of mousespermatogonial stem cells (mSSCs)A: Purification of mSSCs by differential attachment method, using the differences of SSCs, somatic cells (support cells and a small number of pericyte cells) and other spermatogenic cells of adherence to different media; B: The mSSCs are purified by immunomagnetic bead method. The specific antigen Thy1 on the surface of mSSCs can be combined with the specific monoclonal antibody connected to the magnetic beads. In an external magnetic field, the cells connected to the magnetic beads through the antibody are adsorbed and stay in the magnetic field. Cells without surface antigens have no magnetism because they cannot bind to a specific monoclonal antibody connected to magnetic beads, and do not stay in a magnetic field, so that cells can be separated
1.4 免疫磁珠法纯化精原干细胞
mSSCs细胞表面具有的特异抗原Thy1能与连接在磁珠上的特异性单抗相结合[10],在外加磁场中,带有抗原Thy1的细胞被磁珠上抗体吸附而滞留在磁场中,无表面抗原Thy1的细胞由于不能与连接在磁珠上的特异性单抗结合而没有磁性,不在磁场中停留,从而使细胞得以分离。在进行免疫磁珠分离前,曲细精管单细胞悬液首先经30% percoll密度梯度离心,DMEM/F12培养液重悬,再利用免疫磁珠法进行分离(图1B)。根据细胞悬液的体积加入1/50体积的PE-抗-Thy1单抗,冰浴,每107细胞按照9∶1的比例加入抗PE磁珠,冰浴,加入10倍体积磁珠分选缓冲液洗涤两次,加入1 ml磁珠分选缓冲液,过柱,待阴性细胞通过分选柱后,从分选器内取出分选柱,置于15 ml离心管上,滴加5 ml缓冲液于柱上,利用活塞冲洗出阳性细胞,离心,弃上清,精原干细胞培养液重悬备用。
1.5 小鼠SSCs体外长期培养和生长曲线测定
将新鲜纯化的mSSCs以5×105cells/ml的浓度接种到以丝裂霉素处理的STO(SIM mouse embryo-derived thioguanine and ouabain resistant)细胞为滋养层的12孔细胞培养板中。分别在无血清成分明确的精原干细胞培养液中加入生长因子GDNF、GFRa1和 bFGF,使其终浓度为20 ng/ml,150 ng/ml和10 ng/ml,置于37℃, 5% CO2的培养箱中,每隔一天换一次培养液。在原代培养后的6~9 d进行传代培养,以后每隔6~9 d依SSCs和滋养层的生长状况进行一次传代培养并计数。两种方法纯化得到的mSSCs均可在体外连续培养超3个月,传代15代以上。
1.6 小鼠SSCs细胞的鉴定
取出体外连续培养超3个月的mSSCs,DPBS冲洗,加入4%多聚甲醛溶液固定。用含10%正常山羊血清的封闭液室温封闭,封闭后直接加入一抗4℃共孵育,过夜。DPBS冲洗,在完全避光的条件下加入二抗室温孵育30 min。DPBS冲洗,加入Hochest 33342室温孵育8 min。DPBS冲洗,倒置荧光显微镜下观察并拍照。本研究使用的一抗有兔抗鼠CDH1 IgG一抗和山羊抗鼠GFRα1 IgG一抗,mSSCs为阳性细胞与二抗偶联后会呈现出绿色和红色荧光标记,而STO滋养层细胞则不会被标记。
2 结果
2.1 差异贴壁法和免疫磁珠法分离纯化mSSCs的结果
经两种方法分离纯化后的mSSCs均可在以STO细胞为滋养层、添加生长因子而无血清的培养体系中连续培养超6个月,传代超30代。原代培养的mSSCs生长缓慢,大约经过3次1∶1~1∶1.5传代培养后细胞逐渐进入稳定状态,开始增殖(图2)。原代培养48 h后mSSCs开始贴附于滋养层细胞上(图2 A, B)。5 d时经差异贴壁法纯化得到的mSSCs开始形成集落(图2C),经免疫磁珠法纯化得到的的mSSCs也开始增殖,但没有观察到明显的细胞集落(图2D)。传代培养三次以后经两种方法纯化得到的的mSSCs逐渐进入稳定状态,以后视滋养层和mSSCs的生长状况每隔6~9 d以1∶2~1∶3的比例进行传代培养,1个月后可看到典型的葡萄串状克隆,并可在体外连续传代培养超过3个月(图2E, F)。
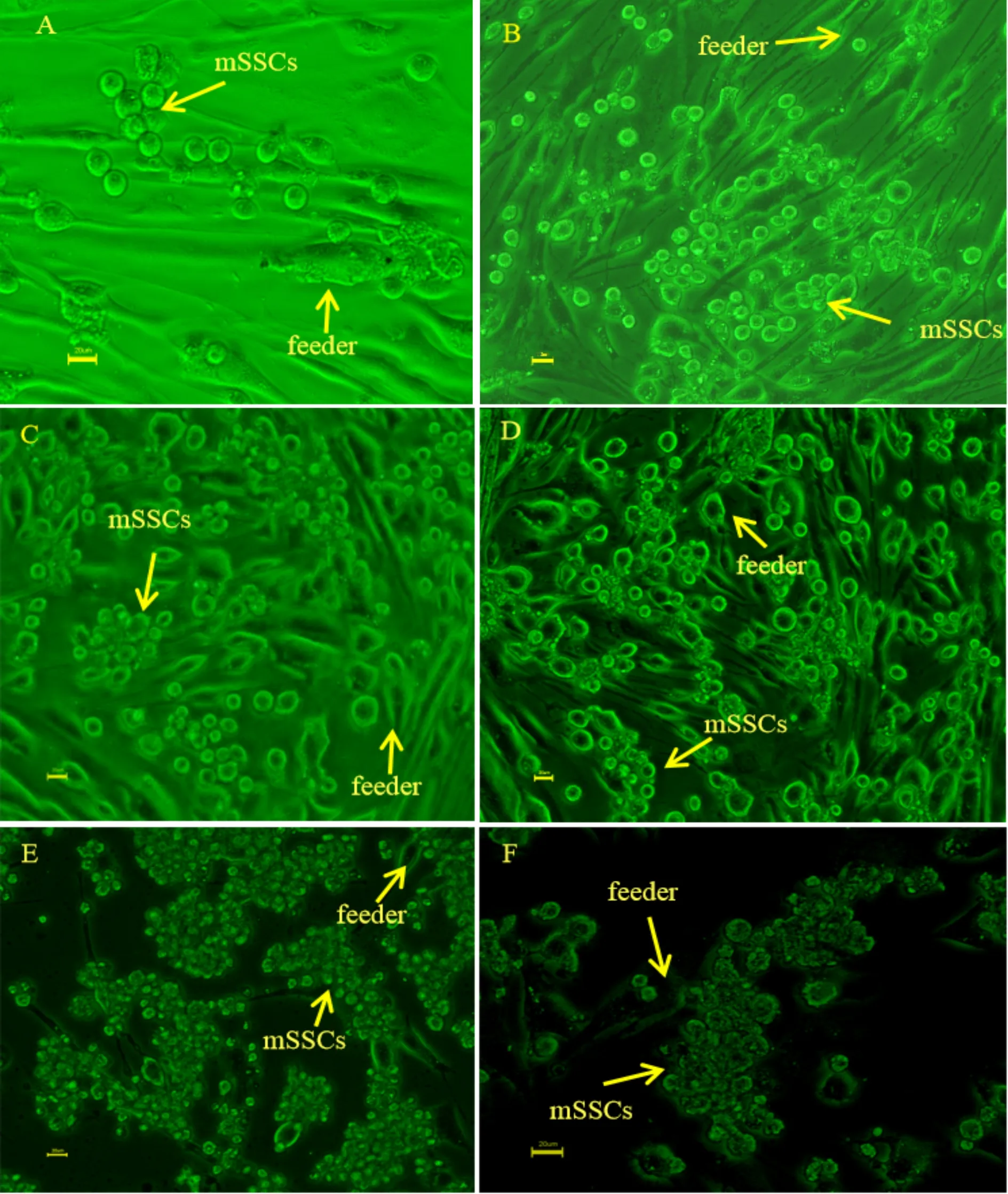
Fig. 2 In vitro proliferation and morphological observation of mouse spermatogonial stem cells (mSSCs). mSSCs purified by differential attachment method were cultured in vitro for 48 h (A), 5 d (C) and more than 3 m (E), and mSSCs purified by immunomagnetic bead method were cultured in vitro for 48 h (B), 5 d (D) and more than 3 m (F). The arrows show mSSCs or feeder cells (Feeder). The scale bar is 20 μm
2.2 差异贴壁和免疫磁珠分离方法的比较
2.2.1 细胞数量的比较 利用两步酶消化法,10只小鼠的睾丸经处理后可得到2.0×107± 0.1×107个细胞的曲细精管单细胞悬液(n=5)。12~15 d 龄的小鼠曲细精管单细胞悬液中主要含有未分化的精原细胞、各级分化的生精细胞和支持细胞及少量的管周细胞等体细胞。差异贴壁法分离后,经过65 h的培养,绝大多数体细胞已完成贴壁。收集未贴壁的生殖细胞,接种到鼠尾胶原包被的培养皿,经过4 h的培养后,绝大多数的已分化细胞完成贴壁。收集未贴壁细胞,接种到Laminin包被的培养皿中,40 min后,绝大多数的未分化精原细胞完成贴壁, 弃上清,收集贴壁细胞,计数。经纯化后10只小鼠的睾丸可以得到3.0×105± 0.4×105个mSSCs(n=5),细胞回收率(纯化后细胞数曲细精管单细胞悬液细胞数)约为1.5%。曲细精管单细胞悬液经30% Percoll密度梯度离心后,重悬细胞,经过免疫磁珠分选柱后,利用活塞冲洗出阳性细胞,离心,重悬,计数。经纯化后10只小鼠的睾丸可以得到6.0×105± 0.4×105个mSSCs(n=5),细胞回收率约为3%,约为差异贴壁法的二倍。
2.2.2 二种分离方法对细胞增殖生长影响的比较 经差异贴壁法纯化得到的mSSCs,原代培养的前3代细胞生长较缓慢,均以1∶1~1∶1.5的比例进行传代培养,3~4次传代培养之后细胞逐渐进入稳定状态,开始增殖。经免疫磁珠法纯化得到的细胞前几代较差异贴壁法得到的mSSCs生长更缓慢,但经过4~5次传代培养后细胞逐渐稳定,开始增殖。两种纯化方法对mSSCs体外长期增殖生长的影响,经卡方检验无显著统计学差异(P>0.05,图3)。
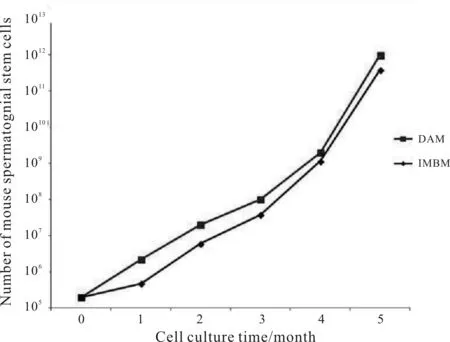
Fig. 3 In vitro proliferation curves of mouse spermatogonial stem cells (mSSCs). The mSSCs obtained by differential attachment method (DAM) and immuno magnetic bead method (IMBM) were all cultured from a concentration of 1 × 105 cells/ml. There was no significant difference in the proliferation and growth of SSCs between the two purification methods (P>0.05)
2.3 小鼠精原干细胞的鉴定
经两种方法纯化后的mSSCs在体外培养过程中形成典型的葡萄串状克隆(图4 Visible),经免疫荧光染色鉴定均可表达CDH1和GFRα1(图4),而滋养层细胞则不被染色。这两个基因均为公认的mSSCs的特异性表面标记基因[2],免疫荧光细胞染色法分析结果证实本实验得到的为可在体外长期稳定培养的mSSCs。
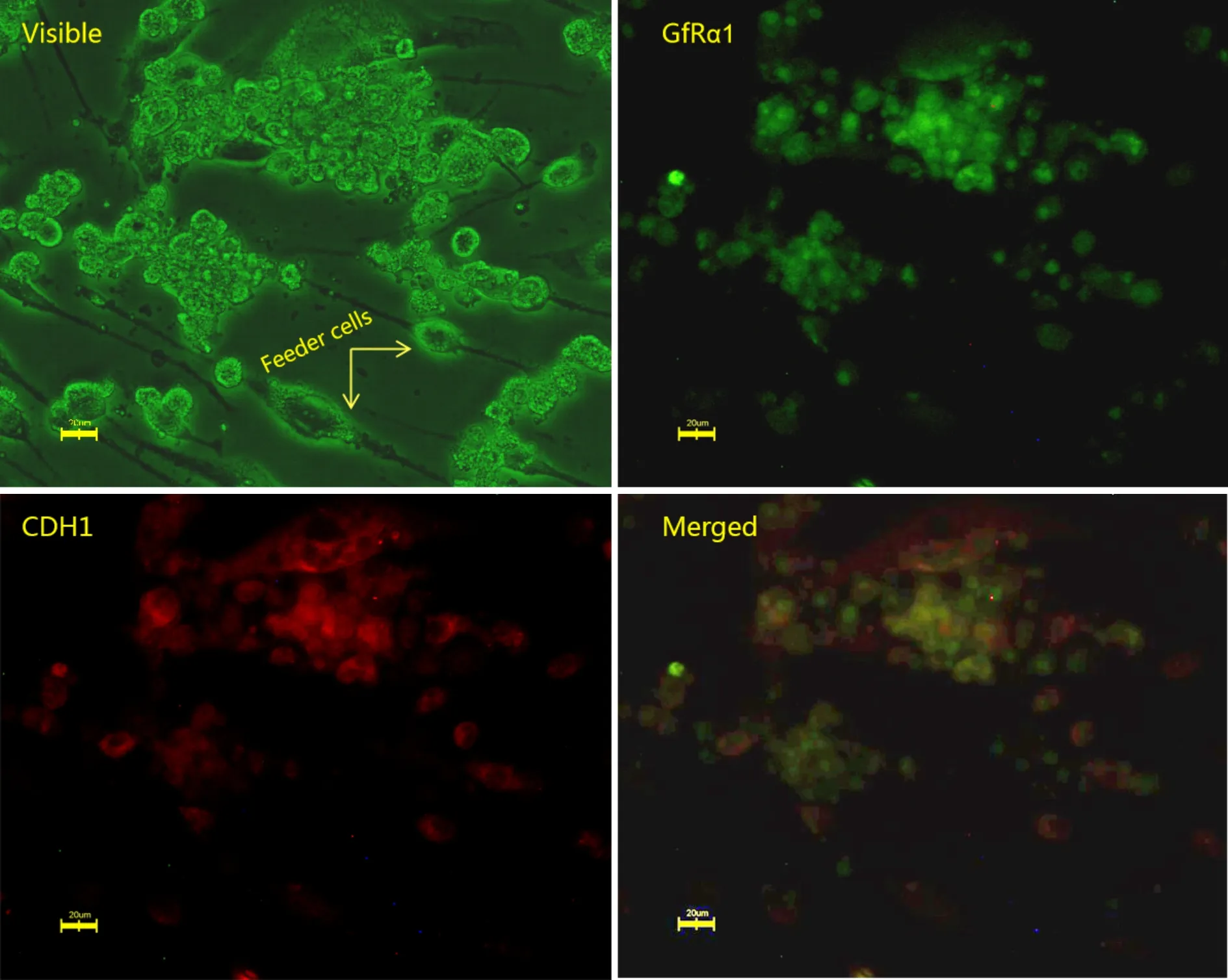
Fig. 4 Double immunofluorescence staining analysis of mousespermatogonial stem cells (mSSCs ) cultured in vitro. Mouse SSCs can form cell clones (Visible), and single adherent cells are STO feeder cells (arrows). The cell clone was recognized by both anti-GFRα1 (GFRα1) and anti-CDH1 (CDH1) antibodies. Microscopic examination showed fluorescence, while feeder cells were negative. The scale bar is 20 μm
3 讨论
开始于雄性哺乳动物青春期的精子发生是体内一个高效、有序、精准的过程,它起始于SSC,经过增殖分化,精母细胞减数分裂和精子形成3个阶段发育为成熟精子,因此深入研究SSC对进一步明确精子发生机制、对阐述男性不育病因进而解决男性不育难题具有深远意义[16]。此外,SSC还可以在不添加任何外源基因和病毒的情况下转变为多能干细胞,为再生医学与细胞治疗增添新来源[5,6]。最近,研究者对未成年双侧隐睾患者的睾丸组织切片进行体外增殖并异体移植取得成功,这为SSC在男性先天和获得性不育症的治疗提供理论依据[7]。获得高纯度、高活力的SSCs是在体外对SSCs进行研究的关键,已报道的mSSCs的纯化方法有基于细胞形态的筛选法、差异贴壁法、流式细胞分选法、免疫磁珠分离法等,这些方法在纯化效率、经济成本等方面各有优劣[17]。本研究对比两种使用率和纯化效率都高的mSSCs纯化方法——差异贴壁法和免疫磁珠法,并且经这两种方法得到的SSCs均可在体外长期培养。
差异贴壁法是利用曲细精管单细胞悬液中多种细胞在细胞比重和贴壁能力等方面的差异进行分离纯化。首先在明胶处理的培养皿中,支持细胞和睾丸间质细胞等体细胞的贴壁速度远远超过生殖细胞,过夜培养后,体细胞大多完成贴壁,而生殖细胞尚未贴壁或贴壁不牢,轻轻吹打即脱落[13]。收集未贴壁的生殖细胞接种到鼠尾胶原包被的培养皿中,经4 h培养后,分化的生精细胞优先粘附于鼠尾胶原,而未分化的精原细胞尚未贴壁。收集未贴壁细胞接种到Laminin包被的十二孔板中,Laminin是曲细精管基底膜细胞外基质主要成分之一,所以SSCs优先粘附于Laminin表面[18,19],弃上清,收集贴壁细胞即为mSSCs,每只12~15 d龄的小鼠约可以得到6×104数量级的未分化精原细胞。
免疫磁珠法是利用磁珠上的抗体与细胞上的相应抗原发生特异性结合后形成细胞-抗原-抗体-磁珠免疫复合物,在磁场作用下,使复合物与未结合物质分离,达到纯化具有特异性抗原的细胞的目的[10]。因此,高特异性表面抗原是能否高效纯化SSCs的关键一步。本研究采用的是THY1+抗体偶联的免疫磁珠进行分选,该抗体已被多篇文章证实可以得到较纯的SSCs细胞群[20,21]。经免疫磁珠技术进行纯化的SSCs数量较差异贴壁法多,大约为差异贴壁法的二倍,每只12~15 d龄的小鼠约可以得到105数量级的未分化精原细胞,并且用时短,可在一天之内完成纯化。
在本研究中,利用两种方法均可以得到高纯的mSSCs,并可用于后续研究使用,但两种方法各有优缺点。差异贴壁法纯化得到的细胞数量相对较低(回收率约为1.5%),但纯度更高,可在培养5 d左右即得到干细胞克隆。纯化方法简单、经济,无需购买专门的设备,实用性强,但是细胞数量相对较低,并且用时较长,前后需要3 d的时间。免疫磁珠法纯化得到的细胞数量更大(回收率约为3%),但是纯度相对较低,体外培养约10 d才开始看到明显的细胞集落,并且免疫磁珠法主要依赖连接有特异性抗体的磁珠。免疫磁珠法用时较差异贴壁法短,可在1 d内完成实验,但是操作步骤相对复杂,而且需要购买专门的设备,每次纯化都需要购买含有特异表面标记的磁珠,价格也较昂贵。综上所述,具体采用哪种方法纯化SSCs主要取决于材料和用途,如果取材比较珍贵而样本量又较小时,例如病理过程中采集的人睾丸组织,建议采用灵敏度和回收率都较高的免疫磁珠分离法;如果纯化的是珍惜物种的睾丸组织,没有特异的表面抗原磁珠,则可以选择差异贴壁法。
