钙敏感受体通过JNK途径参与内毒素心肌损伤*
2021-12-10宋佳玉姜春明
宋佳玉, 郭 敬, 姜春明,3△
(1. 哈尔滨医科大学附属第一医院新生儿科, 黑龙江 哈尔滨 150001; 2. 阜新市第二人民医院新生儿科, 辽宁 阜新 123000;3. 珠海市妇幼保健院新生儿科, 广东 珠海 519060)
内毒素是革兰氏阴性菌细胞壁的一种成分,新生儿免疫力低,内毒素血症仍然是新生儿期危重症及造成死亡的重要原因。既往研究提出内毒素可能通过以下几个方面引起心肌损伤:Toll样受体的异常表达、体内一氧化氮含量增加、促炎细胞因子的过度释放、氧化应激反应异常激活、细胞内能量代谢异常、腺苷受体活性降低、心肌细胞凋亡等[1]。我们研究发现,CaSR的激活可促进内毒素所诱导的心肌损伤,这与内质网的应激和自噬途径的上调有关[2],然而相关的信号转导途径尚不清楚。因此,本实验通过建立内毒素新生大鼠心肌损伤模型,观察CaSR及JNK在内毒素所致的心肌损伤中的表达变化,揭示其在内毒素所诱导的心肌损伤中的作用及可能的信号转导途径。
1 材料与方法
1.1 材料与仪器
健康2-3日龄SPF级Wistar新生大鼠48只,雌雄不限,由吉林省长春市亿斯实验动物技术有限责任公司提供;内毒素(LPS)(L-2880)购自sigma公司;SC-211006和SC-207394购自santa cruz biotechnology,lnc;SP600125购自碧云天生物技术研究所;CaSR兔多抗(alomone labs,ACR-004);JNK兔多抗(CST,9258);GAPDH 鼠单抗(天德悦,TDY042);光学显微镜(日本 OLYMPUS);ABI 7500型荧光定量PCR仪(Applied Biosystems)。
1.2 内毒素新生大鼠模型的建立及分组
Wistar大鼠随机分成6组,每组8只:(1)对照(Control)组:腹腔注射与用药组等体积的生理盐水;(2)内毒素(LPS)组:将LPS用1 ml 0.9%NaCl溶解后,按照5 mg/kg腹腔注射入体内;(3)LPS+CaSR激动剂(SC-211006 )组:腹腔注射LPS 1 h后,再注射SC-211006(0.02 ml/g);(4)LPS+CaSR抑制剂(SC-207394)组:腹腔注射LPS 1 h后,再注射SC-207394(0.02 ml/g);(5)LPS+JNK抑制剂(SP600125)组:腹腔注射LPS 1 h后,再注射SP600125(30 mg/kg);(6)LPS+ SC-207394+ SP600125组:腹腔注射LPS 1 h后,注射SC-207394(0.02 ml/g),间隔1 h,再注射SP600125(30 mg/kg)。
1.3 标本的采集
1.3.1 血清标本:腹腔注射10%水合氯醛(3 ml/kg)将大鼠完全麻醉,直扎心脏取约1~2 ml的血液,离心后取出血清至EP管内,标记后,置于-20℃冻存。
1.3.2 心肌标本:取出心脏组织,用冰盐水冲洗,解剖出心室部分,将其分为两份。一份用10%甲醛溶液固定,标记后置于4℃存放,待用光镜观察;另一份置于冷冻管内,标记后在-80℃下冻存,用于Western blot实验。
1.4 观察指标
1.4.1 光镜下观察心肌形态:将甲醛溶液固定后的心室标本常规脱水,石蜡包埋,切成厚约4 μm的薄片,再经二甲苯脱蜡,苏木素和伊红染色,乙醇逐级脱水,二甲苯透明,中性树胶封片后,用光镜观察并摄片。
1.4.2 LDH含量测定:取眼球血约2 ml,3 000 r/min 4℃离心,取上层血清,按试剂盒说明操作,测定LDH含量。
1.4.3 Real Time PCR 检测IL-6的表达:用提取试剂盒从血清标本中提取总RNA后,取5 μl RNA进行1%琼脂糖凝胶电泳以检测RNA的完整性。用DNase Ⅰ试剂盒消化提取后的RNA, HiFi-MMLVcDNA第一链合成试剂盒将RNA反转录为cDNA。再以2 μl cDNA为模板在20 μl反应体系中依次加入2×UltraSYBR Mixture及靶基因IL-6的上下游引物,用荧光定量PCR仪器进行扩增,反应条件:预变性95℃10 min,(变性95℃15 s,退火/延伸60℃1 min)×45个循环。采用2-△△CT法进行数据的相对定量分析,同时以GAPDH作为内参照。
1.4.4 Western blot检测CaSR和JNK的蛋白表达情况:将心肌标本剪碎,加入含PMSF的RIPA裂解液,匀浆后冰上孵育20 min,4℃条件下,以13 000 r/min离心20 min,取上清液分装,用BCA法测定蛋白浓度。调整蛋白浓度后煮沸变性5 min,进行10%SDS-PAGE凝胶电泳,使目的蛋白分离,将分离的蛋白质转移至NC膜上,TBS洗膜。在室温下,把膜置于5%脱脂牛奶中封闭1 h,剪下所需的片段,将其置于一抗稀释液(CaSR兔多抗1∶1 000稀释液;JNK兔多抗1∶4 000稀释液)中,4℃过夜。孵育结束后,用TBST洗膜5次,再按抗体种属不同,将碱性磷酸酶标记的二抗稀释液放置在不同膜内,室温轻摇,TBST洗膜。把膜置于显色液中,曝光显影,再定影。同时用GAPDH鼠抗体作为内参照。
1.5 统计学处理
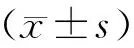
2 结果
2.1 心肌形态学变化
光镜下可见Control组心肌细胞正常,细胞核清晰可见;LPS组心肌细胞肿胀,空泡变性,个别细胞出现核固缩,细胞间质内可见炎性细胞浸润;LPS+SC-211006 组心肌细胞明显肿胀,空泡变性,可见少量凋亡细胞,部分细胞核固缩,间质内炎性细胞浸润;LPS+SC-207394组:心肌细胞肿胀,发生轻度空泡变性,部分细胞核固缩;LPS+SP600125组:部分心肌细胞肿胀,空泡变性较前减轻,部分细胞核固缩;LPS+SC-207394+ SP600125组:心肌细胞肿胀明显减轻,空泡变性也明显减少(图1)。

Fig. 1 HE staining in the myocardium of rats(×200)1: Control group; 2: LPS group; 3: LPS +SC-211006 group; 4: LPS+SC-207394 group; 5: LPS + SP600125 group; 6: LPS+SC-207394+SP600125 group
2.2 内毒素所致的LDH含量的变化
与对照组比较,LPS组LDH含量显著增加(P<0.05);给予SC-211006后LDH含量为(76.8± 6.4),高于LPS组(P<0.05);给予SC-207394和SP600125后LDH含量分别为53.5±3.2和50.6±5.5,均明显低于LPS组(P<0.05);LPS+SC-207394+ SP600125组LDH含量为41.4±2.9,进一步明显低于LPS组(P<0.05,表1)。
2.3 血清IL-6 Real Time PCR检测结果
与对照组比较,LPS组IL-6的 mRNA表达水平显著增加(P<0.05);与LPS组比较,给予SC-211006后IL-6的mRNA表达明显高于LPS组(P<0.05);给予SP600125后IL-6的mRNA表达值为(1.597±0.086),明显低于LPS组和SC-207394组(P<0.05);LPS+SC-207394+ SP600125组IL-6的mRNA表达值为(1.558±0.076),进一步明显低于LPS组(P<0.05,表1)。

Tab. 1 The changes of LDH content and levels of IL-6 n=8)
2.4 心肌组织中CaSR蛋白表达
与对照组相比,LPS组CaSR蛋白表达增加(P<0.05);给予SC-211006后,CaSR的蛋白表达水平高于LPS组(P<0.05);给予SC-207394和SP600125后,CaSR的蛋白表达量均低于LPS组(P<0.05);LPS+SC-207394+ SP600125组CaSR的蛋白表达量降到最低,明显低于LPS组(P<0.05,图2)。

Fig. 2 The expression of CaSR protein analyzed by Western blotA: control group; B: LPS group; C: LPS +SC-211006 group; D: LPS+SC-207394 group; E: LPS + SP600125 group; F: LPS+SC-207394+SP600125 group*P<0.05 vs control group; #P<0.05 vs LPS group
2.5 心肌组织中JNK蛋白表达
与对照组相比,LPS组JNK蛋白表达增加(P<0.05);给予SC-211006后,JNK的蛋白表达水平高于LPS组(P<0.05);给予SC-207394和SP600125后,JNK的蛋白表达量均低于LPS组(P<0.05);LPS+SC-207394+ SP600125组JNK的蛋白表达量降到最低,明显低于LPS组(P<0.05,图3)。

Fig. 3 The expression of JNK protein analyzed by Western blotA: control group; B: LPS group;C: LPS +SC-211006 group; D: LPS+SC-207394 group; E: LPS + SP600125 group; F: LPS+SC-207394+SP600125 group*P<0.05 vs control group; #P<0.05 vs LPS group
3 讨论
内毒素可通过刺激内源性介质的释放来参与新生儿败血症的发生与发展;也可对新生儿缺氧缺血性脑病引起的脑损伤起增敏作用[3],探讨内毒素血症的诊断和治疗一直是新生儿医学的研究重点。尽管抗生素的应用可以有效的控制革兰氏阴性菌的感染,但在杀死革兰氏阴性菌的同时也导致内毒素的大量释放,使血液中内毒素的水平进一步升高,进一步加重内毒素血症。其中内毒素诱导的心肌损伤是重要的死亡原因之一,也是感染或败血症休克难治的原因之一。然而内毒素是通过何种方式来诱导心肌损伤,机制尚未完全阐明。
自2003年Wang Rui等[4]首次在大鼠心肌中发现CaSR后,有关CaSR在心血管方面的研究取得了长足的进步。徐长庆等认为钙敏感受体的表达与缺血再灌注心肌细胞损伤的程度呈正相关,并先后证实了CaSR可能通过MAPK信号通路及Fas受体死亡通路导致心肌细胞凋亡[5]。白淑芝等研究发现糖尿病大鼠心肌中CaSR的表达降低,引发细胞内钙调节紊乱,从而导致心脏的收缩和舒张功能异常[6]。最新的研究发现CaSR可通过促进细胞凋亡来参与心肌梗死的发展[7]。虽然有关CaSR与心肌损伤方面的研究颇多,但CaSR在内毒素诱导的心肌损伤中的作用还知之甚少。
丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路是近年来的研究热点,目前将MAPK分为四个亚族:细胞外信号调节激酶(extracellular-signal regulated protein kinase,ERK1/2)、p38 MAPK、JNK、ERK5。其中ERK1/2和ERK5多表现为促进细胞增殖分化和发育的作用,而JNK及p38MAPK多表现为促进组织炎症和细胞凋亡的作用[8]。有研究表明,当CaSR被激活时,可使MAPK信号通路中的JNK/p38因子激活,调节MAPK级联,导致细胞损伤[9]。如在慢性癫痫过程中,CaSR表达增加通过激活ERK通路来保护心肌,同时通过激活JNK途径来促进心肌细胞凋亡[10]。
炎症是内毒素心肌损伤后一个重要的病理环节,IL-6是活性较强的炎症启动因子,可以参与机体的免疫反应过程,常作为早期诊断细菌感染和败血症的灵敏指标[11]。当内毒素血症发生时,LPS/LBP/CD14三元复合物可与心脏及血管细胞膜上的TLR4结合,将信号传递到胞内,进而激活MyD88 依赖的信号通路,随后通过激活MAPK通路等来启动LPS炎症信号通路,导致IL-6、TNF-α等多种炎症介质的释放[12]。2013年,Li等证实CaSR激动剂三氯化钆使细胞因子IL-6和TNF-β的表达增加。CaSR调节细胞因子分泌的过程涉及多种信号转导通路,其中,CaSR介导的MAPK信号通路对细胞因子的分泌起重要作用。
为研究在内毒素诱导的心肌损伤中,CaSR与JNK途径之间的关系,本实验通过建立内毒素新生大鼠心肌损伤模型,从形态学角度观察心肌细胞损伤的程度,通过测定血清中LDH的含量来评价内毒素对心肌细胞的毒性及心肌损伤的情况,并通过Real Time PCR测定IL-6的mRNA表达情况,以此来反应机体的炎症损伤程度。实验观察到,内毒素组及CaSR激动剂组心肌损伤严重,LDH含量及IL-6的表达增加,而CaSR抑制剂组和JNK抑制剂组心肌损伤减轻,LDH含量及IL-6的表达下降,JNK抑制剂组尤其明显。这说明内毒素可能引起心肌损伤,而CaSR抑制剂和JNK抑制剂可以减轻这种损伤。同时,实验观察到激活CaSR可使JNK的蛋白表达增加,心肌损伤加重;而抑制CaSR可使JNK的蛋白表达下降,心肌损伤减轻;当应用 JNK抑制剂时,CaSR表达下降,心肌损伤进一步减轻;而同时应用CaSR抑制剂和JNK抑制剂时,CaSR及JNK的表达量降至最低,心肌损伤明显减轻。这表明CaSR可能通过激活JNK途径来诱导内毒素心肌细胞的损伤。
既往有研究提出以CaSR作为治疗靶点,这在许多疾病中发挥了重要的作用[13],如CaSR激动剂西那卡塞可用于血液透析患者继发性甲状旁腺功能亢进的治疗[14],雷奈酸锶可促进成骨细胞增殖,治疗激素性骨质疏松[15]。而本实验研究表明CaSR可能通过JNK途径参与内毒素所致的心肌损伤,并且观察到,与抑制CaSR相比,抑制JNK对内毒素新生大鼠心肌的保护作用更加明显。因此JNK途径有望成为治疗内毒素引起的心肌损伤的重要靶点,既往已有研究表明,硫化氢及乌司他丁可以通过抑制JNK通路的活性来缓解心肌缺血再灌注损伤[16,17],黄芪多糖可以通过抑制JNK途径来减轻内毒素诱导的心肌细胞凋亡[18]。然而由于新生儿的心肌尚不成熟,与成人有很大不同,以JNK途径为靶点的药物尚未在新生儿中应用,与之相关的动物实验也十分罕见。在新生儿方面,选择抑制JNK途径的靶向药的假设是否可行,是否有其他途径参与内毒素心肌的损伤,这些途径又起到怎样的作用,本实验的相关结论在体内其他的组织器官中是否适用,这些都有待进一步研究。
总之,我们的研究结果表明CaSR可能通过激活JNK途径来参与内毒素所诱导的心肌损伤,具体机制仍需进一步探讨。
