养殖暗纹东方鲀中7 种醇提鲜味肽的鉴定及其呈鲜特性
2021-12-03宁梦华王文利陈高乐
宁梦华,王文利,陈高乐,刘 源
(上海交通大学农业与生物学院食品科学与工程系,上海 200240)
鲜味肽是一类分子质量小于3 000 Da的寡肽类,具有鲜味醇厚圆润、后味绵长的呈味特点[1]。鲜味肽主要来自于蛋白质合成和分解的中间产物,属于营养和风味物质[2]。近年来从食品中发掘天然的鲜味肽成为风味研究领域的热点[3],如从鸡肉(汤)[4]、牛肉(汤)[5]、河鲀[6]、文蛤[7]、鳕鱼[8]、火腿[9]、花生蛋白[10]、腐乳[11]、干酪[12]、豆豉[13]等物质中发掘了系列鲜味肽。截止2020年8月份,从不同食物中发掘鉴定的鲜味肽已有179 条。养殖暗纹东方鲀营养丰富,味道鲜美,前期课题组发现鲜味肽对河鲀鲜美圆滑、醇香浓郁的味感具有决定性贡献[14-18]。目前鲜味肽的发掘大多是水提取法,关于溶剂提取对鲜味肽的特性影响尚不明确。
近年来,鲜味分子的味觉机制以及鲜味受体对鲜味肽的识别机制备受关注。同源建模及分子对接应用于鲜味配体及受体之间结合位点的计算,可解释鲜味分子与受体之间的作用机制,如以代谢型谷氨酸受体(metabotropic glutamate receptor 1,mGluR1)的晶体结构构建了T1R1/T1R3模型,考察其与谷氨酸[19]以及鲜味肽[7-8,13]的关键结合位点和自由能。此外,谷氨酸与5’-鸟苷酸二钠(disodium 5’-guanylate,GMP)[20]和鲜味肽[21]的协同作用机制也基于分子动力学被阐释。Liu Hai等[22]以同源性更高的鱼味觉受体T1R1/T1R3建立了人的T1R1/T1R3受体结构模型,较为系统考察谷氨酸钠(monosodium glutamate,MSG)、琥珀酸二钠、GMP、肌苷酸二钠和牛肉辛肽(beefy meaty peptide,BMP)5 类鲜味分子,探究不同鲜味配体结合对受体T1R1/T1R3结构动力学的影响,发现了关键的结合位点以及对受体口袋的调整作用,进而从原子水平上部分揭示了其呈鲜机理。整体来看,分子模拟可作为有效可行的方法用于鲜味肽与T1R1/T1R3受体的作用研究。
本研究以乙醇溶液提取暗纹东方鲀肌肉中的鲜味肽,并采用分子模拟研究鲜味肽的呈鲜特性,在发掘新型鲜味肽的同时,拟进一步解释鲜味肽的构效关系,为后期进一步探究肽的呈鲜规律提供参考。
1 材料与方法
1.1 材料与试剂
30 尾2 龄养殖暗纹东方鲀购买于江苏中洋集团股份有限公司,参考SC/T 3033—2016《养殖暗纹东方鲜、冻品加工操作规范》,专业厨师对暗纹东方鲀进行剖杀、放血、去头、去皮、去内脏。经处理的河鲀鱼被冰鲜运至实验室后,从每条鱼取下两片完整背部肌肉,取肉分装于铝箔袋,抽真空后储存于-80 ℃冰箱备用。
二硫苏糖醇、碘乙酰胺、碳酸氢铵(均为色谱纯)美国Sigma公司;乙腈(色谱纯) 美国赛默飞世尔科技公司;甲酸(色谱纯) 上海安谱科技股份有限公司;其他所需试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
T25高速分散机 德国IKA公司;3K15高速冷冻离心机 德国Sigma公司;Alpha1-2 LDplus真空冻干机德国Chirist公司;NW10VF超纯水系统 中国香港力康发展有限公司;BT-100L实验用膜分离装置上海摩速科学器材有限公司;RH-digital磁力搅拌器德国IKA公司;ÄKTA pure蛋白纯化系统、SuperdexTM30 Increase 10/300 GL凝胶色谱柱 美国通用电气医疗公司;R-100旋转蒸发仪 步琦实验室设备贸易(上海)有限公司;C-Tongue电子舌系统 上海保圣实业发展有限公司;Easy nLC1200-Q Eaxtive plus纳升液相四极杆轨道阱质谱仪、离心浓缩仪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 60 %乙醇溶液提取暗纹东方鲀肌肉中鲜味肽
基于前期实验结果,参考Zhang Meixiu等[16]的方法略作调整,用60%乙醇溶液提取河鲀肌肉中的鲜味肽。-80 ℃的暗纹东方鲀肌肉置于4 ℃冰箱过夜解冻,去除肌肉上的肌膜,准确称取200 g,鱼肉绞碎后按照料液比为1∶4(g/mL)添加60%乙醇溶液进行匀浆(10 000 r/min,10 s×3),将匀浆液置于4 ℃条件下搅拌提取3 h。随后将匀浆液4 ℃、9 500×g离心20 min,取上清液在40 ℃旋转蒸发除去残留的乙醇,此提取过程进行3 次平行实验,合并3 次除醇上清液,即得到暗纹东方鲀肌肉乙醇溶液提取的鲜味肽组分。
1.3.2 鲜味肽组分的超滤分级
将1.3.1节中60%乙醇溶液提取物用0.22 µm滤膜过滤,随后用截留分子质量分别为3 000 Da超滤膜和300 Da纳滤膜进行膜过滤分级,最终得到3 个不同分子质量范围的组分,即U1(<300 Da),U2(300~3 000 Da)和U3(>3 000 Da),将此3 个分级组分进行真空冷冻干燥,收集各自冻干粉储存于-80 ℃备用。
1.3.3 鲜味肽组分的凝胶色谱分离
取1.3.2节中的U2冻干粉用超纯水配制成5 mg/mL溶液,经0.22 µm水相滤膜过滤后,随后在ÄKTA pure蛋白纯化系统上进行凝胶色谱分离纯化。具体色谱条件如下:色谱柱为SuperdexTM30 Increase 10/300 GL预装柱,上样体积为500 µL,流动相为超纯水,流速为0.5 mL/min,检测波长为214 nm。使用蛋白纯化仪馏分自动收集器收集不同峰组分,分别冻干后将其保存于-80 ℃冰箱中,留待后续实验使用。
1.3.4 纳升液相色谱-质谱鉴定鲜味肽的结构
鲜味肽的结构鉴定参考Bennike等[23]的方法略作调整。取1.3.3节凝胶色谱分离组分F2,加入100 μL溶液上样缓冲液(99.9% H2O、0.1%甲酸)溶解,取50 μL溶解好的样品用ZipTip脱盐处理并干燥,利用10 μL上样缓冲液溶解干燥的样品,将溶解样品加入样品瓶中待测。
液相色谱条件:分析柱为C18反相分析柱(50 mm×50 cm整体柱);流动相A为99.9%水和0.1%甲酸混合液,流动相B为80%乙腈和0.1%甲酸混合液。液相洗脱梯度为0~2 min,98%~95% A、2%~5% B;2~45 min,95%~78% A、5%~22% B;45~53 min,78%~65% A、22%~35% B;53~54 min,65%~0%A、35%~100% B;54~60 min,0% A、100% B;流动相流速为500 nL/min。
质谱条件:电喷雾电离正离子模式,采用数据依赖性扫描模式,在分辨率为70 000(自动增益控制3×106)的轨道阱中进行全扫描采集(m/z350~1 800)。将分离出的前20 个肽信号(电荷态≥+1)母离子通过高能碰撞破碎,标准化碰撞能为28.0 eV。毛细管温度为275 ℃,喷雾电压为1 800 V,子离子在分辨率为17 500(自动增益控制1×105)的轨道上测量。全扫描和串联质谱扫描的最大填充时间分别设置为50 ms和45 ms,动态排除时间设置为30 s。利用Peaks studio10.0软件搜索引擎及Protein Discoverer 2.4软件对样品中的多肽进行序列分析。
质谱鉴定得到鲜味肽的序列结构后,委托上海吉尔生化有限公司对其进行合成,采用固相合成法,并进行脱盐等处理得到纯度大于98%的多肽。
1.3.5 感官评定
1.3.5.1 感官员培训
感官评定小组成员由3 名男性和7 名女性组成(20~30 岁),每位感官员均无味觉障碍史且通过筛选及培训。感官员培训参考Liu Ziyuan等[6]的实验,对感官员进行5 种基本味道酸味、甜味、苦味、咸味和鲜味以及浓厚感的培训,与其相对应的标准溶液如下:5 mmol/L柠檬酸溶液、10 mmol/L蔗糖溶液、1 mmol/L奎宁溶液、12 mmol/L氯化钠溶液、10 mmol/L MSG溶液以及8 mmol/L谷胱甘肽溶液。感官实验在正常光照和室温((23±2)℃)进行,样品溶于超纯水中,以5 mL的量盛放于标有3 位随机数字编号的30 mL感官小杯中随机递给感官员,为避免感官疲劳效应和遗留效应,每品尝1 个样品后用清水充分漱口且休息2 min。
1.3.5.2 河鲀提取物原始及纯化组分的滋味轮廓
采用滋味描述及0~7 分鲜味评分法对样品进行感官评定,在滋味描述中,要求感官员对样品的滋味进行评价并对5 种基本味觉强度进行描述(0~7 分对应的强度描述词为极弱、微弱、较弱、中等、较强、很强和极强);在鲜味评分中,以超纯水、0.1 g/100 mL和0.2 g/100 mL的MSG溶液为参照液,其鲜味分值分别定义为0、4 分和7 分,根据其分值对应的鲜味强度进行评分。60%乙醇溶液提取冻干粉(60%-F)、超滤组分(U1、U2和U3)及凝胶色谱过滤组分(F1、F2和F3)分别溶于超纯水中配制成5 mg/mL溶液,并转移到30 mL的感官杯中,样品溶液温度保持在室温,以随机顺序呈递给感官员。感官员被要求啜饮样品,在口腔中仔细品尝后然后吐出。为避免感官疲劳和遗留效应,每品尝完一个样品休息2 min并用50~60 mL超纯水漱口,按上述方法对样品进行滋味描述及鲜味打分。
1.3.5.3 合成肽滋味描述及阈值测定
固相合成的多肽采用1.3.5.2节方法进行人工感官滋味描述,并参考Zhang Ziyuan等[16]的方法稍作修改,以4 mmol/L的MSG为标准溶液,利用电子舌味觉分析系统对7 条合成肽进行智能感官评价。另外参考Toelstede等[24]的方法,对合成肽进行了阈值的测定。合成肽重溶于超纯水中至质量浓度为1 mg/mL,pH值调整为6.5,感官小组对其滋味特性进行描述。随后根据三角实验准备1 个样品实验组和2 个空白对照组,按照1∶1逐步稀释,逐级稀释后的样品依次呈递给感官员品评。合成肽的呈味阈值为样品组恰好与2 个空白组(超纯水)区分的浓度,所有感官员的品评结果平均值记为最终结果。
1.3.6 鲜味肽与受体T1R1/T1R3的分子对接
使用Gauss View 5.0.9软件构建鲜味肽配体的结构,在Biological Fragment模块下按照鉴定的多肽氨基酸序列构建其三维模型,通过Clean工具及UFF方法对其进行初步结构计算,即得到鲜味肽的初始结构。随后基于DFT密度泛函法通过Gaussian 09软件进行进一步结构优化。优化后的鲜味肽配体结构与鲜味受体T1R1/T1R3进行对接实验,鲜味受体结构基于实验室前期Liu Hai等[22]构建所得,分子对接在软件AutoDock和AutoDock Vina软件上完成。人源T1R1是鲜味识别关键受体[25],参考Liu Hai等[22]的方法将对接盒子设在T1R1空腔区,大小为(30,30,30)。根据AutoDock Vina默认的打分函数挑选出亲和力最高(能量最小)的复合物结构,所得配体T1R1/T1R3复合物结构使用Pymol和VMD软件进行结构可视化查看及结构分析。
1.4 数据分析
采用SPSS 21.0统计分析软件对3 次重复实验的数据进行单因素方差分析,P<0.05,差异显著。
2 结果与分析
2.1 暗纹东方鲀肌肉鲜味肽的分离纯化
2.1.1 膜超滤法分离鲜味肽
3 个组分U1(<300 Da)、U2(300~3 000 Da)和U3(>3 000 Da)及粗组分(60%-F)感官评价结果如图1所示。U1(<300 Da)主要由一些无机盐和氨基酸类小分子物质组成[26],鲜味表现不明显。U2(300~3 000 Da)比其他两个组分的鲜味显著更强(P<0.05),且与60%-F具有相似的滋味轮廓,说明U2组分可代表河鲀提取物的滋味特征。前期研究表明鲜味肽的分子质量通常都低于3 000 Da[11,27-28]。故选取U2进行进一步的分离纯化,以期发掘其中的鲜味肽。
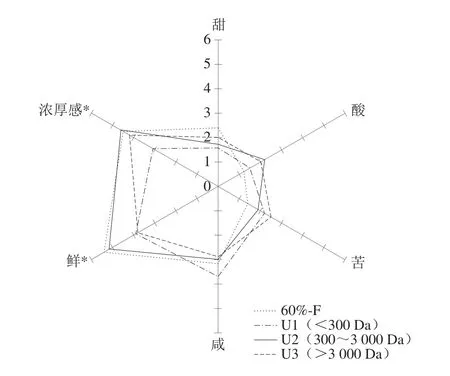
图1 河鲀肌肉提取物超滤组分的滋味轮廓Fig.1 Taste profile of ultrafiltration fractions of pufferfish muscle extracts
2.1.2 凝胶层析法分离鲜味肽
根据洗脱曲线(图2A)可知,凝胶色谱层析后主要得到5 个馏分,其中第1(F1)、第2(F2)和第3个馏分(F3)是U2的主要组成部分(93.3%),第4(F4)和第5个馏分(F5)占原始组分U2的比例较低(6.7%)。考虑到感官评价实验需要较多馏分样本,因此采用感官评定对F1、F2和F3进行分析(图2B)。结果表明,3 个馏分的鲜味、咸味和酸味存在显著差异,其中F2馏分的鲜味及酸味均强于F1和F3,同时F2的咸味也强于F3(P<0.05)。鲜味和咸味具有协同增强效应[29],这可能是F2具有较强鲜味的一个主要原因。
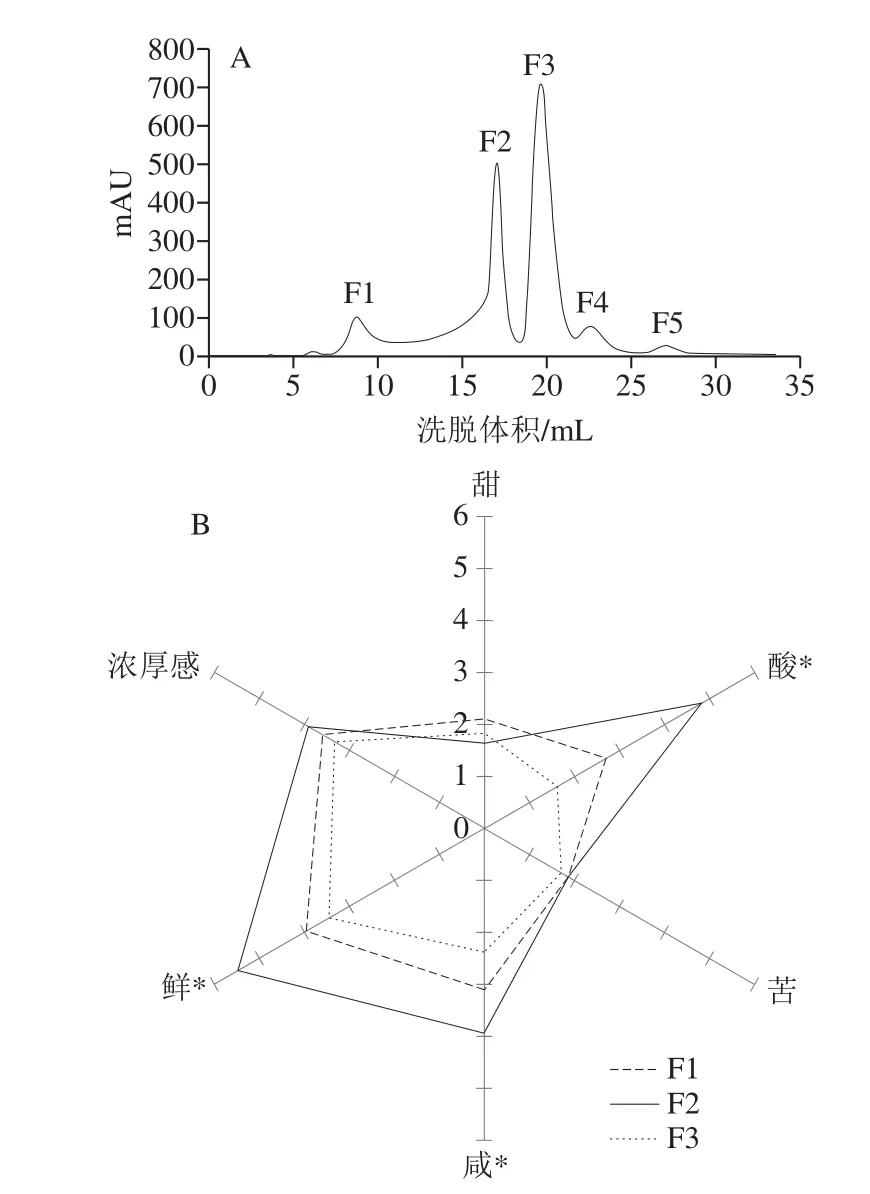
图2 300~3 000 Da超滤组分的凝胶色谱洗脱图(A)和凝胶色谱纯化组分滋味轮廓(B)Fig.2 Gel filtration chromatographic profile of ultrafiltration fractions with molecular mass of 300–3 000 Da (A), and taste profile of gel filtration chromatographic fractions of pufferfish extracts (B)
2.2 鲜味肽的结构鉴定
通过纳升液相色谱-质谱鉴定馏分F2中的肽段分子质量在1 000 Da左右,质谱鉴定得到7 种主要肽段,包括1 条七肽、3 条九肽和3 条十一肽,具体肽段相关信息见表1及图3。研究表明,肽的呈味特性与其氨基酸的组成密切相关,通常其感官特征与组成氨基酸的呈味特性呈正相关,鲜味肽的氨基酸组成往往表现为谷氨酸、天冬氨酸、天冬酰胺、谷氨酰胺之间相互结合或与苏氨酸、丝氨酸、丙氨酸、甘氨酸、甲硫氨酸和半胱氨酸相互结合形成多元酸钠盐[30]。由表1可以看出,这几条多肽均含有鲜味氨基酸天冬氨酸或谷氨酸,且甜味氨基酸苏氨酸、甘氨酸、丝氨酸和丙氨酸占比较高,可能与多肽的鲜味特性呈正相关。
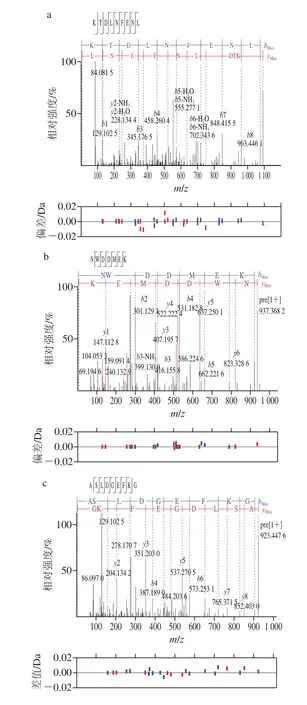
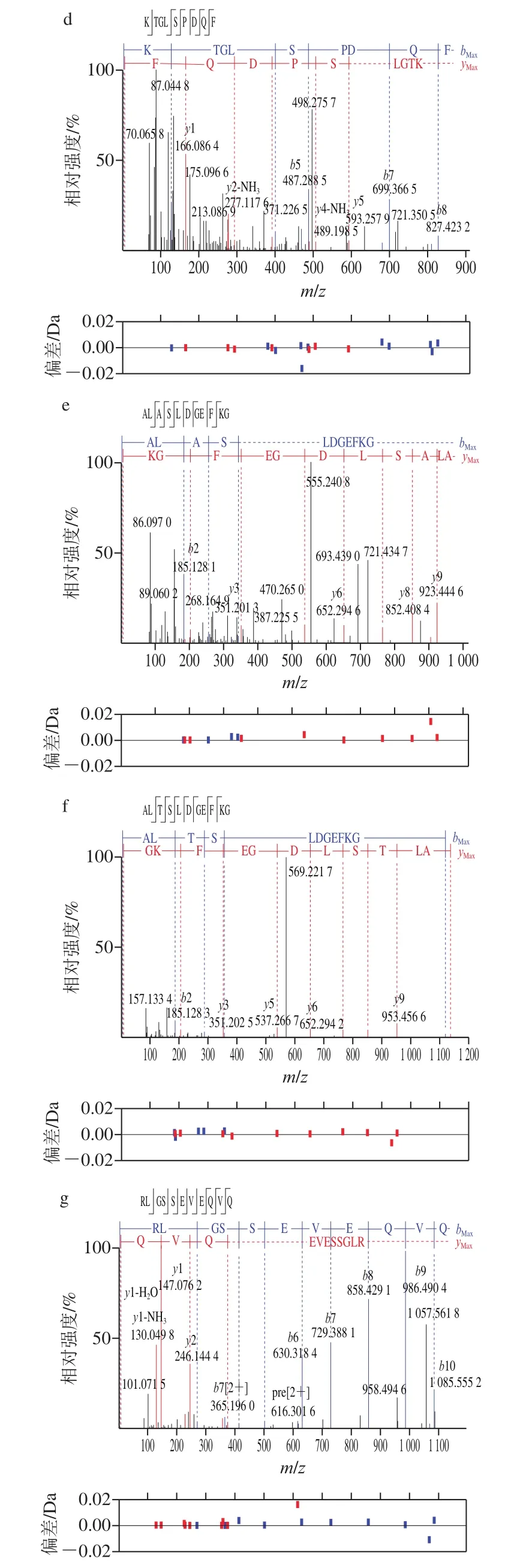
图3 凝胶色谱分离组分F2中肽段的二级质谱图Fig.3 Secondary mass spectra of peptides identified from gel filtration chromatographic fraction F2
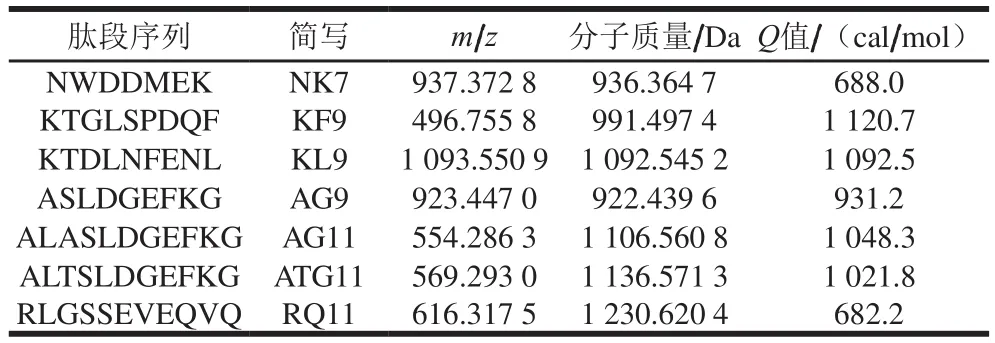
表1 凝胶分离鲜味组分中鉴定的特征肽段Table 1 Signature peptide sequences identified in fractions separated by gel filtration chromatography
组成氨基酸残基的疏水性影响肽的平均疏水性,Ney在1971年提出Q定则[31]至今仍被应用于评价多肽的苦味强度,即以Q值表示肽的平均疏水性,计算式为:Q=∑Δf/n(其中,Δf表示肽段中氨基酸残基侧链从乙醇转移至水的自由能变化,n为组成肽链的氨基酸残基数)。通常多肽Q值大于1 400 cal/mol时表现明显苦味,小于1 300 cal/mol时苦味不明显,Q值介于两者之间则不能判断苦味的程度。经计算这7 条肽的疏水性Q值范围为682.2~1 120.7 cal/mol,表明苦味均不是这7 条多肽的主要呈味特征。综合以上分析,这7 条多肽可能对养殖暗纹
东方鲀的鲜味具有积极影响,因此选取以上7 条肽段进行化学合成,通过人工感官以验证其滋味特性。
2.3 鲜味肽的滋味特性
7 条合成肽段进行感官滋味描述及鲜味阈值识别实验结果如表2所示。从滋味描述可以发现,7 条合成肽均呈现鲜味特性,其中NK7兼具鲜味和甜味;KF9具有微弱的鲜味、甜味和苦味;KL9具有鲜味和弱苦味;AG9、AG11和ATG11主要表现为鲜味、甜味和浓厚感;RQ11具有鲜味和微弱的苦味和酸味;这7 条多肽的鲜味阈值范围为0.38~1.04 mmol/L。7 条合成肽与标准品MSG的电子舌主成分分析(principal component analysis,PCA)结果如图4所示,可以看出二维PC的累计贡献率达到96.7%,说明该数据基本可代表原数据的全部信息。PC1在水平上贡献最大(91.823%),说明各样品在水平距离越远,则差异越大。图4中ATG11、AG11、NK7与MSG的水平距离最近,说明这3 条多肽滋味特性更接近于MSG的鲜味,与人工感官测得这3 条肽鲜味阈值(分别为0.44、0.45 mmol/L和0.38 mmol/L)较低的结论一致。而鲜味肽KF9、KL9及RQ11的鲜味阈值较大,分别为1.04、0.92 mmol/L和0.81 mmol/L,相应地它们与MSG距离也较远,AG9鲜味阈值(0.54 mmol/L)较低却远离MSG,可能由于其感官甜味属性协同增强其鲜味,导致人工感官的鲜味阈值偏低。从氨基酸组成来看,NK7呈现最低的鲜味阈值,可能与组成上有3 个鲜味氨基酸(两个天冬氨酸和一个谷氨酸)有关,而多肽KF9鲜味阈值最大(1.04 mmol/L)且带有苦味,可能与其末端疏水性氨基酸苯丙氨酸有关。Ishibashi等[32]研究结果也表明,苯丙氨酸和酪氨酸会增强多肽的苦味,尤其当其位于多肽的C末端。Shinoda等[33]通过对酪蛋白中的苦味肽序列的研究,发现多肽N末端碱性氨基酸的存在会促进苦味的感知,因此本研究中KF9和RQ11的苦味可能与N端赖氨酸和精氨酸有关。Liu Ziyuan等[6]对从红鳍东方鲀中分离鉴定的7 条鲜味肽序列进行分析,发现末端含有精氨酸的肽序列呈现苦味且阈值较高,本实验RQ11研究结果与其相似。AG9、AG11和ATG11三条多肽具有相似的呈味特性,可能与其相似的氨基酸组成有关,且都能被感知到甜味,与其组成中甜味氨基酸(苏氨酸、丙氨酸和甘氨酸)的含量高有关。

表2 合成肽水溶液滋味特性Table 2 Taste characteristics of synthetic peptides in aqueous solution

图4 7 条合成肽与MSG的二维PCA图Fig.4 Two-dimensional principal component analysis plot of seven synthetic peptides and MSG
2.4 鲜味肽与受体T1R1/T1R3的结合位点分析
基于Huang Yulin等[25]以受体T1R1为识别元件构建了纳米金传感器考察不同鲜味物质的结合常数,发现T1R1可作为鲜味识别的关键受体。因此,考察鲜味肽与受体T1R1的结合位点,7 条鲜味肽配体与鲜味受体T1R1/T1R3结合位点的关键氨基酸情况如表3所示。可以看出,7 条鲜味肽共与受体上23 个氨基酸残基通过氢键结合,其中有10 个氨基酸残基为4 个以上鲜味肽的共同结合位点,包括S48、G49、N69、D147、T149、N150、R151、S217、S276和R277;对鲜味肽上与受体结合的氨基酸进行分析,发现鲜味肽序列中的亲水性氨基酸残基天冬氨酸、谷氨酸和赖氨酸出现频次最高,分别为12、18 次和14 次,是被鲜味受体识别的关键位点。为更直观地展现鲜味肽与T1R1/T1R3的结合情况,以与受体结合位点氨基酸较多的鲜味肽AG11为例,分析鲜味肽与受体的结合模式,AG11-T1R1/T1R3对接复合物如图5所示。

表3 鲜味肽与鲜味受体T1R1/T1R3分子对活性位点中关键氨基酸残基Table 3 Key amino acid residues around the active sites in umami peptides and T1R1/T1R3
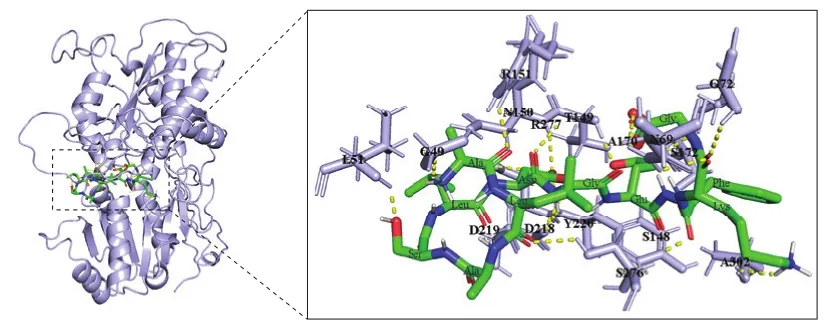
图5 鲜味肽AG11(主体为绿色的棒状结构)与受体T1R1/T1R3(紫色飘带结构)的对接复合物Fig.5 AG11 (rod-like structure, denoted in green)-T1R1/T1R3(streamer-like structure, denoted in purple) docking complex
从图5可以看出,鲜味肽配体AG11通过氢键结合在受体T1R1的空腔内,配体上负电基团D6和E8通过氢键与受体上N150、A170、T149、S172等氨基酸残基直接相互作用,配体的A1、L2、K10与受体上R151、G49、R277、N69、A302等氨基酸残基相互结合,从而形成了一个稳定的复合结构。
Liu Hai等[22]以MSG和BMP为配体与T1R1/T1R3的结合,发现T1R1受体上的N69、S276、R151、R277、A302、A170、D147、T149、S172、Y220、S385等氨基酸残基是MSG和BMP与鲜味受体结合的关键氨基酸残基。本研究中鉴定的7 条鲜味肽也大多包含与BMP及MSG相似的结合位点(表3),除以上氨基酸残基外,S48、S217、N150和G49等氨基酸残基也存在多条鲜味肽与受体结合位点中,因此这些位点也可能对肽类鲜味感知具有重要作用。这些与文献[7-8,13]鲜味肽与受体T1R1/T1R3对接结果中发现的关键位点(D196、E128、E429、N302、G304、H364等)不同,这可能由于在实验过程中采用mGluR1的晶体结构作为模板构建了T1R1/T1R3模型和使用了Discovery Studio 4.0软件中的CDOCKER模块进行的对接。
3 结 论
在本研究中,以60%乙醇溶液为提取溶剂,结合超滤纳滤、凝胶色谱纯化及纳升液相色谱-质谱从养殖暗纹东方鲀肌肉中分离鉴定出7 条鲜味肽NWDDMEK、KTGLSPDQF、KTDLNFENL、ASLDGEFKG、ALASLDGEFKG、ALTSLDGEFKG和RLGSSEVEQVQ,鲜味阈值范围为0.38~1.04 mmol/L。鲜味肽上的氨基酸残基天冬氨酸、谷氨酸及赖氨酸等与受体上的N69、S276、R151、R277、A302、T149和N150等氨基酸基团对鲜味的呈现具有重要作用。本研究为进一步发现鲜味肽的呈鲜规律,阐明鲜味肽构效关系提供一定的参考依据。
