禾谷炭疽菌中候选G蛋白偶联受体蛋白理化性质及遗传关系分析
2021-12-02喻红稠韩长志
喻红稠,韩长志,2*
(1.西南林业大学生物多样性保护学院,昆明 650224;2.云南省森林灾害预警与控制重点实验室,昆明 650224)
禾谷炭疽菌Colletotrichumgraminicola(Cesati)Wilson作为一种半活体营养型真菌[1-3],该生活方式为其侵染玉米、小麦、高粱等诸多禾本科作物提供了重要的基础[4-5],由该菌引起的炭疽病,在中国、美国等国家发生非常普遍,严重制约着农林业经济的发展,给农林业生产造成巨大的损失[6]。据估计,该菌每年导致玉米产量降低高达40%,相当于美国一年损失10亿美元[2]。随着基因组学和分子生物学的快速发展[7],该菌全基因组序列的公布,极大地促进了中外对禾谷炭疽菌的研究,前人研究主要集中在其侵染过程、细胞信号转导、致病基因、生物学特性分析等方面[6,8]。
G蛋白偶联受体(G protein-coupled receptors,GPCR)是数量最多的一大类具有典型的七跨膜结构域蛋白受体[9],具有7个显著的疏水性跨膜结构[10],存在于大多数真核生物中[11],对细胞的信号转导途径具有重要作用,即主要将胞外跨膜信号传递到胞内区域[11-13],调节细胞的一系列生理生化活动。目前,学术界关于禾谷炭疽菌中GPCR的研究较少,本研究小组已报道了关于该菌的4个GPCR[5]、14-3-3蛋白[14]、分泌蛋白[15]、磷酸二酯酶[8]、G蛋白信号途径相关蛋白[16]等,其他研究者也报道了禾谷炭疽菌的CgRab5A的亚细胞定位[2]、Rab蛋白家族[17]、氨基酸通透酶GAP3基因的功能[18]等研究。另外,对酿酒酵母、构巢曲霉[19]、稻瘟菌[20]、大豆疫霉等GPCR也有研究,如大豆疫霉GPCR候选编码基因的生物信息学预测与转录分析,在大豆疫霉、橡树疫霉和致病疫霉中分别已挖掘出大量的GPCR候选编码基因[21],为明确GPCR在一些生理生化过程中的功能解析奠定基础。然而,关于禾谷炭疽菌候选GPCR的生物信息分析尚未见报道,严重制约植物病原丝状真菌中GPCR相关蛋白的功能研究。前期,基于GPCR所具有的典型七跨膜结构域特性,通过TMHMM、Philius和TOPCONS三种常用软件对禾谷炭疽菌中全基因组蛋白序列进行在线分析,明确该菌中具有七跨膜结构域特征的蛋白数量有243个,进一步结合保守结构域、预测功能分析等,最终明确该菌中含有220个候选GPCR蛋白。
基于前期所获得的禾谷炭疽菌中220个候选GPCR蛋白序列,现利用SignalP、ProtParam、ProtScale以及MEGA等程序对其信号肽、理化性质、疏水性以及遗传关系等进行分析,以期为后期分析候选GPCR蛋白在该菌中的功能研究提供重要的理论指导。
1 材料与方法
1.1 材料
禾谷炭疽菌中220个候选GPCR蛋白序列。
1.2 方法
1.2.3 候选GPCR蛋白生物信息学分析
(1)信号肽预测。利用SignalP 5.1(http://www.cbs.dtu.dk/services/SignalP/)[22]在线进行信号肽的分析。
(2)理化性质分析。利用ProtParam (https://web.expasy.org/protpara m/)程序在线进行理化性质分析,包括理论等电点、不稳定系数和总平均亲水性等[23]。
(3)疏水性分析。利用ProtScale(https://web.expasy.org/protscale/)程序在线分析蛋白质的疏水性[23]。
(4)遗传关系分析。利用MEGA_X_10.1.8软件进行多重比对分析和构建系统进化树[5,17]。
(5)相互作用关系分析。利用STRING v.11在线数据库开展相互作用预测,寻找蛋白-蛋白相互作用关系[24]。
2 结果与分析
2.1 信号肽预测
通过对禾谷炭疽菌中220个候选GPCR蛋白(涉及含有7个跨膜结构域但不含有信号肽序列或者含有信号肽序列的具有8个跨膜结构域的蛋白)中信号肽进行预测,结果表明,仅有7个候选GPCR蛋白含有信号肽,ID号分别为XP_008088898.1、XP_008091374.1、XP_008095233.1、XP_008095290.1、XP_008097275.1、XP_008098329.1、XP_008099709.1,所占比例为3.18%。其中,ID号为XP_008088898.1具有七跨膜结构蛋白(TOPCONS和Philius分析),XP_008091374.1、XP_008095233.1、XP_008099709.1等蛋白具有八跨膜结构蛋白(TOPCONS分析),XP_008095290.1、XP_008097275.1、XP_008098329.1是具有八跨膜结构蛋白(TMHMM分析)。进一步对7个候选GPCR信号肽长度进行分析,明确信号肽长度集中在19~22个氨基酸,其中信号肽长度最多的为19个氨基酸,蛋白数量为3个,所占比例为42.86%;其次是长度为22个氨基酸,蛋白数量为2个,所占比例为28.57%;长度为23个氨基酸、28个氨基酸,蛋白数量均为1个,所占比例均为14.29%。
2.2 理论等电点分析
对候选GPCR蛋白的理论等电点进行分析,结果表明,XP_008092362.1具有最高理论等电点,为10.28;XP_008099443.1具有最低理论等电点,为4.97,进一步以理论等电点1.00为1个间隔单位,对全部候选GPCR蛋白进行分类汇总,结果表明,上述候选GPCR蛋白质理论等电点主要集中于9.01~10.00,其数量为78个,所占比例为35.45%;其次集中在8.01~9.00的候选GPCR蛋白有67个,所占比例为30.45%。理论等电点为4.01~5.00、5.01~6.00、6.01~7.00、7.01~8.00、10.01~11.00,候选GPCR蛋白数量分别为2、20、30、18、5个,所占比例分别为0.91%、9.09%、13.64%、8.18%、2.27%(图1)。同时,对属于酸性蛋白质(理论等电点小于6.01)的候选蛋白质进行分析,其数量为22个,所占比例为10.00%;对属于中性蛋白(理论等电点位于6.01~8.00)的分泌蛋白进行分析,其数量为48个,所占比例为21.82%;对属于碱性蛋白质(理论等电点大于8.00)的候选蛋白质进行分析,其数量为150个,所占比例为68.18%。上述结果表明,候选蛋白质中酸性蛋白质、中性蛋白质、碱性蛋白质数量分布不均匀。对含有信号肽的7个候选GPCR理论等电点进行分析,得出理论等电点<6.01蛋白数量为1个(属酸性蛋白),理论等电点在6.01~8.00蛋白数量为3个(属中性蛋白),理论等电点>8.00蛋白数量为3个,7个候选GPCR多属于中性或碱性蛋白。
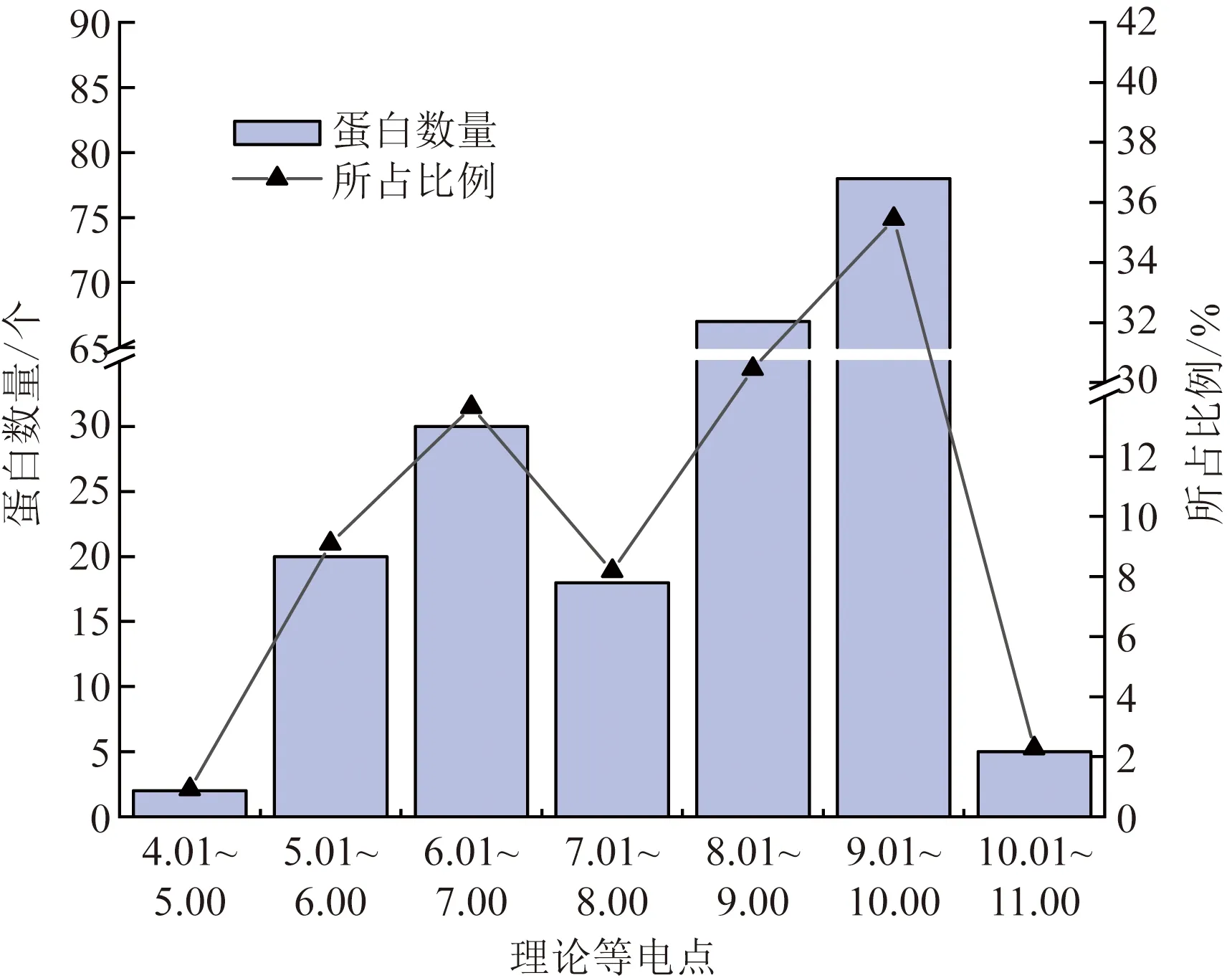
图1 禾谷炭疽菌中候选GPCR蛋白理论等电点的分布情况Fig.1 Distribution of theoretical isoelectric point of candidate GPCR protein in C.graminicola
2.3 不稳定系数分析
通过对禾谷炭疽菌中候选GPCR蛋白中的不稳定性系数分析,结果表明,XP_008097524.1的不稳定系数值最大,其不稳定性系数为62.26;XP_008098852.1的不稳定系数值最小,其不稳定性系数为21.11。不稳定性系数主要集中在40.01~50.00,其蛋白质有97个,所占比例为44.09%。次要集中在30.01~40.00,蛋白数量为84个,所占比例为38.18%。其余不稳定系数在<30.00、50.01~60.00、>60.00的蛋白数量分别为12、26、1个,所占比例分别为5.45%、11.82%、0.45%(图2)。同时,不稳定性系数小于40.01(稳定蛋白质)的GPCR有96个,所占比例为43.64%;不稳定性系数大于或等于40.00(不稳定蛋白质)的GPCR有124个,所占比例为56.36%。上述结果表明,候选GPCR蛋白在稳定性和不稳定性方面所占比例相当,推测其具有不同的功能特征。

图2 禾谷炭疽菌中候选GPCR蛋白不稳定性分布情况Fig.2 Distribution of candidate GPCR protein instability in C.graminicola
2.4 疏水性特征分析
对上述220个候选GPCR进行疏水性分析,结果表明,亲水性蛋白质(亲水性值小于0),蛋白数量为45个,所占比例为20.91%;疏水性蛋白(亲水性值大于0),蛋白数量为174个,所占比例为79.09%。进一步对上述蛋白亲水性最强氨基酸残基、疏水性最强氨基酸残基种类进行统计分析,明确亲水性最强的有18种氨基酸残基,存在较多的是R(精氨酸)、E(谷氨酸)、K(赖氨酸)3种氨基酸残基,蛋白数量分别为50、38、32个,所占比例分别为20.66%、15.70%、13.22%(图3);疏水性最强的有13种氨基酸残基,存在较多的是L(亮氨酸)、V(缬氨酸)、I(异亮氨酸)、A(丙氨酸)4种氨基酸残基,蛋白数量分别为52、50、37、32个,所占比例分别为22.32%、21.46%、15.88%、13.73%(图4)。

图3 禾谷炭疽菌中候选GPCR蛋白亲水性和疏水性氨基酸残基分布情况Fig.3 Distribution of hydrophilic and hydrophobic amino acid residues of candidate GPCR proteins in C.graminicola
对具有信号肽的7个候选GPCR进行亲水性分析,均属于疏水性蛋白,亲水性最强氨基酸为S(丝氨酸)、T(苏氨酸)、P(脯氨酸)、Y(酪氨酸)、K、E、R共7种氨基酸,存在较多的是S,疏水性最强氨基酸C(半胱氨酸)、F(苯丙氨酸)、V、T、G(甘氨酸)、I、S共7种氨基酸,其数量均衡。
2.5 遗传关系分析
对220个候选GPCR蛋白质序列进行同源序列分析并进行遗传关系解析,结果表明,禾谷炭疽菌中候选GPCR明显分为三大类(图4中的A、B、C,ID号为红色的蛋白是7个具有信号肽的候选GPCR),其中最多的是假定蛋白(hypothetical protein)。为了进一步明确上述蛋白中的保守结构域与遗传关系之间的关系,从上述三大类候选GPCR蛋白中各选择5个蛋白进行保守结构域分析,结果显示,均无明显的保守结构域,仅含有数量不等的跨膜结构域(图5)。

图4 禾谷炭疽菌中候选GPCR蛋白的遗传关系Fig.4 Genetic relationship of candidate GPCR proteins in C.graminicola

图5 禾谷炭疽菌中部分候选GPCR蛋白的保守结构域情况Fig.5 Conserved domains of candidate GPCR proteins in C.graminicolas
2.6 相互作用关系分析
前人研究发展,蛋白质主要通过自身或是与其他蛋白质等形成复合体来执行生物学功能。通过STRING在线分析蛋白——蛋白互作关系,明确不同蛋白之间存在着较为紧密的关系(图6),进一步选择具有核心相互作用关系的GLRG_05787、GLRG_04512、GLRG_04171、GLRG_10567、GLRG_02030、GLRG_00022、GLRG_07391、GLRG_05683、GLRG_18008、GLRG_18009、GLRG_03657、GLRG_05394、GLRG_05322、GLRG_01849、GLRG_03748、GLRG_00376、GLRG_08672、GLRG_02620、GLRG_05948、GLRG_08500、GLRG_04939、GLRG_09992、GLRG_03678、GLRG_06302、GLRG_04841、GLRG_11173、GLRG_03011、GLRG_02235、GLRG_04562以及GLRG_05637、GLRG_06940等蛋白进行分析,结果显示,上述蛋白存在着较为紧密的相互作用关系(图7),该研究结果为进一步解析禾谷炭疽菌中候选GPCR蛋白的互作用关系提供重要的理论参考。

图6 候选GPCR蛋白互作关系Fig.6 Candidate GPCR protein interaction

图7 禾谷炭疽菌中候选GPCR蛋白互作关系分析Fig.7 Analysis of interaction between candidate GPCR proteins in C.graminicola
3 结论与讨论
GPCR作为仅具有七跨膜螺旋结构域的蛋白,对细胞信号转导具有重要作用,其会影响着真菌一系列的生理生化作用。前人对于GPCR蛋白的预测分析,仅能依靠跨膜结构域、同源比对等开展相关工作,同时,对于蛋白理化性质、信号肽等研究也开展了诸多生物信息学分析软件的开发利用等。本研究基于前期所获得禾谷炭疽菌中候选GPCR蛋白序列,利用较为成熟的生物信息学分析软件开展了上述蛋白的信号肽、理化性质、疏水性以及保守结构域等方面的研究工作,有效地实现了该菌中候选GPCR蛋白性质明确,为进一步开展该菌中GPCR蛋白找寻及功能分析提供了重要的理论支撑。
与前期所开展的蛋白生物信息学分析相比,研究较好地实现了GPCR蛋白的信号肽、理化性质、疏水性和遗传关系等特性分析,与前期利用酿酒酵母中GPCR蛋白序列为基础根据同源序列比对情况所获得候选GPCR相比,以及对其特性研究相比,研究较好地实现了全部候选GPCR蛋白的诸多特性研究,有效地解决了禾谷炭疽菌中候选GPCR蛋白的性质不明等问题,为深入开展其他植物病原真菌中候选GPCR蛋白特性解析提供了重要的理论指导。同时,近期研究发现秀丽线虫中有部分GPCR蛋白可以通过控制UPR和p38MAPK信号通路来控制免疫稳态[25],而研究中所发现的候选GPCR蛋白并未与上述蛋白信号通路发生明显关系,有待于进一步开展互作蛋白找寻及功能分析提供重要的理论支撑。在酵母中有3个GPCR蛋白,其中2个可作为激酶,1个可作为感应器[26],而对于禾谷炭疽菌中候选GPCR蛋白功能的解析,特别是蛋白互作通路方面的解析将是未来研究的重点。前人明确禾谷镰刀菌中85个候选GPCR蛋白与其生长及产孢等生物过程调控密切相关,推测不同蛋白具有功能的冗余性[9],而本研究中禾谷炭疽菌中220个候选GPCR蛋白在理化性质方面存在着诸多相似性特征,推测其也具有功能冗余性。
基于前期所获得的220个候选GPCR蛋白,对其进行生物信息分析,明确7个具有七跨膜结构域含有信号肽的候选GPCR蛋白,多属于中性或碱性蛋白,不稳定性分布相对均匀且全是疏水性蛋白,同时,明确了上述候选GPCR蛋白之间存在着较为相近的亲缘关系。为进一步实现禾谷炭疽菌中候选GPCR蛋白的功能研究提供重要的理论依据,也为实现同属于炭疽菌属中核桃炭疽病菌中GPCR蛋白功能解析提供重要的理论指导。
