白斑狗鱼Dmrta1基因克隆及其表达分析
2021-11-23赵瑞阳张俊杰古丽帕日艾克拜
李 菁,赵瑞阳,唐 露,张俊杰,古丽帕日·艾克拜
( 新疆农业大学 动物科学学院,新疆 乌鲁木齐 830052 )
果蝇Dsx基因和线虫Mab-3基因相关转录因子A1(Dmrta1)基因是Dmrt家族的亚族Dmrta中的一员。Dmrt是目前关注度较高的性别相关基因家族之一,该家族成员广泛参与到动物的性别决定与两性分化中。Dmrt家族基因是目前已知保守的性别分化相关基因,最初是在果蝇的性别调控基因Doublesex中发现了DM结构域[1]。在鱼类、鸟类、哺乳类、爬行类均发现其存在,表明该基因在动物的进化过程中具有高度的保守性[2-5]。
目前,在动物中已克隆出Dmrt家族成员基因约有10个[6]。Dmrta基因家族成员包括Dmrta1(Dmrt4), Dmrta2 (Dmrt5), Dmrta3(Dmrt3)[7]。在小家鼠(Musmusculus)中,Dmrt4基因在性腺、肝脏、肾等组织中均有表达[8]。Dmrt4基因在半滑舌鳎(Cynoglossussemilaevis)精巢中的表达量显著高于卵巢[9]。江东能等[10]研究表明,Dmrt4基因在金钱鱼(Scatophagusargus)精巢和卵巢及鳃中均有较高表达。鉴于Dmrta1基因广泛参与了鱼类的性别形成与分化,有必要研究其参与调控的分子机制。在脊椎动物的进化过程中,鱼类作为低等动物有着举足轻重的进化地位。对Dmrta1基因的研究有助于了解从低等的无脊椎动物到高等生物进化过程的性别决定机制。
白斑狗鱼(Esoxlucius),属鲑形目、狗鱼属,分布于世界各大水域[11]。在我国主要分布于新疆额尔齐斯河流域[12]。白斑狗鱼作为自然水域中的主要捕食者,摄食范围广,能适应温度范围变化大的生活环境,生长迅速,营养价值高,是新疆地区额尔齐斯河流域重要的水产品之一。近年来对白斑狗鱼的研究主要是对其生长性能、胚胎发育及外源性激素诱导性别发育等[13-15]。目前白斑狗鱼的性别分化机制尚未阐明,关于Dmrta1基因在其性腺发育过程中的研究未见报道。笔者通过RT-PCR方法克隆得到白斑狗鱼的Dmrta1基因,通过实时荧光定量PCR方法对白斑狗鱼Dmrta1基因在生长发育不同阶段的组织中表达情况进行分析,从而探讨其在性别形成与分化中的作用,为白斑狗鱼性别决定机制提供基础资料。
1 材料与方法
1.1 试验材料
试验用鱼为本实验室人工繁殖的白斑狗鱼仔鱼,繁殖所用亲鱼购于乌鲁木齐北园春市场的乌伦古湖野生白斑狗鱼,饲养于新疆农业大学水产实验室,取180日龄和320日龄的白斑狗鱼,雌雄各3尾,共12尾。将鱼体解剖,分别取出脑、肌肉、肾脏、性腺、头肾、鳃、肠等组织,将其迅速置于液氮里,于超低温冰箱中-80 ℃保存。
1.2 试验试剂
反转录试剂盒PrimeScritTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(宝生物工程大连有限公司)、Trizol试剂(Invitrogen公司)、荧光定量PCR检测试剂盒(TIANGEN生化科技有限公司)、PCR试剂盒TaKaRa TaqTM(宝生物工程大连有限公司)。
1.3 方法
1.3.1 引物设计
根据美国国立生物技术信息中心GenBank数据库中已有的白斑狗鱼转录组测序结果序列(NC_047592.1),根据已报道鲑科鱼类的Dmrta1保守区域设计引物Dmrta1-F-Primer及Dmrta1-R-Primer,用于白斑狗鱼Dmrta1基因扩增。根据克隆得到的Dmrta1基因序列设计荧光定量PCR特异性引物Dmrta1-GSP-F和Dmrta1-GSP-R;采用实验室之前设计的白斑狗鱼的肌动蛋白(β-actin)基因引物Actin1F和Actin1R,上述引物均采用Primer 5.0设计,由生工生物工程(上海)股份有限公司合成。

表1 白斑狗鱼Dmrta1基因克隆及荧光定量PCR引物
1.3.2 总RNA的提取和cDNA的制备
将180日龄、320日龄两个时期的性腺(精巢、卵巢)、脑、肌肉、肾脏、头肾、鳃、肠道、肝脏等8种不同的组织分别在加入液氮的研钵中充分研磨,用Trizol法对RNA进行提取,全程在冰上操作,用DEPC处理过的双蒸水溶解上述得到的白色沉淀,将RNA放置于冰箱-80 ℃保存。用紫外光分光光度计检测RNA的光密度值;用琼脂糖凝胶电泳检测各组织的总RNA的完整性。以500 ng的RNA为初始模板进行反转录,反转录步骤按照TaKaRa试剂盒说明书进行,cDNA于冰箱-20 ℃保存,用于后续荧光定量PCR使用。
1.3.3 Dmrta1基因的克隆
以白斑狗鱼精巢的cDNA为起始模板,加入2.5 mmol/L dNTP Mixture,4 μL;10×PCR buffer,5 μL;Dmrta1-F/R-Primer各2 μL;TaKaRa TaqTM(5 U/μL),0.5 μL;cDNA,3 μL;双蒸水补齐至50 μL。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,循环35次;最后72 ℃延伸10 min,4 ℃终止程序。PCR反应结束后,在1%的琼脂糖凝胶电泳中以D2000 DNA Marker作为分子质量标准进行检测,并置于紫外凝胶成像系统中观察电泳结果,产物回收送生工生物工程(上海)股份有限公司测序。
1.3.4 Dmrta1基因的生物信息学分析
采用DNAMAN软件将测序所得cDNA序列进行拼接,运用BLAST查询该物种在数据库中同其他物种的Dmrta1基因序列同源性相似程度;使用生物信息学网络平台上的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)工具分析白斑狗鱼Dmrta1基因序列的开放阅读框,进一步推导出该基因的氨基酸序列;使用CD Search程序搜索该基因的蛋白功能结构域;采用SMART分析蛋白质保守结构域;运用ExPASy和Swiss-model分析Dmrta1蛋白质理化性质及预测蛋白质三级结构;采用DNAMAN软件进行氨基酸序列多重对比;最后使用Clustal X和MEGA 5.1软件基于邻接法对其构建系统发育树。
1.3.5 白斑狗鱼Dmrta1基因的表达分析
采用相对定量的方法对白斑狗鱼Dmrta1基因在2个时期不同组织的表达量进行测定。以各个组织的总RNA反转录产物为起始模板,选择内参β-actin基因、目标基因Dmrta1,分别对所选不同组织进行实时荧光定量PCR,每个样品重复测定3次。实验室采用BIO-RAD CFX 96定量PCR仪,SYBR Green I荧光染料。以20 μL为反应体系,其中2×SuperReal PreMix Plus(TianGen)10 μL,正反向引物各0.6 μL,cDNA模板为1 μL,最后补齐无RNA酶单蒸水7.8 μL。反应程序:95 ℃ 5 min;95 ℃ 30 s,59 ℃ 30 s,39个循环;95 ℃ 30 s。根据Dmrta1基因和β-actin基因,在各组织中扩增得到的Ct值,通过2-ΔCt法计算白斑狗鱼各组织中Dmrta1基因的相对表达量。统计数据表示为平均值±标准误差。采用SPSS 21.0进行单因素方差分析,并使用LSD方法进行多重比较。
2 结 果
2.1 白斑狗鱼Dmrta1基因的克隆和序列分析
将cDNA模板与特异性引物进行PCR扩增,最终产物采用琼脂糖凝胶电泳检测(图1),分子大小约1500 bp,长度符合目的基因序列。对测序片段进行拼接,获得Dmrta1基因的cDNA序列,长度为1408 bp。通过与美国国立生物技术信息中心上已知的白斑狗鱼转录组测序基因序列比对,相似性达99.7%。运用美国国立生物技术信息中心上ORF Finder对白斑狗鱼Dmrta1基因的开放阅读框进行查询,得出1条序列长度为1302 bp的开放阅读框,编码433个氨基酸(图2)。对开放阅读框进行生物信息学分析,得到Dmrta1蛋白的分子质量为36.047 ku,理论等电点为5.94。运用SMART对该基因的结构功能域进行分析发现,Dmrta1基因具有2个保守结构域,分别为DM和DMA结构域。说明该基因符合Dmrt基因家族成员特征,在进化过程中具有高度的保守性。该DM结构域共编码47个氨基酸,将推导出的氨基酸序列与其他物种的DM结构域进行对比,发现其与6种哺乳动物的DM结构域完全一致(图3),而与其他3种动物仅有1个位点不同。运用Swiss-model预测白斑狗鱼与黑猩猩(Pantroglodytes,XP_528576.1)Dmrta1基因的DM结构域氨基酸的三维结构模型图(图4),对比发现,这1个氨基酸位点的差异并未影响DM结构域的改变,表明Dmrta1基因的DM结构域在不同物种的进化上具有高度的保守性。

图1 白斑狗鱼Dmrta1基因PCR扩增结果Fig.1 The PCR amplification result of Dmrta1 gene in northern pike E. lucius1.白斑狗鱼扩增结果; M.DNA marker.1.the amplification result of E. lucius; M.DNA marker.

图2 白斑狗鱼Dmtra1基因的cDNA序列和推测的氨基酸序列Fig.2 cDNA sequence and the deduced amino acid sequence of Dmtra1 gene in northern pike E. luciusATG为翻译起始子,*为翻译结束终止子.ATG indicates translation initiation codon ,* indicates translation termination codon.

图3 Dmrta1基因DM结构域的序列多重比对Fig.3 Multiple sequence alignment of DM domain of Dmrta1 gene
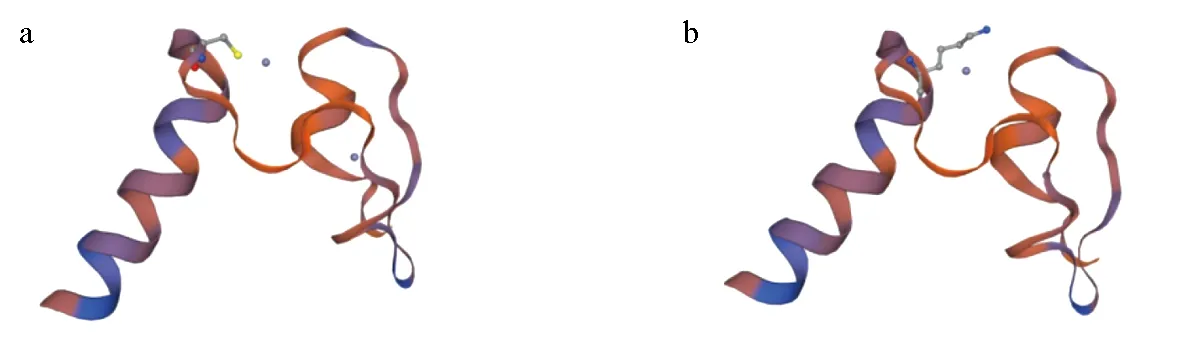
图4 白斑狗鱼(a)和黑猩猩(b)Dmrta1基因的DM结构域氨基酸序列模拟三维结构Fig.4 Three dimensional structure comparison of DM domain in Dmrta1 gene from northern pike E. lucius (a) and chimpanzee P. troglodytes (b)
2.2 Dmrta1基因同源比较和进化分析
通过BLAST对白斑狗鱼的Dmrta1蛋白进行氨基酸同源性分析发现,该氨基酸序列与美国国立生物技术信息中心上已公布的其他物种的Dmrta1氨基酸序列具有较高的相似性,结果显示,氨基酸序列与银大麻哈鱼(XP_020326315.1)同源性为80.32%;与红大麻哈鱼(XP_029510939.1)同源性为80.09%;与虹鳟(XP_021433981.1)、大西洋鲑(Salmosalar,XP_014061928.1)的同源性分别为79.41%,79.64%,与黄金鲈(Percaflavescens,XP_028419844.1)同源性为63.95%。通过MEGA 5.1 软件用邻接建树法对16个物种的Dmrta1氨基酸构建系统进化树(图5),发现白斑狗鱼与虹鳟、红大麻哈鱼的亲缘关系最近,属于同一分支。将该基因编码的氨基酸序列与其他9个物种的氨基酸序列进行比对(图6),根据比对结果推测其保守特征序列。

图6 白斑狗鱼与其他物种Dmrta1基因的氨基酸序列比对分析Fig.6 Multiple sequence alignment analysis of amino acid sequences of Dmrta1 gene in northern pike E. lucius and other species为Dmrta1保守序列位置.Black box is the conserved sequence position of Dmrta1.
2.3 Dmrta1基因的定量表达分析及其在不同时期的表达差异
通过检测2对引物的扩增效率基本一致,运用2-ΔCt法计算Dmrta1基因的相对表达量。实时荧光定量PCR结果显示,白斑狗鱼Dmrta1基因在不同日龄期的不同组织中的表达具有差异,Dmrtal基因只在白斑狗鱼的鳃、性腺、肌肉中表达,在肠道和肝脏、脑、肾脏、头肾中各龄期几乎不表达(图7~8)。
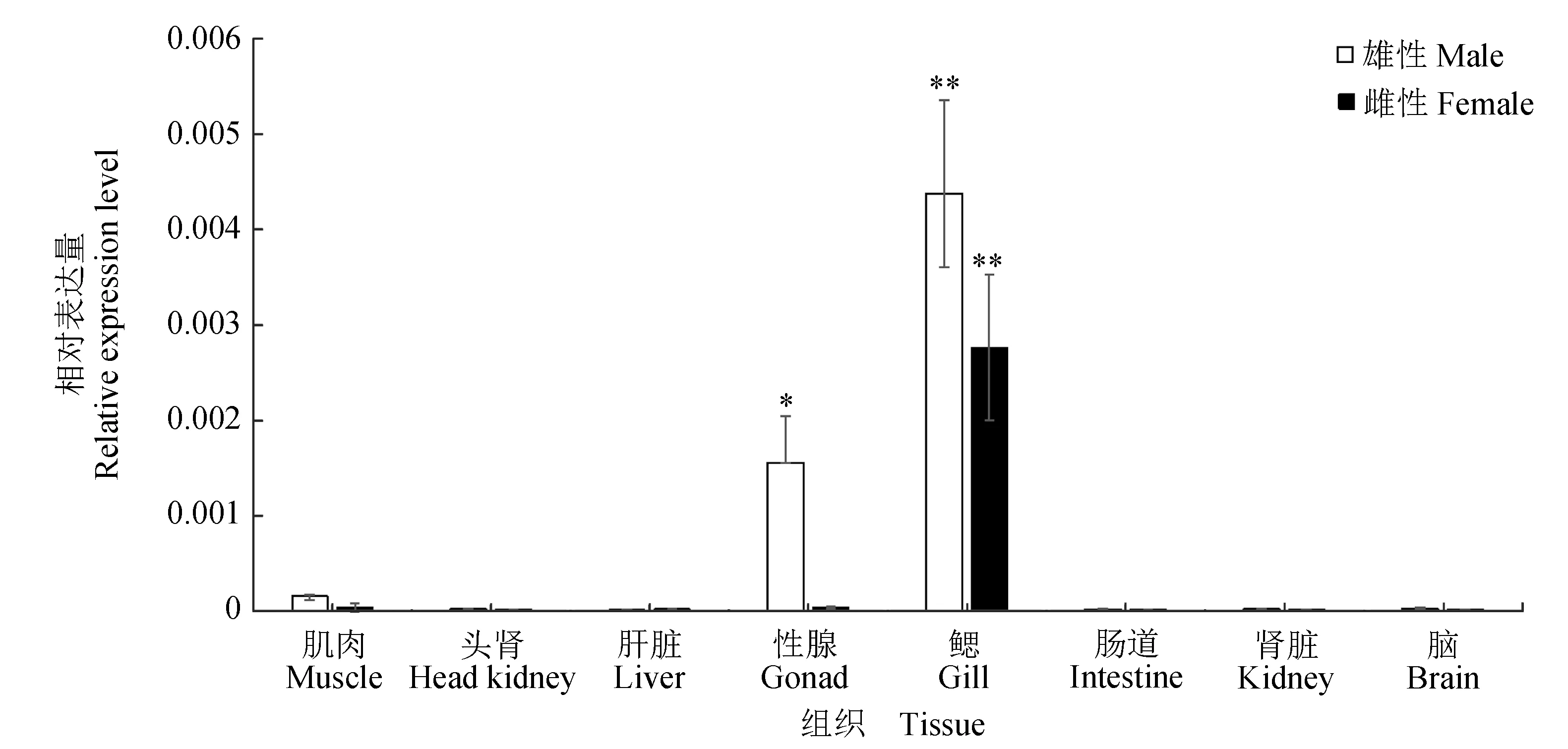
图7 实时荧光定量PCR检测的Dmrta1基因在白斑狗鱼180日龄期不同组织的相对表达量Fig.7 Relative expression levels of Dmrta1 gene detected in different tissues in 180 days old northern pike E. lucius by real-time PCR *为差异显著(P<0.05); **为差异极显著(P<0.01);下同.* indicates significant difference at P<0.05 level; ** indicates very significant difference at P<0.01 level; et sequentia.

图8 实时荧光定量PCR检测的Dmrta1基因在白斑狗鱼320日龄期不同组织的相对表达量Fig.8 Relative expression levels of Dmrta1 gene detected in different tissues in 320 days old nothern pike E. lucius by real-time PCR
180日龄期,Dmrta1基因在精巢、鳃中有较高表达(图7)。精巢的表达量显著高于肌肉(P<0.05),其他组织之间表达量不存在显著性差异(P>0.05)。在180日龄的雌鱼卵巢几乎不表达;对比同一时期的雌雄性腺表达量可知,Dmrta1基因在精巢中的表达量显著高于卵巢(P<0.05)。
在320日龄期,Dmrta1基因在精巢中的表达依然显著高于卵巢(P<0.05)(图8),并且在320日龄期卵巢中开始出现微量的表达。对比两个时期精巢的表达量可知,在320日龄期精巢的表达量是180日龄期的2倍,Dmrta1基因在精巢中的表达呈明显增长趋势。
3 讨 论
3.1 白斑狗鱼Dmrta1基因结构预测及进化位的关系
Dmrta1基因是Dmrt基因家族中的一员,Dmrt家族成员共同特征是都含有一个锌指DM结构域[3],作为性别决定机制中的转录调节因子可以与特异的DNA序列结合。通过蛋白质结构预测,本试验中的Dmrta1基因同样存在着一个锌指结构的保守结构域,推测其可以与DNA进行特异结合,从而在性别的分化及发育过程中起到调节作用。在本试验中,白斑狗鱼Dmrta1基因与其他6种哺乳动物的DM结构域一致,说明在进化过程中该结构域高度保守。在人类中,Dmrt基因位于人常染色体区域的9P24.3[4],它的表达模式与性别决定基因SRY相似,参与了雄性的性别决定过程,仅在雄性性腺中表达。而鱼类的原始生殖腺具有双向发展潜力,分为雌雄异体型和雌雄同体型[16]。因此研究鱼类的性别控制机制更加复杂。
通过氨基酸同源性的比对可知,白斑狗鱼Dmrta1基因同目前已报道的众多物种Dmrta1氨基酸序列具有75%以上的同源性,表明Dmrta1基因在不同物种中是高度保守的。通过选择处于动物分类系统中不同进化位的各类动物Dmrta1基因构建系统发育树,发现白斑狗鱼与同属鲑科的鱼类聚为一个分支,遗传距离最近,与两栖纲、爬行纲、哺乳纲的分支遗传距离较远。从分子进化关系上看该基因符合传统的物种进化理论。
3.2 Dmrta1基因的表达模式分析
通过实时荧光定量PCR技术获得了白斑狗鱼Dmrta1基因在不同时期不同组织的相对表达量,结果表明,Dmrta1基因在精巢中表达,在卵巢中几乎无表达。Dmrta1基因在白斑狗鱼精巢的不同时期表达量有所差异,随着日龄期的增加,表达量呈上升趋势。表明Dmrta1(Dmrt4)基因对白斑狗鱼的精巢生长发育可能具有维持作用。有研究表明,在小鼠的各个组织中,Dmrt1基因只在睾丸中表达,其他组织中不表达,说明该基因对雄性精巢的分化起重要作用[3];黑斑蛙(Rananigromaculata)[17]Dmrt4基因在雌、雄成体中的各组织表达无明显差异;周丽青等[18]研究发现,在虾夷扇贝(Patinopectenyessoensis)性别决定机制中,pyDmrt4基因与雄性的性别形成有关;吴启迪等[19]对菲律宾蛤仔(Ruditapesphilippinarum)Dmrt4-like-2基因的研究发现,通过雌二醇处理,该基因在精巢中的表达量显著上调,说明其与性别分化、性腺发育形成有关。白斑狗鱼Dmrta1(Dmrt4)基因在精巢中的表达量显著高于卵巢,这与红鳍东方鲀[20]、青鳉(Oryziaslatipes)[21]Dmrt4基因在精巢中表达量高于卵巢,Dmrt4基因在精巢中较高表达,在卵巢中较低表达情况相一致。在本试验中,Dmrta1基因在雌、雄白斑狗鱼的鳃中均有较高表达,并且表达量随时间的延长而呈现上升趋势,这与Wen等[22]的研究结果——Dmrta1基因在褐牙鲆(P.olivaceus)的精巢中表达量显著高于雌性卵巢,并且在鳃中表达也显著高于其他组织相符合。这说明Dmrta1基因可能与性别的形成和分化有关,并且在一定程度上对鳃弓的形成和发育过程起重要作用。
4 结 论
本试验通过克隆得到白斑狗鱼Dmrta1基因,并对其进行生物信息学分析,该基因具有典型的DM、DMA保守结构域。运用实时荧光定量PCR对Dmrta1基因在雌、雄各组织中的表达情况进行了分析,得到Dmrta1基因在精巢及卵巢中的表达量存在显著差异,并且在雌、雄的鳃中均有表达;可以推断,该基因在维持精巢的发育及鳃弓的形成中具有重要的支持作用,而有关Dmrta1基因在白斑狗鱼精巢中的作用机理,则有待今后进一步研究。
