植物防御反应的研究进展
2021-11-18王诗宇王志兴张丽丽毛艇李鑫刘研赵一洲倪善君钟顺成张战
王诗宇 王志兴 张丽丽 毛艇 李鑫 刘研 赵一洲 倪善君 钟顺成 张战
摘要:植物具有可以抵抗病原菌的复杂防御系统。病原菌侵袭植物时,其相关分子模式和效应因子触发的植物免疫诱导相关致病基因表达,进而改变不同类型的激酶如丝裂原活化蛋白激酶(MAPKs)调控植物激素或转录因子进一步影响下游事件,例如超敏反应、活性氧的生成、细胞壁修复、气孔关闭或几丁质酶、蛋白酶抑制剂、防御素和植物抗毒素等抗微生物蛋白质的分泌。本文总结了上述植物防御系统的主要途径、防御反应和未来抗性育种的研究方向,为植物抗性育种提供理论参考。
关键词:植物防御系统;病原菌;抗性育种;研究进展
中图分类号:Q945.78 文献标志码: A文章编号:1002-1302(2021)19-0039-06
由病原菌和害虫引起的植物病害一直威胁着全球粮食安全,为减少作物直接损失而用于防控病害的措施(如使用杀虫剂)具有重大的农业、经济和社会影响。因此,我们必须了解植物防御系统的机制,这一系统使植物能够抵抗从昆虫到病原菌等多种生物的攻击。植物防御系统涉及与病原菌相互作用及双向协同进化的过程。在这一过程中,病原菌已经进化出从宿主中获取营养来供应生长的机制作为回应,植物进化出了多种防御途径来进行自我保护。
1防御机制
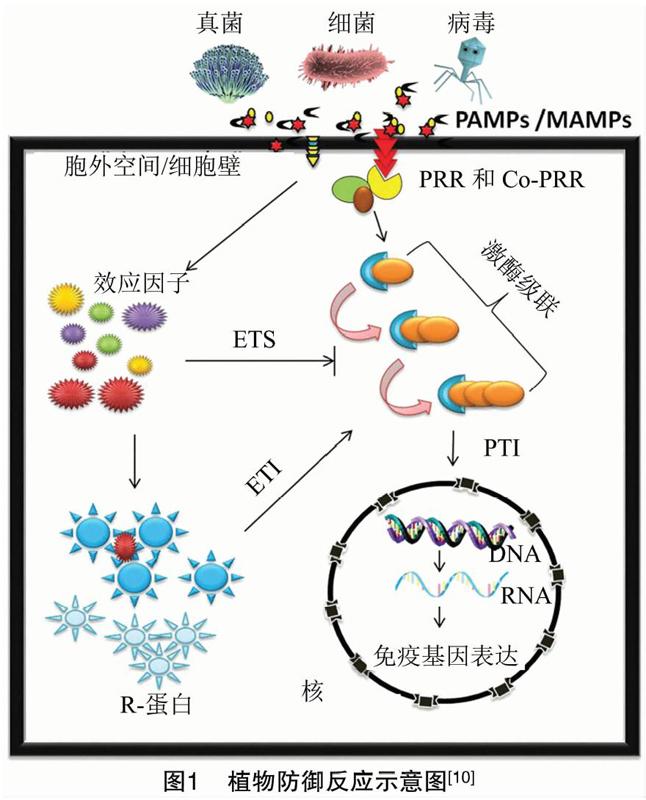
普遍的防御机制分为3个防御层:病原菌相关分子模式(PAMP)引发的免疫(PTI)[1]、效应因子引发的免疫(ETI)和RNAi介导的防御。PAMPs被定义为高度保守的分子,对PAMP的识别会激活PAMP触发的免疫反应,从而引发一系列的免疫反应,但成功感染植物的病原菌会将效应子分泌到植物细胞中,从而抑制PTI,为了抵消这些效应因子,植物触发第2级防御,即ETI。ETI与强烈的免疫反应相关,例如感染部位的程序性细胞死亡即HR。这些免疫反应可以减少病原菌的进一步扩散。
1.1植物第1层防御反应:PTI
植物细胞壁是病原性真菌、卵菌、病毒和细菌面对的物理屏障。突破此障碍后,病原菌会被植物模式识别受体(PRR)识别,从而激活PTI。PAMP是微生物衍生的分子,对微生物至关重要,可以被植物识别。植物PRR位于细胞表面,PRR通常是质膜结合受体激酶(RLK)和受体蛋白(RLPs),可感知微生物相关分子模式/损伤相关分子模式(MAMP/DAMP)。RLK由细胞外结构域、跨膜结构域和细胞内激酶结构域组成,它们是将信号传输至下游防御反应所必需的,而RLP仅由基本构象组成,而没有细胞内激酶结构域,已经克隆了各种MAMP及其相应的PRR。一些最典型的MAMP-PRR是鞭毛蛋白(flg22):鞭毛蛋白受体(FLS2)、延伸因子Tu(EF-Tu):延伸因子Tu受体(EFR)等。FLS2直接与flg22相互作用,flg22是一种来源于鞭毛蛋白氨基末端的22氨基酸肽。EFR特异识别EF-Tu N端的第1个18个氨基酸序列elf18肽。植物感应到病原菌/微生物相关的分子模式后,这些模式识别受体立即触发许多下游响应。
1.2植物第2层防御反应:ETI
具有广谱防御的PTI不足以防御大多数病原菌,病原菌利用各种效应因子来克服PTI并成功感染,植物Resistance (R) 蛋白感知病原菌相关无毒基本(Avr)蛋白触发植物生理防御反应的表达,称为ETI。因此可以说ETI在效应因子介导的第二防御中发挥作用。ETI也称为基因对基因抗性,植物已经进化出数百种抗性(R)基因来防御多种病原菌。最早克隆的R基因是玉米(Zea mays)Hm1。Hm1编码一种酶,可以使来自真菌病原菌的蠕虫炭疽毒素解毒。继Hm1的克隆之后,在番茄、烟草、拟南芥中又相继克隆了Pto、Cf-9、RPS2等R基因。到目前为止,已经鉴定并分离出许多不同的R基因[2]。大多数植物R基因编码具有核苷酸结合和富亮氨酸重复(NB-LRR)结构域的蛋白质。LRR的C末端结构域在不同的R蛋白之间高度可变,是决定不同Avr分子特异性的主要区域。R-Avr相互作用很少通过R受体与Avr因子直接接触而发生,而是通过其他宿主特异性蛋白间接发生[3]。
为了抑制病原菌死亡侵袭,PTI和ETI均可诱导一系列抗菌肽(AMP)、致病相关蛋白(PR)、核糖体抑制蛋白(RIP)和防御性次级代谢产物以及其他植物生理防御生物分子的表达[4]。AMP是植物防御肽,其长度最多为100个氨基酸,大多范围为 10~50个氨基酸。AMP表现出结构和功能的多样性,通过各种机制对不同的植物病原菌发挥抗微生物活性。PR蛋白在患病植物中积累,并直接或间接参与植物对病原菌的防御。到目前为止,已经描述了总共17个PR蛋白家族(PR-1~PR-17)[5]。RIP可能会不可逆地使核糖体失活,并抑制目标病原菌中蛋白的合成。感染细胞中的HR与之前积累的防御信号向同一器官内相邻未感染细胞的转移以激活植物远端的系统防御反应,以保护未受伤害的组织免受病原菌的后续入侵。
1.3RNAi介导的防御
在染病初期,植物可以通过导致基因沉默的RNA干涉(RNAi)来规避病毒感染。其中,包括2种不同的基因沉默现象,即转录基因沉默(TGS)和转录后基因沉默(PTGS)[6]。植物通过小型调节RNA(sRNA)特异性靶向并灭活侵入核酸。sRNA是 20~30个核苷酸(nt)长的非编码RNA分子。sRNA通过与Argonaute(AGO)蛋白结合并将RNA诱导的沉默复合体(RISC)引导至具有互补序列的基因来诱导基因沉默[7]。病原菌可以将sRNA传递到植物中。例如灰葡萄孢菌将小RNA(Bc-sRNA)传递至植物细胞,以沉默宿主免疫基因。相反,宿主也可以将天然存在的小RNA转移到有害生物或病原菌中,以减弱其毒力[8]。为响应黄萎病菌的感染,棉花会增加microRNA 159(miR159)和microRNA 166(miR166)的表达水平,然后将二者输出到真菌菌丝中进行特定沉默[9]。总之,植物可以通过输出特定的sRNA來诱导病原真菌中的基因沉默,并赋予植株抗病性,从而确定宿主植物的新型防御策略(图1)。
总的来说,植物具有一组称为跨膜蛋白的识别受体[11],这些受体识别与病原菌或微生物相关的分子模式,并启动PAMP触发的PTI与病原菌作斗争[12-13]。针对这一防御系统,一些病原菌分泌效应因子来对抗植物自身免疫,并通过激活敏感蛋白来抑制PTI,从而进行侵染,这个过程被称为效应器触发的侵染(ETS)。为了对抗病原菌分泌的效应因子,植物利用抗性R基因启动第2道防线,该基因通过识别来自效应因子或无毒(avr)蛋白信号而被激活,从而引发ETI。通常,PTI是一种非特异性的免疫形式,在一类病原菌中保守。与此相反,ETI是一种高度特异性的免疫,通过对病原菌效应因子的识别来激活,并通过超敏反应引起程序性细胞死亡,抑制病原菌在感染部位的蔓延[14]。RNAi与PTI和ETI一起,是植物检测和根除病原菌的一种方式[15-17]。
2防御反应
2.1HR、ROS和細胞壁增强抑制病原菌感染
HR是病原体被识别后由免疫受体激活触发的植物防御反应,其特征是感染部位或其周围细胞迅速死亡。细胞死亡的部位相当于隔离区,可以阻止病原菌进一步扩散。病原菌感染植物细胞会触发过氧化物酶的产生,从而产生活性氧(ROS),这些活性氧参与抗性反应的多个方面[18]。NADPH氧化酶是产生超氧物所必需的,过氧化物酶利用超氧物产生过氧化氢(H2O2)。一种NADPH氧化酶D(RBOHD)结合植物模式识别受体EFR(PRRs EFR)和FLS2,被BIK1磷酸化,触发活性氧的产生[19],活性氧引发程序性细胞死亡,H2O2转移至临近的细胞,保护其免受损伤[20]。ROS与HR创造了不适合病原菌生存和繁殖的环境,在这个过程中ROS直接参与信号转导和防御反应,从而抑制真菌孢子的萌发[21],ROS也可以介导糖蛋白交联,以增强细胞壁。由于真菌、细菌和线虫需要穿透植物细胞壁来获得完成繁殖所需的营养物质,但细菌病原菌缺乏许多真菌所具有的降解酶,所以它们利用伤口和气孔来获取植物营养物质。气孔保卫细胞识别细菌PAMP(即flg22)和脂多糖,通过相关激素信号诱导气孔关闭,以防止其侵入[22-23]。
2.2酶和酶抑制剂可对抗致病因子
真菌合成纤维素酶等蛋白酶降解植物细胞壁。同样地,植物细胞通过合成酶抑制剂,并积累胼胝质和木质素来加固细胞壁[24]。除了纤维素酶之外,像禾谷镰刀菌这样的病原菌还利用果胶酶和木聚糖酶降解植物碳水化合物[25-26]。同样地,植物也进化出降解病原菌碳水化合物的酶,包括几丁质酶和β-1-3-葡聚糖酶[27-28]。小麦几丁质酶降解真菌细胞壁的主要成分,抑制真菌孢子萌发。重组小麦几丁质酶已被证明对多种不同的真菌具有抗性,而且抗性不仅限于小麦病原真菌[29]。与几丁质酶类似,植物β-1,3-葡聚糖酶降解真菌细胞壁中的 β-1,3-葡聚糖,并产生能进一步刺激植物防御反应的单体[30]。这些方法都是通过降低病原菌中致病成分的有效性来增强植物的防御能力。由于细胞壁的组成成分(即纤维素、半纤维素、果胶、木质素等)多种多样,病原菌必须有一组不同的蛋白质来感染寄主,从而导致植物受体防御蛋白的排列也更加复杂。因此,围绕穿透或强化细胞壁能力的进化之争是植物-病原相互作用整体共同进化的一个缩影。
植物和病原菌均释放出蛋白酶,从而降低了催化蛋白(即植物几丁质酶和真菌纤维素酶)的活性。同时,植物和病原菌利用蛋白酶抑制剂来抑制这些蛋白酶的活性[31]。Thomas 等讨论了10种重要的蛋白酶类型,并根据位置将它们分为质外体、细胞核、液泡、内膜[32],这些蛋白酶在防御机制中起多种作用。大麦蛋白酶抑制剂可以抑制镰刀菌胰蛋白酶、胰凝乳蛋白酶和α-淀粉酶的活性[33]。小麦和大麦α-淀粉酶抑制剂通过干扰α-淀粉酶(昆虫和真菌用来代谢淀粉)来干扰害虫对淀粉的消化[34-35]。与蛋白质一样,脂质也参与许多细胞活动。脂类可以形成将寄主植物与潜在病原菌分开的主要屏障。小麦锈菌和小麦青霉菌分别在与小麦和大麦的表面蜡质接触时启动附着孢的形成[36-37],然后真菌利用角质酶将角质水解成角质单体,并在角质层中移动。脂质转移蛋白通过增加病原菌膜的通透性来提高植物的抗菌功能。然而,关于这些蛋白质如何影响微生物的细节仍有待阐明[38]。脂质也可以是病原菌或植物感知信号的直接靶点,例如镰刀菌毒素伏马菌素干扰鞘脂代谢和细菌脂多糖PAMPs引发的防御反应[39],磷脂酶和脂氧合酶(LOX)参与磷脂/半乳糖脂分解为游离脂肪酸以产生防御因子[40],并在气孔关闭中发挥作用[41]。磷脂酶活性与各种激素和应激反应有关[42],可以产生直接参与防御反应的产物,如磷脂酸[43]。
2.3防御素和Thaumatin蛋白可抑制病原菌感染
防御素是一类小植物蛋白,直接攻击或抑制入侵的微生物和寄生植物。最初报道的有大麦和小麦γ-硫素,研究表明,它们与动物防御素具有结构相似性[44]。与许多医用抗生素的作用类似,植物防御素干扰病原菌蛋白的合成和酶的功能。大麦防御素γ-大麦硫磺素(hordothionin)和ω-大麦硫磺素可以干扰病原菌蛋白的合成和酶的功能[3,45]。小麦防御素1(Tad1)在冠层中表达,具有抗病原特性[46]。与抑制细菌生长的动物防御素不同,许多植物防御素具有抗真菌作用,并且在种子中特别活跃。在植物的许多组织中都发现了防御素,并且其产生可能受季节变化的诱导。植物防御素由45~54个氨基酸组成,其中包含蝎毒素样结构、结蛋白和嘌呤蛋白结构域,具有保守的半胱氨酸残基。在拟南芥[47]和蒺藜苜蓿[48]中鉴定了300多种富含半胱氨酸的防御素样蛋白。Nicole等根据防御素的种类、结构和功能提出了将防御素分为18类的建议[49]。植物防御素具有作为医用抗生素、抗肿瘤药物[50]和人造甜味剂的潜力。Thaumatin样蛋白也是致病相关蛋白。大麦Thaumatin样蛋白与1,3-β-D-葡聚糖结合[51],参与白粉病、禾谷镰刀菌[52]和其他真菌的抗性反应。Thaumatin样蛋白是构成PR蛋白的17种类别之一,包括氧化酶和氧化酶样(PR-9、15和16)、几丁质酶(PR-3、4、8和11)、β-1,3-葡聚糖酶(PR-2)、内蛋白酶(PR-7)、蛋白酶抑制剂(PR-6)、脂质转移蛋白(PR-14)、核糖核酸酶样(PR-10)、防御素和硫蛋白(分别为 PR-12 和13)、Thaumatin样(PR-5)抗真菌(PR-1)和功能性未分的(PR-17)[53-55]。
2.4植物抗毒素和有益共生體是化学和生物武器
植物抗毒素是响应入侵害虫并干扰其代谢、发育和繁殖而产生的有机化合物。最初研究的植物抗毒素是作为保护马铃薯免受马铃薯晚疫病菌侵染的防御化合物。在拟南芥上应用的一种植物抗毒素Camalexin,是针对许多不同类型的微生物病原菌和害虫而产生的[56],由MAPK级联[57]和WRKY转录因子[58-59]调节。谷物和其他植物的抗毒素包括燕麦中的安非他明和水稻中的二萜类化合物。作为一种皂苷类植物抗毒素,燕麦酸A-1由燕麦根表皮产生,并通过与真菌膜甾醇相互作用在真菌膜上形成孔隙[60]。虽然植物抗毒素已在许多物种中被发现具有分类化感作用[61],但其产生的信号机制仍然难以捉摸。植物抗毒素可用于医学[62],也可应用于作物的外源化学物质,如草甘膦基除草剂,增加作物对疾病的敏感性[63]。
植物也可以通过草食动物诱导的植物挥发物来招募草食性昆虫的天敌。以玉米叶为食的毛虫诱导萜类化合物和吲哚的产生,吸引以毛虫为食的寄生蜂[64]。为了保护自己免受侵害,植物还可以产生黏着物来诱捕昆虫,如树脂和乳胶[65-66]。除了为植物提供养分外,一些共生体还可以协助宿主防御病原菌。小麦根瘤菌通过产生抗生素物质来防御土传病原菌禾顶囊壳菌(Gaeumanomyces graminis)。水稻丛枝菌根可触发并增强免疫反应来保护宿主[67]。也有研究表明,共生体通过抑制茉莉酸(JA)介导的防御[68]或干扰ROS和β-1,3-葡聚糖酶的产生[69-70]而影响抗性反应。这些相互作用证明了植物免疫系统的多层性。
3结论与展望
在农业中,植物病害导致农作物减产,抗性成为育种的关键因素之一[71]。因此,了解植物免疫系统是必不可少的。尽管在这里回顾了大量的研究,但仍需要进一步的研究来充分了解植物防御系统是如何整体地发挥作用来产生抗病性的。未来的几年里,生物信息学和分子生物学的飞速发展,这将推动信息爆炸式增长,有关植物与病原菌相互作用的更多细节将会陆续被发现,更多的抗性调控和反应机制将被阐明,这将会提高我们对植物免疫的认识并育成更好的抗性品种将其应用于农业系统。现代植物育种项目已经联合了具有统计学、生物化学、生理学、生物信息学、分子生物学、农学和经济学领域专业知识的跨学科团队,作物育种已经发生了革命性的变化,DNA测序技术的进步已经开启了作物改良的“基因组学时代”。一些防御相关基因包括水稻bsr-d1和bsr-k1等,介导了对稻瘟病的持久抗性,使用组成型启动子驱动防御反应相关基因的表达,在不降低产量的情况下获得高抗性,但转基因技术在育种计划中的应用仍然存在争议。因此,有必要从现有的遗传资源中鉴定出更多的天然或修饰的基因/等位基因。分子工具作为作物育种的新策略得到了迅速的发展,分子育种是在短时间内整合多个显性基因的有效途径[72]。通过分子设计和基因组编辑等分子方法应用这些基因/等位基因资源,是未来抗性育种的潮流方向。
参考文献:
[1]Zipfel C. Early molecular events in PAMP-triggered immunity[J]. Current Opinion in Plant Biology,2009,12(4):414-420.
[2]Kourelis J,van der Hoorn R A L. Defended to the nines:25 years of resistance gene cloning identifies nine mechanisms for R protein function[J]. The Plant Cell,2018,30(2):285-299.
[3]van der Weerden N L,Lay F T. The plant defensin,NaD1,enters the cytoplasm of Fusarium oxysporum hyphae[J]. The Journal of Biological Chemistry,2008,283(21):14445-14452.
[4]Silva M S,Arraes F B M,Campos M D A,et al. Review:potential biotechnological assets related to plant immunity modulation applicable in engineering disease-resistant crops[J]. Plant Science,2018,270:72-84.
[5]Ng T B,Wong J H X,Wang H. Recent progress in research on ribosome inactivating proteins[J]. Current Protein & Peptide Science,2010,11(1):37-53.
[6]Muthamilarasan M,Prasad M. Plant innate immunity:An updated insight into defense mechanism[J]. Journal of Biosciences,2013,38(2):433-449.
[7]Weiberg A,Wang M,Lin F M,et al. Fungal small RNAs suppress plant immunity by hijacking host RNA interference pathways[J]. Science,2013,342(6154):118-123.
[8]Wang M,Weiberg A,Lin F M,et al. Bidirectional cross-kingdom RNAi and fungal uptake of external RNAs confer plant protection[J]. Nature Plants,2016,2(19):16151.
[9]Zhang T,Zhao Y L,Zhao J H,et al. Cotton plants export microRNAs to inhibit virulence gene expression in a fungal pathogen[J]. Nature Plants,2016,2(10):16153.
[10]Tyagi S,Kumar R,Kumar V,et al. Engineering disease resistant plants through CRISPR-Cas9 technology[J]. Crops & Food,2021,12(1):125-144.
[11]Kachroo A,Vincelli P,Kachroo P. Signaling mechanisms underlying resistance responses:what have we learned,and how is it being applied?[J]. Phytopathology,2017,107(12):1452-1461.
[12]Andersen E,Ali S,Byamukama E,et al. Disease resistance mechanisms in plants[J]. Genes,2018,9(7):339.
[13]Tyagi S,Mulla S I,Lee K J,et al. VOCs-mediated hormonal signaling and crosstalk with plant growth promoting microbes[J]. Critical Reviews in Biotechnology,2018,38(8):1277-1296.
[14]Oskar M,Buchwald W,Nawrot R. Plant defense responses against viral and bacterial pathogen infections.Focus on RNA-binding proteins(RBPs)[J]. Herba Polonica,2015,60(4):60-73.
[15]Almagro L,Ros L V G,Belchi-Navarro S,et al. Class Ⅲ peroxidases in plant defence reactions[J]. Journal of Experimental Botany,2009,60(2):377-390.
[16]Dong O X,Ronald P C. Genetic engineering for disease resistance in plants:recent progress and future perspectives[J]. Plant Physiology,2019,180(1):26-38.
[17]Rosa E,Woestmann L,Biere A,et al. A plant pathogen modulates the effects of secondary metabolites on the performance and immune function of an insect herbivore[J]. Oikos,2018,127(10):1539-1549.
[18]Passardi F,Cosio C,Penel C,et al. Peroxidases have more functions than a Swiss army knife[J]. Plant Cell Reports,2005,24(5):255-265.
[19]Kadota Y,Sklenar J,Derbyshire P,et al. Direct regulation of the NADPH oxidase RBOHD by the PRR-associated kinase BIK1 during plant immunity[J]. Molecular Cell,2014,54(1):43-55.
[20]Levine A,Tenhaken R,Dixon R,et al. H2O2 from the oxidative burst orchestrates the plant hypersensitive disease resistance response[J]. Cell,1994,79(4):583-593.
[21]Lamb C,Dixon R A. The oxidative burst in plant disease resistance[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1997,48(1):251-275.
[22]Melotto M,Underwood W,He S Y. Role of stomata in plant innate immunity and foliar bacterial diseases[J]. Annual Review of Phytopathology,2008,46(2):101-122.
[23]Melotto M,Underwood W,Koczan J,et al. Plant stomata function in innate immunity against bacterial invasion[J]. Cell,2006,126(5):969-980.
[24]Bellincampi D,Cervone F,Lionetti V. Plant cell wall dynamics and wall-related susceptibility in plant-pathogen interactions[J]. Frontiers in Plant Science,2014,5:228.
[25]Kang Z,Buchenauer H. Ultrastructural and cytochemical studies on cellulose,xylan and pectin degradation in wheat spikes infected by Fusarium culmorum[J]. Journal of Phytopathology,2000,148(5):263-275.
[26]Wanjiru W M,Kang Z S,Buchenauer H. Importance of cell wall degrading enzymes produced by Fusarium graminearum during infection of wheat heads[J]. European Journal of Plant Pathology,2002,108(8):803-810.
[27]Anguelova-Merhar V S,Westhuizen A J,Pretorius Z A. β-1,3-Glucanase and chitinase activities and the resistance response of wheat to leaf rust[J]. Journal of Phytopathology,2008,149(7/8):381-384.
[28]Kong L R,Anderson J M,Ohm H W. Induction of wheat defense and stress-related genes in response to Fusarium graminearum[J]. Genome,2005,48(1):29-40.
[29]Singh A,Kirubakaran S I,Sakthivel N.Heterologous expression of new antifungal chitinase from wheat[J]. Protein Expression & Purification,2007,56(1):100-109.
[30]Doxey A C,Yaish Mahmoud W F,Moffatt Barbara A,et al. Functional divergence in the arabidopsis β-1,3-glucanase gene family inferred by phylogenetic reconstruction of expression states[J]. Molecular Biology & Evolution,2007,24(4):1045-1055.
[31]Jashni M K,Mehrabi R,Collemare J,et al. The battle in the apoplast:further insights into the roles of proteases and their inhibitors in plant-pathogen interactions[J]. Frontiers in Plant Science,2015,6:584.
[32]Thomas E L,van der Hoorn R A L. Ten prominent host proteases in Plant-Pathogen interactions[J]. International Journal of Molecular Sciences,2018,19(2):639.
[33]Pekkarinen A I,Longstaff C,Jones B L. Kinetics of the inhibition of Fusarium serine proteinases by barley (Hordeum vulgare L.) inhibitors[J]. Journal of Agricultural and Food Chemistry,2007,55(7):2736-2742.
[34]Franco O L,Rigden D J,Melo F R,et al. Plant α-amylase inhibitors and their interaction with insect α-amylases[J]. European Journal of Biochemistry,2002,269(2):397-412.
[35]Franco O L,Rigden D J,Melo F R,et al. Activity of wheat α-amylase inhibitors towards bruchid α-amylases and structural explanation of observed specificities[J]. European Journal of Biochemistry,2000,267(8):2166-2173.
[36]Reisige K,Gorzelanny C,Daniels U,et al. The C28 aldehyde octacosanal is a morphogenetically active component involved in host plant recognition and infection structure differentiation in the wheat stem rust fungus[J]. Physiol Molec Plant Pathol,2006,68(1/2/3):33-40.
[37]Tsuba M,Katagiri C,Takeuchi Y,et al. Chemical factors of the leaf surface involved in the morphogenesis of Blumeria graminis[J]. Physiological & Molecular Plant Pathology,2002,60(2):51-57.
[38]Finkina E I,Melnikova D N,Bogdanov I V,et al. Lipid transfer proteins as components of the plant innate immune system:structure,functions,and applications[J]. Acta Naturae,2016,8(2):47-61.
[39]Desaki Y,Miya A,Venkatesh B,et al. Bacterial lipopolysaccharides induce defense responses associated with programmed cell death in rice cells[J]. Plant & Cell Physiology,2006,47(11):1530-1540.
[40]Canonne J,Froidure-Nicolas S,Rivas S. Phospholipases in action during plant defense signaling[J]. Plant Signaling & Behavior,2011,6(1):13-18.
[41]Montillet J L,Leonhardt N,Mondy S,et al. An abscisic acid-independent oxylipin pathway controls stomatal closure and immune defense in Arabidopsis[J]. PLoS Biology,2013,11(3):e1001513.
[42]Zhao J A. Phospholipase D and phosphatidic acid in plant defence response:from protein-protein and lipid-protein interactions to hormone signalling[J]. Journal of Experimental Botany,2015,66(7):1721-1736.
[43]Rentel M C,Lecourieux D,Ouaked F,et al. OXI1 kinase is necessary for oxidative burst-mediated signalling in Arabidopsis[J]. Nature,2004,427(6977):858-861.
[44]Terras F R,Eggermont K,Kovaleva V,et al. Small cysteine-rich antifungal proteins from radish:their role in host defense[J]. Plant Cell,1995,7(5):573-588.
[45]van der Weerden N L,Hancock R E W,Anderson M A. Permeabilization of fungal hyphae by the plant defensin NaD1 occurs through a cell wall-dependent process[J]. The Journal of Biological Chemistry,2010,285(48):37513-37520.
[46]Koike M,Okamoto T,Tsuda S,et al. A novel plant defensin-like gene of winter wheat is specifically induced during cold acclimation[J]. Biochemical and Biophysical Research Communications,2002,298(1):46-53.
[47]Silverstein K A,Graham M A,Paape T D,et al. Genome organization of more than 300 defensin-like genes in Arabidopsis[J]. Plant Physiology,2005,138(2):600-610.
[48]Graham M A,Silverstein K A,Cannon S B,et al. Computational identification and characterization of novel genes from legumes[J]. Plant Physiology,2004,135(3):1179-1197.
[49]van der Weerden N L,Anderson M A. Plant defensins:common fold,multiple functions[J]. Fungal Biology Reviews,2013,26(4):121-131.
[50]Wang S Y,Rao P F,Ye X Y. Isolation and biochemical characterization of a novel leguminous defense peptide with antifungal and antiproliferative potency[J]. Applied Microbiology and Biotechnology,2009,82(1):79-86.
[51]Osmond R I W,Hrmova M,Fontaine F,et al. Binding interactions between barley thaumatin-like proteins and (1,3)-β-D-glucans. Kinetics,specificity,structural analysis and biological implications[J]. European Journal of Biochemistry,2001,268(15):4190-4199.
[52]Trümper C,Paffenholz K,Smit I,et al. Identification of regulated proteins in naked barley grains (Hordeum vulgare nudum) after Fusarium graminearum infection at different grain ripening stages[J]. Journal of Proteomics,2016,133:86-92.
[53]Singh A,Singh I K. Role of pathogenesis-related (PR) proteins in plant defense mechanism[M]//Archana S,Indrakant K S. Molecular aspects of plant-pathogen interaction. Berlin:Springer,2018,12(1):265-281.
[54]van Loon L C,Rep M,Pieterse C M. Significance of inducible defense-related proteins in infected plants[J]. Annual Review of Phytopathology,2006,44(1):135-162.
[55]Sinha M,Singh R P,Kushwaha G S,et al. Current overview of allergens of plant pathogenesis related protein families[J]. The Scientific World Journal,2014:543195.
[56]Gj K,Drurey C,Schoonbeek H J,et al. Resistance of arabidopsis thaliana to the green peach aphid,myzus persicae,involves camalexin and is regulated by microRNAs[J]. The New Phytologist,2013,198(4):1178-1190.
[57]Xu J,Li Y,Wang Y,et al. Activation of MAPK kinase 9 induces ethylene and camalexin biosynthesis and enhances sensitivity to salt stress in Arabidopsis[J]. The Journal of Biological Chemistry,2008,283(40):26996-27006.
[58]Ahuja I,Kissen R,Bones A M. Phytoalexins in defense against pathogens[J]. Trends in Plant Science,2012,17(2):73-90.
[59]Mao G H,Meng X Z,Liu Y D,et al. Phosphorylation of a WRKY transcription factor by two pathogen-responsive MAPKs drives phytoalexin biosynthesis in Arabidopsis[J]. Plant Cell,2011,23(4):1639-1653.
[60]González-Lamothe R,Mitchell G,Gattuso M,et al. Plant antimicrobial agents and their effects on plant and human pathogens[J]. International Journal of Molecular Sciences,2009,10(8):3400-3419.
[61]Wu H,Pratley J,Lemerle D,et al. Allelopathy in wheat(Triticum aestivum)[J]. Annals of Applied Biology,2006,139(1):1-9.
[62]Adhikari K B,Tanwir F,Gregersen P L,et al. Benzoxazinoids:cereal phytochemicals with putative therapeutic and health-protecting properties[J]. Molecular Nutrition & Food Research,2015,59(7):1324-1338.
[63]Martinez D,Loening U E,Graham M C. Impacts of glyphosate-based herbicides on disease resistance and health of crops:a review[J]. Environmental Sciences Europe,2018,30(1):2.
[64]Turlings T C J,McCall P J,Alborn H T,et al. An elicitor in Caterpillar oral secretions that induces corn seedlings to emit chemical signals attractive to parasitic wasps[J]. Journal of Chemical Ecology,1993,19(3):411-425.
[65]Agrawal A A,Konno K. Latex:A model for understanding mechanisms,ecology,and evolution of plant defense against herbivory[J]. Annual Review of Ecology Evolution and Systematics,2009,40(1):311-331.
[66]McKay S A B,Hunter W L,Godard K A,et al. Insect attack and wounding induce traumatic resin duct development and gene expression of (—)-pinene synthase in Sitka spruce[J]. Plant Physiology,2003,133(1):368-378.
[67]Campos-Soriano L,García-Martínez J,Segundo B S. The arbuscular mycorrhizal symbiosis promotes the systemic induction of regulatory defence-related genes in rice leaves and confers resistance to pathogen infection[J]. Molecular Plant Pathology,2012,13(6):579-592.
[68]Plett J M,Daguerre Y,Wittulsky S,et al. Effector MiSSP7 of the mutualistic fungus Laccaria bicolor stabilizes the Populus JAZ6 protein and represses jasmonic acid (JA) responsive genes[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(22):8299-8304.
[69]Cárdenas L,Martínez A,Sánchez F,et al. Fast,transient and specific intracellular ROS changes in living root hair cells responding to Nod factors (NFs)[J]. The Plant Journal,2008,56(5):802-813.
[70]Mitra R M,Long S R. Plant and bacterial symbiotic mutants define three transcriptionally distinct stages in the development of the Medicago truncatula/Sinorhizobium meliloti symbiosis[J]. Plant Physiology,2004,134(2):595-604.
[71]Bentham A R,de la Concepcion J C,Mukhi N,et al. A molecular roadmap to the plant immune system[J]. Journal of Biological Chemistry,2020,295(44):14916-14935.
[72]Wang L,Long X Y,Chern M,et al. Understanding the molecular mechanisms of trade-offs between plant growth and immunity[J]. Science China. Life Sciences,2021,64(2):234-241.
基金項目:辽宁省自然科学基金(编号:2020-MS-342);东北南部滨海稻区耐盐碱优质高产高效新品培育项目(编号:2017YFD0100502-3)。
作者简介:王诗宇(1992—),辽宁盖州人,女,硕士,助理研究员,主要从事水稻抗性基因的鉴定和克隆、水稻遗传育种研究。E-mail:1603487409@qq.com。
通信作者:张战,研究员,主要从事水稻常规育种研究。E-mail:skycg_zz@126.com。
