大叶冬青皂苷与牛血清蛋白的相互作用研究
2021-10-29焦安妮倪帅帅焦连庆
焦安妮,于 敏,关 玥,倪帅帅,焦连庆
(吉林省中医药科学院,吉林长春 130012)
大叶冬青(Ilex latifoliaThunb.)为冬青科(Aquifoliaceae)冬青属(Ilex)常绿乔木,作为苦丁茶基源植物之一,药用其叶,俗称大叶茶,具有清热解毒、止咳化痰、健胃消积、明目益思等功效[1]。大叶冬青中主要含有三萜及三萜皂苷类、黄酮类、甾体、氨基酸、多糖及核苷等类成分[2]。血清白蛋白是运输内源性及外源性物质的重要载体,也是血浆中含量最丰富的蛋白质[3]。药物小分子被吸收入血后,将可逆性地结合血浆蛋白,再经血液循环到受体部位,故药物与BSA的结合能力直接影响药物在体内的吸收代谢、药效发挥、药理、毒理等方面[3−4]。因此,研究血清白蛋白与药物小分子间的相互作用对于阐明药物分子的作用机制,加强药物的开发利用以及深入了解药物毒副作用具有重要意义。
至今对大叶冬青活性成分的体内药代动力学研究鲜有报道,因此有必要深入研究大叶冬青苦丁茶的化合物的提取分离以及单体化合物的作用机制,明确大叶冬青苦丁茶的药效物质基础,为大叶冬青皂苷药用开发提供技术支持。
本文利用荧光光谱及圆二色谱法研究从大叶冬青叶中分离得到3 种不同结构的皂苷类化合物:Latifoloside G、Latifoloside C 及Kudinoside G 与BSA的相互作用机理,实验结果对于探索大叶冬青皂苷在体内的运输转运机制及相关药代动力学研究具有参考意义。
1 材料与方法
1.1 材料与仪器
牛血清白蛋白 美国Sigma 公司;大叶冬青叶
于2015 年7 月采自浙江省新昌县,由吉林省中医药科学院牛志多研究员鉴定为冬青科冬青属植物大叶冬青的干燥叶;水 为超纯水;乙腈、甲醇 色谱纯,美国Fisher 公司;乙醇、石油醚、二氯甲烷、乙酸乙酯 分析纯,北京化学试剂公司。
LC-20A 型高效液相色谱仪、SPD-M20A 二极管阵列检测器、RF-5301PC 型荧光分光光度计 日本岛津公司;薄层色谱成像仪YOKO-ZS 武汉药科新技术开发有限公司;PMS 450 圆二色谱仪 法国Biologic 公司;BT25S 型十万分之一电子天平 德国赛多利斯科学仪器有限公司;RE-2000A 旋转蒸发器
上海亚荣生化仪器厂;ZK-82A 型真空干燥箱 上海市实验仪器总厂;HH-S 型恒温水浴锅 常州中捷实验仪器制造有限公司。
1.2 实验方法
1.2.1 大叶冬青皂苷的提取、分离、鉴定 实验室前期将干燥的大叶冬青叶粗粉(10 kg)分别加10 倍量70%乙醇浸提3 次,每次3 d,合并提取液,使用旋转蒸发仪在30 ℃条件下将提取液减压浓缩成无醇味浸膏(1 L),分别依次以石油醚、乙酸乙酯、水饱和正丁醇萃取两次,每次溶剂量为浸膏体积的5 倍量。取正丁醇萃取部位(100 g),经硅胶柱色谱,以二氯甲烷-甲醇梯度洗脱,再经薄层色谱成像仪分析合并相同流分(通过10%硫酸乙醇液显色鉴别)得到8 个流分。选取2 个流分经反相键合色谱(ODS)以及半制备型高效液相色谱进行分离纯化得到3 个化合物(Ⅰ、Ⅱ、Ⅲ),采用核磁共振1H 谱、核磁共振13C 谱等波谱手段进行结构解析,并与文献数据比对[4−8],确定化合物Ⅰ、Ⅱ、Ⅲ分别为Kudinsoide G、Latifoloside G 和Latifolosides C。
1.2.2 相关试剂配置 以pH7.4,0.02 mol/L的Na2HPO4-NaH2PO4缓冲液配置1.0×10−5mol/L的牛血清蛋白贮备溶液以及1.0×10−2mol/L的大叶冬青皂苷贮备溶液,置于4 ℃冰箱中备用。
1.2.3 荧光光谱测定 精密吸取3 mL BSA 标准溶液(1.0×10−5mol/L)于1 cm 石英比色皿中,以微量注射器逐次加入大叶冬青皂苷溶液(1.0×10−2mol/L),控制累积加样体积在100 μL 以内,使Latifoloside G、Latifoloside C 及Kudinoside G 最终浓度达到0、0.3322×10−4、0.6623×10−4、0.9901×10−4、1.3158×10−4、1.6639×10−4、1.9608×10−4、2.2801×10−4、2.5974×10−4、2.9126×10−4、3.2258×10−4mol/L。激发波长设置为280 nm,发射波长为340 nm,狭缝均为5 nm,分别记录298、310 K 两个温度下300~500 nm 波长范围内所测量的荧光光谱结果。再结合所得到的不同温度下的荧光猝灭常数及猝灭速率常数,分析不同结构的皂苷类化合物对BSA的荧光猝灭机理。
1.2.4 圆二色谱测定 在室温下,利用1 mm的石英比色皿进行圆二色谱测定。扫描参数:狭缝宽度1 nm,反应时间5 s,波长扫描范围190~250 nm,扫描速度5 nm/s。大叶冬青皂苷与BSA的摩尔浓度比设置为:13:1、26:1、39:1、52:1、65:1。以磷酸盐缓冲液为参比矫正吸收背景,观察反应体系中圆二色谱值的变化,使用SELCON 3.0 程序得到BSA 中α-螺旋含量的变化。
1.3 数据处理
文章中数据采用Excel 2010,图表使用0rgin 8.5 软件进行处理。采用SELCON 3.0 程序计算蛋白质二级变化的百分比,进一步推算Kudinoside G,Latifoloside C 及Latifoloside G 对BSA 构象的影响。
2 结果与分析
2.1 三萜类皂苷与BSA的相互作用的荧光光谱
2.1.1 荧光猝灭光谱 BSA的荧光强度主要来源于色氨酸残基,设置激发波长为280 nm,BSA的发射波长为340 nm,通过荧光光谱得出小分子与蛋白的结合特征,通过双对数方程可以得到不同温度下的结合常数(Ka)和结合位点数(n)等。
图1 表示在298 K 和310 K 条件下,Kudinoside G、Latifoloside C、Latifoloside G 浓度微量变化对于BSA 荧光强度的影响。可看出,随着三种药物小分子浓度的增加,BSA的内源荧光强度降低,两种温度下BSA的最大发射峰皆发生轻微蓝移,三种皂苷的发射波长皆由347 nm 蓝移到345 nm。温度为298 K 时,Kudinoside G、Latifoloside C 和Latifoloside G 对BSA的荧光猝灭程度分别为22.0%、24.1%和27.1%;温度为310 K 时,三种皂苷对BSA的猝灭程度分别为17.7%、19.0%和22.7%。根据荧光猝灭程度可判断出三种皂苷与BSA 结合能力的顺序[9−10]为Latifoloside G>Latifoloside C>Kudinoside G。荧光强度的蓝移表明,蛋白的生色团疏水结构变紧密,肽链的伸展程度减少,使其所处微环境的极性减小,疏水性增加[11−16]。

图1 Kudinoside G、Latifoloside C、Latifoloside G 与BSA 相互作用的荧光光谱图Fig.1 Fluorescence spectra of Kudinoside G,Latifoloside C and Latifoloside G interacting with BSA
2.1.2 三萜类皂苷对BSA的荧光猝灭机理 小分子对蛋白的荧光猝灭主要以静态猝灭和动态猝灭为主,动态猝灭是由分子扩散和碰撞引起的,静态猝灭是因猝灭剂与生物大分子之间形成复合物引起的。两种猝灭机制均遵循Stern-Volmer 方程:
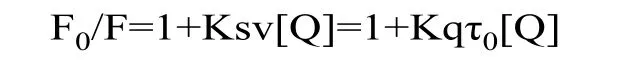
其中,F0和F 代表无猝灭剂和有猝灭剂时的蛋白质相对荧光强度,[Q]是猝灭剂摩尔浓度,mol/L,Kq 为双分子荧光猝灭常数,Ksv 为Stern-Volmer 猝灭常数,代表荧光团对于猝灭剂的敏感性,τ0为无猝灭剂时荧光团的平均寿命,BSA的平均荧光寿命为l0−8s[9]。
结合表1 和图2 可看出,三种皂苷的Ksv 值均较低,这可能是因为Kudinoside G、Latifoloside C、Latifoloside G 分子量较大(分别为1074、1074、1220 Da),极性基团较少,很难插入到BSA的疏水局部区域中[7−8,12]。在不同温度下,Latifoloside G的Ksv 值大于Kudinoside G 及Latifoloside C的Ksv 值,表明Latifoloside G的荧光猝灭程度较大,这可能与Latifoloside G的结构中C-28 位含有Rha的糖支链有关[6−8]。

表1 不同温度下的猝灭常数及猝灭速率常数Table 1 Quenching constants and quenching rate constants at different temperatures

图2 不同温度下药物小分子对BSA 荧光猝灭Stern-Volmer 图Fig.2 Fluorescence quenching of BSA by small moleces at different temperatures stern-volmer diagram
2.1.3 三萜类皂苷与BSA的结合常数和结合位点通过双对数回归曲线可得到结合常数Ka 和结合位点n 数,荧光强度和猝灭剂浓度关系则表示为[9]:

以log[(F0−F)/F]对log[Q]作图,得出的斜率即为结合位点数n,所得截距则为logKa,结合常数为Ka,其结果如表2 所示。可看出,随温度的增加,Kudinoside G的结合常数在降低,结合荧光猝灭结果,表明Kudinoside G 对BSA的荧光猝灭类型为静态猝灭,形成的复合物稳定性较小。Latifoloside C、Latifoloside G 与BSA 相互作用的结合常数随着温度升高而升高,表明作用过程中以动态猝灭为主[15−18]。

表2 不同温度下结合常数及结合位点Table 2 The binding constants and binding sites at different temperatures
2.1.4 三萜类皂苷与BSA的热力学性质及作用力类型 药物小分子与蛋白质之间的主要作用力包括:疏水作用力、范德华作用力、静电力和氢键等;根据Van’t Hoff 方程(下式1)和热力学公式(下式2)计算出反应过程中焓变ΔH、熵变ΔS 以及吉布斯自由能ΔG 等参数,并根据ΔH 及ΔS的相对大小推断三种皂苷与BSA 之间的作用力类型。

当温度相对稳定时,ΔH 为常数,R 为气体常数,T 为实验时的温度,Ka 为相应温度下结合常数,以RlnKa 为纵坐标对−1/T 作图,所得斜率即为ΔH,截距则为ΔS,结果如表3 所示。
由表3 可知,Kudinoside G 与BSA 相互作用过程中,ΔH<0,ΔS<0,ΔG<0,|ΔH|> T| ΔS|,表明,反应为自发进行,且其会使温度升高的放热过程不利于形成稳定的复合物,反应过程中的作用力主要为氢键和范德华力。Latifoloside C 及Latifoloside G 在与BSA作用的过程中,ΔH>0,ΔS>0,ΔG<0,且T| ΔS|>| ΔH|,这表明此过程为熵驱动吸热反应,两者之间的主要作用力为疏水作用力[19−23]。

表3 相关热力学参数Table 3 Relevant thermodynamic parameters
2.2 圆二色谱法研究三萜类皂苷对BSA 构象的影响
圆二色谱法(CD)在研究蛋白质构象方面具有独特的优势,可获得蛋白构象变化信息以及定量计算α-螺旋、β-折叠以及无规则卷曲含量。BSA 含有典型α-螺旋结构,含量为67%,并在CD 远紫外区的208、220 nm 处均存在负峰[12],其余的多肽形成无规卷曲[20]。图3 为BSA 与不同浓度的大叶冬青皂苷结合后的结构变化。
如图3 所示,随着大叶冬青皂苷浓度的不断增加,BSA的负椭圆率峰较未加药物前总趋势是增加的。通过计算得到表4,当Kudinoside G 与BSA 摩尔浓度比39:1、Latifoloside C 与BSA 摩尔浓度比39:1、Latifoloside G 与BSA 摩尔浓度比65:1 时,复合物二级结构α-螺旋含量最高。Kudinoside G 使得BSA的α-螺旋结构从66.4%增加到78%;Latifoloside C 使得BSA的α-螺旋结构从61.6%增加到78%,Latifoloside G 使得BSA的α-螺旋结构从63.8%增加到75.1%。Kudinoside G 使得无规则卷曲含量由21.5%降低到4.9%,Latifoloside C 使得无规则卷曲含量由23.3%降低到9.1%,Latifoloside G 使得无规则卷曲含量由20.3%降低到4.6%。综上表明皂三种苷与BSA 结合后,Latifoloside C 及Latifoloside G 与BSA 在疏水作用力下、Kudinoside G 与BSA 在氢键及范德华力的作用下均使得BSA的α-螺旋结构含量变高,均使得无规则卷曲含量降低[24−28]。

表4 BSA 二级结构在不同浓度药物小分子作用下的变化(%)Table 4 Changes of BSA’s secondary structure under the effect of small moleces with different concentrations of drugs(%)

图3 室温下Kudinoside G、Latifoloside C、Latifoloside G 与BSA 作用的圆二色谱图Fig.3 Circular dichroism of Kudinoside G,Latifoloside C,Latifoloside G and BSA at room temperature
3 结果与讨论
对比具有相同的母核结构的Latifoloside G 和Kudinoside G 发现,Latifoloside G的结合常数和结合位点均大于Kudinoside G,这两种皂苷仅在C-28 位所连的糖链不同,这说明与BSA的结合能力与C-28 位所连的极性基团有关。对比Kudinoside G 和Latifoloside C 发现,两者分子量相同,Kudinoside G 比Latifoloside C 在C-19 位处多连接一个甲基,这使得C-19 位的羟基空间位阻增大[29],甲基作为给电子基团,会导致C-19 位羟基的吸电子能力减弱,羟基极性减弱,氢键不易断裂[30],因而使得Kudinoside G 与BSA的结合能力变弱,齐墩果烷型的Latifoloside C 更易于插入到BSA的疏水腔中[5−8,12]。三种苷与BSA 结合后,Latifoloside C 及Latifoloside G与BSA 在疏水作用力下、Kudinoside G 与BSA 在氢键及范德华力的作用下均会使得BSA的α-螺旋结构含量变高,使得无规则卷曲含量降低。
本文研究了298、310 K 温度下Latifoloside G、Latifoloside C 及Kudinoside G 与BSA 相互作用情况,结合Stern-Volmer 方程、双对数回归曲线、Van’t Hoff 方程等结果,推断出Kudinoside G 对BSA的荧光猝灭类型为静态猝灭,Latifoloside C、Latifoloside G 与BSA 以动态猝灭为主。Latifoloside G、Kudinoside G 和Latifoloside G 均与BSA 有结合位点,坡莫醇酸型皂苷类化合物Latifoloside G 与BSA的结合程度最高,其更容易插入到BSA 内部疏水腔中,三种皂苷与BSA 结合能力的顺序为Latifoloside G>Latifoloside C>Kudinoside G。三种大叶冬青皂苷与BSA 结合皆会改变BSA的结构,增加α-螺旋含量,降低规则卷曲含量,紧密蛋白的生色团疏水结构,减少肽链的伸展程度,减小使其所处微环境的极性,增加其疏水性。这些结果为研究大叶冬青皂苷在体内运输及作用机制提供实验依据,对于大叶冬青入血成分的研究具有重要意义。
