miR-34b-3p调控Keap1表达减轻脑缺血再灌注氧化应激损伤
2021-10-29刘晓蓓
刘晓蓓,马 娟,牛 博,李 晋,常 剑,刘 鹏,陈 婷,刘 硕,黄 荣
(1新疆医科大学第五附属医院CT核磁室,乌鲁木齐 830054;2新疆医科大学第一附属医院神经外科,乌鲁木齐 830011;3新疆医科大学第五附属医院神经外科,乌鲁木齐 830054)
脑卒中是世界上严重危害人类的健康问题之一[1-2],已成为发展中国家死亡和致残的首要原因[3]。近年来我国脑卒中患者逐渐趋于年轻化,伤残人数持续上升,社会压力和负担加剧[4]。脑卒中发病机制复杂、参与因素众多。当前对缺血性脑卒中(又称脑梗死)发病机制和致损原因并不完全清楚,仍需要大量研究。近年来缺血再灌注(ischemiareperfusion,I/R)导致的脑组织损伤受到大量研究者的关注[5-7]。目前人们对于再灌注损伤仍旧很模糊,而I/R引起的氧化应激、炎症、细胞凋亡等都在再灌注损伤过程中发挥重要作用[8-10]。
miRNA是一类由18~23个核苷酸组成的非编码RNA,广泛存在生物体内。miRNA在进化上高度保守,其表达具有组织特异性和时效性。miRNA具有基因转录后调控活性,在各类生物学过程中发挥重要作用[11]。研究发现miRNA在脑血管疾病[12-13]和中枢神经系统损伤[14-15]的发生发展过程中同样发挥重要作用。有研究指出,miRNA参与调控机体再灌注损伤过程[16-18]。
本研究构建了I/R动物模型,通过检测miR-34b-3p的表达分析其对脑梗死损伤和氧化应激的影响。
1 材料和方法
1.1 材料
1.1.1 实验动物及细胞 SPF级雄性SD大鼠,10~13周龄,体质量200~240 g,购于湖南斯莱克景达实验动物有限公司。恒温20~25℃,湿度50~70%,明暗各12 h,自由饮水摄食。所有实验符合伦理学要求。大鼠中枢神经细胞B35购自美国模式培养物典藏中心(ATCC),使用含10%胎牛血清的DMEM培养液于37℃、5%CO2条件下培养。
1.1.2 主要试剂 DMEM培养基、胎牛血清(Gibco);miR-34b模拟物miR-34b-3p mimics、对照模拟物mimics-NC、miR-34b抑制物miR-34b-3pinhibitor、对照抑制物inhibitor-NC、Keap1干扰片段si-Keap1、对照干扰片段si-NC(上海吉玛);miR-34b过表达慢病毒(湖南讴睿);2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染料、3-硝基酪氨酸(3-nitrotyrosine,3-NT)和一氧化氮(nitric oxide,NO)检测试剂盒(上海生工),总超氧化物歧化酶(superoxide dismutase,SOD)和锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)检测试剂盒(南京建成);双萤光素酶报告基因检测试剂盒(Promega);Keap1抗体、Nrf2抗体、HO-1抗体、GAPDH抗体(proteintech)。
1.2 方法
1.2.1 大鼠大脑中动脉栓塞(MCAO)模型制备及分组参考文献[19]建立的MCAO模型制备脑缺血动物模型,1 h后进行再灌注,完成I/R动物模型制备。为检测I/R动物模型中miR-34b的表达,将30只SD大鼠随机分为5组(对照组、假手术组、I/R 1h组、I/R 4 h组、I/R 24 h组),每组6只。对照组不做任何处理;假手术组只手术不栓塞血管,手术24 h后处死大鼠;I/R组分别在再灌注1、4、24 h后处死大鼠。为检测过表达miR-34b对动物模型的影响,将18只SD大鼠随机分为3组(假手术组、pLVX-NC组、pLVXmiR-34b组),每组6只。假手术组不注射病毒,24 h后处死大鼠;另外两组大鼠脑部注射相应病毒,3 d后进行MCAO造模,再灌注后24 h处死大鼠。
1.2.2 神经功能行为学评价 参照Bederson评分方法[20],对实验大鼠的神经功能进行评分。无任何损伤症状记“0”分;对侧前爪伸展障碍记“1”分;不转圈、伴有前爪屈曲对侧压抵抗记“2”分;向左转圈、伴有前爪屈曲对侧压抵抗记“3”分;行走中无自发活动或大鼠死亡记“4”分。
1.2.3 脑梗死体积测定 大鼠处死后取出大脑组织。置于-20℃冰箱,速冻20min。将大鼠脑组织切成薄片,使用质量分数2%的2,3,5-三苯基氯化四氮唑(TTC)溶液染色,37℃避光孵育30 min。弃去TTC染色液,4%的多聚甲醛固定24h。正常组织染色后呈红色,而缺血组织染色后呈苍白色。使用ImageJ1.41软件计算脑梗死体积。脑梗死体积=[左侧大脑半球面积-(右侧大脑半球面积-梗塞部分面积)]/左侧大脑半球面积×100%。
1.2.4 脑组织3-NT、NO、总SOD和MnSOD含量测定组织使用匀浆器研磨,离心后取上清液进行检测。细胞使用液氮反复冻融,离心后取上清进行检测。采用生化法测定脑组织和细胞中的总SOD活力、Mn-SOD活力和NO含量,ELISA法检测3-NT含量。
1.2.5 细胞模型制备及分组 为检测miR-34b-3p对细胞蛋白表达的影响,将B35细胞分为2组:mimics-NC(过表达对照组)和miR-34b-3pmimics(miR-34b-3p过表达组)。为检测Keap1过表达和干扰效率,将B35细胞分为4组:si-NC(干扰对照组)、si-Keap1(Keap1干扰组)、vector-NC(过表达对照组)、vector-Keap1(Keap1过表达组)。为检测Keap1对细胞氧化应激的影响,将B35细胞分为6组:对照组(不做处理)、H2O2组(200μm H2O2处理)、H2O2+vector-NC组、H2O2+vector-Keap1组、H2O2+si-NC组、H2O2+si-Keap1组。为检测Keap1参与miR-34b对细胞氧化应激的调控作用,将B35细胞分为4组:mimics-NC+vector-NC组、miR-34b-3pmimics+vector-NC组、mimics-NC+vector-Keap1组、miR-34b-3pmimics+Keap1组。
1.2.6 实时定量PCR(qPCR)使用TRIZOL法提取大鼠脑组织总RNA,其后使用U6-R和miR-34b-3p-RT引物分别反转录获得qPCR模板。PCR反应条件为:95℃2 min;95℃15 s、60℃30 s、72℃30 s,进行40个循环。使用2-ΔΔCT法计算基因相对表达量,实验所用引物序列信息见表1。

表1 引物序列信息
1.2.7 免疫印迹(Western Blot,WB)细胞裂解液溶解细胞收集蛋白,二喹啉甲酸(BCA)法检测蛋白浓度。配制十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶进行蛋白电泳。将凝胶中蛋白转移至聚偏氟氯乙烯(PVDF)膜上,5%脱脂奶粉室温封闭1 h。相应一抗Keap1(1:2 000)、Nrf2(1:2 000)、HO-1(1:4 000)、GAPDH(1∶20 000)4℃孵育过夜。PBS洗涤后使用二抗(1∶10 000)室温孵育1 h。PBS洗涤后使用增强化学发光(ECL)液进行显色。使用ImageJ 1.41软件计算条带灰度值。
1.2.8 双萤光素酶报告基因分析 生物信息学预测发现miR-34b-3p序列可靶向结合Keap1的3'-UTR序列。将野生型或突变型Keap1 3'-UTR分别克隆至psiCHECK-2载体中,构建野生型报告基因(Wt-Keap1)和突变型报告基因(Mut-Keap1)。人肾上皮细胞(HEK293)使用含10%胎牛血清的DMEM培养基培养,分为8组。将mimics-NC、miR-34b-3pmimics、inhibitor-NC、miR-34b-3pinhibitor分别与Wt-Keap1或Mut-Keap1共转染,进行萤光素酶活性分析。
1.3 统计学分析所有实验数据均以平均数±标准差(±s)表示,由SPSS17.0统计软件分析处理。格拉布斯准则去除逸出值后,行方差分析,两两比较使用LSD-t检验。对神经评分进行非参数统计。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠脑组织miR-34b-3p表达比较qPCR检测各组大鼠脑组织中miR-34b-3p的表达。结果显示:与对照组相比,假手术组无明显变化(P>0.05);与假手术组相比,I/R 1h组miR-34b-3p表达降低(P<0.05),I/R 4h组和I/R 24h组miR-34b-3p表达降低(P<0.01),见表2。
表2 大鼠脑组织miR-34b-3p表达比较(±s)
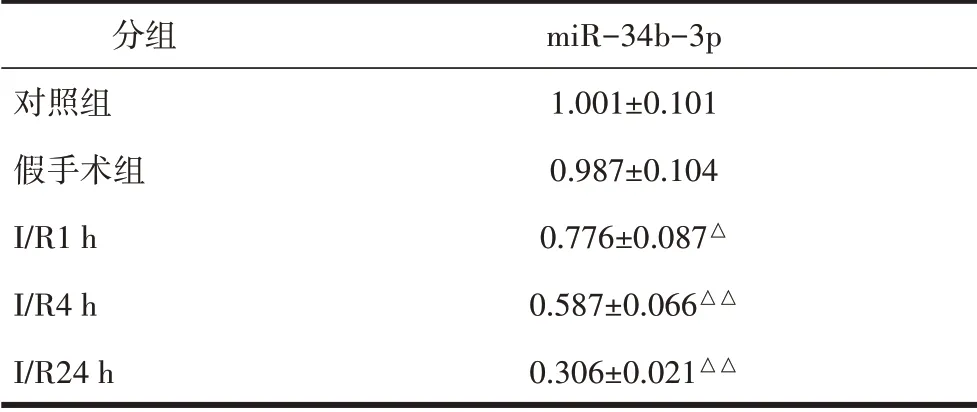
表2 大鼠脑组织miR-34b-3p表达比较(±s)
注:与假手术组相比,△P<0.05,△△P<0.01。
分组对照组假手术组I/R1 h I/R4 h I/R24 h miR-34b-3p 1.001±0.101 0.987±0.104 0.776±0.087△0.587±0.066△△0.306±0.021△△
2.2 注射p LVX-miR-34b后大鼠脑组织miR-34b-3p表达变化比较qPCR结果显示,注射pLVX-miR-34b后大鼠脑组织miR-34b-3p的表达升高(P<0.01),见表3。神经功能评分结果显示,注射pLVXmiR-34b后再灌注后1 h、4 h、24 h神经功能评分均降低(P均<0.05),见表4。2,3,5-三苯基氯化四氮唑(TTC)染色结果显示,注射pLVX-miR-34b后大鼠脑梗死体积减少(P<0.01),见图1和表5。
表5 大鼠脑组织脑梗死体积百分比比较(±s)

表5 大鼠脑组织脑梗死体积百分比比较(±s)
注:与pLVX-NC组相比,△△P<0.01。
分组pLVX-NC pLVX-miR-34b脑梗死体积百分比/%50.0±4.0 29.3±4.7△△
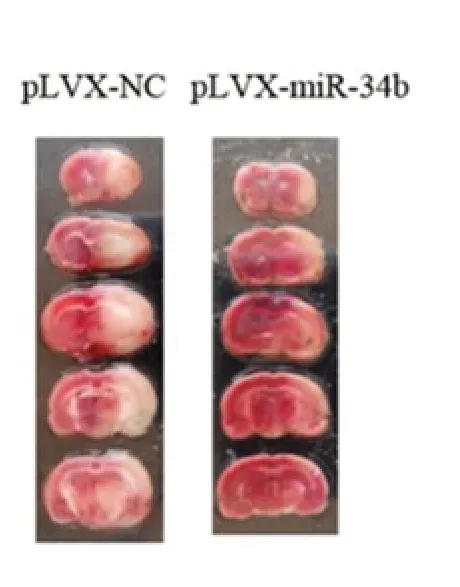
图1 大鼠脑组织TTC染色结果
表3 大鼠脑组织miR-34b-3p表达比较(±s)

表3 大鼠脑组织miR-34b-3p表达比较(±s)
注:与pLVX-NC相比,△△P<0.01。
分组pLVX-NC pLVX-miR-34b miR-34b-3p 1.000±0.114 3.096±0.134△△
表4 大鼠脑组织神经功能评分比较(±s)
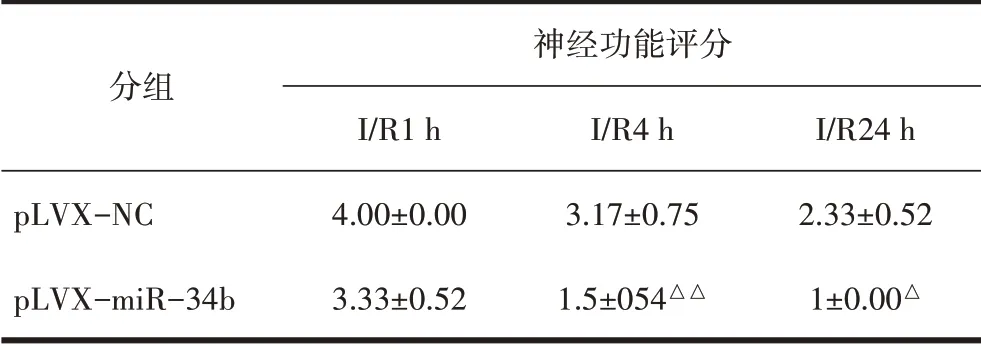
表4 大鼠脑组织神经功能评分比较(±s)
注:与pLVX-NC组相比,△P<0.05,△△P<0.01。
分组pLVX-NC pLVX-miR-34b神经功能评分I/R1 h 4.00±0.00 3.33±0.52 I/R4 h 3.17±0.75 1.5±054△△I/R24 h 2.33±0.52 1±0.00△
2.3 各组大鼠脑组织氧化应激标志物水平比较标志物检测结果显示,与假手术组相比,pLVX-NC组NO和3-NT含量升高(P<0.01,P<0.01),总SOD和MnSOD含量降低(P<0.01,P<0.01);与pLVX-NC组相比,pLVX-miR-34b组NO和3-NT含量降低(P<0.01,P<0.01),总SOD与MnSOD含量升高(P<0.01,P<0.05),见表6。
表6 大鼠脑组织miR-34b-3p表达比较(±s)

表6 大鼠脑组织miR-34b-3p表达比较(±s)
注:与假手术组相比,△P<0.05,△△P<0.01;与pLVX-NC组相比,▲P<0.05,▲▲P<0.01。
分组假手术组pLVX-NC pLVX-miR-34b NO(nmol/g)51.40±6.19 85.87±4.64△△66.30±4.01△▲▲3-NT(pg/μg)233.33±15.04 358.00±23.64△△215.67±18.61▲▲Total SOD(U/mg prot)146.70±4.86 89.63±6.81△△118.33±7.66△△▲▲MnSOD(U/mg prot)71.20±6.12 35.20±1.97△△51.0±2.15△△▲
2.4各组大鼠脑组织和B35细胞Keap1/Nrf2/HO-1信号通路蛋白表达比较大鼠脑组织WB结果显示,与假手术组相比,pLVX-NC组Keap1表达降低,Nrf2和HO-1表达升高(P<0.01,P<0.01,P<0.01);与pLVX-NC组相比,Keap1表达降低,Nrf2和HO-1表达升高(P<0.01,P<0.01,P<0.01),见图2A和表7。B35细胞WB结果显示,与mimics-NC组相比,miR-34b mimics组Keap1表达降低,Nrf2和HO-1表达升高(P均<0.01),见图2B和表8。
表7 大鼠脑组织信号通路蛋白表达比较(±s)

表7 大鼠脑组织信号通路蛋白表达比较(±s)
注:与假手术组相比,△△P<0.01;与pLVX-NC组相比,▲▲P<0.01。
分组假手术组pLVX-NC pLVX-miR-34b Keap1 1.010±0.066 0.567±0.114△△0.267±0.047△△▲▲Nrf2 1.010±0.066 1.707±0.059△△2.363±0.196△△▲▲HO-1 1.040±0.040 2.043±0.172△△2.750±0.151△△▲▲
表8 B35细胞信号通路蛋白表达比较(±s)

表8 B35细胞信号通路蛋白表达比较(±s)
注:与mimics NC组相比,△P<0.05;△△P<0.01。
分组mimicsNC miR-34b-3pmimics Keap1 1.000±0.095 0.397±0.064△△Nrf2 1.000±0.073 1.488±0.156△HO-1 1.000±0.112 2.084±0.244△△

图2 Keap1/Nrf2/HO-1信号通路蛋白表达检测结果
2.5 各组细胞Keap1萤光素酶活性比较双萤光素酶报告基因结果显示,转染WtKeap1的各组细胞中,与mimics-NC组相比,miR-34b-3pmimics组萤光素酶活性降低(P<0.01);与inhibitor-NC组相比,miR-34b-3pinhibitor组萤光素酶活性升高(P<0.01)。转染MutKeap1的各组细胞萤光素酶活性均无明显变化(P>0.05),见表9。
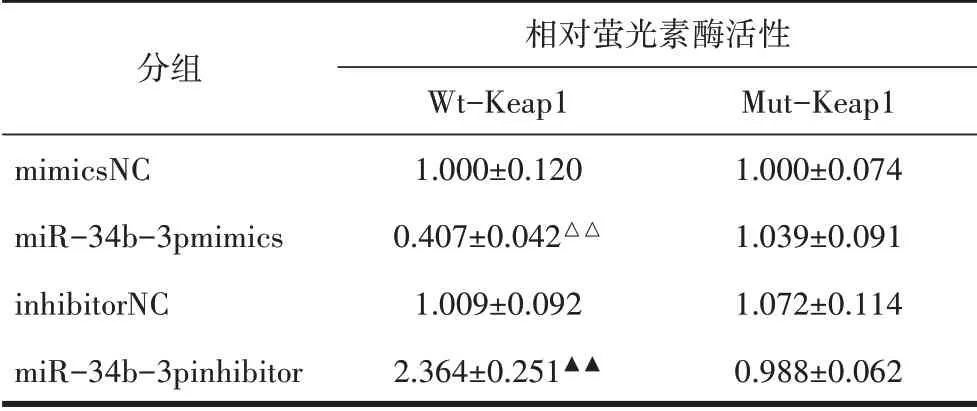
表9 相对萤光素酶活性比较(±s)
2.6 过表达和干扰Keap1后B35细胞氧化应激标志物水平比较WB结果显示,与si-NC组相比,si-Keap1组Keap1表达降低(P<0.01);与vector-NC组相比,vector-Keap1组Keap1表达升高(P<0.01),见图3和表10。标志物检测结果显示,与NC组相比,H2O2组NO和3-NT含量升高(P<0.01,P<0.01),总SOD和MnSOD含量降低(P<0.01,P<0.01);与H2O2+vectorNC组相比,H2O2+vector-Keap1组NO和3-NT含量升高(P<0.01,P<0.01),总SOD和MnSOD含量降低(P<0.01,P<0.01);与H2O2+si-NC组相比,H2O2+si-Keap1组NO和3-NT含量降低(P<0.05,P<0.05),组总SOD和MnSOD含量升高(P<0.05,P<0.05),见表11。
表11 B35细胞氧化应激标志物水平比较(±s)

表11 B35细胞氧化应激标志物水平比较(±s)
注:与对照组相比,△P<0.05,△△P<0.01;与H2O2+vector-NC组相比,▲▲P<0.01;与H2O2+si-NC相比,*P<0.05。
分组对照组H2O2 H2O2+vector-NC H2O2+vector-Keap1 H2O2+si-NC H2O2+si-Keap1 NO 1.000±0.109 1.609±0.138△△1.524±0.098△△2.161±0.220△△▲▲1.479±0.125△△1.214±0.085*3-NT 1.000±0.093 1.351±0.107△△1.248±0.165△1.605±0.073△△▲▲1.313±0.088△△1.129±0.084*Total SOD 1.000±0.118 0.596±0.062△△0.646±0.086△△0.397±0.043△△▲▲0.644±0.084△△0.817±0.065*MnSOD 1.000±0.130 0.671±0.058△△0.699±0.068△△0.406±0.012△△▲▲0.711±0.077△△0.917±0.052*
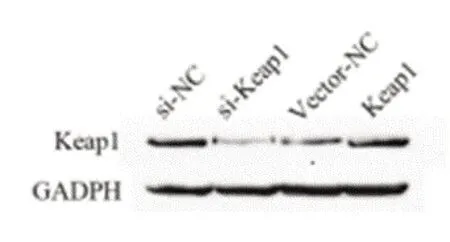
图3 Keap1的干扰及过表达验证结果
表10 B35细胞Keap1蛋白表达比较(±s)
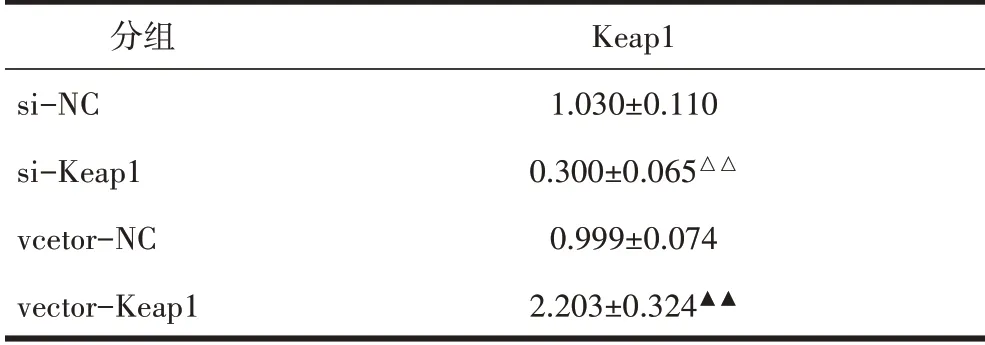
表10 B35细胞Keap1蛋白表达比较(±s)
注:与si-NC组相比,△△P<0.01;与vcetor-NC组相比,▲▲P<0.01。
分组si-NC si-Keap1 vcetor-NC vector-Keap1 Keap1 1.030±0.110 0.300±0.065△△0.999±0.074 2.203±0.324▲▲
2.7 各组B35细胞氧化应激标志物水平比较标志物检测结果显示,与mimics NC+vector-NC组相比,miR-34b-3p过表达组NO和3-NT含量降低(P<0.01,P<0.01),总SOD和MnSOD含量升高(P<0.01,P<0.01),Keap1过表达组NO和3-NT含量升高(P<0.01,P<0.01),总SOD和MnSOD含量降低(P<0.01,P<0.01);与Keap1过表达组相比,miR-34b-3p和Keap1共表达组NO和3-NT含量降低(P<0.01,P<0.01),总SOD和MnSOD含量升高(P<0.01,P<0.01),见表12。
表12 B35细胞氧化应激标志物水平比较(±s)
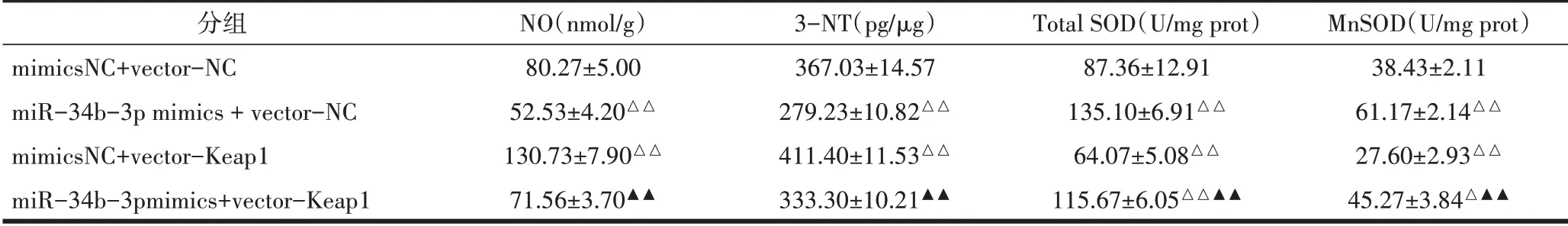
表12 B35细胞氧化应激标志物水平比较(±s)
注:与mimics NC+vector-NC组相比,△P<0.05,△△P<0.01;与mimics NC+vector-Keap1组相比,▲▲P<0.01。
分组mimicsNC+vector-NC miR-34b-3p mimics+vector-NC mimicsNC+vector-Keap1 miR-34b-3pmimics+vector-Keap1 NO(nmol/g)80.27±5.00 52.53±4.20△△130.73±7.90△△71.56±3.70▲▲3-NT(pg/μg)367.03±14.57 279.23±10.82△△411.40±11.53△△333.30±10.21▲▲Total SOD(U/mg prot)87.36±12.91 135.10±6.91△△64.07±5.08△△115.67±6.05△△▲▲MnSOD(U/mg prot)38.43±2.11 61.17±2.14△△27.60±2.93△△45.27±3.84△▲▲
3 讨论
众多研究显示,I/R介导的氧化应激是导致神经细胞和神经元损伤的重要原因[21-22]。本研究发现,miR-34b-3p在I/R介导的氧化应激中发挥重要作用。过表达miR-34b-3p抑制氧化应激,对脑神经细胞产生保护作用,而Keap1蛋白及Nrf2/ARE信号通路参与了该调控过程。
miR-34b已被证明在大脑发育过程中发挥重要功能[23]。近年来,miR-34b被报道在铅神经毒性大鼠模型和帕金森患者脑组织中表达异常[24-25],提示miR-34b可能参与脑神经损伤过程。在本研究中,I/R大鼠模型脑组织miR-34b-3p表达持续降低,而过表达miR-34b-3p可降低脑梗死体积、神经功能评分,表明miR-34b-3p参与I/R损伤调控,是I/R损伤调控中的保护性因素。氧化应激损伤是I/R发生后脑部组织受损的主要原因,NO和3-NT含量可揭示I/R损伤中活性氮簇的活性强弱,总SOD和MnSOD含量可反映脑组织受到氧化损伤的程度。本研究发现,过表达miR-34b-3p可降低NO和3-NT含量,升高总SOD和MnSOD含量,表明miR-34b-3p可减轻动物和细胞氧化应激。已有研究报道miR-34b参与氧化应激。在人神经母细胞瘤细胞和小鼠原代皮层神经元中,miR-34b/c控制活性氧的产生,影响线粒体氧化应激[26]。而在帕金森症中,miR-34b/c早期失调触发线粒体功能障碍和氧化应激,进而使下游转录组发生改变[27]。
MiRNA在哺乳动物中发挥功能的机制主要为与靶基因3'-UTR结合,缩短靶mRNA半衰期或抑制靶mRNA翻译[28]。在本研究中,生物信息学表明Keap1基因3'-UTR包含miR-34b-3p结合位点,提示miR-34b-3p可能靶向调控Keap1表达。双荧光素酶报告基因分析和WB检测结果表明,miR-34b-3p靶向结合Keap1基因3'-UTR序列并抑制Keap1蛋白表达。
Nrf2/ARE是机体调节氧化应激的重要通路,Nrf2是其中的关键因子[29]。Keap1是Kelch家族中的一员,是Nrf2的负调控因子[30]。通常情况下Keap1与Nrf2在细胞质中结合,抑制Nrf2激活,而长期未被激活的Nrf2会被泛素化进而降解。当机体受到刺激时,Nrf2被释放并转移到细胞核,激活下游基因转录。HO-1是机体内的抗氧化剂,受到Nrf2调控[31]。在本研究中,H2O2介导的氧化应激损伤细胞结果表明,Keap1能增强细胞氧化应激,而降低Keap1表达是减轻氧化应激的有效途径。进一步采用过表达Keap1联合过表达miR-34b-3p处理细胞,结果显示联合过表达组氧化应激减轻,表明miR-34b-3p通过降低Keap1表达减轻氧化应激。此外,miR-34b-3p在体内体外均可使Keap1表达降低,使Nrf2和HO-1表达升高,表明miR34b-3p可能通过Keap1调控Nrf2/ARE信号通路,进而减轻氧化应激。
综上所述,本研究表明,miR-34b-3p通过调控Keap1表达抑制氧化应激,保护脑神经细胞。本研究为氧化应激调控机制研究提供了一定的理论基础。
