枸杞MYB转录因子 LrAN2在番茄中的过量表达分析
2021-10-22罗香怡刘宝龙
罗香怡,李 云,曹 东,魏 乐,宗 渊,刘宝龙
(1.青海师范大学 生命科学学院,西宁 810008;2.青海省作物分子育种重点实验室,西宁 810001)
枸杞(Lyciumbarbarum)是枸杞属茄科植物,在中国广泛种植,主要分布于西北、河北、东北等地[1]。枸杞中富含多种营养成分,如枸杞多糖、甜菜碱、氨基酸、总糖、枸杞色素等,具有抗肿瘤、降血糖、降血脂、抗疲劳、免疫调节等丰富的营养价值和药用价值[2-4]。根据其所含花青素含量差异可分为红枸杞、黑枸杞、黄枸杞等[5]。其中黑枸杞是近年来发现的多年生抗旱耐盐性的野生枸杞,是已发现的花青素含量最高的枸杞品种,其药用、保健价值远远高于普通红枸杞[6]。本试验研究中的LrAN2基因仅存于黑枸杞。近年来黑枸杞相关研究较为丰富,2014年张玲艳等[7]研究黑枸杞花青素的提取工业及其抗氧化能力,阐明黑枸杞花青素提取最佳工业条件,发现随着黑枸杞花青素浓度的增加,其清除能力逐渐增强。朱雪冰[8]对黑枸杞和红枸杞的果实进行高通量转录组测序和生物信息学分析,解析了黑枸杞与红枸杞中与花青素代谢相关基因的表达和结构差异,为黑枸杞新品种选育提供良好的理论和实验基础。Li等[9]对黑枸杞在盐胁迫和干旱胁迫下光合特性进行了研究,评估了枸杞的耐盐性和耐旱性。
花青素(Anthocyanin)是一种糖基化的多酚类化合物,能够赋予植物花、种子、果实和营养组织红、紫、蓝等各种不同的颜色,同时具有抗氧化作用[10],是目前最有效的抗氧化剂,花青素能够保护植物免受各种生物和非生物胁迫,如紫外线[11]、干旱[12]、低温[13]及病虫害[14]等。花青素生物合成途径物中的大多数结构基因已从矮牵牛属、拟南芥、玉米和其他物种中鉴定出来[15-16]。这些结构基因的转录直接由MYB-bHLH-WD40复合物(MBW)调控,该复合物由R2R3-MYB、bHLH和WD40蛋白组成[17]。MYB转录因子的转录激活通常会导致植物叶片或果实中花青素的积累[18]。如LhMYB6和LhMYB12可激活花青素生物合成结构基因的表达,引起矮牵牛色素积累[19]。
近年来,研究人员已从番茄MBW复合物中发现了花青素合成调节因子,包括两个编码R2R3-MYB转录因子(TFs)的旁系同源基因花青素1(SlANT1)和花青素2(SlAN2)。SlANT1和SlAN2与矮牵牛花杂交中的PhAN2高度同源[20-21],这两个基因的特异表达能够诱导转基因番茄各器官花青素的合成,并且SlAN2还能够诱导植物在强光和寒冷条件下花青素的生物合成[22]。LrAN2是一个功能性MYB转录因子基因,可以调节花色苷的合成。它包含完整的HTH_MYB,在调节MYB转录因子中起重要作用。它仅在黑枸杞黑色果实中表达,LrAN2的等位基因变异与黑色果实性状密切相关[23]。MYB转录因子系统发育树中LrAN2与NtAN2和AtPAP1同源[24-25],烟草中LrAN2的过表达激活了与花青素生物合成相关的bHLH转录因子AN1b以及与原花青素生物合成相关的MYB转录因子MYB3[26]。这表明LrAN2是NtAN2的功能类似物,编码MYB转录因子,调节植物细胞花青素的合成。
系统发育树显示LrAN2与茄科作物属相邻,与SmAN2、S1AN2、StMTF2、S1ANT1、StNA1等高度同源[23]。过表达SlAN2和SlANT1的番茄品系,都显示出花青素的合成增强,进而导致营养器官、花和果实色素的沉着[22]。LrAN2与SlAN2在发育树分析中聚类相近,同源性较高,但是LrAN2在枸杞中的调控作用还不是很明确。由于枸杞转基因组织培养技术的局限性,本研究选择与枸杞同属茄科作物番茄进行转基因功能分析,并在番茄中过表达LrAN2,以分析LrAN2基因的功能及其调控,为LrAN2的功能研究提供良好的理论基础。
1 材料与方法
1.1 植物材料和生长条件
试验中番茄(SolanumlycopersicumL.)品种 Marker作为野生型材料。将番茄种子进行室内培育,在30 000 lx的光照度下光照16 h,温度25 ℃,土壤湿度为60%~80%。待植株长到4叶期时进行组培试验。种子资源保于中国科学院西北高原生物研究所刘宝龙课题组。
1.2 cDNA制备
取黑枸杞成熟期黑色果实,用RNAprep Pure Plant Plus试剂盒(TIANGEN,DP441)提取RNA。根据说明书使用TIANScript II RT试剂盒(TIANGEN,KR107-01)将RNA反转录成cDNA。
1.3 植物表达载体构建
利用Vector NTI软件设计特异性引物,对上述提取的cDNA进行PCR扩增。反应体系如下:20 μL反应系统包括10 μL 4倍HQ缓冲液(Thermo Fisher Science,北京,中国),1.6 μL 10 mmol/L dNTP,0.2 μL 20 mmol/L引物和0.2 μL cDNA模板,补充ddH2O至20 μL。循环条件如下:98 ℃ 2 min;98 ℃ 10 s,58 ℃ 30 s,32个循环;72 ℃ 1 min;72 ℃ 10min。将扩增产物T链接测序,提取阳性菌落质粒后进行Gateway克隆,最终将目的片段构建于含有CaMV35S启动子的表达载体PJAM1502中。Gateway克隆体系如下:(1)BP反应:100~200 ng PCR回收产物;100 ng pDONR207载体;1 μL BP ClonaseⅡ;加水至5 μL;25 ℃水浴3 h。然后向反应体系中加入1 μ L Proteinase K(2 μg/μL),37 ℃水浴10 min,转化到大肠杆菌DH5α。用质粒提取试剂盒提取入门载体pDONR207-LrAN2。(2)LR反应:100 ng pDONR207-LrAN2重组质粒;100 ng PJAM1502瞬时表达载体;1 μL LR ClonaseⅡ;加水至5 μL;25 ℃水浴3 h。然后向反应体系中加入1 μL Proteinase K(2 μg/μL),37 ℃水浴10 min,得到重组质粒PJAM1502:LrAN2。通过冷冻法将PJAM1502:LrAN2转化到农杆菌LBA4404中。剪取先前培养番茄植株4叶期幼嫩的茎段组织,75%酒精灭菌1 min,2%次氯酸钠灭菌12 min后进行农杆菌侵染,农杆菌OD值为0.6。培养基配置体系如下:预培养:MS + 1 mg/L ZT + 0.2 mg/L IAA;共培养:MS + 1 mg/L ZT + 0.2 mg/L IAA + 1 mL AS;筛选培养:MS + 1 mg/L ZT + 0.2 mg/L IAA + 300 mg/L 特美汀+ 10 mg/L 潮霉素(70 mg/L 卡那霉素);生根培养:1/2 MS + 150 mg/L 特美汀+5 mg/L 潮霉素(50 mg/L 卡那霉素)。相关载体构建、农杆菌检测以及阳性植物挑选的引物见表1。最终利用attb1和attb2引物检测阳性植株。
1.4 qPCR定量分析
分别选取番茄的根、茎、叶、花和果实,进行qPCR检测。内参基因Slactin转录本的扩增可用于标准化PCR前各种逆转录混合物的cDNA含量,并在PCR过程中监控热扩增动力学。至少使用3个独立的测试来检测qPCR揭示的转录模式的可重复性。表1包括本研究用到的引物。
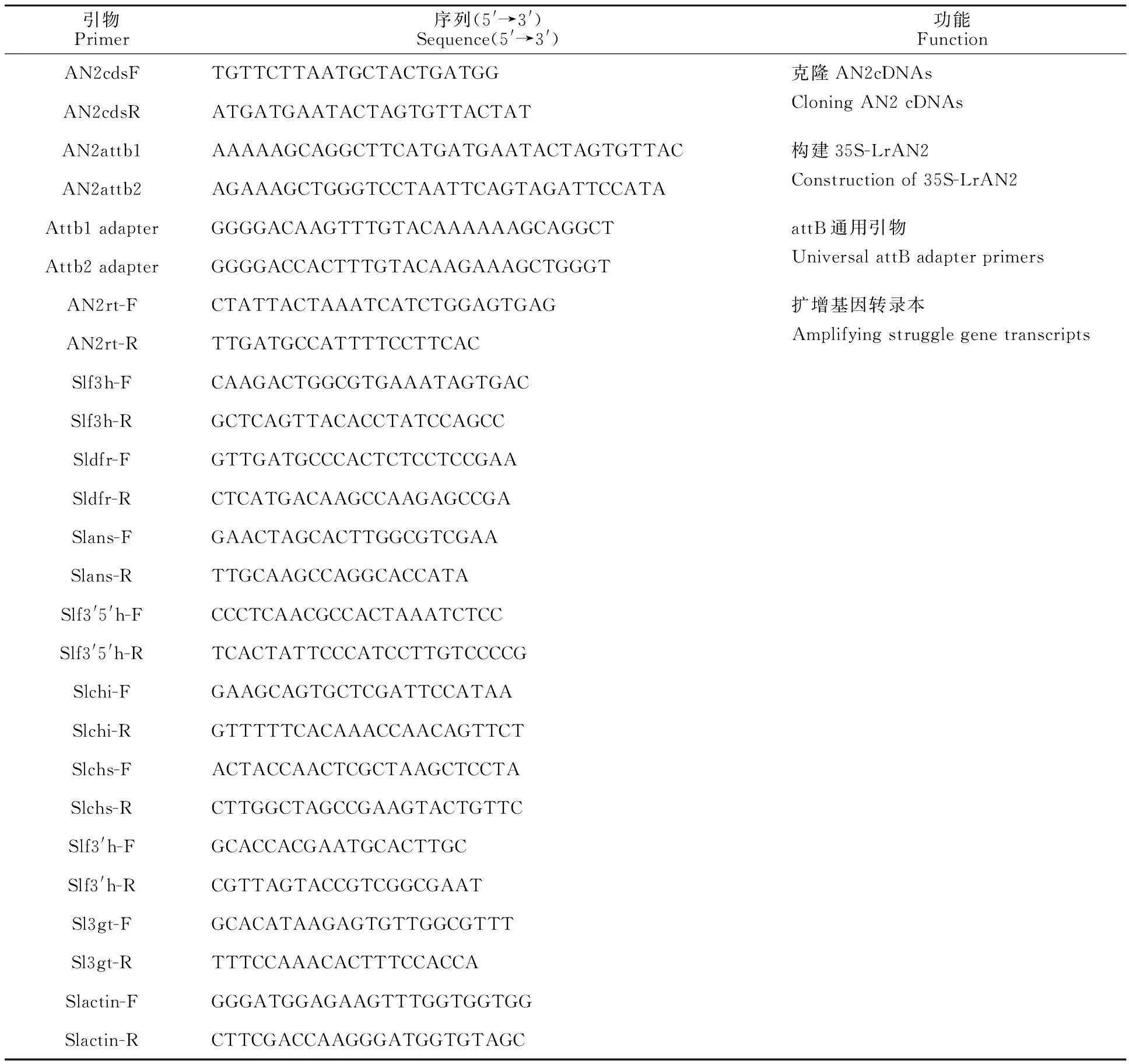
表1 本研究所用引物
1.5 转基因植株表型观察分析
用iPhone11 pro max拍摄转基因番茄和对照番茄中不同组织的照片。用OLYMPUS-BX53显微镜拍摄对应于不同组织的表皮细胞的放大图片,并使用CellSens Standard软件进行图片 处理。
1.6 花青素含量测定
分别取开花后转基因番茄和野生型番茄的根、茎、叶、花和果实,使用(Q=(A530-0.25×A657)/0.1)的方法测量计算花青素含量,并设立3个独立的试验。使用SPSS软件分析数据。
1.7 花青素种类定性分析
称取对照番茄叶、转基因番茄叶和黑枸杞果实各1 g,用0.1%盐酸溶解,然后在32 ℃水浴中放置12 h后超声30 min。经过0.45 μm滤膜后,将提取的花青素转移到液体分析瓶中,使用高效液相色谱法在520 nm光谱条件下扫描花青素提取物,以检测各种花青素的相应吸收峰。液相条件:0~10 min 10%~20%乙腈,10~15 min 20%~30%乙腈,15~20 min 30%~80%乙腈,20~25 min 80%~8%乙腈;柱温:25 ℃,进样量:90 μL;运行时间:25 min。
称取5 g叶子,冻干,备用。通过ABSciexQTRAP LC-MS/MS检测平台,收集样品代谢物光谱信息,并将质谱信息与花青素数据库进行匹配,以鉴定样品中花青素代谢物的类型。使用三重四极杆质谱的多反应检测模式(MRM)获得样品中代谢物的峰面积数据,并获取不同样品中代谢物的相对含量。基于获得的花青素代谢物的定性和定量数据,进行数据模型的质量控制及花青素鉴定和花青素的相对定性分析。
2 结果与分析
2.1 枸杞 LrAN2基因转化番茄植株
将LrAN2基因构建到PJAM1502载体中,并在农杆菌转染后获得过表达转基因植株。PCR检测10棵组培苗,其中阳性植株5棵,阳性植物DNA样品中目标基因LrAN2的开放阅读框(ORF)为774 bp,阴性对照中无法获得有效片段。培养20 d后,转基因植物和非转基因阴性对照植株外观上并无明显差异。LrAN2基因表达载体构建如图1,PCR检测图片如图2,野生型番茄植株和转基因番茄植株对比如图3。
2.2 转基因植株不同组织部位表型观察
通过显微镜观察番茄各个组织细胞,果实表皮无差异,表皮细胞清晰可见,没有色素沉着。在转基因番茄的花中,花药呈紫黑色,在显微镜下更为明显。转基因叶片细胞含有大量色素沉着,而野生型叶片则含有大量叶绿素。茎段中细胞色素没有明显差别。转基因根在外观和细胞观察中显示出明显的紫色。各组织部位根、茎、叶、花、果实表型和表皮细胞对比如图4。
2.3 LrAN2对花青素合成代谢通路的调控分析
花青素含量测定显示,转基因番茄的花,叶,茎和根存在花青素的积累,但果实中花青素积累的不多。叶中的相对含量最高,然后是花和根。两种不同类型番茄花青素含量对比如图5。
qPCR分析表明,转基因植株中LrAN2基因在叶中表达量最高,其次是根。花青素合成代谢通路中所有结构基因表达谱分析显示,DFR基因的转录水平最高,其次是F3′5′H基因。LrAN2基因在各组织部位的相对表达量如图6,结构基因表达量比对如图7。
2.4 LrAN2对其他基因和化合物表达的影响
对番茄叶片和黑枸杞果实进行色谱分析,结果见图8。野生型对照样本中未能提取出花青素,而转基因叶片中能提取出粉红色花色苷提取物,黑枸杞中提取出紫黑色花色苷提取物。分别对转基因番茄和野生型番茄中的飞燕草素、矢车菊素、天竺葵素、芍药素、锦葵色素等花色苷提取物进行定性分析,结果显示,其中飞燕草素-3-O-芸香糖苷在转基因番茄中有效峰面积最大。飞燕草素-3-O-葡萄糖苷、矢车菊素-3-O-葡萄糖苷在转基因番茄中存在有效峰面积,而在野生番茄中检测不到。芍药素、锦葵色素在转基因番茄和野生型番茄中均不存在。具体检测结果见表2。

表2 定性结果
3 讨 论
本研究构建了一种35S:LrAN2的植物表达载体,并通过农杆菌侵染技术在番茄中进行过量表达,从而了解LrAN2基因在茄科作物中的表达调控机制。Zeng等[27]推测LrAN2是调节黑枸杞生物合成的关键基因,并利用qPCR和酵母双杂交技术进行论证。Zong等[23]对黑枸杞进行转录组测序分析,筛选了关键候选基因LrAN2,通过生物信息学、表达谱分析、过表达验证,在54种群体材料中进行等位变异扫描,证明LrAN2基因是参与并调控黑枸杞表达的主效基因。由于枸杞中过量表达基因的组织培养技术一直没有突破性进展,无法验证LrAN2在枸杞中的过量表达调控机制,因此本研究使用茄科作物番茄作为LrAN2功能分析的模式植物。
LrAN2在烟草(Samsun)中过表达后,整个烟草植株呈紫色表型,叶和茎中花青素含量最高[23]。而在转基因番茄中,花青素主要沉积在茎、叶和根部。烟草中LrAN2的过表达激活了紫色烟草146个基因的上调,ANS的表达上调了400倍以上,其次是DFR和CHI[28]。在转基因烟草中类黄酮代谢通路被激活[29],同时其他调控花色苷的转录因子ANb1和MYB3都同时上调,然而LrAN2在番茄中的过表达不能使果实产生花青素,10X物镜观察番茄表皮细胞未出现色素沉着。在以前的研究中,Muir等[30]将矮牵牛的CHI基因转到番茄中,发现在转基因番茄的果皮中黄酮醇含量增加了78倍,但是果实也没变成紫色。Schijlen等[31]将不同植物的花青素合成结构基因转入番茄中,果实也都没有变色。这些研究表明[32]仅有结构基因的表达是不够的,转入特定的转录因子才有可能增加花青素的合成。对于本研究出现果实没有呈现紫色的现象很有可能是需要番茄果实特异表达E8启动子调控目的基因[33],最终才能在果实中实现LrAN2的大量转录,35S启动子无法在番茄果实中激活LrAN2所导致。本研究对转基因番茄和野生型番茄进行代谢组对比分析,发现花青素相关的化合物在转基因番茄中大量积累,说明LrAN2基因能够调控花青素的合成。
4 结 论
在本研究中,LrAN2基因在番茄中过表达,并被启动子CaMV35S调控和激活。结果表明,虽然LrAN2参与了黑枸杞果实花青素生物合成的调控,但还需要黑枸杞启动子的调控。飞燕草色素、矢车菊色素在黑色果实中的大量积累受到LrAN2基因的决定性调控。
