伏核神经细胞GalR2介导针刀干预神经病理性痛大鼠的镇痛作用
2021-10-20刘亚南李崇阳徐世莲
刘亚南 ,杨 双 ,董 玮 ,李崇阳 ,徐世莲
(1)昆明医科大学基础医学院生理学系,云南 昆明 650500;2)云南中医药大学第三附属医院骨伤科,云南 昆明 650041;3)云南省第二人民医院肿瘤科,云南 昆明 650021)
国际疼痛研究会2011年将由躯体感觉神经系统的损伤或疾病而直接造成的疼痛定义为神经病理性痛[1]。目前临床治疗神经痛的药物主要包括阿片类镇痛剂、N-甲基-D-天冬氨酸(N-methyl-Daspartic acid,NMDA)受体阻断剂、钠离子通道阻断剂等。这些药物对某些病人能产生短时的镇痛作用,但其副作用也是十分明显的,如镇静、恶心、腹泻、眩晕以及阿片类镇痛剂长期应用可发生耐受、心理/生理依赖、戒断综合征和自身觅药行为。
小针刀(Small needle knife)疗法是我国朱汉章教授在1976年总结实践经验,在中医基础理论指导下,吸收现代科学技术及西医学的新成果,将手术刀的“刀”与针灸的“针”巧妙融为一体的先进治疗方法[2]。该疗法将小针刀刺入到病变组织进行松解、切割和剥离,以达到止痛祛病的目的[3],具有见效快、方法简便、疗程短、痛苦小、价格低、无毒副作用等优点,因此在临床应用越来越广泛。与其临床应用蓬勃发展的良好态势相比,针刀疗法的实验研究相对滞后。研究报道针刀治疗可促进内源性阿片肽、β-内啡呔、亮氨酸-脑腓呔释放[4-5],从而参与内源性镇痛。
甘丙肽(Galanin)是一种由29个(人类为30个)氨基酸组成的神经活性肽,广泛分布于中枢神经系统和外周组织。甘丙肽通过激活其受体,具有神经内分泌调节、摄食和代谢、认知等多种生物学作用。甘丙肽受体(galanin receptors,GalRs)有3种:GalR1、GalR2、GalR3。笔者所在实验室前期的研究表明:在伏核,甘丙肽通过激活其受体对神经病理性痛具有明显的镇痛作用[6-7]。本实验研究针刀治疗神经痛是否通过促进伏核神经细胞甘丙肽的释放,转而激活其受体来完成。
伏隔核(nucleus accumbens,NAc),也称为伏核,位于尾状核头部、壳核的前部,侧面与透明隔相接,左右对称,在大脑奖赏效应、药物成瘾、认知等功能活动中起重要作用[8-9]。越来越多的研究表明,伏核在痛觉调制中具有重要作用[10-11]。本研究通过坐骨神经痛大鼠模型,检测针刀治疗对神经痛大鼠伏核神经细胞GalR2的表达的影响,并于伏核内注射甘丙肽受体的非特异性阻断剂Galantide及GalR2的特异性阻断剂M871,研究甘丙肽及GalR2介导针刀疗法对神经痛的镇痛作用,为针刀治疗神经痛的作用机制研究提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物实验使用体重(180~220)g的SD雄性大鼠,体重:(180~250)g年龄:(1.5~2)月。购于昆明医科大学实验动物中心。实验期间大鼠分笼饲养,自由取食和饮水,自然光照,室温维持在适宜温度(22±1)℃。所有动物实验步骤均遵循国际疼痛研究协会以及昆明医科大学实验动物伦理委员会管理规定。
1.1.2 实验药品M871([galanin(2-13)-Glu-His-(Pro)3-(Ala-Leu)2-Ala-amide],Tocris,美国);Galantide([galanin(1-13)-substrate P(5-11)amide],MCE,美国)。
1.2 实验方法
1.2.1 行为学测试方法使用智能热板仪(YLS-6B,济南益延科技有限公司)测试大鼠对伤害性热刺激诱导的后爪缩爪潜伏期(hind paw withdrawal latency,HWL)。热板温度维持在(52±0.2)℃。使用Randall-Siletto痛觉测试仪(37 215,意大利UGO Basil 公司)测试大鼠对伤害性机械压力刺激诱导的后爪缩爪阈值(hind paw withdrawal threshold,HWT)。
实验前对大鼠进行5 d的行为学测试训练。每天训练3轮,每轮3次。训练后大鼠HWL保持在3~6 s之间,HWT保持在4~7 g之间。每次测试要求不超过15 s或15 g,以防止造成大鼠后爪组织损伤。
1.2.2 神经病理性痛动物模型的构建采用坐骨神经部分结扎(chronic constriction injury,CCI)制作神经病理性痛动物模型[12]。大鼠腹腔注射戊巴比妥钠(45 mg/kg)进行麻醉,在其左侧大腿中部暴露(8~10)mm长的一段坐骨神经,用4号羊肠线每隔(1.0~1.5)mm轻度结扎神经,共结扎4圈。结扎时看见后肢抽动,神经轻度凹陷即可,最后用4号丝线缝合皮肤。
1.2.3 伏核埋管及微量注射CCI大鼠腹腔注射戊巴比妥钠(45 mg/kg)麻醉,将其固定于脑立体定位仪,根据大鼠脑定位图谱确定伏核定位点(B:+1.7 mm,L or R:1.6 mm,V:7.0 mm。B:前囟向前(+)或向后(-),L or R:中线旁开,V:颅骨平面向下)。标记位点,用骨钻在标记点钻孔,将外径0.8 mm的不锈钢套管垂直插入,并用牙科水泥固定套管。
术后大鼠恢复2~3 d后进行伏核内微量注射。注射前,每只后爪分别测量3次HWL和HWT,取平均值作为基础值,伏核内注射15,30,45,60 min后分别测量双侧HWL和HWT,将给药后不同时间点的HWL和HWT换算成变化百分率,即:

实验结束后,对伏核注射位点进行鉴定,经鉴定注射位点在大鼠伏核组织内的数据方可纳入统计,见图1。
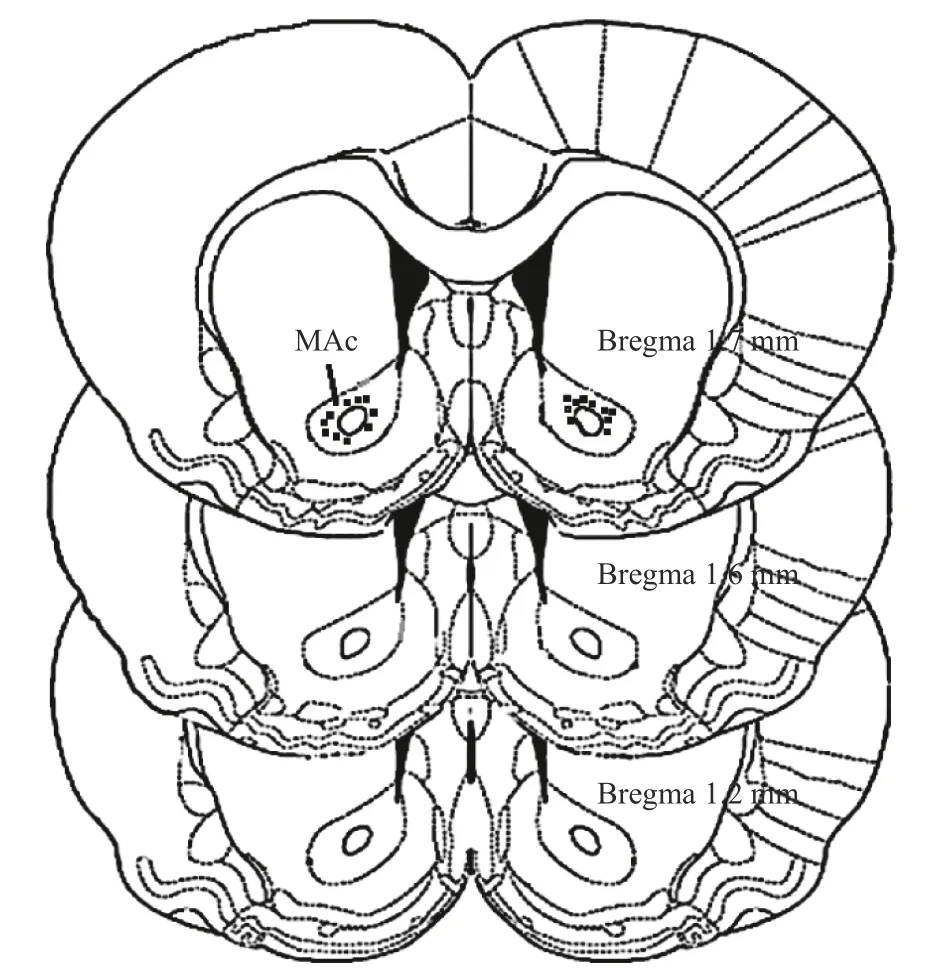
图1 伏核定位图Fig.1 Illustration of the location of the injection needle tips
1.2.4 小针刀疗法为了将CCI大鼠随机分为3组,针刀治疗后分别进行伏核内注射1 μL:(1)生理盐水作为对照组(n=7);(2)1 nmoL的甘丙肽非特异性阻断剂Galantide(n=6);(3)2 nmoL的Galantide(n=6)。研究CCI大鼠伏核神经细胞的甘丙肽及其受体是否介导针刀疗法对神经痛的镇痛作用。随后,为了进一步研究GalR2的激活是否介导了针刀干预神经痛的作用,将CCI大鼠随机分为2组,针刀治疗后分别进行伏核内注射(1)1 μL乙腈(6%)作为对照组(n=8);(2)2 nmoL的 GalR2特异性阻断剂M871(n=8)。
针刀治疗时对大鼠进行触诊,在其坐骨神经结扎周围找到条索状物并用龙胆紫定点,每次选1~2个点,常规备皮、消毒,用针刀纵向疏通及横向剥离周围组织,出针后以消毒棉签按压针眼孔片刻后,在腿部肌肉注射 0.2 mL 青霉素钠(80万U),以预防感染。每周治疗1次,共3次。
1.2.5 蛋白质印迹法将CCI大鼠随机分为3组:治疗组(n=3),CCI大鼠在造模第10天行针刀干预治疗,每周1次,连续3次;模型组(n=3),仅左侧坐骨神经结扎造模,不进行针刀干预治疗;对照组(n=3),CCI大鼠在造模第10天仅针刀插入,不行纵向疏通及横向剥离。在第3次针刀干预术后取各组大鼠双侧伏核组织,Western blot(WB)法检测伏核神经细胞GalR2(兔多克隆抗体,1∶2 000,Abcam,英国)的表达水平,并且以 GAPDH(鼠单克隆抗体,1∶10 000,CST,美国)为内参作为对照,用 Image J 软件分析条带,表达结果重复3次以上。数据采用单因素方差分析进行统计,
1.3 统计学处理
数据以均数±标准误(mean ± S.E.M.)表示,应用GraphPad Prism 5 软件进行统计分析。组间差异采用双因素方差分析(Two-way analysis of variance)或单因素方差分析(One-way analysis of variance)进行组间比较。检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 CCI大鼠伏核内注射甘丙肽非特异性阻断剂Galantide对针刀疗法镇痛作用的影响
与“针刀治疗+生理盐水”对照组相比,CCI大鼠伏核内注射2 nmoL的Galantide可明显减弱针刀治疗引起的HWL(左侧:P< 0.001;右侧:P< 0.05)和HWT(左侧:P< 0.01;右侧:P<0.05)的延长,但注射1 nmoL的Galantide差异没有显著性(P> 0.05)。如图2所示,组间比较采用双因素方差分析方法比较。该结果表明CCI大鼠伏核甘丙肽受体的激活可能介导针刀干预神经痛的镇痛作用。
2.2 针刀干预对CCI大鼠伏核神经细胞GalR2表达的影响
如图3所示,与模型组及对照组相比,针刀治疗组大鼠伏核神经细胞GalR2的表达增加(P<0.01),但比较模型组和对照组GalR2的表达,差异没有显著性(P> 0.05)。数据采用单因素方差分析进行统计。以上实验结果提示提示针刀治疗神经痛可能通过激活伏核神经细胞GalR2来介导完成。

图3 针刀干预对CCI大鼠伏核神经细胞GalR2表达的影响Fig.3 Effect of needle knife therapy on GalR2 expression in NAc of CCI rats
2.3 CCI大鼠伏核内注射GalR2的特异性阻断剂M871对针刀镇痛作用的影响
与“针刀治疗+乙腈”对照组相比,CCI大鼠伏核内注射2 nmoL的 M871可明显减弱针刀治疗引起的HWL(左侧:P< 0.001;右侧:P< 0.001)和HWT(左侧:P< 0.001;右侧:P< 0.01)的延长,如图4所示,差异采用双因素方差分析方法比较。该结果进一步表明CCI大鼠伏核神经细胞GalR2的激活介导针刀干预对神经痛的镇痛作用。
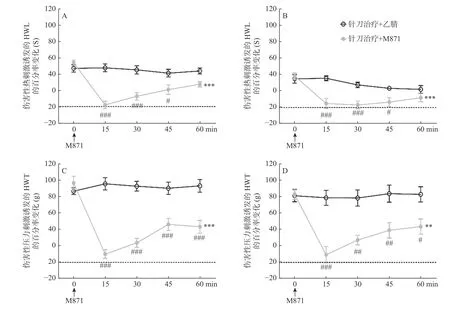
图4 CCI大鼠伏核内注射M871对针刀镇痛作用的影响Fig.4 Effects of intra-NAc injection of M871 on the analgesia of needle knife in CCI rats
3 讨论
目前临床治疗神经病理性疼痛的药物副作用明显,因而大大限制了它们的应用。寻找持续有效且具有临床应用前景的治疗手段或药物,阐明其作用机制,已成为目前亟待解决的问题。
小针刀疗法是中西医结合的一种疗法,它既保留了传统医学的优势,又采用了现代医学的优点,可以起到某些切开手术和针灸难以单独达到的治疗效果。大量的临床研究资料表明小针刀治疗对改善诸如椎管狭窄、椎间盘突出症、带状疱疹后神经痛等所致的疼痛症状和功能障碍疗效显著[13-19]。但有关小针刀疗法的实验研究尚处于起步阶段,小针刀疗法对神经病理性痛的镇痛作用及其作用机制尚未得到明确的阐释。因而限制了其在临床的推广和应用。研究显示针刀治疗能使第3腰椎横突综合征动物模型局部组织中的白细胞介素(interleukin,IL)-6、IL-10、肿瘤坏死因子(tumor necrosis factor,TNF)-α、转化生长因子(transforming growth factor,TGF)-β等炎性细胞因子产生,从而改善局部炎症反应[20]。郭长青等[5]报道针刀治疗可促进内源性阿片肽前体基因的表达,从而合成和释放更多的内源性阿片肽,参与针刀治疗的中枢镇痛作用。针刀松解法在治疗坐骨神经结扎大鼠过程中,能促进中枢β-内啡呔、亮氨酸-脑腓呔释放[5]。这些研究提示,针刀疗法可能通过促进内源性镇痛物质的释放,从而参与镇痛。
甘丙肽是一种重要的神经肽,越来越多的研究表明甘丙肽在痛觉调制中具有重要作用。笔者所在实验室前期的研究发现在正常大鼠、炎症痛大鼠及CCI大鼠伏核内注射甘丙肽具有明显的镇痛作用[7,21-22]。本实验研究探索针刀疗法是否通过促进伏核神经细胞甘丙肽的释放来干预神经痛。
甘丙肽在痛觉调制中的作用可能和甘丙肽作用于不同的GalR有关。研究报道与正常大鼠比较,在鹿角菜碱所致炎症痛大鼠与CCI大鼠,伏核神经细胞甘丙肽、GalR1和GalR2的表达都上调[6,7,22-23],表明伏核神经细胞甘丙肽及其受体在痛觉调制中具有重要作用。本实验研究结果首先发现,与“针刀治疗+生理盐水”对照组比较,CCI大鼠针刀治疗后伏核内注射GalRs的共同阻断剂Galantide(“针刀治疗+Galantide”)明显减弱针刀对CCI大鼠的镇痛作用,且呈剂量依赖性(图2)。先前的研究报道在CCI大鼠伏核内注射GalR2的特异性激动剂M1145具有镇痛作用,而注射M1145后再注射GalR2的特异性拮抗剂M871则能逆转M1145引起的镇痛作用,表明伏核神经细胞GalR2的激活对CCI大鼠具有镇痛作用[23]。本实验研究发现CCI大鼠行针刀治疗后伏核神经细胞GalR2的表达增加(图3),并且在对CCI大鼠行针刀干预治疗后,于伏核内注射M871(针刀治疗+M871)阻断GalR2的激活,结果发现与“针刀治疗+乙腈”对照组比较,针刀治疗后伏核内注射M871削弱了针刀对CCI大鼠的镇痛作用(图4),这些结果提示伏核神经细胞GalR2的激活在针刀干预神经痛中具有重要作用。
综上所述,CCI大鼠伏核内注射Galantide阻断甘丙肽受体后能削弱针刀治疗神经痛的作用;且针刀治疗引起CCI大鼠伏核神经细胞GalR2的表达上调,CCI大鼠伏核内注射GalR2的特异性阻断剂M817明显减弱了针刀疗法对神经痛的镇痛作用,这些研究都提示在CCI大鼠,针刀干预可能通过促进伏核神经细胞甘丙肽的释放,进而激活GalR2介导来针刀对神经痛的镇痛作用,但有关GalRs的激活介导针刀对神经痛的镇痛作用机制,有待进一步深入研究。
