乙酸-亚硫酸盐两步预处理对杨木木质素吸附纤维素酶的影响
2021-10-20王金叶贾丽丽徐勇张军华
王金叶,贾丽丽,徐勇,张军华,*
(1. 西北农林科技大学林学院,陕西 杨凌 712100;2. 南京林业大学化学工程学院,南京 210037)
杨树生长迅速,分布广泛,是我国最主要的造林树种。在杨木生产过程中所产生的刨花锯末等废弃物是一种优良的木质纤维材料,其可以通过纤维素酶水解糖化进而利用微生物发酵制备生物燃料,可减少对化石燃料的依赖[1]。木质纤维素由纤维素、半纤维素和木质素所构成,半纤维素覆盖在纤维素微纤丝表面,通过氢键相互连接,而木质素则通过共价键与半纤维素相连,形成稳定的疏水结构[2]。木质素是纤维素酶水解的主要障碍物,其覆盖在纤维素表面形成物理屏障,且对纤维素酶产生无效吸附,使纤维素酶酶解效率降低[3-4]。因此,为提高纤维素酶水解效率,通常需要将木质纤维原料进行预处理,以破坏其致密的结构,脱除半纤维素和木质素,提高纤维素酶的可及性[5-6]。
Wen等[7]研究表明,采用5%(体积分数)的乙酸在170 ℃下处理杨木可以高效制备低聚木糖,但是预处理后杨木中残留的木质素含量(质量分数)高达35.6%,当酶剂量为20 FPU/g干物质量(DM)时,预处理后杨木的纤维素水解得率仅22.5%。因此,想要提高乙酸预处理后杨木的纤维素酶解率,需进一步脱除残留的木质素。碱性亚硫酸盐预处理技术广泛应用在制浆造纸工业中,其对木质素的脱除效率较高[8]。因此,采用乙酸预处理杨木制备低聚木糖后,再经亚硫酸盐预处理移除木质素,可提高杨木纤维素的转化率。经过两步预处理后杨木样品中剩余木质素的结构和分布发生变化,这可能会引起木质素对纤维素酶的吸附及抑制特性发生改变。
笔者在前期的研究中已证实乙酸预处理会增强木质素对纤维素酶水解的抑制作用[9],而亚硫酸盐二次预处理后木质素对纤维素酶水解的影响有待进一步探究。为探明二次预处理对杨木的酶解效率以及对杨木木质素非生产性吸附纤维素酶的影响,分离了乙酸-亚硫酸盐两步预处理前后的杨木木质素,并运用凝胶渗透色谱(GPC)、二维异核单量子关系核磁(HSQC-NMR)、定量磷谱(31P NMR)等技术分析了木质素在两步预处理过程中的结构和理化性质的变化,考察了预处理后杨木纤维素酶解率以及两步预处理对木质素吸附/脱附纤维素酶的影响。
1 材料与方法
1.1 试验材料
杨木(PopulusL.)屑产自江苏宿迁。首先将杨木屑进行粉碎、过60目筛(孔径为0.3 mm)制备杨木粉备用。用有机溶剂(甲苯和乙醇体积比为2∶1)对杨木粉脱蜡6 h,将剩余固体在45 ℃下通风干燥24 h。经测定杨木的化学组成(质量分数)为:46.33%葡聚糖、18.25%木聚糖和29.83%木质素(其中包含25.12%的酸不溶木质素和4.71%的酸溶木质素)。参照文献[10]报道的球磨条件,对上述脱蜡后的杨木粉进行球磨,制得球磨后杨木样品(BM-poplar)。
商品纤维素酶Cellic Ctec2,购自丹麦Novozyme公司,其酶活为137.8 FPU/mL;微晶纤维素Avicel PH-101、木聚糖酶(来自Aspergillusoryzae)、蛋白酶(来自Streptomycesgriseus)、葡萄糖、氯仿-d1、二甲基亚砜-d6、2-氯-4,4,5,5-四甲基-1,3,2-二氧磷杂环戊烷、环己醇、乙酰丙酮铬(Ⅲ)、吡啶、乙酸酐以及乙酸,购自美国Sigma-Aldrich公司;蛋白检测试剂盒(二喹啉甲酸,BCA法)购自上海碧云天生物技术公司。
1.2 杨木预处理
将BM-poplar和5%(体积分数)乙酸按照固液比1∶10(g∶mL)在170 ℃反应30 min,反应结束后,将反应釜迅速冷却至20 ℃。采用真空抽滤收集反应剩余固体,并用蒸馏水将其洗至中性,最后将固体部分冻干即得到乙酸预处理后的杨木样品(AA-poplar)。
参照文献[8]报道的条件,采用碱性亚硫酸盐对AA-poplar进行第2步预处理。具体操作如下:将AA-poplar与含有1%(质量分数)的氢氧化钠和4%(质量分数)的亚硫酸钠的水溶液按照固液比1∶10(g∶mL)在121 ℃下反应60 min。反应结束后,用真空抽滤收集剩余固体,并用蒸馏水将其洗至中性,最后将固体剩余物冻干即得到乙酸-亚硫酸盐两步预处理后的杨木样品(AA-AS-poplar)。参照文献[11]分析预处理后杨木样品的化学组分,结果为2次重复测定的平均值。
1.3 杨木的X射线光电子能谱分析
采用Escalab 250Xi型X射线光电子能谱仪(XPS,美国Thermo Fisher Scientific)对杨木样品表层(2~10 nm)碳原子的化学环境进行检测,且样品表面木质素的覆盖率S木质素按下式计算[12]:
S木质素=[n(O/C)-0.83]/(0.33-0.83)×100%
(1)
式中:n(O/C)为XPS测得的杨木样品表面的氧碳比;0.83为n(O/C碳水化合物)值;0.33为n(O/C木质素)值。
1.4 木质素的制备
用纤维素酶(60 FPU/g DM)和木聚糖酶(299.4 U/g DM)在50 ℃下水解杨木样品(BM-poplar和AA-AS-poplar)72 h,重复3次,水解结束后,5 000 r/min下离心5 min得到固体残渣。将上述水解残渣均匀分散在pH 7.0的磷酸缓冲液中配成固含量为5%(质量分数)的物料体系,添加蛋白酶(20 U/g DM)在37 ℃水解24 h。水解结束后,用蒸馏水对水解残渣进行充分洗涤,然后5 000 r/min下离心5 min得到固体残渣,冻干后即得到BM-poplar和AA-AS-poplar的酶解残渣。经测定,AA-AS-poplar的酶解残渣中的木质素含量大于93%,无须进一步提取纯化,直接将其作为乙酸-亚硫酸盐预处理后的木质素样品(AA-AS-lignin)进行后续实验。参照文献[13]报道的提取方法,采用二氧六环(二氧六环和水体积比为96∶4)从BM-poplar的酶解残渣中提取分离得到木质素样品(BM-lignin)。
1.5 纤维素酶水解实验
在预处理后的2%(质量分数)杨木样品中分别添加5,10和20 FPU/g DM的纤维素酶,并在pH 5.0、50 ℃的条件下水解48 h。待水解完成后,用高效液相色谱(HPLC)测定水解上清液中的葡萄糖含量。实验结果为2组平行实验的平均值。
为考察预处理后杨木木质素对纤维素酶水解的影响,将BM-lignin和AA-AS-lignin分别添加到2%(质量分数)Avicel的酶解体系中,在50 ℃下水解6~48 h,其中木质素的添加量为200 mg/g纤维素,纤维素酶剂量为10 FPU/g纤维素。待水解完成后,于5 000 r/min下离心10 min取上清液,采用HPLC测定上清液中的葡萄糖含量。实验结果为2组平行实验的平均值,且标准误差以误差线显示。
1.6 纤维素酶吸附实验
将不同含量的纤维素酶(24~480 mg/g 木质素)与1%(质量分数)木质素在pH 5.0、4 ℃、磁力搅拌的条件下平衡1 h。然后,将固液两相离心分离(4 ℃、5 000 r/min、10 min),上清液中游离蛋白含量的测定方法参照文献[9]。木质素吸附的酶蛋白量为初始添加的酶蛋白量与上清液中游离蛋白量的差值。根据Langmuir吸附等温线方程可计算得到木质素对纤维素酶的吸附参数[13]。实验结果为2组平行测定的平均值,标准误差以误差线显示。
1.7 纤维素酶脱附实验
将1%(质量分数)木质素与纤维素酶(480 mg/g木质素)在4 ℃下进行吸附-脱附实验,具体操作流程及纤维素酶脱附回收率计算公式见文献[14]。采用蛋白质量检测BCA法测定所得到的吸附和脱附上清液中的蛋白含量。将最终所得的固体残渣(木质素-纤维素酶复合物)分成2等份,其中一份作为纤维素酶源于50 ℃水解1%(质量分数)Avicel 48 h,待水解结束后,用HPLC测定上清液中的葡萄糖含量;另一半用于氮元素分析。采用有机元素分析仪(德国Elementar Analysen systeme GmbH)对木质素-纤维素酶复合物中的氮元素含量进行测定,测试结果为2组重复测定的平均值。
1.8 木质素的表征
将木质素粉末与乙酸酐/吡啶混合液(体积比1∶1)按照固液比25∶1(mg∶mL)混合,在室温、磁力搅拌的条件下反应24 h将木质素乙酰化[15],然后将乙酰化的木质素溶解到四氢呋喃溶剂中,采用GPC测定木质素的分子量。流动相为四氢呋喃,流速为1.0 mL/min,所用的凝胶渗透色谱仪型号为Waters1525(美国Waters),检测器为Waters 2414示差折光检测器,色谱柱型号为Agilent PL gel 5 μm MIXED-C(美国Agilent)。
取50 mg木质素溶解于1 mL DMSO-d6,将溶解好的样品转移至直径为5 mm的核磁管中待测。采用500 MHz的AVIII核磁波谱仪(瑞士Bruker)对木质素进行HSQC-NMR分析。参数设置为:标准脉冲序列“hsqcetgpsi”;1H维度的采样点数为1 024,13C维度的采样点数为256;弛豫时间为1.5 s(D1),累加(NS)64次。以环己醇作为内标,采用定量31P NMR对木质素的各类羟基含量进行测定[16]。测试条件:脉冲延迟时间25 s,累积次数192次。采用TopSpin 3.5软件对核磁谱图进行定量积分计算。
采用有机元素分析仪测定木质素样品的硫元素含量,测试结果为3次重复测定的平均值。木质素的Zeta电位和疏水性的测定步骤见文献[14]。
2 结果与分析
2.1 预处理后杨木的化学组分及酶水解
杨木经乙酸预处理可以高效制备低聚木糖[7]。预处理后杨木的化学组分见表1。乙酸预处理对木质素的脱除效果较差。为进一步有效脱除乙酸预处理后杨木中的剩余木质素,对其进行了亚硫酸盐第2步预处理。结果显示,亚硫酸盐预处理后残渣中木质素的含量(质量分数,下同)从34.23%减少到26.75%,这可能是因为木质素以木质素磺酸盐的形式溶出[17]。经过乙酸-亚硫酸盐两步预处理后,杨木木聚糖的含量从18.25%降低到0.65%。这说明在乙酸-亚硫酸盐两步预处理过程中杨木半纤维素大量溶出。随着木质素和木聚糖含量的减少,葡聚糖的相对含量从46.33%增加到72.60%。
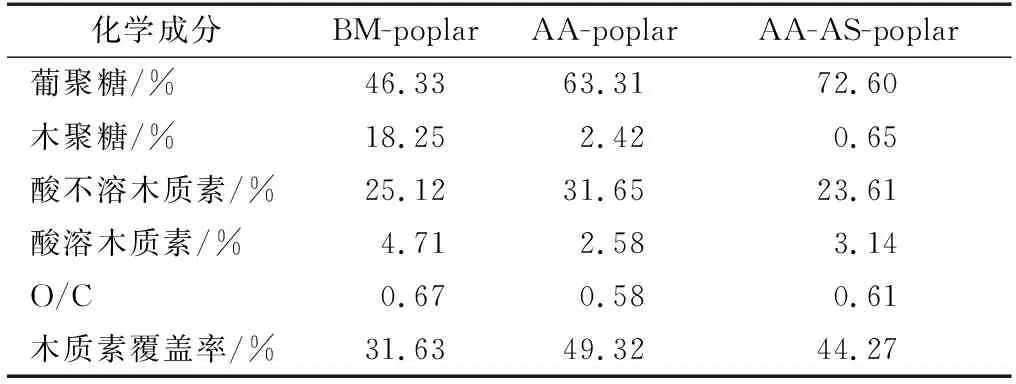
表1 预处理后杨木的化学组分Table 1 Chemical compositions of poplar after pretreatment

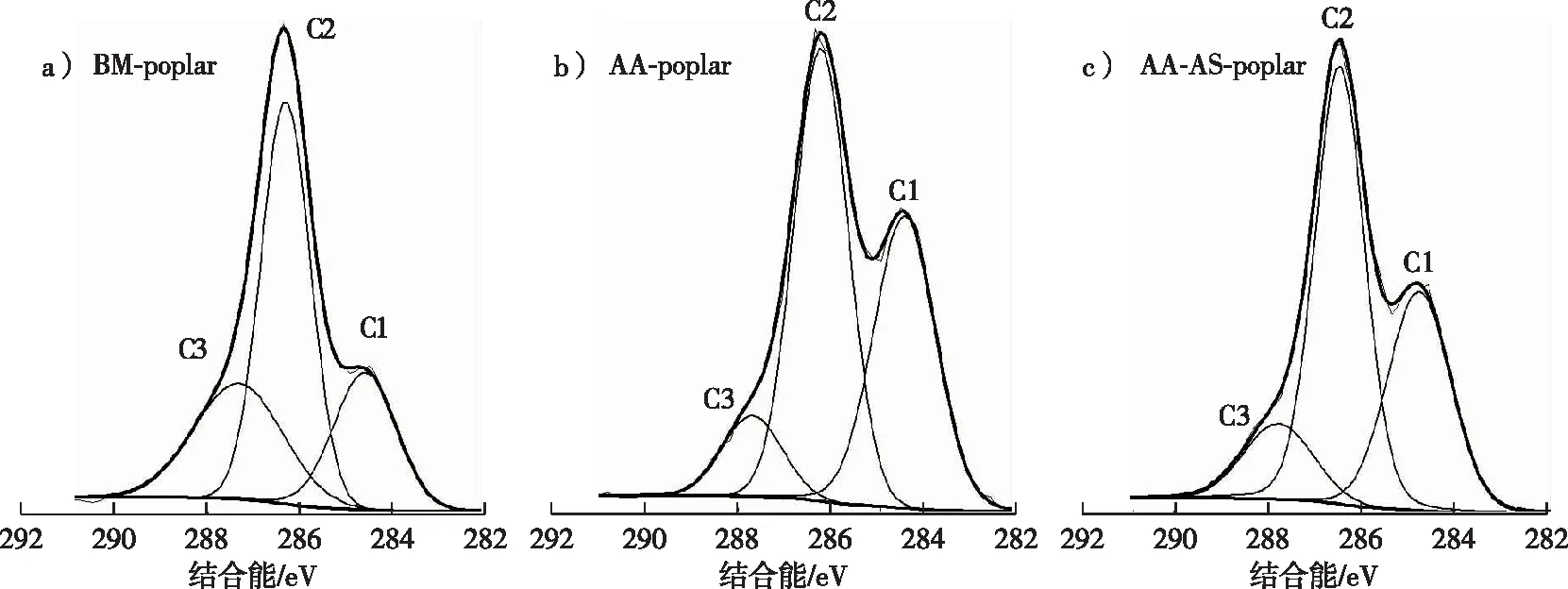
图1 预处理后杨木的XPS谱图Fig. 1 XPS spectras of poplar samples after pretreatment
乙酸-亚硫酸盐两步预处理后杨木水解的葡萄糖得率有明显的提高,当酶剂量为20 FPU/g DM时,葡萄糖得率可达到67.1%,而在同等条件下BM-poplar水解的葡萄糖得率仅为32.4%。这归因于第2步预处理后杨木中的木聚糖和木质素得到了进一步的脱除,增加了纤维素的可及性。尽管两步预处理对木质素的脱除效果有限,而且AA-AS-poplar样品表面的木质素覆盖率高达44.27%(表1),但是两步预处理后杨木的水解得率仍然有明显提高,这说明预处理后木质素在原料中的分布以及结构变化均会对原料的纤维素酶水解产生影响。然而,在酶增加到20 FPU/g DM时AA-AS-poplar的水解得率仍未超过70%。因此,有必要对乙酸-亚硫酸盐两步预处理后杨木木质素的化学结构及理化性质进行表征,进而探明其对纤维素酶水解的影响。
2.2 木质素的表征
木质素样品的化学组分分析表明,两种木质素样品的纯度较高,木质素含量均大于93%。其中,BM-lignin含有少量的葡聚糖(0.7%)和木聚糖(1.8%),可能是因为木质素-碳水化合物连接键在球磨及酶水解过程中不易断裂[5]。AA-AS-lignin是未经有机溶剂萃取的酶解残渣,因而有少量的葡聚糖(1.3%)以及木聚糖(0.6%)残留。木质素分子量测定结果显示,乙酸-亚硫酸盐两步处理后木质素的重均分子量(Mw)和数均分子量(Mn)分别从12 211和6 372 g/mol(BM-lignin)降低到了1 206 和844 g/mol,推测是因为在预处理过程中木质素的醚键大量断裂[19],而且木质素以木质素磺酸盐的形式溶出[17]。此外,乙酸-亚硫酸盐两步预处理后木质素分子量分散系数(PDI)从1.91减小至1.43,说明预处理使木质素的分子量大小变得更加均一。
采用HSQC-NMR对木质素样品的结构单元及连接键进行定量分析(图2)。木质素的主要结构单元和连接键分别在HSQC谱图的芳环区(δ100.0~140.0/6.0~8.0)和侧链区(δ50.0~90.0/2.5~6.0)进行定量计算[15],计算结果列于表2中。
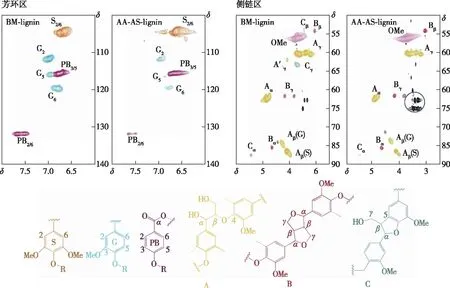
图2 木质素的二维HSQC核磁谱图Fig. 2 HSQC-NMR spectras of lignin

表2 采用二维HSQC核磁分析得到的木质素子结构的相对含量Table 2 Quantitative information of lignin substructures by HSQC-NMR analysis
在HSQC谱图的芳环区,木质素的紫丁香基(S)、愈创木基(G)和对羟苯基(PB)单元的相对含量分别由S单元的C2,6—H2,6相关信号、G单元的C2—H2相关信号以及PB单元的C2,6—H2,6相关信号进行积分计算。其中,各结构单元的含量是被测结构单元占S和G单元总数的百分数。由表2可知,乙酸-亚硫酸盐两步预处理后木质素的S单元增加,而G单元的含量减少,因而S/G值从1.4(BM-lignin)增加到4.0(AA-AS-lignin),而PB单元的含量随着S/G的增加而减少。在木质素的侧链区,采用β-O-4醚键(A)、树脂醇结构(β-β,B)以及苯基香豆满结构(β-5,C)的α位碳氢相关信号(Cα-Hα)进行积分计算各连接键的相对含量。其中,各连接键的含量是指被测连接键占β-O-4、β-β和β-5总数的比例。乙酸-亚硫酸盐两步预处理后木质素的β-O-4醚键减少,而β-β和β-5的相对含量增加。这是因为在酸性或者碱性环境的高温预处理过程中,木质素醚键的断裂会伴随着木质素碎片的再缩合反应发生[19]。结合木质素的分子量数据,推测在两步预处理过程中木质素的解聚和缩合同时发生,而解聚反应占据主导地位,最终导致木质素的分子量减小。另外,在AA-AS-lignin的侧链区可以看到木聚糖及葡聚糖的相关信号(图2),位于δ72.8~75.2/3.2~3.5。这是由于AA-AS-lignin是未经有机溶剂萃取提纯的酶解残渣,其中的碳水化合物比如葡聚糖含量相对较高。
以环己醇为内标,对磷化后的木质素样品进行定量磷谱分析(图3),谱图的归属情况见前期报道[9]。结果显示,乙酸-亚硫酸盐两步预处理后木质素的脂肪族羟基含量减少,而酚羟基(S—OH、G—OH及PB—OH)的含量明显增加(表3),这可能是由于木质素β-O-4醚键断裂后形成了新的酚羟基[13]。乙酸-亚硫酸盐两步预处理后随着木质素S—OH和G—OH的含量增加,PB—OH的含量则从0.45 mmol/g降低到0.08 mmol/g,这与表2中木质素PB单元的相对含量的变化趋势一致。此外,AA-AS-lignin的谱图中可以看到一些杂峰位于δ144~145,这可能是木质素样品中残留多糖的羟基峰[16]。
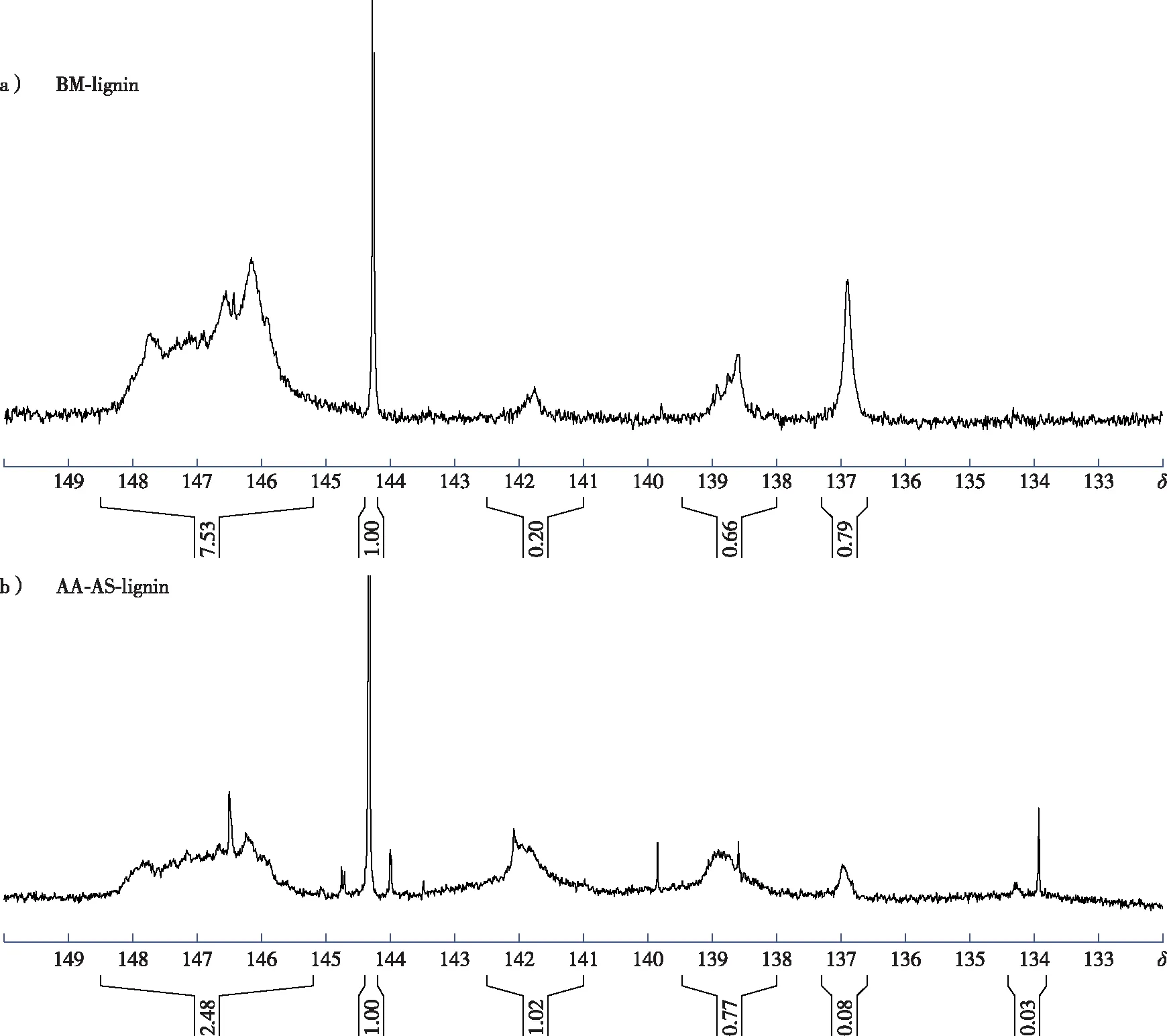
图3 木质素的定量磷谱图Fig. 3 Quantitative 31P NMR spectra of lignin
木质素的静电特性和疏水性会影响其对纤维素酶的吸附能力[20]。两个木质素在水相环境下均带负电荷,且两步预处理后木质素的Zeta电位从-47.63 mV(BM-lignin)略降低到-44.23 mV(AA-AS-lignin)。据报道,木质素羟基和羧基可以在水相环境下解离而带负电荷[21]。与BM-lignin(0.05%)相比,AS-AA-lignin的硫元素含量增加到0.76%,说明亚硫酸盐预处理后木质素中发生了磺化。因而AS-AA-lignin的负电荷可能来自于磺酸基、羟基和羧基的解离。木质素基团的解离能力与其所处化学环境有关[21],故而乙酸-亚硫酸盐两步预处理后木质素Zeta电位略降低的原因是很可能与其脂肪族羟基、酚羟基、羧基和磺酸基含量变化有关(表3)。未预处理的BM-lignin的疏水性较高为3.7 L/g,而经过两步预处理后木质素的疏水性降低至0.89 L/g。木质素的疏水性基团(如甲氧基和芳基等)和亲水性基团(如羟基和羧基等)的比例决定其总的疏水性大小。因此,预处理后木质素官能团的形成与消去会影响其整体疏水性的大小。BM-lignin较高的疏水性表明杨木的原本木质素含有较多的疏水性基团。AA-AS-lignin疏水性的降低可能是由于木质素侧链断裂之后形成了大量的亲水性官能团,如羟基和羧基(表3)。此外,木质素的磺化也会降低其疏水性[8,22]。

表3 采用定量磷谱对木质素各羟基含量的测定结果Table 3 Quantitative information on OH groups in lignin by a quantitative 31P NMR method mmol/g
2.3 木质素对纤维素酶水解的影响
一般认为,从球磨后的木质纤维原料中分离得到的木质素样品保留了原料中木质素的结构特征[13]。结果表明,添加BM-lignin后Avicel水解的葡萄糖得率几乎没有降低,而添加AA-AS-lignin后对Avicel酶水解的抑制率达到了16.5%(图4)。Kellock等[23]的研究表明纤维素酶对原本木质素的吸附能力较弱,这可以解释BM-lignin对纤维素酶水解较弱的抑制作用。然而,乙酸-亚硫酸盐两步预处理后木质素对纤维素酶水解的抑制作用明显增强。据报道,木质素磺酸盐可以表现出表面活性剂的特性,通过静电斥力减少木质素对纤维素酶的非生产性吸附,进而促进纤维素酶水解[17]。尽管AA-AS-lignin也被磺化,但是AA-AS-lignin却表现出较强的抑制作用,导致二者对纤维素酶水解产生不同影响的原因很可能是其结构差异较大。木质素磺酸盐是亚硫酸盐预处理水解液中的游离态木质素衍生物,而AA-AS-lignin是经过乙酸-亚硫酸盐两步预处理后的剩余木质素固体残渣。两步预处理过程中木质素分子侧链的断裂产生的大量酚羟基很可能是导致其抑制作用增强的原因之一[13]。此外,AA-AS-lignin较高的S/G比值也可能是导致其对纤维素酶水解抑制增强的原因[24-25],究其原因可能是木质素S单元比G单元对纤维素酶水解有更显著的抑制效果[24]。
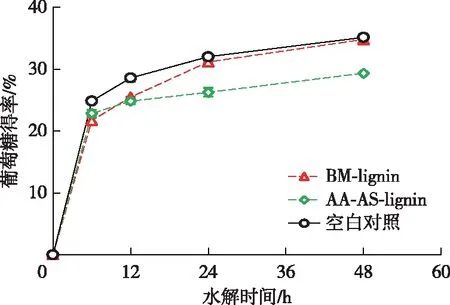
图4 木质素对纤维素酶水解的影响Fig. 4 Effects of lignin on enzymatic hydrolysis of cellulose
2.4 木质素对纤维素酶的吸附
木质素对纤维素酶的吸附符合Langmuir吸附等温线(决定系数R2>0.8)(图5)。BM-lignin的最大吸附容量(Pads,m)为55.7 mg/g,而AA-AS-lignin的Pads,m则增大到了175.0 mg/g,表明两步预处理后木质素对纤维素酶的吸附位点增多。结合强度是由Pads,m乘以吸附平衡常数(Kp,BM-lignin为0.44,AA-AS-lignin为0.41)所得,它可以更加全面地反映木质素对纤维素酶的吸附强度。两步预处理后木质素的结合强度从24.7 mL/g(BM-lignin)增大到72.1 mL/g。木质素的疏水性被认为是其吸附纤维素酶的主要推动力[20],而带负电荷较多的木质素与纤维素酶之间存在较强的静电斥力[17,20]。
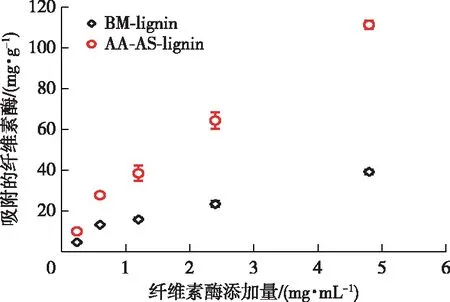
图5 木质素对纤维素酶的吸附等温线Fig. 5 Adsorption isotherm of cellulase on lignin
实验结果显示,虽然AA-AS-lignin有较低的疏水性,但是却表现出较大的吸附纤维素酶的能力。另外,AA-AS-lignin和BM-lignin的Zeta电位很接近,但是二者却表现出不同的纤维素酶吸附能力,说明乙酸-亚硫酸盐预处理后木质素的疏水性和Zeta电位不是影响其对纤维素酶吸附能力的主导因素。据报道,木质素发生磺化后所带的磺酸基与带负电的纤维素酶之间可产生较强的静电斥力,进而缓解其对纤维素酶的吸附[8],然而,被磺化的AA-AS-lignin却表现出较大的纤维素酶吸附能力。结合木质素羟基官能团的分析结果(表3),推测导致AA-AS-lignin对纤维素酶吸附能力增强的原因很可能是两步预处理后木质素的酚羟基含量的增多(表2),因为木质素酚羟基的增加会使其对纤维素酶的吸附能力增强[13,22]。
2.5 木质素对纤维素酶的脱附
木质素脱附纤维素酶的定量分析结果见表4。当20.0 mg的木质素与9.6 mg的纤维素酶在4 ℃下平衡60 min后,约有0.39和1.11 mg的纤维素酶分别被BM-lignin和AA-AS-lignin吸附。采用新鲜的缓冲液对木质素吸附的纤维素酶进行洗脱,纤维素酶的回收率分别达到61.1%和28.8%,说明两步预处理后木质素对纤维素酶的脱附能力降低。吸附-脱附之后所得的木质素-纤维素酶复合物中氮元素含量的高低可以间接地反映木质素表面吸附的酶量多少[23]。由表4可知,AA-AS-lignin与纤维素酶复合物的氮元素含量较高,这进一步证实了两步预处理后木质素对纤维素酶的脱附能力降低。以木质素-纤维素酶复合物作为酶源对Avicel进行水解,并测定葡萄糖得率。结果表明,尽管AA-AS-lignin结合了较多的纤维素酶,但是采用AA-AS-lignin-纤维素酶复合物水解Avicel却获得较低的葡萄糖得率(3.0%)(表4)。木质素-纤维素酶复合物的酶活损失可能是归因于木质素与纤维素酶之间较强的结合力,这会导致纤维素酶与纤维素有效接触的机会减少[23]。因而AA-AS-lignin与纤维素酶较强的结合强度可能是导致AA-AS-lignin-纤维素酶复合物水解能力较低的原因。
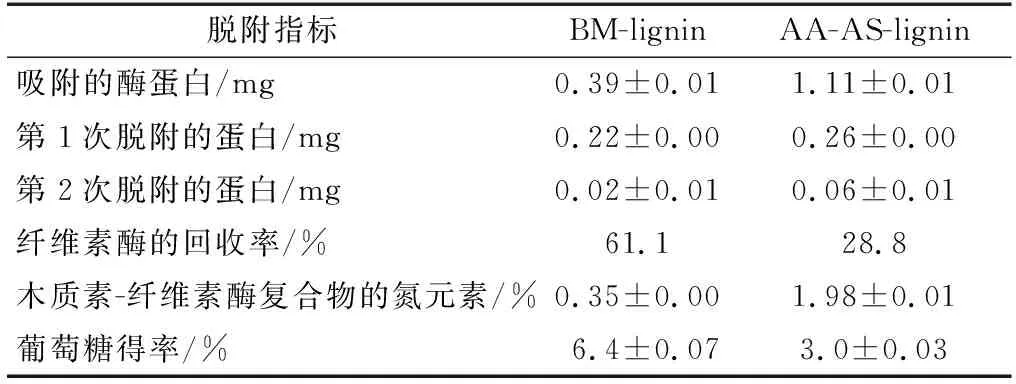
表4 木质素对纤维素酶的脱附Table 4 Desorption of cellulase from lignin
3 结 论
采用亚硫酸盐对乙酸预处理后的杨木残渣进行二次预处理,重点探究了乙酸-亚硫酸盐两步预处理对杨木化学组分、酶水解率、残渣中木质素的结构及其对纤维素酶的吸附和抑制的影响。主要的结论如下:
1)乙酸-亚硫酸盐两步预处理后杨木的木质素含量减少,预处理后杨木的水解得率从32.4%提高到67.1%。两步预处理使木质素严重降解,预处理后木质素发生磺化并且其S/G比值及酚羟基含量增加。两步预处理后木质素对纤维素酶的结合强度从24.7 mL/g增大到72.1 mL/g,而其对纤维素酶的脱附能力降低,预处理后木质素对纤维素酶水解的抑制率从1.0%增至16.5%。
2)乙酸-亚硫酸盐两步预处理后杨木中剩余木质素对纤维素酶的非生产性吸附及空间阻碍都对后续的纤维素酶水解不利。相比草本原料,阔叶材杨木的纤维结构更为致密坚硬,致使其木质素更难脱除。另外,在170 ℃的高温乙酸预处理过程中会形成大量的木质素缩合结构。以上都可能是导致乙酸-亚硫酸盐预处理后杨木木质素脱除率低,进而使预处理后杨木纤维素水解率低的主要原因。因而,为实现杨木的多组分高效转化利用,第2步亚硫酸盐预处理的条件(如乙酸及亚硫酸盐两步预处理的温度和试剂浓度等)需要继续优化。
