阿托伐他汀对急性肺栓塞大鼠SIRT2/NF-κB通路及动脉血气指标的影响
2021-10-19梁蔚繁李朝锋
梁蔚繁 李朝锋
急性肺栓塞(acute pulmonary embolism,APE)是呼吸科常见的疾病,由外源性或内源性血栓堵塞肺血管引起,起病隐匿,早期难以及时诊断,病情发展迅速,且致死、致残率较高[1,2]。APE后的肺血循环障碍可导致患者肺组织缺血、缺氧,引发严重的炎性反应,使得肺组织发生充血水肿,破坏肺部换气功能,造成肺功能障碍[2,3]。SIRT2/NF-κB是机体调控炎性反应的重要信号通路,APE引起的肺组织缺血、缺氧可下调SIRT2表达,抑制NF-κB蛋白去乙酰化,促使其向核内转移,激活促炎因子表达,引发炎症并加快其进展;激活SIRT2信号,可增强NF-κB的去乙酰化,抑制其核移位,进而阻止炎症的发生发展,改善APE诱导的肺动脉高压、低氧血症和肺功能衰竭症状[4-6],表明SIRT2/NF-κB是治疗APE的作用靶点。阿托伐他汀是一类他汀类药物,具有抗炎、降低胆固醇、改善心血管功能的作用,能显著抑制冠状动脉微栓塞导致的心肌炎性反应,减轻心肌损伤,改善心功能,还可降低APE患者肺动脉平均压,抑制肺血管重构,改善其临床症状[7,8]。但阿托伐他汀对APE大鼠SIRT2/NF-κB通路及动脉血气指标的影响目前还未见明确阐释,本文通过建立APE大鼠模型,对此进行探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级SD大鼠,无锡珊瑚礁生物科技有限公司,许可证号为SCXK(苏)2017-0009,雄性,体重200~240 g。在本院动物房中饲养,温度25℃,相对湿度50%,12 h/12 h交替照明,保证室内环境达到清洁级,且安静、通风良好,具体按照《关于善待实验动物的指导性意见》进行饲养,1周后进行实验。
1.1.2 试剂与仪器:速碧林(低分子肝素钙注射液,规格0.6 ml),葛兰素史克有限公司;阿托伐他汀钙片(规格10 mg),辉瑞制药有限公司;大鼠IL-18 ELISA试剂盒、大鼠IL-6 ELISA试剂盒、兔源Anti-GAPDH、Anti-SIRT2、Anti-NF-κB、Anti-PCNA一抗、羊抗兔二抗—货号ab206386、ab100772、ab100768、ab115681、ab38515、ab18197、ab86299,美国Abcam公司;HE染色试剂盒—货号RS3390,北京金克隆生物技术有限公司;BCA试剂盒、蛋白裂解液—货号P0011、P0013B,上海碧云天公司等。DHX-300动物呼吸机:成都仪器厂,中国;ABL80血气分析仪:雷度米特公司,丹麦;2.7F微导管:泰尔茂株式会社,日本;YP100压力换能器:上海益联医学仪器发展有限公司,中国;PowerLab多导生理记录仪:上海然哲仪器设备有限公司,中国;Elx800酶标仪、1658033小型蛋白垂直电泳转印系统:Bio-Rad公司,美国;RM2035轮转切片机:Leica公司,德国;SMZ745光学显微镜:尼康公司,日本;GelSMART凝胶成像仪:北京大龙兴创实验仪器有限公司,中国。
1.2 方法
1.2.1 大鼠模型制备及分组给药:参照文献[9]制备APE大鼠模型:经SD大鼠尾静脉取血约1 ml,静置使其凝固,置于70℃水浴锅内,加热10 min后,倒入平皿中,将凝固的血液切为小血栓颗粒,直径约0.5 mm,以2.5%戊巴比妥钠溶液腹腔注射,麻醉大鼠,剂量为45 mg/kg,颈部备皮、消毒,分离右颈静脉,以5 ml注射器吸取剪好的血栓27~30个及1 ml 0.9%氯化钠溶液,排除气泡后,刺入颈静脉,循静脉回流方向缓慢推注血栓,用时约5 min,然后缝合伤口,消毒,4 h后,采用改良右心导管法测量大鼠肺动脉平均压(mean pulmonary arterial pressure,mPAP)和右心室压力(right ventricular pressure,RVP),当其明显升高,且大鼠呼吸加深加快、两肺出现弥漫性干湿啰音等症状时,表明建模成功。共建模64只,成功60只,随机分为假手术组、阿托伐他汀低剂量组(1 mg/kg)、阿托伐他汀中剂量组(2 mg/kg)、阿托伐他汀高剂量组(4 mg/kg)、速碧林组(0.01 ml/kg),每组12只,另取12只SD大鼠分离右颈静脉后不输注血栓,只输入1 ml 0.9%氯化钠溶液,其他操作相同,设定为假手术组。参照文献,以0.9%氯化钠溶液溶解阿托伐他汀钙片[10],制备为0.1、0.2、0.4 mg/ml的溶液,阿托伐他汀各剂量组以10 ml/kg的剂量灌胃,速碧林组以0.01 ml/kg的剂量皮下注射低分子肝素钙注射液[11],假手术组及模型组大鼠皮下注射等剂量0.9%氯化钠溶液,同时以10 ml/kg 的剂量灌胃,1次/d,持续14 d。
1.2.2 大鼠mPAP和RVP测定:末次给药结束24 h后,将2.7F微导管经肺动脉、右心房插入右心室,连接压力换能器,测定大鼠mPAP和RVP。
1.2.3 标本采集:大鼠mPAP、RVP测定结束后,参照1.2.1中的方法麻醉大鼠,开胸,钝性分离气管和股动脉,经股动脉取血2 ml备用;剪断股动脉放血,以2 ml注射器刺入气管下段,向其中缓慢注入1ml 0.9%氯化钠溶液,当左肺膨隆,并变苍白时,缓慢回抽,然后再次缓慢注入后回抽,重复3次,所得液体离心5 min(4℃,3 000 r/min),收集上清,可得肺泡灌洗液(bronchoalveolar lavagefluid,BALF),储存在-80℃备用;解剖取出双肺,剪取约0.5 g肺组织,储存于液氮中备用;其余肺组织以生理盐水漂洗、4%多聚甲醛溶液固定、梯度乙醇溶液(由低到高)脱水、二甲苯透明、石蜡包埋后,以切片机做连续病理切片备用,厚度为5 μm。
1.2.4 大鼠动脉血气指标测定:采用全自动血气分析仪检测1.2.2中的股动脉血中血气指标:氧分压(arterial partial pressure of oxygen,PaO2)、二氧化碳分压(arterialpartial pressure of carbon dioxide,PaCO2),具体操作步骤参照其说明书进行。
1.2.5 大鼠肺部病理形态检测:选取1.2.2中完好、典型的切片,进行二甲苯脱蜡、梯度乙醇(从高到低)浸泡处理,参照试剂盒说明书的步骤进行HE染色,以蒸馏水漂洗后,再次脱水、透明,采用中性树胶封片,使用光学显微镜观察大鼠肺部病理形态,每个切片随机选取5个视野拍照。
1.2.6 大鼠BALF中IL-18、IL-6含量测定:中BALF放置在冰水浴中,缓慢解冻,参照ELISA试剂盒说明书中的操作步骤,测定其中IL-18、IL-6含量。
1.2.7 大鼠肺组织SIRT2/NF-κB通路相关蛋白表达检测:取出1.2.2中肺组织,剪碎后置于含有1 ml蛋白裂解液的干净试管中,以匀浆机制备为匀浆液,离心20 min(4℃,3 000 r/min),收集上清液,得蛋白样品液,以BCA法测定其中总蛋白浓度,具体步骤参照试剂盒说明书进行,煮沸5 min变性,各组分别取含20 μg 总蛋白的样品液上样,电泳分离蛋白,湿转转移全部分离蛋白至PVDF膜上,然后以5%的脱脂奶粉室温孵育2 h,进行封闭处理,根据蛋白分子量截取目的蛋白条带,放置在小盒中,做好标记,分别加入兔源Anti-GAPDH、Anti-SIRT2、Anti-NF-κB、Anti-PCNA一抗溶液,稀释比例分别为1∶1 000、1∶2 000、1∶2 000、1∶2 000,4℃冰箱中孵育过夜,TBST漂洗3次,加入羊抗兔二抗溶液,稀释比例为1∶2 000,室温孵育2 h,TBST再次漂洗3次,以增强化学发光法显色,使用凝胶成像仪对蛋白条带拍照,以Image-J软件分析图像,获得各组蛋白相对表达量。
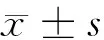
2 结果
2.1 阿托伐他汀对大鼠mPAP和RVP的影响 与假手术组相比,模型组大鼠mPAP、RVP明显增高(P<0.05);与模型组相比,阿托伐他汀低、中、高剂量组及速碧林组大鼠mPAP、RVP降低(P<0.05),且阿托伐他汀各组之间呈剂量依赖性(P<0.05);阿托伐他汀高剂量组与速碧林组相比,大鼠mPAP、RVP差异无统计学意义(P>0.05)。见表1。

表1 6组大鼠mPAP、RVP比较
2.2 阿托伐他汀处理对大鼠动脉血气相关指标的影响 与假手术组相比,模型组大鼠PaCO2明显增高(P<0.05),PaO2明显降低(P<0.05);与模型组相比,阿托伐他汀低、中、高剂量组及速碧林组大鼠PaCO2降低(P<0.05),PaO2增高(P<0.05),且阿托伐他汀各组之间呈剂量依赖性(P<0.05);阿托伐他汀高剂量组与速碧林组相比,大鼠PaCO2、PaO2差异无统计学意义(P>0.05)。见表2。

表2 6组大鼠动脉血气相关指标比较
2.3 阿托伐他汀对大鼠肺组织病理形态的影响 假手术组肺泡结构完整清晰,肺泡间隔未见炎症细胞浸润,肺血管结构正常;模型组大鼠肺组织呈现肺泡结构损环,间隔充血水肿,炎性细胞浸润明显,肺血管管腔变窄,动脉内膜明显增生等病理损伤,阿托伐他汀低、中、高剂量组及速碧林组大鼠上述肺组织病理损伤减轻,且病理损伤随阿托伐他汀剂量升高而逐次减轻;阿托伐他汀高剂量组与速碧林组相比,大鼠肺组织病理损伤程度无明显差异。见图1。
2.4 阿托伐他汀对大鼠肺BALF中IL-18、IL-6水平的影响 与假手术组相比,模型组大鼠肺BALF中IL-18、IL-6水平明显增高,差异有统计学意义(P<0.05);与模型组相比,阿托伐他汀低、中、高剂量组及速碧林组大鼠肺BALF中IL-18、IL-6水平降低,差异有统计学意义(P<0.05),且阿托伐他汀各组之间呈剂量依赖性(P<0.05);阿托伐他汀高剂量组与速碧林组相比,大鼠肺BALF中IL-18、IL-6水平差异无统计学意义(P>0.05)。见表3。

2.5 阿托伐他汀对大鼠肺组织SIRT2/NF-κB通路相关蛋白表达的影响 与假手术组相比,模型组大鼠肺组织SIRT2/NF-κB通路相关蛋白SIRT2表达水平明显降低(P<0.05),核内NF-κB表达水平明显增高(P<0.05);与模型组相比,阿托伐他汀低、中、高剂量组及速碧林组大鼠肺组织SIRT2/NF-κB通路相关蛋白SIRT2表达水平增高(P<0.05),核内NF-κB表达水平降低(P<0.05),且阿托伐他汀各组之间呈剂量依赖性(P<0.05);阿托伐他汀高剂量组与速碧林组相比,各蛋白表达差异无统计学意义(P>0.05)。见表4,图2。

图2 免疫印迹检测各组大鼠肺组织SIRT2/NF-κB通路相关蛋白表达;A 假手术组;B 模型组;C 阿托伐他汀低剂量组;D 阿托伐他汀中剂量组;E 阿托伐他汀高剂量组;F 速碧林组

表4 6组大鼠肺组织SIRT2/NF-κB通路相关蛋白相对表达
3 讨论
近年来,我国APE的发病率逐年升高,严重危害人民群众身心健康,因肺部血流循环障碍,APE患者可产生肺动脉高压、肺血管内膜增生、肺不张、气体交换障碍、低氧血症一系列病理症状,其中缺血缺氧引发的肺部炎性反应是主要的致病基础[12-14]。本文以自体血栓回输法构建APE大鼠模型,结果显示,建模大鼠肺组织呈现肺泡结构损环,间隔充血水肿,炎性细胞浸润明显,肺血管管腔变窄,动脉内膜明显增生等病理损伤,肺部mPAP、RVP、动脉血PaCO2、BALF中IL-18及IL-6水平明显升高,动脉血PaO2明显降低,表明血栓回输后,大鼠肺血管栓塞后,大鼠肺动脉压和右心室压力明显升高,促炎因子IL-18、IL-6大量表达合成,引发严重的炎性反应,造成肺组织损伤及肺血管增生,导致肺脏换气功能障碍,使动脉血中CO2潴留,O2减少,揭示模型建立成功。
APE常用的治疗方法是溶栓、抗凝,低分子肝素能降低凝血因子Ⅹa的活性,抑制血栓形成,是治疗APE的临床常用抗凝药物,可作为研究APE的阳性对照药[15]。阿托伐他汀作为临床常用的降脂药,具有明显的抗氧化、抗炎作用,可通过降低氧化应激水平,抑制炎性反应过程来减轻乙醇诱导的肝毒性,并可减小脑梗死体积,减轻APE导致的肺损伤,改善肺功能[8,16-18]。本文结果显示,与模型组相比,阿托伐他汀低、中、高剂量组大鼠肺组织病理损伤减轻,大鼠mPAP、RVP、动脉血PaCO2、BALF中IL-18及IL-6水平降低,动脉血PaO2升高,且阿托伐他汀各组之间呈剂量依赖性,表明阿托伐他汀可降低促炎因子合成分泌,抑制炎性反应,降低肺动脉压和右心室压,减轻肺组织损伤,缓解肺血管内膜增生,改善肺脏换气功能,进一步证实阿托伐他汀对APE具有治疗作用。
SIRT2/NF-κB作为机体调节炎性反应的主要信号,在APE的发生发展过程中起到重要的调控作用。在APE的病理反应过程中,SIRT2表达受到抑制,降低NF-κB蛋白的去乙酰化水平,增强其向细胞核内的转移,促使炎症进展,加重了肺部损伤;通过上调SIRT2表达,可增强NF-κB蛋白的去乙酰化,抑制其核转移,进而抑制炎症的发生发展,减轻APE引发的肺损伤[4,19,20]。本文结果显示,APE模型大鼠肺组织SIRT2蛋白表达明显降低,核内NF-κB蛋白表达明显升高,经阿托伐他汀治疗后,大鼠肺组织SIRT2蛋白表达升高,核内NF-κB蛋白表达降低,表明SIRT2/NF-κB参与介导APE大鼠的肺组织损伤过程,阿托伐他汀可上调SIRT2表达,抑制NF-κB蛋白的核转移,缓解肺组织损伤,改善APE大鼠的动脉血气指标,减轻其临床症状。
综上所述,阿托伐他汀可激活SIRT2信号,降低NF-κB蛋白核转移,阻止炎症发生发展,降低肺动脉压及右心室压力,减轻肺部病理损伤,恢复肺泡正常换气功能,提高动脉血中氧气含量,减少CO2潴留,改善APE临床症状。上调SIRT2表达,抑制NF-κB信号激活可能是阿托伐他汀治疗APE的药理机制之一,后续还需通过上调及下调SIRT2表达来进行对照验证。
