黔中地区马尾松林土壤细菌群落结构特征研究
2021-09-24杨云礼
陈 进, 徐 明, 邹 晓, 杨云礼, 张 姣, 张 健
(贵州大学生命科学学院 真菌资源研究所山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550025)
微生物多样性与陆地生态系统的多功能性间联系紧密,并对人类社会未来的核心生态过程有巨大影响。所以,微生物生态学家在过去的十几年中,一直致力于描述环境中(尤其是土壤中)微生物的多样性,并确定微生物群落结构和功能的驱动因素[1-2]。土壤作为一种高度复杂、异质化的环境介质,是孕育地球上微生物多样性最高的生境[3]。由于森林土壤作为碳汇和碳的潜在来源,以及其对气候变化预测的敏感性,森林土壤已成为微生物生态学家关注的焦点之一[4]。而土壤细菌群落在地球化学循环和诸如土壤固碳、养分循环和水渗透等生态系统功能中具有重要作用[5-7]。此外,土壤细菌群落对土壤环境变化较为敏感,因此可作为土壤有机碳指示生物[6]。土壤细菌代谢产生的次生代谢产物在与其他生物的相互作用中发挥重要的生态作用[8-9],在植物修复和土壤有机污染物修复领域扮演一个重要角色[10-12]。因此,土壤细菌逐渐成为微生物生态学家关注的焦点中的热点。最近的研究表明,土壤和气候参数(如降水和温度)是微生物群落在各种环境(包括北方和温带森林土壤)中的组成、多样性和代谢潜力的关键驱动因素[13-16]。然而,这些驱动因素在多大程度上决定了土壤微生物(如细菌、真菌、古菌、原生生物和/或线虫)在不同生态位的形成,仍有很多未知。因此,探讨土壤等环境因子对微生物群落的组成和分布的影响显得尤为重要。马尾松(Pinusmassoniana)是我国亚热带植被恢复的先锋树种,具有抗逆性、抗旱性等优势,在黔中地区(贵州的中部地区)分布广泛,是该地区工业用油和用材的关键树种,占贵州总用材林面积的46.54%,位居第一[17]。但是,人为干扰导致的人工林地力减弱使生产力下降,使马尾松群落处于分布面积大而生态经济效益低下的尴尬境地[18]。因此,了解黔中马尾松林土壤细菌群落组成的关键枢纽种,探讨土壤环境对马尾松林土壤细菌群落组成结构和多样性的影响,有利于进一步了解马尾松、土壤和土壤细菌群落三者之间相互作用的生态联系,以期为马尾松林的提质增效、科学化管理以及充分发挥马尾松林生态多功能效益提供科学参考。
1 材料与方法
1.1 材料
1.1.1 研究区概况 黔中地区包括贵阳市、开阳县、息烽县、修文县、清镇市、平坝县等22个市县区[19]。该区属亚热带季风气候,土壤以黔中山原黄壤为主,土壤呈酸性,年均降雨量800~1 000 mm,年均气温15~17 ℃,年均相对湿度76%~80%,年均日照时数在1 000 h以上,年均风速0.2~0.3 m/s。区域植被主要以马尾松(Pinusmassoniana)为优势乔木;以山茶(Camelliajaponica)、铁仔冬青(Ilexchuniana)和白栎(Quercusfabri)等组成优势灌木层;以蕨类和荩草(Arthraxonhispidus)等组成优势草本植物[20]。
1.1.2 土壤样品 选取黔中地区的花溪区久安乡(HX_JA)、长顺县广顺农场(CS_GS)、白云区长坡岭公园(BY_CPL)和花溪区贵州大学西校区(HX_GD)的马尾松成熟林为调查样地(表1),每个地区选取林型、林龄及立地条件较为一致的马尾松林地,植被调查样方为20 m×20 m,每个地区选取3块马尾松调查样方重复(仅久安乡为2个调查样方重复)。采用六点取样法,使用直径4.5 cm土钻采集 0~20 cm土层的土样, 均匀混合土壤样品,将土壤样品置于低温保藏箱内带回实验室。去掉土壤中的根、石块等杂质并混合均匀,过2 mm筛,按四分法准备1份用于DNA分析的冷冻干燥的土壤样品(置于-80 ℃超低温冰箱中保存备用)和1份用于土壤理化性质分析的自然风干的土壤样品。
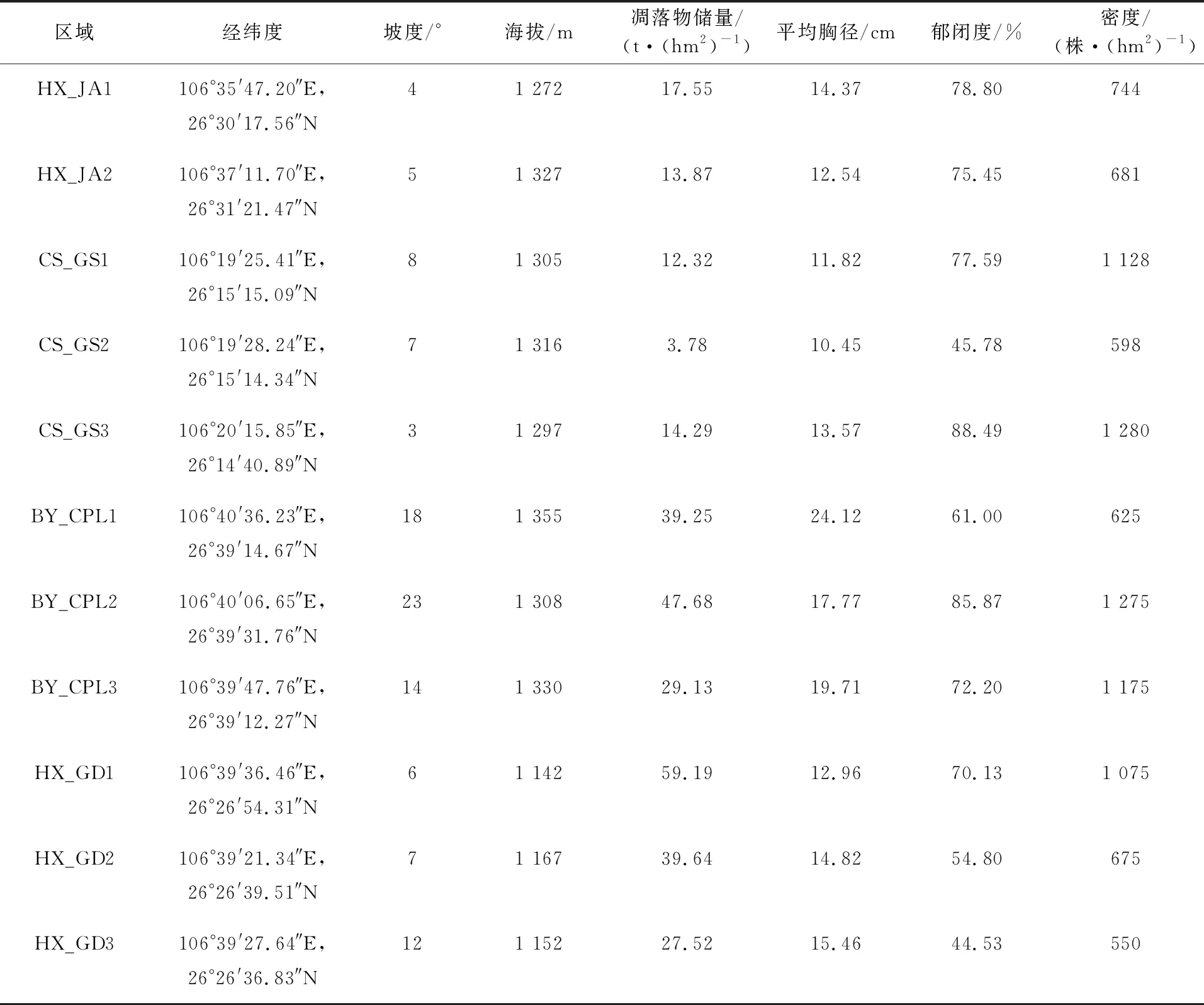
表1 黔中马尾松林样地基本信息表
1.1.3 主要仪器与设备 冷冻干燥机(FD-A10N-50,上海皓庄仪器有限公司);旋片式真空泵(2XZ-2,临海市潭氏真空设备有限公司);pH计(雷磁PHS-25,中国上海);红外智能消化炉(SKD-1852,上海沛欧分析仪器有限公司);紫外分光光度计(VU-1780,岛津仪器(苏州)有限公司);自动凯氏定氮仪(ZDDN-11,浙江托普云农科技股份有限公司);土钻等。
1.2 方法
1.2.1 土壤理化分析 土壤pH值采用水土比2.5∶1(质量比) pH计测定;土壤有机质采用重铬酸钾氧化-分光光度法测定;土壤全磷采用钼锑抗比色法(LY/T 1232-2015) 测定;土壤有效磷采用双酸(H2SO4-HCl)浸提-钼锑抗比色法(LY/T 1232-2015) 测定;土壤全氮采用半微量凯氏定氮法(LY/T 1228-2015) 测定;土壤蔗糖酶采用比色法测定。
1.2.2 土壤16S rRNA基因测序 将每个土样提取出的3个DNA样品充分混合后作为PCR扩增模版,采用原核生物通用引物338F(5′-ACTCCTACGGGAGGCAGCAC-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对土壤微生物16S rRNA 基因V3~V4区进行目的片段的扩增。PCR反应体系:5×FastPfubuffer 4.0 μL,dNTPs (2.5 mmol/L)2.0 μL,正、反向引物(5 μmol/L)各0.8 μL,FastPfupolymeraseW (2.5 U/μL) 0.4 μL,BSA 0.2 μL,模板DNA 10 ng,ddH2O补足20 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,25个循环;72 ℃ 10 min;10 ℃ 保存。扩增产物均取3 μL于1%琼脂糖凝胶中,在凝胶成像系统中检测。参照电泳初步定量结果,使用Qubit 2.0 荧光定量系统对PCR产物进行检测定量,之后按照每个样本的测序量要求,根据精确定量结果进行相应比例的混合。随后运行MiSeq 2500文库构建,Illumina上机测序,生成配对末端读数[21]。
1.2.3 数据处理 采用Excel 2019进行数据整理,采用R(version 4.0.2)进行数据多元统计分析;其中,运用R语言的base包进行Pearson相关性检验;ggplot2包绘制稀释曲线图、物种丰度堆叠条形图、多维尺度分析(MDS)和冗余分析(Redundancy analysis, RDA)图;vegan包进行冗余分析、非度量多维尺度分析、群落相似性分析(Analysis of similarities,ANOSIM);相似性分析是一种用于分析高维度数据组间相似性的非参数检验方法[22-24]。首先通过变量计算样本间距离(一般为Bray-Curtis距离,取值范围为0~1),然后计算关系排名,最后通过排序进行置换检验判断组间差异是否显著不同于组内差异[25-26]。
2 结果与分析
2.1 黔中不同区域马尾松林土壤理化性质
黔中不同区域马尾松林土壤理化性质不同,其中不同区域马尾松林土壤pH差异显著(P<0.05),表现为HX_GD(5.11)>BY_CPL(4.94)>HX_JA(4.77)>CS_GS(4.17);不同区域马尾松林土壤有机碳(SOC)差异显著(P<0.05),表现为CS_GS(1.71%)>BY_CPL(0.79%)>HX_JA(0.60%)>HX_GD(0.45%);不同区域马尾松林土壤有效磷(AP)差异显著(P<0.05),表现为BY_CPL(83.23 mg/g)>HX_GD(70.14 mg/g)> HX_JA(62.55 mg/g)>CS_GS(5.31 mg/g);不同区域马尾松林土壤全磷(TP)差异不显著(P>0.05);不同区域马尾松林土壤全氮(TN)差异显著(P<0.05),表现为:HX_GD(0.74 mg/g)>BY_CPL(0.63 mg/g)>HX_JA(0.50 mg/g)>CS_GS(0.29 mg/g);不同区域马尾松林土壤蔗糖酶(Inv)差异显著(P<0.05),表现为HX_GD(4.15 mg/g)>HX_JA(3.89 mg/g)>BY_CPL(3.16 mg/g)>CS_GS(2.94 mg/g)。
2.2 马尾松林土壤细菌群落组成
经高通量测序总获得1 289 533个质量序列,在97%相似度阈值上,测序的稀释曲线均逐渐趋于平缓,说明所测OTU数能够很好覆盖研究样品的细菌种类(图2)。经UCHIME软件去掉嵌合体序列,质控后Silva数据库比对得到34个门、58纲、134目、244科、599属和5 486个OTU,其中,优势门类为变形菌门(Proteobacteria)44.48%~57.12%、酸杆菌门(Acidobacteria)15.10%~31.13%、放线菌门(Actinobacteria)2.88%~19.21%),平均相对丰度均在10%以上,占总相对丰度的80%以上。拟杆菌门(Bacteroidetes)1.74%~5.46%、疣微菌门(Verrucomicrobia)0.35%~13.37%、厚壁菌门(Firmicutes)1.74%~5.46%、绿弯菌门(Chloroflexi)0.31%~4.98%、蓝细菌门(Cyanobacteria)0.02%~13.59%和芽单胞菌门(Gemmatimonadetes)0.18%~1.97%,平均相对丰度均在1%以上,是土壤中的主要群落(图3)。除放线菌门、绿弯菌门和芽单胞菌门在不同区域马尾松林土壤中相对丰度显著外(P<0.05),其余均不显著。
2.3 马尾松林土壤细菌群落α多样性及其与环境因子相关性
群落多样性主要用Simpson指数和Shannon指数表征,丰度用Chao1指数和ACE指数表征。表2为不同地区样地组间Shannon、Simpson、Chao1和ACE指数,不同地区马尾松林土壤细菌群落多样性和丰度不同,除Simpson指数外,Shannon、Chao1和ACE指数组间差异显著(P<0.05),其中,广顺组(GS)的多样性指数和丰度指数均最低,贵大组(GD)均最高。

图1 不同区域马尾松林群落土壤理化性质Fig.1 Soil physical and chemical properties of Pinus massoniana forests community in different areas不同小写字母表示数据差异显著,反之差异不显著(P<0.05)The different lowercase letters indicate significant differences in data, conversely data differences are not significant (P<0.05)

图2 黔中不同区域马尾松林土壤细菌稀释曲线Fig.2 Soil bacterial rarefaction curves of Pinus massoniana forests in different regions of central Guizhou
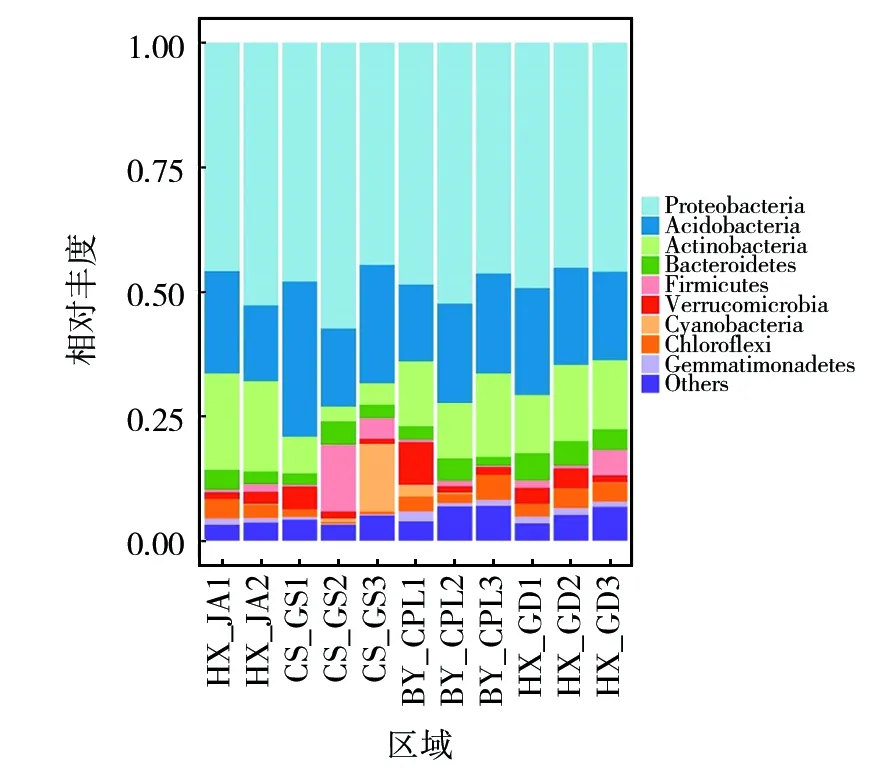
图3 黔中马尾松林土壤细菌群落门分类水平群落组成Fig.3 Phylum taxonomic horizontal community composition of soil bacterial community in Pinus massoniana forests of central Guizhou

表2 黔中马尾松林土壤细菌群落的多样性指数
在黔中马尾松林土壤中,Shannon多样性指数与经度、pH极显著正相关(P<0.01);与有效磷显著正相关(P<0.05);与土壤有机质极显著负相关(P<0.01)。Simpson指数与土壤有机质极显著负相关(P<0.01);Chao1指数与经度极显著正相关(P<0.01),与土壤酸碱度显著正相关(P<0.05),与土壤有机质极显著负相关(P<0.01);ACE指数与经度极显著正相关(P<0.01),与土壤酸碱度极显著负相关(P<0.01)。黔中马尾松林土壤细菌群落多样性指数与环境因子的相关性见图4。

图4 黔中马尾松林土壤细菌群落多样性指数与环境因子的相关性Fig.4 Correlation between soil bacterial community diversity index and environmental factors in Pinus massoniana forests of central Guizhou**在置信度(双测)为 0.01 时,相关性是显著的;*在置信度(双测)为 0.05 时,相关性是显著的;红色表示正相关,蓝色表示负相关;AP为有效磷;TP为全磷;TN为全氮;pH为酸碱度;SOC为土壤有机质;Slope为坡度;DBH为平均胸径;L_S为凋落物现存量;Canopy为郁闭度;Alt表示海拔;Inv表示土壤蔗糖酶;Lat表示纬度;Log表示经度。下同** The correlation was significant when the confidence (double measure) was 0.01;* The correlation was significant when the confidence (double measure) was 0.05; Red means positive correlation and blue means negative correlation; AP in the figure is available phosphorus; TP is total phosphorus; TN is total nitrogen; SOC is soil organic matter; Slope is slope; DBH is mean diameter at breast height; L_S is the litter reserves; Alt means altitude; Inv means soil invertase; Lat means latitude; Log means longitude. The following symbols are consistent with this place
2.4 马尾松林土壤细菌群落相似性
相似性分析(Analysis of similarities)表明黔中不同地区马尾松林土壤细菌群落组成组间差异大于组内差异(R=0.493,P=0.02),组间差异达到显著性水平(P=0.02),表明来自黔中不同地区的马尾松林土壤细菌群落在空间差异显著(图5)。

图5 黔中马尾松林土壤细菌群落相似性分析Fig.5 Anosim analysis of soil bacterial community forests in Pinus massoniana forests in central Guizhou
2.5 马尾松林土壤细菌群落冗余分析
采用冗余分析探讨黔中马尾松林地间土壤细菌群落结构差异及其与环境因子间的作用关系(图6)。9个环境变量共能解释黔中不同区域马尾松林土壤细菌OTU分类水平变异程度的46.79%,表明前两轴的贡献值可以较好地解释各因子对土壤细菌群落结构的影响,来自不同区域的马尾松林土壤细菌群落结构之间差异显著。花溪贵大组和部分白云长坡岭马尾松林土壤细菌群落结构与凋落物储量、DBH、pH和有效磷呈正相关,与海拔、郁闭度和土壤有机碳含量呈负相关。花溪久安马尾松林土壤细菌群落结构与全氮、全磷呈正相关;与坡度负相关。广顺马尾松林土壤细菌群落与海拔、郁闭度和土壤有机碳呈现正相关,与凋落物储量、DBH、pH、和有效磷呈负相关。
在黔中不同区域马尾松林土壤样点与各因子的冗余分析中,海拔(R2=0.51)、凋落物储量(R2=0.63)、DBH(R2=0.38)、土壤有机碳(R2=0.72)和土壤蔗糖酶(R2=0.33)与轴1的相关性较大(表3);郁闭度(R2=0.70)、全磷(R2=0.09)与轴2的相关性较大。但是只有海拔(P=0.04)、凋落物储量(P=0.02)、郁闭度(P=0.01)、pH(P=0.04)、有机碳(P=0.00)和有效磷(P=0.03)对不同区域马尾松林土壤细菌群落组成达显著性水平(P<0.05),其余环境因子未达到显著性水平(P>0.05)。表明海拔、凋落物储量、郁闭度、pH有机碳和有效磷是影响黔中不同区域马尾松林土壤细菌群落结构的相关因子。

图6 马尾松林土壤细菌群落与环境因子的冗余分析Fig.6 Redundancy analysis of soil bacterial communities and environmental factors in Pinus massoniana forests

表3 冗余分析相关参数
2.6 马尾松林土壤细菌群落网络分析
网络可以表示为一组由无向边连接的统一节点。这些节点可以代表生物层级中大多数层次的单位,从基因和蛋白质到神经元、器官和四肢,从种群中的个体到群落中的物种。边通常代表节点之间的某种相互作用,包括转录控制、生化相互作用、能量流和物种相互作用[27]。网络中的Hub(枢纽)通常是具有较高的度或较高的中心性的节点。而节点的中心性衡量网络中所有其他节点对之间的最短路径中有多少条经过该路径。因此,具有高中心性的节点对于网络的高效通信至关重要[28-29]。Hub节点在网络中往往具备较高的度、高的介数和高的紧密性[30-31]。在微生物共存网络中,Hub种在网络中可根据度、介数中心性(betweenness centrally)和紧密中心性(closeness centrally)三个网络的拓扑学特征决定[30-32]。因此,Hub种在微生物群落中扮演着群落构建、信息传递和能量流通等关键枢纽作用。
由于共存网络是根据计算Spearman相关性系数和显著性进行构建。由此,根据OTU在所有样本中出现比率为100%作为界限,去除不满足条件的OTU,以消除某一特定样本中的单一OTU对于相关性矩阵的影响。以相关性系数R>0.75并且显著性P<0.05为阈值构建共存网络,并计算度、介数中心性、紧密中心性。构建的共存网络如图7所示。
根据Hub种的相关定义,得到OTU386(Gammaproteobacteria)、OTU472(Acidobacteriales)、OTU381(Chitinophagaceae)为枢纽OTU,分属变形菌门、酸杆菌门和拟杆菌门(图8)。

图7 黔中不同地区马尾松林土壤细菌共存网络Fig.7 Co-occurrence network of soil bacteria in masson pine forests in different areas of central Guizhou图中点的大小表示丰度大小,不同颜色表示不同模块,黄色线表示正相关关系,蓝色线表示负相关关系The size of the points in the figure represents the abundance, different colors represent different modules, the yellow line represents the positive correlation, and the blue line represents the negative correlation
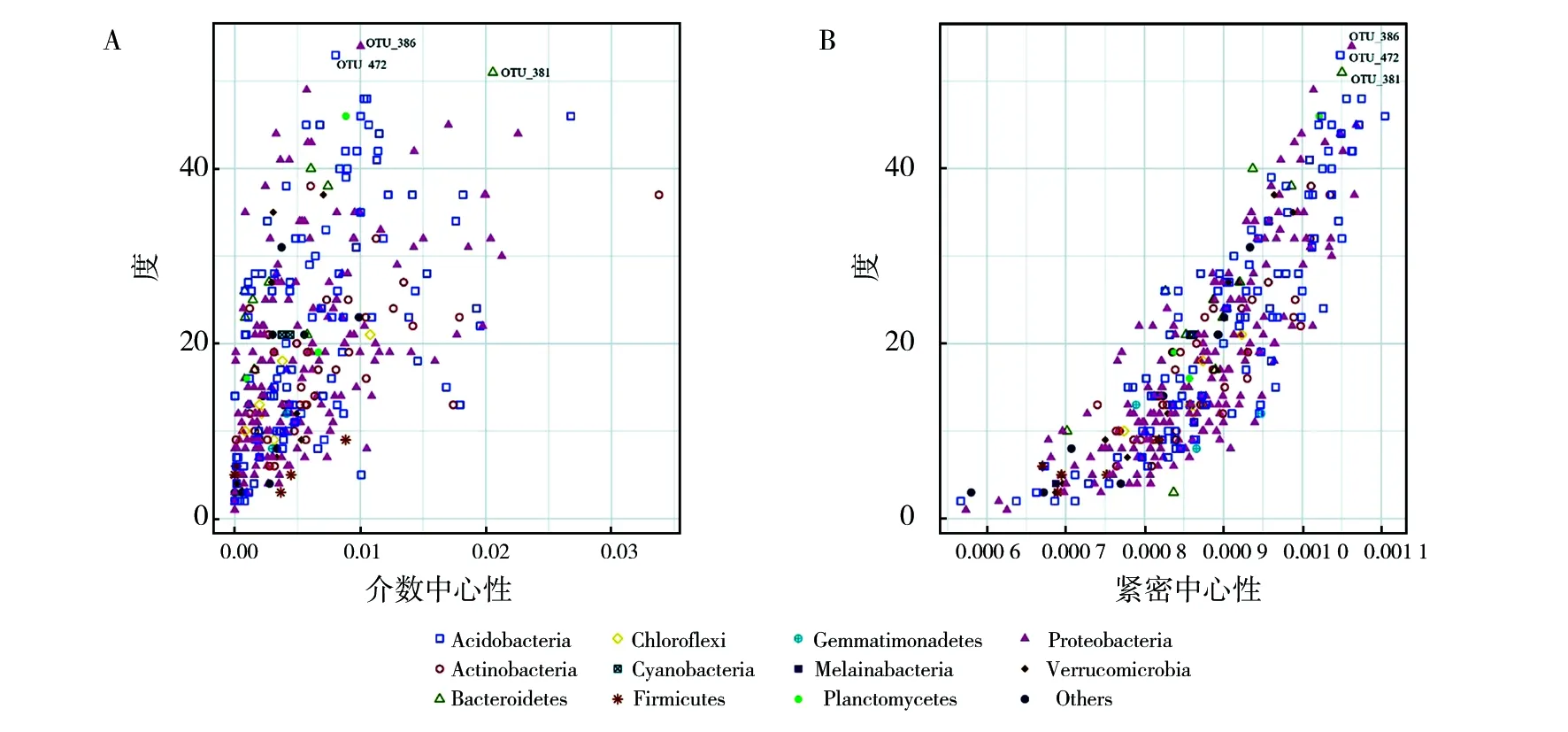
图8 度与介数中心性和紧密中心性之间的相关关系Fig.8 The correlation between degree and betweenness centrality and closeness centrality
3 讨 论
马尾松林作为黔中地区普遍分布的森林生态系统,揭示马尾松林土壤微生物群落多样性的空间分布特征,有利于提高对该区域马尾松林的群落生态理论的理解与科学管理。本研究基于高通量测序技术,探讨黔中不同区域马尾松林土壤细菌群落组成结构及多样性变化特征。结果表明:在门分类水平上,来自黔中不同区域马尾松林土壤细菌群落共检测出9个门相对丰度大于1%,其中,以富营养菌群的变形菌门和放线菌门[33]以及寡营养的酸杆菌门[34-35]为关键优势门,表明黔中不同区域马尾松林土壤养分状况良好。此外,黔中不同区域马尾松林土壤细菌群落组成结构上其优势细菌群落组成与华北落叶松土壤细菌群落组成结构以及不同年代公园绿地土壤细菌多样性相似[35-36]。
在黔中不同区域马尾松林土壤细菌群落组成中,放线菌门、绿弯菌门和芽单胞菌门在不同区域马尾松林土壤中相对丰度显著(P<0.05),而占有优势地位的放线菌门相对丰度在不同区域间差异不显著,这可能是该菌群生态幅较大,受到环境条件的影响较小[35]。有研究显示,变形菌门是一类有益于土壤固氮的异养菌群,其丰度和分布受到土壤有机碳含量的影响[35,37],本研究中黔中不同区域马尾松林土壤有机碳含量不同导致放线菌门相对丰度的显著性差异。除Simpson指数外,Shannon、Chao1和ACE指数在不同区域马尾松林土壤细菌群落间差异显著(P<0.05),其中,长顺县广顺组(CS_GS)的多样性指数和丰度指数均最低,花溪贵大组(HX_GD)均最高。相似性分析表明,黔中不同区域马尾松林土壤细菌群落β多样性差异显著(P<0.05),揭示了黔中不同地区的马尾松林土壤细菌群落空间差异显著。
凋落物储量、郁闭度、pH、有机碳和有效磷是影响黔中不同区域马尾松林土壤细菌群落结构的相关关键因子。对于凋落物储量和土壤养分(有机碳和有效磷):凋落物是土壤有机碳的主要且直接的输入来源,凋落物储量直接影响土壤有机碳的固定与流通。有研究表明土壤微生物群落不仅具有分解土壤有机质的功能,而且为土壤有机质的形成提供了主要的化学物质来源[6]。并且大多数土壤微生物群落依靠有机碳分解获得能量,并在土壤有机碳含量高的地区达到峰值[38]。植物生产力和土壤矿物质组成间接地影响了微生物群落组成,两者相互作用,决定了有机质含量和微生物多样性[39]。但本研究发现事实并非如此。土壤微生物多样性与土壤有机质呈显著负相关。应该明确的一点是,丰富的土壤有机质来源不一定能够导致丰富的土壤微生物多样性,还必须考虑酶促反应在其中的重要转化作用。同时,土壤蔗糖酶含量与土壤微生物多样性呈正相关,并且与Chao1指数显著正相关(P<0.05),这进一步表明土壤有机质含量并不是衡量土壤微生物多样性的唯一可靠指标,在探讨土壤微生物多样性的同时,还需考虑土壤酶活性。此外,在森林中,树木负责绝大多数的初级生产[38,40],因此,与无植被覆盖的生境相比,树木通过凋落物和腐木的输入量或根系活动控制有机碳的生物地球化学,从而改变了土壤有机质的组成[41]。森林郁闭度会直接影响光的输入,在森林生态系统中,树木会形成环境因子梯度(如水分、温度、光照、pH和养分可用性),从而影响土壤地下多样性的空间分布。
有研究表明pH会直接影响土壤微生物群落分布[42]。森林凋落物中的可交换碱性阳离子(如Ca2+和Mg2+)的释放会极大地影响土壤的pH值,由于凋落物中的Ca2+和Mg2+与土壤中的H+和Al3+争夺土壤颗粒表面或有机质层中的交换位点,从而保持土壤较低的酸化水平[43-44]。据有关研究报道,有机层中pH的缓冲作用和土壤有机质的周转是通过树冠层的Ca2+和Mg2+循环、凋落物的产生以及真菌把土壤矿物中的Al以及Fe元素迁移到有机层来调节的,从而增强了土壤有机质中难降解成分的降解[45]。Ca2+和Mg2+通过树冠循环通常会增加碱饱和度和森林有机土壤层表面的pH值[46]。相反,针叶树种(如云杉和松树等)会显著降低土壤pH,因为常绿植物的凋落物的化学结构及其对大气酸性化合物有一定的捕获作用。由此,树木对化学成分的影响可能是树木在细菌群落结构中起重要作用的主要原因之一,由凋落物引起的土壤养分状况和pH值的变化间接驱动森林土壤的微生物群落组成及其功能[47-49]。
通过共存网络,得到影响黔中马尾松林土壤细菌群落构建、群落信息传递、物质和能量传输的关键枢纽OTU属酸杆菌门、变形菌门和拟杆菌门。然而,枢纽OTU却不一定是优势OTU,这表明枢纽OTU对于群落的构建和功能不完全与其丰度相关[50]。因此,在表征群落功能和组成时,用优势OTU的方式值得商榷。
变形菌门、酸杆菌门、放线菌门、厚壁菌门、拟杆菌门、疣微菌门、蓝细菌门和绿弯菌门是黔中不同区域马尾松林土壤细菌群落的8个主要优势门。Shannon、Chao1和ACE指数在不同区域马尾松林土壤细菌群落间差异显著(P<0.05),Simpson指数在不同区域马尾松林土壤细菌群落间差异不显著(P>0.05)。相似性分析表明,黔中不同区域马尾松林土壤细菌群落β多样性差异显著(P<0.05)。凋落物储量、郁闭度、pH、有机碳和有效磷是影响黔中不同区域马尾松林土壤细菌群落结构的关键因子。酸杆菌门、变形菌门和拟杆菌门是黔中马尾松林土壤细菌群落构建、群落信息传递、物质和能量传输的关键枢纽OTU。
