梭梭根际解磷菌的分离及其解有机磷能力
2021-09-22孟建宇张婷婷杨丽华
孟建宇 张婷婷 杨丽华
摘 要:以内蒙古巴丹吉林沙地药用植物梭梭为材料,采用传统分离培养技术,使用有机磷培养基对梭梭根际解磷菌进行分离,基于16S rRNA基因序列分析进行分类鉴定,采用钒钼比色法测定其解有机磷能力,以植酸酶活性表示。从梭梭根际土壤中分离纯化得到8株解有机磷细菌,分属根瘤菌属(Rhizobium)、鞘氨醇单胞菌属(Sphingomonas)、假单胞菌属(Pseudomonas)、肠杆菌属(Enterobacter)、泛菌属(Pantoea)、马西利亚菌属(Massilia)和节杆菌属(Arthrobacter)。变形菌门(Proteobacteria)是梭梭根际极优势类群,占总数的87.5%。其中,菌株Y29 和B333解有机磷能力最强,植酸酶活分别为24.21,20.43 μg·mL-1,是2株极具开发潜力的解磷菌。本文揭示了梭梭根际可培养解有机磷细菌的类群组成,为认识和利用荒漠解磷菌提供了理论依据。
关键词:梭梭;根际;有机磷降解菌;植酸酶活性;16S rRNA
中图分类号:S567 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2021.08.001
Isolation of Organophosphate-degradation Bacteria from Rhizosphere of Haloxylon ammodendron and Their Organophosphate-degradation Capability
MENG Jianyu,ZHANG Tingting, YANG Lihua
(Life Sciences College,InnerMongolia Agricultural University, Hohhot 010011, China)
Abstract:Traditional isolation and culture technology and organic phosphorus media were used to isolate organophosphate-degradation bacteria in the rhizosphere of medicinal plant Haloxylon ammodendron from the sandland of Badainjaran in Inner Mongolia. A preliminary identification was based on the 16S rRNA gene.Vanadium-ammonium-molybdate was used to measure the organophosphate-degradation capabilities, and the organophosphate-degradation cability was indicated by phytase activity. The results showed that a total of 8 organophosphate-degradation bacteria were isolated, which belonged to Rhizobium,Sphingomona, Pseudomonas,Enterobacter,Pantoea,Massilia and Arthrobacter, respectively. The Extremely dominant class was Proteobacteria with ratio of 87.5%. The strains Y29 and B333 had the strongest ganophosphate-degradation ability, and the phytase activity was 24.21, 20.43 μg·mL-1, respectively,which were of great potential applicationvalue. This study preliminarily revealed the composition of cultivable organophosphate-degradation bacteria from rhizosphere of Haloxylon ammodendron, which provides a basis for understanding and using desert organophosphate-degradation bacteria for applications.
Key words: Haloxylon ammodendron;rhizosphere;organophosphate-degradation bacteria;phytaseactivity;16S rRNA
磷是植物生長所需的大量元素、养分资源,对植物的抗逆性、抗病性和光合作用都有影响[1]。土壤中总磷(Total phosphorus,TP)含量较高,但生物可利用磷(Bioavailable phosphorus,BAP)仅占TP 的0.1 %[2]。BAP 的匮乏导致植物获取有效磷受限,重影响作物的正常生长[2-3]。施加磷肥是提高BAP 的主要方法,但过量添加无机磷会对环境的健康造成严重影响[4],因其在施用过程中会对农作物、大气、土壤等造成影响,对人或动物的毒害越来越大[5-6],成为21世纪全球环境的挑战[7-8]。
土壤中存在大量解磷微生物(Phosphorus solubilizing microorganism,PSM)可以提高植物对磷的需求,并且广泛参与不可溶性磷的转化[9]。微生物分泌特异的酶,如碱性磷酸酶、酸性磷酸酶和植酸酶等,通过这些酶的催化作用,将植酸盐等不可溶的有机磷酸盐迅速分解成可溶性小分子[10],也可以通过分解有机质的磷-酯键和磷-酐键而释放磷[11],在磷的转化过程中发挥至关重要的作用[9]。解磷微生物基因信息丰富、代谢类型多样、生长周期短,使得微生物降解效率高、条件温和且成本低,具有良好的应用前景[12]。但目前对于以植酸磷为惟一磷源的有机磷降解菌的研究还较少[6]。
梭梭抗旱、抗热、抗寒、耐盐碱性都很强,防风固沙能力强,是我国西北和内蒙古干旱荒漠地区固沙造林的优良树种,而且是一种名贵的中药材,可清肺化痰、降血脂、降血压和杀菌等。本研究选择以植酸钙为唯一磷源,从梭梭根际土中分离高效有机磷降解菌,以期认识和利用荒漠中解磷菌类群,为降解有机磷的微生物肥料提供高效稳定的菌种来源及基础资料,对于维护干旱荒漠地区生态系统的稳定,改善荒漠化状态具有重要的意义和应用价值。
1 材料和方法
1.1 材料
1.1.1 试验样品 样品为采集自内蒙古阿拉善巴丹吉林梭梭根际土,用已灭菌的刷子轻轻将梭梭根际土刷至聚乙烯塑料无菌采样袋中,4 ℃保存运回实验室。1.1.2 培养基 1/2R2A培养基:酵母膏0.25 g,蛋白胨0.25 g,酸水解络素0.25 g,葡萄糖0.25 g,淀粉0.25 g,磷酸氢二钾0.15 g,丙酮酸钠0.15 g,硫酸镁0.025 g,蒸馏水1 000 mL,pH自然。
LB液体培养基:胰蛋白胨10 g,氯化钠5 g,酵母粉5 g,蒸馏水1 000 mL,pH自然。
液体发酵培养基:葡萄糖15 g,蛋白胨3 g,可溶性淀粉20 g,硫酸铵0.5 g,氯化钾0.5 g,硫酸镁0.5 g,硫酸锰0.3 g,硫酸亚铁0.3 g,磷酸二氢钾0.4 g,蒸馏水1 000 mL,pH 5.5。
有机磷培养基:取2 mL植酸溶于400 mL去离子水中;取6 g醋酸钙于100 mL去离子水中;将二者缓慢搅拌混匀。将混合液不断搅拌,并加热至沸腾,冷却至室温,于4 ℃过夜。将葡萄糖10 g,硫酸铵0.5 g,氯化钠0.3 g,氯化钾0.3 g,硫酸镁0.3 g,硫酸亚铁0.03 g,硫酸锰0.03 g加入混合液,并补水至1 000 mL,调节pH 7.0~7.5。制备固体培养基时加入20.0 g琼脂。
1.2 解磷菌的分离鉴定
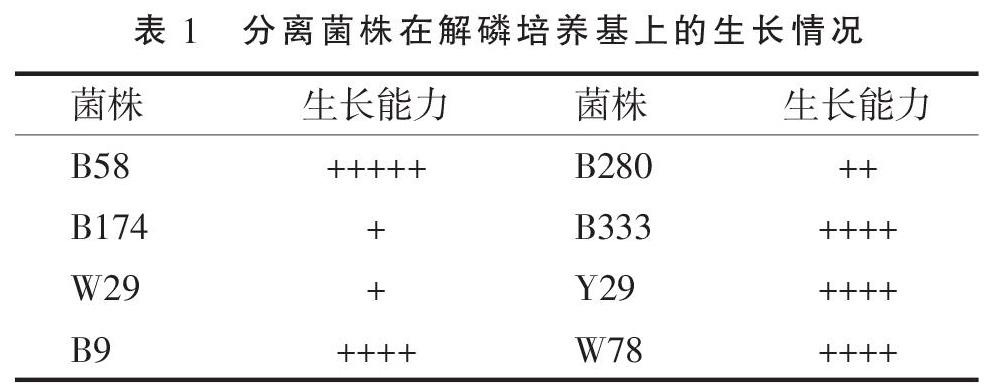
称取植物根际土 0.5 g,加入 49.5 mL无菌水,震荡 30 min,静置 10 min。吸取 1 mL上清液,用无菌水稀释成 10-6~10-2五个梯度,各自涂布在固体有机磷培养基,每个梯度设3个平行。28 ℃条件下培养1周,挑取形态各异的单菌落,用四区划线法划线培养,连续观察7 d,记录菌株的生长能力:第1天接菌,第2天开始观察,第3天记录,第3天长出的菌,记为“+++++”,第4天长出的菌,标记为“++++”,依此类推,第7天长出的菌,标为“+”,若第7天还未生长,则标为“-”。
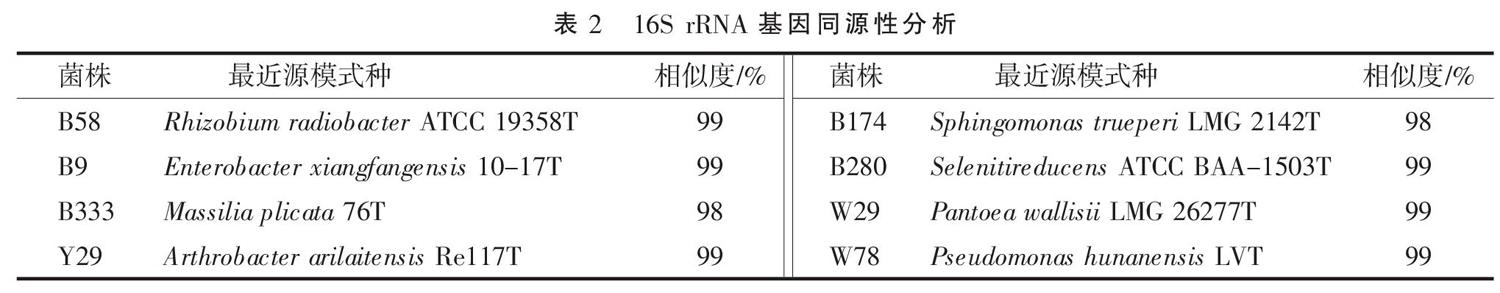
利用细菌通用引物27F和1492R对分离得到的菌株进行16S rRNA基因PCR扩增[13],扩增产物送生上海工生物工程股份有限公司进行测序,利用EzTaxon对测序所得16S rDNA片段序列进行同源性分析,以确定菌株的种属关系。
1.3 解磷能力测定
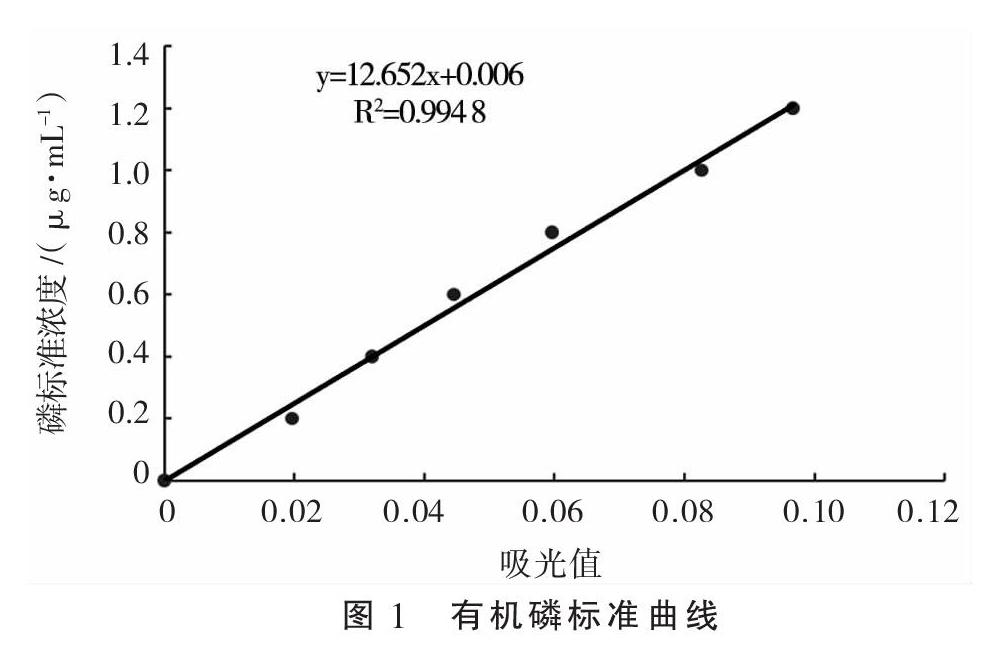
采用钒钼比色法[14]对菌株进行解磷能力测定。将分离的菌株接种于LB液体培养基中,于28 ℃、170 r·min-1条件下摇床培养过夜。取适量发酵液,在10 000 r·min-1的离心机中离心10 min,取1 mL上清液,加入1 mL 5 mmol·L-1植酸钠,37 ℃保温30 min,再添加3 mL终止液中止反应,充分振荡,静置15 min后,4 000 r·min-1离心15 min,然后在波长415 nm处测定吸光值。根据磷标准曲线计算酶活,每个样品均做3个平行。酶活力单位(IU)的定义为:37 ℃、pH 5.5的条件下,从浓度为8.4 g·L-1的植酸钠溶液里每分钟所释放出1 μmol有机磷所需要的植酸酶量。以415 nm波长下测得的吸光值为X轴、标准磷浓度为Y轴绘制有机磷标准曲线(图1),其方程式为y=12.652x+0.006(R2=0.9948),符合使用标准。
2 结果与分析
2.1 解磷菌的分离与鉴定
使用有机磷细菌培养基,对内蒙古阿拉善巴丹吉林梭梭根际解磷细菌进行分离培养,共筛选得到具有解有機磷-植酸磷能力的解磷细菌8株(表1)。分别以8株解磷菌的基因组DNA为模板进行16S rRNA基因扩增,扩增片段测序后在EzTaxon数据库中进行相似性分析(表2)。变形菌门(Proteobacteria)为主要类群,共有7株,占总数的87.5%,其中α-变形菌纲(α-Proteobacteria)有3株,菌株B58、B280属于根瘤菌属(Rhizobium),B174属于鞘氨醇单胞菌属(Sphingomonas);γ-变形菌纲(γ-Proteobacteria)有3株,W78属于假单胞菌属(Pseudomonas),B9属于肠杆菌属(Enterobacter),W29属于泛菌属(Pantoea);β-变形菌纲(α-Proteobacteria)有1株,属于马西利亚菌属(Massilia)的B333。放线菌门有1株,属于节杆菌属(Arthrobacter)的Y29。
2.2 解有机磷能力
用钒钼比色法对8株菌进行解有机磷-植酸磷能力的定量测定,测定结果如图2所示。这些菌株植酸酶活力在1.61~24.21 μg·mL-1。菌株Y29和B333解有机磷能力最强,植酸酶活分别为(24.21±1.21)μg·mL-1和(20.43±1.02) μg·mL-1,W78株植酸酶活力为16.54±0.83 μg·mL-1,B58株植酸酶活力为11.77±0.58 μg·mL-1,菌株B9植酸酶活力为9.14±0.45 μg·mL-1,B174、W29解有机磷能力最弱,植酸酶活都小于2 μg·mL-1。
3 结论与讨论
从环境中分离有机磷高效降解微生物,研制解磷功能的微生物有机肥对解决植物可溶性磷供应问题是一有效途径[15]。近年来,有机磷降解菌的应用逐步引起人们的关注,并在农作物上已有应用报道[16],但其在荒漠固沙植物上的应用却鲜有报道,特别是中药材根际解有机磷细菌研究较少[17]。
自然界中的部分功能微生物对有机磷具有降解作用,研究比较深入的是细菌和真菌。细菌主要有芽孢杆菌属(Bacillus)、棒状杆菌属(Corynebacterium)、黄杆菌属(Xanthomonas)、固氮菌属(Azotobacter)和硫杆菌属(Thiobacillus)等。假单胞菌属(Pseudomonas)、拟杆菌属(Bacteroides)、红螺菌属(Rhodospirllum)、节细菌属(Arthrobacter)、沙雷氏菌属(Serratia)、金黄杆菌属(Chryseobacterium)、肠杆菌属(Enterobacter)、泛生菌属(Pantoea)、鞘氨醇单胞菌属(Sphingomonas)和克雷伯氏菌属(Klebsiella)等。解磷菌分布受土壤类型、有机质含量、土壤地质等因素的影响[18],本文从荒漠灌木梭梭根际分离纯化获得8株解有机磷细菌,分属2个门7个属,与已分离的荒漠解磷菌种属类似[19-21]。其中,根瘤菌属(Rhizobium)有2株,鞘氨醇单胞菌属(Sphingomonas)有1株,假单胞菌属(Pseudomonas)有1株,肠杆菌属(Enterobacter)有1株,泛菌属(Pantoea)有1株,马西利亚菌属(Massilia)有1株,节杆菌属(Arthrobacter)有1株;变形菌门(87.5%)是梭梭根际极优势类群。对分离的菌株进行解有机磷能力测定,植酸酶活性普遍较高,处中上等水平,其中菌株Y29 和B333解有机磷能力最强,植酸酶活分别为(24.21±1.21) μg·mL-1和(20.43±1.02) μg·mL-1,高于已报道菌株的解有机磷能力[19,22-24]。本研究为内蒙古荒漠地区植物根际解磷菌资源的研究提供了理论依据和实践基础,其中筛选所得的2株菌(Y29和B333)在微生物肥料及农药降解方面具备较高的应用价值,为微生物肥料的开发利用以及农药的微生物降解奠定了基础。
参考文献:
[1] ALORI E T, GLICK B R, BABALOLA O O. Microbial phosphorus solubilization and its potential for use in sustainable agriculture[J]. Frontiers in Microbiology, 2017, 8: 971.
[2] INGLE K P, PADOLE D A. Phosphate solubilizing microbes: an overview[J]. International Journal of Current Microbiology and Applied Science, 2017, 6(1): 844-852.
[3] KIHARA J, NJOROGE S. Phosphorus agronomic efficiency in maize-based cropping systems: a focus on western Kenya[J]. Field Crops Research, 2013, 150: 1-8.
[4] KANG J, AMOOZEGAR A, HESTERBERG D, et al. Phosphorus leaching in a sandy soil as affected by organic and inorganic fertilizer sources[J]. Geoderma, 2011, 161(3/4): 194-201.
[5] 魏欣. 中国农业面源污染管控研究[M]. 北京: 中国农业出版社, 2015.
[6] 陈娟, 王治业, 杜津昊, 等. 当归根系土壤有机磷降解菌的分离鉴定及其生长特性的研究[J]. 中国酿造, 2018, 37(9): 78-82.
[7] 李险峰, 郭昭滨. 黑土区水土保持生态修复模式探讨[J]. 防护林科技, 2018(7): 83-84.
[8] 郑金玲. 国家农发水保项目东北黑土区水土流失综合治理初探[J]. 科学技术创新, 2017(35): 94-95.
[9] BABALOLA O O, GLICK B R. Indigenous African agriculture and plant associated microbes:current practice and future transgenic prospects[J]. Science Research and Essays, 2012, 7(28): 2431-2439.
[10] 张黎丽, 张阁, 王欣艺, 等. 土壤中降解有机磷微生物的筛选[J]. 山东农业大学学报(自然科学版), 2019, 50(5): 774-777.
[11] SUZUKI M T, PARROT D, BERG G, et al. Lichens as natural sources of biotechnologically relevant bacteria[J]. Applied Microbiology and Biotechnology, 2016, 100(2): 583-595.
[12] 白云鵬, 程欢, 许建和. 有机磷水解酶的挖掘、改造及应用[J]. 微生物学报, 2017, 57(8): 1168-1179.
[13] KALANETRA K M, HUSTON S L, NELSON D C. Novel, attached, sulfur-oxidizing bacteria at shallow hydrothermal vents possess vacuoles not involved in respiratory nitrate accumulation[J]. Applied and Environmental Microbiology, 2004, 70(12): 7487-7496.
[14] 徐丹丹, 赵邯郸, 王秀然, 等. 两种测定植酸酶酶活的方法比较及发酵条件研究[J]. 湖北农业科学, 2019, 58(12): 134-137.
[15] 王欢, 王敬敬, 徐松, 等. 有机磷降解菌的筛选及其促生特性[J]. 微生物学报, 2017, 57(5): 667-680.
[16] 苏辉兰, 莫雪雪, 余炳锋, 等. 贡柑果园高效解磷菌的筛选及其解磷条件优化[J]. 北方园艺, 2019(5): 101-107.
[17] 杜慧慧, 朱芙蓉, 杨敏, 等. 不同生境滇重楼根际解磷菌的筛选与鉴定[J]. 中国中药杂志, 2021, 46(4): 915-922.
[18] 滕泽栋, 李敏, 朱静, 等. 解磷微生物对土壤磷资源利用影响的研究进展[J]. 土壤通报, 2017, 48(1): 229-235.
[19] 贾丽娟, 唐凯, 高晓丹, 等. 库布齐沙地生物土壤结皮中解磷菌的分离鉴定及解磷能力[J]. 应用与环境生物学报, 2018, 24(2): 390-394.
[20] 杨鸿儒. 西鄂尔多斯荒漠灌木根际细菌多样性和群落结构的研究[D]. 呼和浩特: 内蒙古农业大学, 2016.
[21] 巩瑞红, 王小兵, 赵吉睿, 等. 荒漠草原植物根际溶磷细菌的分离鉴定及其溶磷能力的比较[J]. 内蒙古农业科技, 2014(4): 6-9, 81.
[22] JORQUERA M A, HERNNDEZ M T, RENGEL Z, et al. Isolation of culturable phosphobacteria with both phytate-mineralization and phosphate-solubilization activity from Biology and Fertility of Soils, 2008, 44(8): 1025-1034.
[23] BEHERA B C, YADAV H, SINGH S K, et al. Phosphate solubilization and acid phosphatase activity of Serratia sp. isolated from mangrove soil of Mahanadi river delta, Odisha, India[J]. Journal, Genetic Engineering & Biotechnology, 2017, 15(1): 169-178.
[24] 上官亦卿, 常帆, 呂睿, 等. 解磷菌的分离、筛选、鉴定及解磷能力研究[J]. 湖北农业科学, 2019, 58(1): 30-34, 38.
