水牛热休克蛋白70基因克隆及其表达分析
2021-09-13汤玉燕,姚顺,濮黎萍,赵秀玲,陈东荣,张鹏飞,张明
汤玉燕,姚顺,濮黎萍,赵秀玲,陈东荣,张鹏飞,张明

摘要:【目的】克隆水牛热休克蛋白70基因(HSP70)并进行生物信息学分析,同时明确HSP70基因在水牛成熟卵母细胞(MII期)和2-细胞期胚胎中的表达情况,为研究HSP70在水牛卵母细胞成熟及着床前早期胚胎发育中的作用机理提供理论依据。【方法】根据NCBI已公布的水牛HSP70基因mRNA预测序列(MH814759.1)设计引物,通过RT-PCR克隆水牛HSP70基因,运用DNAStar、MEGA 7.0、TMHMM 2.0及SignalP 4.1 Server等在线软件进行生物信息学分析;同时采用细胞免疫荧光分析HSP70在水牛成熟卵母细胞及2-细胞期胚胎中的表达情况。【结果】水牛HSP70基因编码区(CDS)长度为1926 bp,共编码641个氨基酸残基。克隆获得的水牛HSP70基因序列与NCBI已公布水牛HSP70基因mRNA预测序列(MH814759.1)的相似性高达97.7%;与牛、家犬、山羊、小鼠、绵羊和大鼠的HSP70基因序列具有较高的相似性,其中与牛的相似性高达99.1%。基于HSP70基因核苷酸序列相似性构建的系统发育进化树也显示,水牛与牛的亲缘关系最近。水牛HSP70分子量为70.27 kD,分子式为C3088H4967N8670972S15,理论等电点(pI)为5.67,不稳定系数为32.84,属于稳定蛋白;不存在跨膜结构及信号肽,主要定位于细胞质(60.9%)、细胞核(30.4%)及线粒体(8.7%),其亲水性较强;水牛HSP70蛋白结构以α-螺旋和β-折疊为主。HSP70在水牛成熟卵母细胞及2-细胞期胚胎中均有表达,且主要集中在细胞质。【结论】水牛HSP70基因在进化过程中具有高度的保守性,在水牛成熟卵母细胞和 着床前早期胚胎中均有表达,且主要集中在细胞质,属于结构型HSP70。
关键词: 水牛;热休克蛋白70(HSP70);基因克隆;表达分析;细胞质
中图分类号: S823.83 文献标志码: A 文章编号:2095-1191(2021)09-2599-09
Cloning and expression analysis of buffalo heat
shock protein 70 gene
TANG Yu-yan, YAO Shun, PU Li-ping, ZHAO Xiu-ling, CHEN Dong-rong,
ZHANG Peng-fei, ZHANG Ming*
(Animal Reproduction Institute/State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources,Guangxi University, Nanning 530004, China)
Abstract:【Objective】The heat shock protein 70 gene of buffalo(HSP70) was cloned and analyzed by bioinformatics.Meanwhile, its expression was analyzed in buffalo mature oocytes(MII stage) and 2-cell stage embryos, which provided a theoretical basis for studying the mechanism of HSP70 in the maturation of oocytes and pre-implantation embryos development. 【Method】Primer was designed according to the published mRNA sequence of buffalo gene HSP70(MH814759.1) in GenBank. Bioinformatics analysis was performed using online software such as DNAStar, MEGA 7.0, TMHMM 2.0, and SignalP 4.1 Server. Meanwhile, the immunofluorescence assay was used to detect the expression of HSP70 in mature oocytes and 2-cell stage embryos. 【Result】The coding region(CDS) of buffalo gene HSP70 was 1926 bp,and 641 amino acids were encoded. The cloned buffalo gene HSP70 had 97.7% homology with the published buffalo HSP70 mRNA prediction sequence(MH814759.1). And it had high homology with that of Bos taurus, Canis lupus familiaris, Capra hircus, Mus musculus, Ovis ariesis, Rattus norvegicus, among which the homology of B. taurus was as high as 99.1%. The phylogenetic tree based on the similarity of the nucleotide sequence of HSP70 also showed that the relationship between the buffalo and the B. taurus was the closest. The molecular weight of buffalo HSP70 was 70.27 kD, molecular formula was C3088H4967N8670972S15,the theoretical isoelectirc point (pI) was 5.67, which showed the HSP70 belonged to stabilized protein (instability index was 32.84). There was no transmembrane structure and signal peptide, mainly located in the cytoplasm (60.9%), nucleus(30.4%) and mitochondria(8.7%), and its hydrophilicity was strong. The structure of buffalo HSP70 protein was mainly α-helix and β-sheet. HSP70 was expressed in buffalo MII oocytes and 2-cell stage embryos, and was mainly concentrated in the cytoplasm. 【Conclusion】The buffalo gene HSP70 is highly conserved du-ring the evolution process. It is expressed in mature buffalo oocytes and early embryos before implantation, and is mainly concentrated in the cytoplasm. It belongs to structural HSP70.
Key words: buffalo; heat shock protein 70(HSP70); gene cloning; expression analysis; cytoplasm
Foundation item: National Natural Science Foundation of China(31960660); Guangxi Natural Science Foundation (2018GXNSFAA294144);Open Project of State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources(SKLCUSA-b201914)
0 引言
【研究意义】近年来,针对动物抵抗热应激反应方面的研究主要集中于热休克蛋白(Heat shock protein,HSP)。HSP能促使细胞适应环境的逐渐变化,在环境应激适应和热平衡中发挥关键作用,同时在细胞稳态及信号转导中扮演重要角色(S?rensen et al.,2003;黄建芳等,2015;祁磊等,2019)。热休克蛋白70(Heat shock protein 70,HSP70)是一种应激蛋白,是HSP家族中功能最重要、结构最保守以及对应激条件最敏感的一员(陈强等,2007;李小红等,2017)。HSP70高度保守,不同来源的HSP70氨基酸序列具有很高的相似性(50%~90%)(姜忠玲,2006;牛杨莉等,2019),且具有分子伴侣、抗细胞凋亡、刺激自身免疫反应及参与炎症反应等生物学功能。作为分子伴侣,HSP70可与新生肽链结合,促进肽链折叠,完成蛋白跨膜运输,通过泛素蛋白酶体系统(Ubiquitin proteasome system,UPS)或溶酶体介导的自噬,将错误折叠的蛋白传递至降解部位进行降解(da Silva and Borges,2011),在保护细胞免受热应激及受损蛋白的清除过程中发挥作用(Parsell and Lindquist,1993)。HSP70還能与核受体、激酶和转录因子发生短暂结合,而调控这些因子的生物活性(Mayer and Bukau,2005)。此外,在胚胎发育过程中需要HSP70发挥分子伴侣功能及对细胞凋亡进行调控(Baehrecke,2002)。因此,开展水牛HSP70基因克隆及其表达规律研究,对揭示水牛卵母细胞成熟及着床前胚胎发育机理具有重要意义。【前人研究进展】Ritossa(1962)将果蝇幼虫置于32 ℃高温环境中,发现果蝇唾液腺染色体上有明显的膨突,表明此处的基因较一般基因更易转录。在此基础上,Ritossa等(1974)通过SDS-PAGE分离获得由热应激反应产生的一组新蛋白质,并命名为热休克蛋白(HSP)。由于对细胞产生损害的各种化学和物理因素均能促使HSP产生或增加,因此又被称为应激蛋白。吴伟忠等(2000)利用蛋白层析法从热休克处理的小鼠肝癌H22细胞中分离出高纯度的HSP70,以其免疫小鼠具有抗肝癌作用。金欢胜等(2005)采用RT-PCR成功克隆出小鼠HSP70基因(1990 bp),并通过构建真核表达重组质粒HSP70/pAAV-MCS成功表达出融合蛋白HSP70,为深入研究HSP70在肾脏缺血预适应的作用及其机制打下了基础。刘波等(2011)通过对吉福罗非鱼进行急性冷刺激试验,结果发现其肝脏内的HSP70基因表达水平明显上调。至今,有关HSP70与疾病相关性的研究越来越多,如血浆中的HSP70水平与动脉粥样硬化严重程度存在直接联系(Xie et al.,2016),与乳腺癌、子宫内膜癌和胃癌的发生也密切相关(Morii et al.,2010)。吴庚香等(2015)通过免疫组织化学分析发现,患多囊卵巢综合征(Polycystic ovary syndrome,PCOS)大鼠卵巢中的HSP70表达水平较正常大鼠显著提高,且主要表达于卵泡膜细胞和颗粒细胞中。沈爱群等(2016)研究发现,子宫内膜细胞与HSP70共培养后,上皮细胞标志物和HSP70表达水平显著降低,而间皮细胞标志物和HSP70表达水平明显上升,说明HSP70对子宫内膜细胞上皮间质化有促进作用,有利于异位内膜细胞种植转移。Witkin等(2017)研究证实,卵巢受氧化应激、无菌性炎症等过度刺激或将其暴露在环境毒素中均会引起卵巢内HSP70表达水平上升,进而抑制自噬,提高卵巢早衰(Premature ovarian failure,POF)和妊娠并发症发生的可能性。【本研究切入点】水牛是热带亚热带地区主要的畜牧资源,相对于其他牛种更适应于高温高湿的环境,但在此环境下水牛的泌乳、发情和受胎等生理功能也会受到一定程度的影响,尤其是随着全球气候变暖,提高水牛的耐高温性能已成为主要育种目标之一。目前,有关牛源HSP70基因及其功能的研究主要以荷斯坦奶牛为对象,而针对水牛的相关研究鲜见报道。【拟解决的关键问题】利用RT-PCR克隆水牛HSP70基因,通过在线软件进行生物信息学分析,同时明确HSP70基因在水牛成熟卵母细胞(MII期)和2-细胞期胚胎中的表达情况,为研究HSP70在水牛卵母细胞成熟及着床前早期胚胎发育中的作用机理提供理论依据。
1 材料与方法
1. 1 试验材料
水牛卵巢取自广西南宁市肉联食品屠宰场。TRIzol购自美国Invitrogen公司,PrimeScriptTM RT rea-gent Kit with gDNA Eraser、2×Taq PCR Master Mix、pMD18-T载体、大肠杆菌DH5α感受态细胞及胶回收试剂盒等购自TaKaRa公司,其他生化试剂均为进口分析纯。
1. 2 引物设计与合成
根据NCBI已公布的水牛HSP70基因mRNA预测序列(MH814759.1),通过Primer 5.0设计上、下游引物(5'-GAAGCTCATCTCGGAGCCGAA-3'和5'-TGGCTGATGAAAGGCAGATA-3'),并委托深圳华大基因科技有限公司合成。
1. 3 总RNA提取
采用TRIzol法提取水牛卵巢组织总RNA:剪碎水牛卵巢组织加入适量液氮研磨成细小的白色粉末,加入1 mL TRIzol,上下颠倒混匀,室温静置5 min后4 ℃下12000×g离心5 min,取上清液,加入200.0 μL氯仿,用力振荡15 s,室温静置5 min,自然分层;4 ℃下12000×g离心15 min,取上层水相500.0 μL,加入500.0 μL异丙醇,摇匀,室温放置10 min;4 ℃下12000×g离心10 min,可见RNA沉淀;弃上清液,加入1 mL预冷75%乙醇;4 ℃下12000×g离心5 min,弃上清液,干燥乙醇,加入30.0 μL DEPC水溶解RNA沉淀;紫外分光光度计检测总RNA含量及其完整性, -80 ℃保存备用。
1. 4 反转录合成cDNA
去除基因组DNA,反应体系10.0 μL:5×gDNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,总RNA 1.0 μg,RNase Free dH2O 6.0 μL;反应条件:42 ℃ 2 min。反转录体系20.0 μL:5×Fastking-RT Super Mix 4.0 μL,RNA模板5.0 μL,RNase Free ddH2O 11.0 μL;反转录程序:42 ℃ 15 min,85 ℃ 3 min。
1. 5 PCR扩增
PCR扩增反应体系25.0 μL:2×Taq PCR Master Mix 12.5 μL,上、下游引物(10 μmol/L)各0.5 μL,cDNA模板2.0 μL,ddH2O 9.5 μL。扩增程序:98 ℃预变性3 min;98 ℃ 5 s,60 ℃ 15 s,72 ℃ 20 s,进行30个循环;72 ℃延伸5 min。
1. 6 PCR产物连接及测序分析
依照胶回收试剂盒说明回收并纯化1.0%琼脂糖凝胶电泳分离的目的片段,然后与pMD18-T载体连接,转化DH5α感受态细胞,将菌液涂布至固体LB培养基(Amp抗性)上,37 ℃培养16 h,挑取单克隆菌斑进行菌液PCR鉴定,阳性菌液送至深圳华大基因科技有限公司测序。
1. 7 生物信息学分析
使用在线软件对克隆获得的水牛HSP70基因序列进行同源比对分析及构建系统发育进化树,并预测其编码蛋白结构、亲/疏水性、亚细胞定位及信号肽,具体生物信息学分析软件见表1。
1. 8 细胞免疫荧光分析
水牛成熟期卵母细胞及2-细胞期胚胎参照濮黎萍等(2017)的方法获得,然后以PBS将成熟卵母细胞及2-细胞期胚胎洗涤3次;在4%多聚甲醛中固定30 min,PBS洗涤3次;用1% Triton X-100通透细胞膜20 min,PBS洗涤3次,用1% BSA封闭1 h;加入一抗(Anti-Hsp70抗体[3A3],货号AB5439,含1% BSA的PBS,1∶200)后4 ℃孵育12 h,PBS洗涤3次,每次2 min;加入二抗(山羊抗小鼠IgG H&L,Alexa Fluor? 647,货号AB15011,含1% BSA的PBS,1∶500)室温孵育1 h,PBS洗涤3次,每次2 min;以抗荧光淬灭剂(含DAPI)进行封片,置于荧光显微镜下检测拍照,以检测HSP70在水牛成熟卵母细胞及2-细胞期胚胎中的表达情况。同时以含1% BSA的PBS代替一抗设为对照组。
2 结果与分析
2. 1 水牛HSP70基因克隆及测序结果
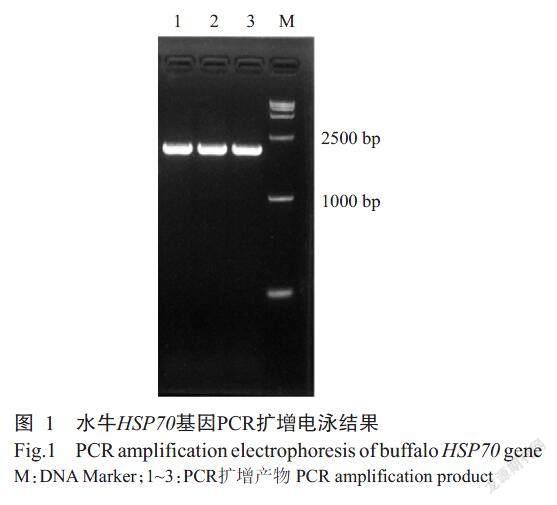
以1.0%琼脂糖凝胶电泳对PCR扩增产物进行检测,结果发现在2000 bp处附近出现与预期结果相符的清晰条带(图1)。经菌液PCR鉴定,同样得到约2000 bp的特异性条带,即初步判定为阳性克隆。测序结果显示,克隆获得的目的基因片段为2054 bp,其中编码区(CDS)长度为1926 bp。
2. 2 同源比对分析结果
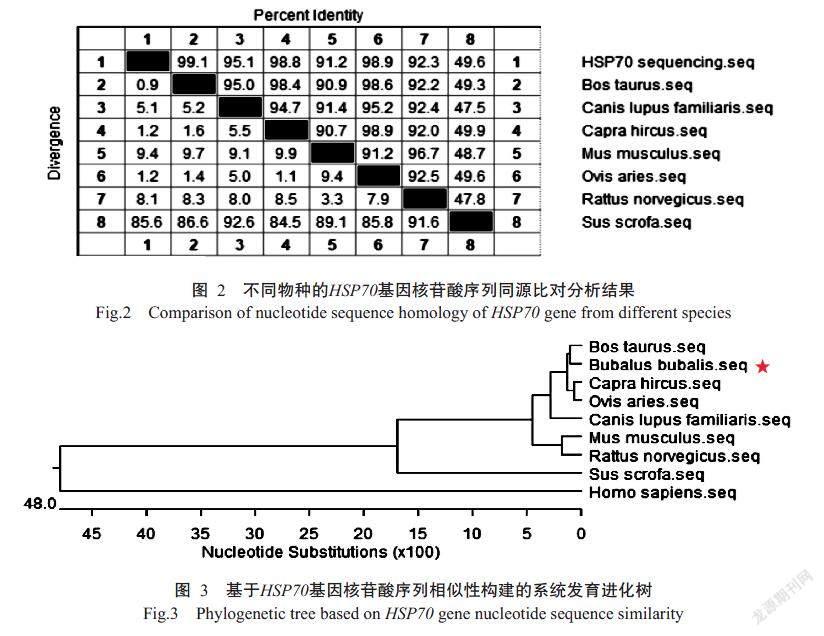
将克隆获得的目的基因序列与水牛HSP70基因mRNA预测序列(MH814759.1)进行BLAST比对分析,结果发现二者的相似性达97.7%;与其他物种的HSP70基因核苷酸序列进行BLAST比对分析,发现该基因序列与牛(Bos taurus,MN636872.1)、家犬(Canis lupus familiaris,NM_001003 067.2)、山羊(Capra hircus,JN604433.1)、小鼠(Mus musculus,EF100780.1)、绵羊(Ovis aries,JN604434.1)和大鼠(Ruttus norvegicus,L16764.1)的HSP70基因核苷酸序列具有较高的相似性(图2),其中与牛的相似性高达99.1%,与野猪(Sus scrofa,NM_00112 3127.1)的相似性也有49.6%,说明HSP70基因在物种间高度保守。利用MEGA 7.0构建基于HSP70基因核苷酸序列相似性的系统发育进化树,结果(图3)也显示,水牛与牛的亲缘关系最近,其次是山羊、绵羊和家犬,而与野猪的亲缘关系相对较远。
2. 3 HSP70蛋白理化性质及其结构预测分析结果
2. 3. 1 水牛HSP70蛋白基本理化性质 将克隆获得的水牛HSP70基因序列利用ORF Finder翻译成相应的氨基酸序列,结果发现其共编码641个氨基酸残基(图4)。ProtParam预测结果显示,水牛HSP70分子量为70.27 kD,分子式为C3088H4967N8670972S15,理论等电点(pI)为5.67,不稳定系数为32.84,属于稳定蛋白,含92个负电荷氨基酸[天冬氨酸(Asp)+谷氨酸(Glu)]及83个正电荷氨基酸[精氨酸(Arg)+赖氨酸(Lys)],其中丙氨酸(Alu)和高氨酸(Leu)含量較高,分别占8.9%和7.8%。
2. 3. 2 水牛HSP70蛋白跨膜性、信号肽、亚细胞定位及亲/疏水性预测结果 利用TMHMM 2.0进行蛋白跨膜性预测,结果发现水牛HSP70蛋白不包含跨膜结构,不属于跨膜蛋白(图5)。SignalP 4.1 Server预测结果显示,水牛HSP70蛋白不存在信号肽,即不属于分泌蛋白,在细胞内不进行跨膜运输(图6)。采用PSORTⅡ对水牛HSP70蛋白亚细胞定位情况进行预测,结果显示该蛋白主要定位于细胞质(60.9%)、细胞核(30.4%)及线粒体(8.7%)。以ProtScale预测水牛HSP70蛋白亲/疏水性,发现该蛋白亲水性较强(图7)。
2. 3. 3 水牛HSP70蛋白结构 利用DNAStar Pro-tean对水牛HSP70蛋白进行二级结构预测,结果发现其二级结构含有26个α-螺旋、38个β-折叠、24个β-转角及28个无规则卷曲,以α-螺旋和β-折叠为主(图8)。利用SWISS-MODEL进行同源建模预测水牛HSP70蛋白三级结构,同样发现该蛋白含有较多的α-螺旋和β-折叠结构(图9),与其二级结构预测结果一致。
2. 4 HSP70在水牛成熟卵母细胞及2-细胞期胚胎中的表达情况
采用细胞免疫荧光检测HSP70在水牛成熟卵母细胞及2-细胞期胚胎中的表达情况,结果显示, HSP70在水牛成熟卵母细胞及早期胚胎中均有表达,且主要集中在細胞质(图10)。
3 讨论
HSP70家族主要包括4类蛋白:(1)诱导型HSP70,主要存在于细胞核中,细胞受到应激后迅速大量产生;(2)结构型HSP70,存在于细胞浆中,为组成型表达,属于结构蛋白,其表达量与应激反应相关性不明显;(3)葡萄糖调节蛋白78,位于内质网中,在应激状态下略有表达;(4)葡萄糖调节蛋白75,主要位于线粒体中,其表达量受细胞能量代谢的影响。HSP70作为一种重要的分子伴侣,在蛋白折叠、解聚及降解中发挥重要作用(Zuiderweg et al.,2017),尤其在多种共伴侣蛋白如HSP40s的辅助下,能促进底物由HSP70转移至HSP90(Alvira et al.,2014),通过蛋白协同作用催化错误折叠的多肽展开,从而促使多肽自发重折叠(Luengo et al.,2018)。HSP70在抗细胞凋亡中也扮演重要角色,对胚胎发生、发育及维持细胞稳态至关重要(Baehrecke,2002)。在细胞凋亡信号传导过程中,高表达的HSP70直接或间接调节内源(线粒体依赖)和外源(死亡受体)的凋亡途径,HSP70基因敲低可促进细胞凋亡(Kumar et al.,2016)。
水牛具有适应性和抗病力强、耐高温高湿、耐粗饲、易饲养及使用年限长等生物学特性,但其繁殖力较低,限制了其产业的快速发展。在热带亚热带地区,夏季常出现35 ℃以上的高温高湿天气,高温高湿会引起水牛热应激,进而通过诱导氧化应激、促使细胞凋亡及阻碍细胞有丝分裂等机理抑制早期胚胎发育(屈平平等,2015)。因此,提高水牛耐热性是水牛产业发展亟待解决的重大问题,而研究抵抗热应激相关基因对促进水牛产业发展具有重要意义。HSP70基因可作为荷斯坦奶牛耐热性能和乳腺炎抗性等的评估指标(陈强等,2007;程维杰等,2008;梁学武等,2009),但至今在水牛中鲜有报道。本研究成功克隆获得水牛HSP70基因CDS序列,并运用DNAStar、MEGA 7.0、TMHMM 2.0及SignalP 4.1 Server等在线软件进行生物信息学分析,结果发现水牛HSP70基因序列与牛、家犬、山羊、小鼠、绵羊和大鼠的HSP70基因序列具有较高的相似性,其中与牛的相似性高达99.1%,说明不同物种间的HSP70基因较保守;基于HSP70基因核苷酸序列相似性构建的系统发育进化树也显示,水牛与牛的亲缘关系最近,而与野猪的亲缘关系相对较远,种属差异性较高,符合物种进化论学说,也说明HSP70基因具有种属特异性。此外,本研究通过细胞免疫荧光分析HSP70在水牛成熟卵母细胞及2-细胞期胚胎中的表达情况,结果表明,HSP70在水牛成熟卵母细胞及2-细胞期胚胎中均有表达,且主要集中在细胞质,综合其亚细胞定位分析结果,可判定为结构型HSP70,但其具体功能还有待进一步探究。
4 结论
水牛HSP70基因在进化过程中具有高度的保守性,在水牛成熟卵母细胞和着床前早期胚胎中均有表达,且主要集中在细胞质,属于结构型HSP70。
参考文献:
陈强,李忠浩,王根林. 2007. 奶牛HSP70基因多态性与生产性能的关系[J]. 江西农业学报,19(7):84-86. [Chen Q,Li Z H,Wang G L. 2007. Relationship between HSP70 gene polymorphism and production performance in dairy cows[J]. Acta Agriculturae Jiangxi,19(7):84-86.] doi:10.3969/j.issn.1001-8581.2007.07.027.
程维杰,李秋玲,王洪梅,孙延鸣,王长法,李建斌,仲跻峰. 2008. 荷斯坦牛HSP70-1基因遗传多态性与乳腺炎抗性关系分析[J]. 新疆农业科学,45(6):1187-1191. [Chen W J,Li Q L,Wang H M,Sun Y M,Wang C F,Li J B,Zhong J F. 2008. The relations between genetic polymorphism and mastitis resistance of holstein cattle HSP70-1 gene[J]. Xinjiang Agricultural Science,45(6):1187-1191.]
黄建芳,鄢胜飞,吴敏,陈秋明,周亭亭,蒋钦杨,郭亚芬,兰干球. 2015. 陆川猪热休克蛋白90基因的克隆与序列分析[J]. 南方农业学报,46(8):1505-1510. [Huang J F,Yan S F,Wu M,Chen Q M,Zhou T T,Jiang Q Y,Guo Y F,Lan G Q. 2015. Gene cloning and sequence analysis of heat shock protein 90 in Luchuan pig[J]. Journal of Sou-thern Agriculture,46(8):1505-1510.] doi:10.3969/j:issn. 2095-1191.2015.08.1505.
姜忠玲. 2006. 热应激对雄鼠生殖机能损伤的研究[D]. 哈尔滨:东北农业大学. [Jiang Z L. 2006. Study on heat stress on male rats reproductive function damage[D]. Harbin:Northeast Agricultural University.] doi:10.7666/d.y976131.
金欢胜,吴雄飞,金锡御,杨青浩,倪兵. 2005. HSP70基因的克隆与表达[J]. 免疫学杂志,21(3):201-204. [Jin H S,Wu X F,Jin X Y,Yang Q H,Ni B. 2005. Cloning and expression of HSP70 gene[J]. Immunological Journal,21(3):201-204.] doi:10.3969/j.issn.1000-8861.2005.03.011.
李小紅,罗珊,樊伟,曾珣,白瑜,秦朗,李尚为. 2017. HSP70在不同应激程度CUMS昆明小鼠胚胎中的表达及作用[J]. 四川大学学报(医学版),48(4):515-519. [Li X H,Luo S,Fan W,Zeng X,Bai Y,Qin L,Li S W. 2017. Expression of HSP70 in Kunming mouse embryos stimula-ted by chronic mild anticipatory stress[J]. Journal of Sichuan University(Medical Edition),48(4):515-519.] doi:10.13464/j.scuxbyxb.2017.04.003.
梁学武,杨毅,刘庆华,甘乾福,兰海娟. 2009. 奶牛HSP70表达量与温湿指数的相关性研究[J]. 中国农学通报,25(23):27-30. [Liang X W,Yang Y,Liu Q H,Gan Q F,Lan H J. 2009. Study on the relationship between heat stress protein 70 of dairy cow in blood lymphocytes and temperature humidity index[J]. Chinese Agricultural Scien-ce Bulletin,25(23):27-30.]
刘波,王美垚,谢骏,徐跑,戈贤平,何义进,缪凌鸿,潘良坤. 2011. 低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J]. 生态学报,31(17):4866-4873. [Li B,Wang M Y,Xie J,Xu P,Ge X P,He Y J,Miao L H,Pan L K. 2011. Effects of acute cold stress on serum biochemical and immune parameters and liver HSP70 gene expression in GIFT strain of Nile tilapia (Oreochromis niloticus)[J]. Acta Ecologica Sinica,31(17):4866-4873.]
牛杨莉,朱小佩,杨亚萍,葛晓敏,杜晓华,刘会超. 2019. 不同耐热三色堇材料HSP70基因克隆及热胁迫下的表达分析[J]. 河南农业科学,48(10):127-132. [Niu Y L,Zhu X P,Yang Y P,Ge X M,Du X H,Liu H C. 2019. Cloning and expression analysis of HSP70 gene in different heat-resistant pansy(Viola tricolor) materials under heat stress[J]. Journal of Henan Agricultural Sciences,48(10):127-132.] doi:10.15933/j.cnki.1004-3268.2019.10.019.
濮黎萍,候振,徐壮壮,陈富美,王焕景,黄凤玲,张明. 2017. 水牛波形蛋白基因克隆及其表达分析[J]. 南方农业学报,48(12):2266-2272. [Pu L P,Hou Z,Xu Z Z,Chen F M,Wang H J,Huang F L,Zhang M. 2017. Cloning and expression analysis of buffalo vimentin gene[J]. Journal of Southern Agriculture,48(12):2266-2272.] doi:10. 3969/j.issn.2095-1191.2017.12.24.
屈平平,李涛,胡士林. 2015. 热应激抑制哺乳动物早期胚胎发育的作用机理及Hsp70的保护作用[J]. 中国牛业科学,41(5):62-65. [Qu P P,Li T,Hu S L. 2015. The me-chanism of heat stress inhibiting early embryonic development in mammals and the protective effect of Hsp70[J]. China Cattle Science,41(5):62-65.] doi:10.3969/j.issn. 1001-9111.2015.05.016.
祁磊,張全伟,王琪,李宗帅,杜嘉祥,张勇,崔焕忠. 2019.‘岷县黑裘皮羊不同组织中HSP60基因的表达定位[J]. 甘肃农业大学学报,54(1):24-29. [Qi L,Zhang Q W,Wang Q,Li Z S,Du J X,Zhang Y,Cui H Z. 2019. Study on localization and expression of HSP60 gene in diffe-rent tissues of Minxian black-fur sheep[J]. Journal of Gansu Agricultural University,54(1):24-29.] doi:10.13432/j.cnki.jgsau.2019.01.004.
沈爱群,初磊,李莉,梁俊华,童晓文,李怀芳. 2016. 热休克蛋白70在异位子宫内膜细胞上皮间质化中的作用研究[J]. 同济大学学报(医学版),37(3):45-49. [Shen A Q,Chu L,Li L,Liang J H,Tong X W,Li H F. 2016. Expression of HSP70 in ectopic uterine endometrium and its relation to epithelial-mesenchymal transition[J]. Journal of Tongji University(Medical Sciences),37(3):45-49.] doi:10. 16118/j.1008-0392.2016.03.009.
吴庚香,尹太郎,杨菁,徐望明,李维,余楠,邹宇洁,张博,王雅琴. 2015. 多囊卵巢综合征大鼠卵巢HSP70及HSP90的表达研究[J]. 医学分子生物学杂志,(5):263-266. [Wu G X,Yin T L,Yang J,Xu W M,Li W,Yu N,Zou Y J,Zhang B,Wang Y Q. 2015. Expression of heat shock protein 70 and 90 in ovary tissues of rats with polycyst ova-rian syndrome[J]. Journal of Medical Molecular Biology,(5):263-266.] doi:10.3870/j.issn.1672-8009b.2015*.05ⅱ.004.
吴伟忠,刘康达,高艳琴,吴厚生,汤晓雷,汤钊猷. 2000. 热休克蛋白70的纯化及其抗小鼠肝癌作用的研究[J]. 中华肿瘤杂志, 22(2):96-98. [Wu W Z,Liu K D,Gao Y Q,Wu H S,Tang X L,Tang Z Y. 2000. Purification of hsp70 and its immunoprotective effect against mouse he-patoma[J]. Chinese Journal of Oncology,22(2):96-98.] doi:10.3760/j.issn:0253-3766.2000.02.002.
Alvira S,Cuéllar J,R?hl A,Yamamoto S,Itoh H,Alfonso C,Rivas G,Buchner J,Valpuesta J M. 2014. Structural chara-cterization of the substrate transfer mechanism in Hsp70/Hsp90 folding machinery mediated by Hop[J]. Nature Communications,5:5484. doi:10.1038/ncomms6484.
Baehrecke E H. 2002. How death shapes life during development[J]. Nature Reviews. Molecular Cell Biology,3(10):779-787. doi:10.1038/nrm931.
da Silva K P,Borges J C. 2011. The molecular chaperone Hsp70 family members function by a bidirectional heterotrophic allosteric mechanism[J]. Protein & Peptide Letters,18(2):132-142. doi:10.2174/092986611794475057.
Kumar S,Stokes J,Singh U P,Scissum Gunn K,Acharya A,Manne U,Mishra M. 2016. Targeting Hsp70:A possible therapy for cancer[J]. Cancer Letters,374(1):156-166. doi:10.1016/j.canlet.2016.01.056.
Luengo M T,Kityk R,Mayer M P,Rüdiger S G D. 2018. Hsp90 breaks the deadlock of the Hsp70 chaperone system[J]. Molecular Cell,70(3):545-552. doi:10.1016/j.molcel.2018.03.028.
Mayer M P,Bukau B. 2005. Hsp70 chaperones:Cellular functions and molecular mechanism[J]. Cellular & Molecular Life Sciences,62(6):670-684. doi:10.1007/s00018-004-4464-6.
Morii T,Ohtsuka K,Ohnishi H,Mochizuki K,Satomi K. 2010. Inhibition of heat-shock protein 27 expression elimi-nates drug resistance of osteosarcoma to zoledronic acid[J]. Anticancer Research,30(9):3565-3571.
Parsell D A,Lindquist S. 1993. The function of heat-shock proteins in stress tolerance:Degradation and reactivation of damaged proteins[J]. Annual Review of Genetics,27:437-496. doi:10.1146/annurev.ge.27.120193.002253.
Ritossa F,Scalenghe F,Turi N D,Contini A M. 1974. On the cell stage of X-Y recombination during rDNA magnification in Drosophila[J]. Cold Spring Harbor Symposia on Quantitative Biology,38:483-490. doi:10.1101/sqb.1974. 038.01.052.
Ritossa F. 1962. A new puffing pattern induced by temperature shock and DNP in Drosophila[J]. Experientia,18:571-573. doi:10.1007/BF02172188.
S?rensen J G,Kristensen T N,Loeschcke V. 2003. The evolutionary and ecological role of heat shock proteins[J]. Ecology Letters,6(11):1025-1037. doi:10.1046/j.1461-0248.2003.00528.x.
Witkin S S,Kanninen T T,Sisti G. 2017. The role of Hsp70 in the regulation of autophagy in gametogenesis,pregnancy,and parturition[J]. Advances in Anatomy,Embryology,and Cell Biology,222:117-127. doi:10.1007/978-3-319-51409-3_6.
Xie F,Zhan R,Yan L C,Gong J B,Zhao Y,Ma J,Qian L J. 2016. Diet-induced elevation of circulating HSP70 may trigger cell adhesion and promote the development of athe-rosclerosis in rats[J]. Cell Stress & Chaperones,21(5):907-914. doi:10.1007/s12192-016-0716-2.
Zuiderweg E R P,Hightower L E,Gestwicki J E. 2017. The remarkable multivalency of the Hsp70 chaperones[J]. Cell Stress & Chaperones,22(2):173-189. doi:10.1007/s12192- 017-0776-y.
(責任编辑 兰宗宝)
