茶树花青素形成分子机理的研究进展
2021-09-10庞丹丹韦康
庞丹丹 韦康
摘要:花青素是由类黄酮合成途径产生的次生代谢产物,含量高时会使茶树新梢呈现红色或紫色。同时,花青素相比儿茶素等具有更明显的抗氧化、预防肿瘤等药理保健作用。文章就茶树花青素合成途径、转录及转录后调控等方面进行综述,以期更好地为高花青素茶树的育种研究提供理论依据。
關键词:茶树;花青素;形成;调控
Research Advance on Molecular Mechanism of
Anthocyanin Formation in Tea Plants
PANG Dandan1, WEI Kang2*
1. Tea Research Institute, Yunnan Academy of Agricultural Sciences/Yunnan Provincial Key Laboratory for Tea Science/Yunnan
Technology Engineering Research Center of Tea Germplasm Innovation and Supporting Cultivation, Menghai 666201, China;
2. Tea Research Institute, Chinese Academy of Agricultural Sciences/National Center for Tea Improvement/Key Laboratory of
Tea Biology and Resources Utilization, Ministry of Agriculture, Hangzhou 310008, China
Abstract: Anthocyanins are crucial secondary metabolites produced by the flavonoid synthesis pathway. Their accu-mulations result in the formation of red or purple shoots in tea plants. Meanwhile, anthocyanins have many health effects such as anti-oxidation and cancer prevention. In this paper, anthocyanin biosynthesis pathway, transcription and post-transcriptional regulation in tea plants were reviewed, which would provide a better theoretical basis for theresearch of hype accumulation of anthocyanins in tea plants.
Keywords: tea plant (Camellia sinensis), anthocyanins, formation, regulation
茶叶中含有大量具有保健功能的多酚类物质,其中花青素是茶树次生代谢产生的类黄酮化合物的一种,是天然食用色素的重要来源[1]。花青素有助于人体消除自由基,具有抗氧化、预防心脑血管疾病及抗癌等药理保健作用[2-4],因此,富含花青素的紫娟、紫嫣和红芽佛手等紫芽茶越来越受人们的关注。茶树芽叶紫化性状是特色茶树品种改良的重要内容,探明茶树芽叶花青素合成的分子机理在理论和应用中均具有重要意义。
一、茶树中花青素的种类
花青素,又名花色素,是一种重要的水溶性色素,为性质稳定的色原烯衍生物[5]。自然状态下,花青素主要以花色苷的形式存在,通过形成糖苷键的方式与葡萄糖、半乳糖或鼠李糖等结合。紫化茶树种质资源中花青素含量相对常规的茶树品种高,一般茶叶中花青素含量约占干物重的0.01%,紫芽茶中的含量可高达0.5%~1.0%。目前,对于紫娟、紫嫣等特异紫色芽叶茶树花青素组分的研究已开展较多。紫娟的花青素成分主要是飞燕草-3-O-半乳糖苷、矢车菊素-3-O-半乳糖苷、飞燕草-3-O-(6-香豆酰)-半乳糖苷和矢车菊素-3-O-(6-香豆酰)-半乳糖苷,且新梢红紫化程度较高,主要集中于幼嫩芽叶,成熟叶片花青素含量较少[6]。紫嫣的花青素成分主要是矢车菊素和飞燕草素等[7]。在上述2个茶树品种中,飞燕草素及其糖苷衍生物是最主要的色素组分,此外还有少量的天竺葵色素及其糖苷。
二、花青素在茶树中的生物合成与转运
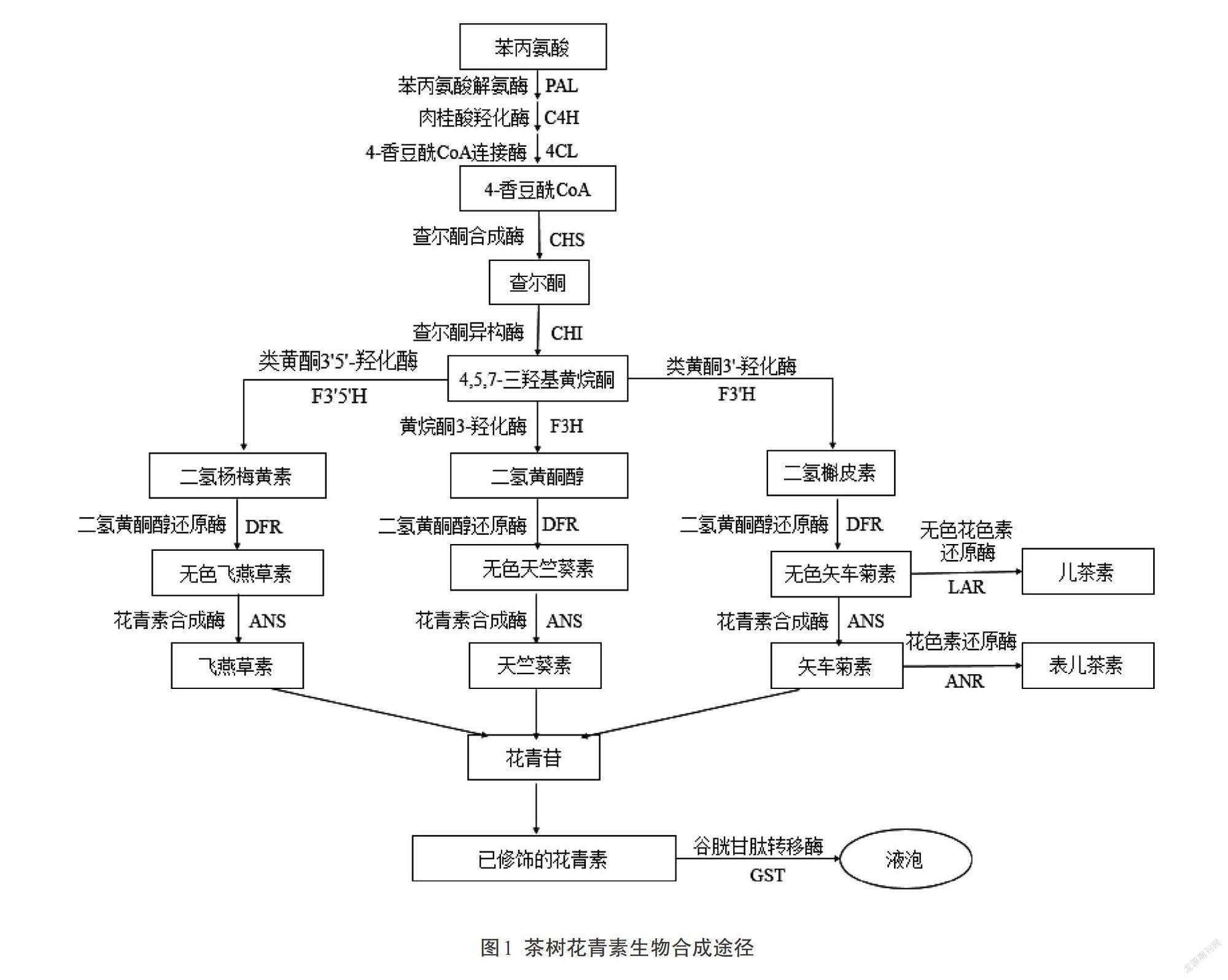
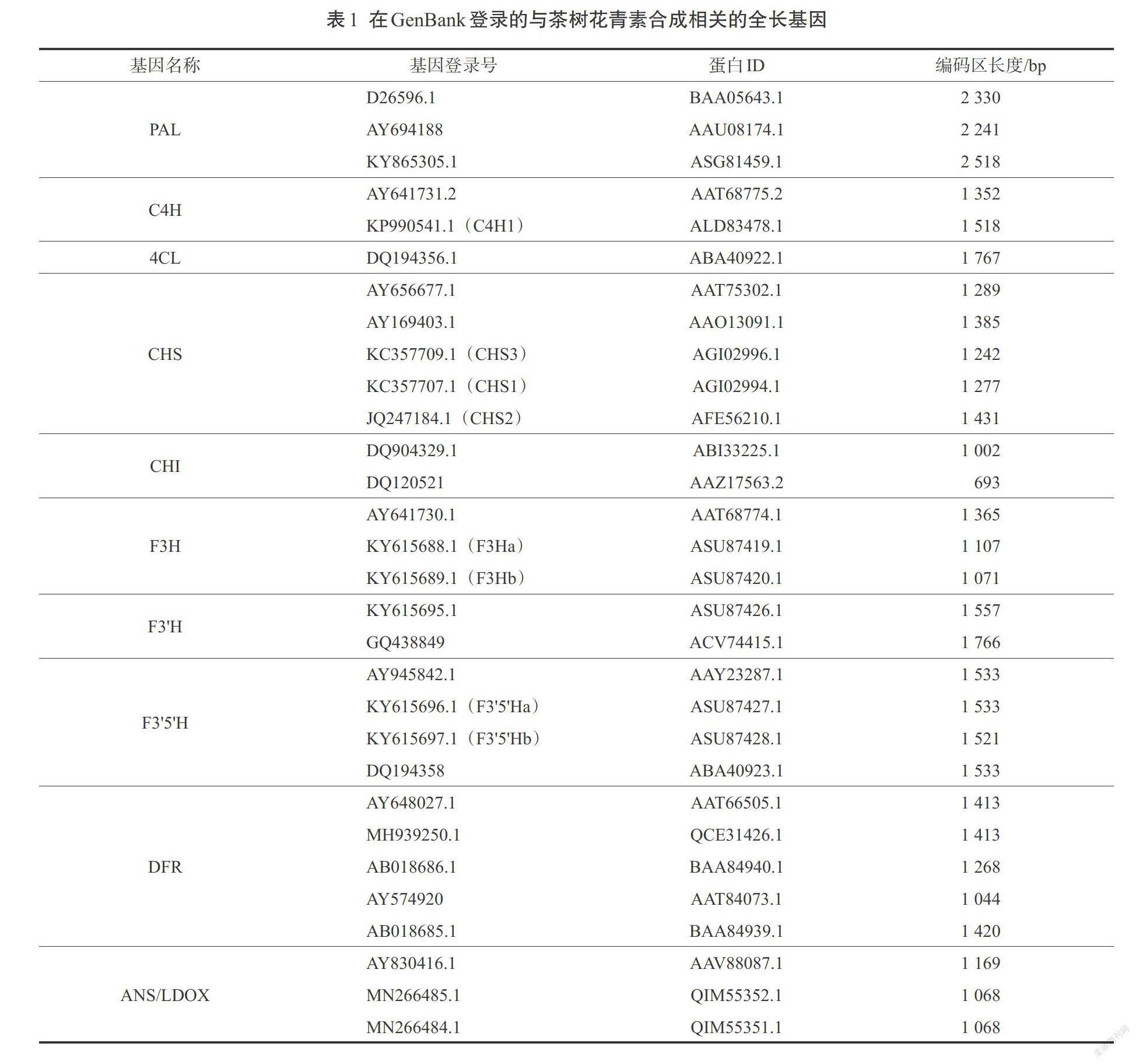
植物花青素生物合成途径已被很好地鉴定,并且这一代谢途径在不同物种中是高度保守的。茶树中花青素的合成途径主要包括苯丙烷途径、类黄酮合成途径(图1)[8],其生物合成需要经过一系列的酶促氧化反应,其中涉及到多种酶类:苯丙氨酸脱氨酶(PAL)、肉桂酸羟化酶(C4H)、4-香豆酰CoA连接酶(4CL)、查尔酮合成酶(CHS)、查耳酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、类黄酮3'-羟化酶(F3'H)、类黄酮3',5'-羟化酶(F3'5'H)、二氢黄酮醇还原酶(DFR)、花青素合成酶(ANS)等[9]。首先,苯丙氨酸作为花青素合成途径的前体物质,在PAL、C4H和4CL的作用下合成4-香豆酰CoA[10];然后,香豆酰CoA进入类黄酮合成途径,CHS催化香豆酰CoA和丙二酰CoA生成查尔酮,进而在CHI和F3H的作用下合成柑橘素和二氢山柰酚(DHK),DHK被F3'H或F3'5'H进一步催化产生二氢杨梅素(DHM)或二氢槲皮素(DHQ),其中F3'H和F3'5'H是花青素合成途径的两个关键酶,两者通过决定花青素B环羟基化类型从而决定花青素的种类[11];之后,底物DHK、DHM及DHQ可在DFR、ANS等酶的催化下生成不同颜色稳定的花色苷;最终,花青素经过各种修饰被转运至液泡中储存。目前,NCBI已登录的茶树中花青素合成途径的基因搜索结果见表1,尚没有登录花青素糖基化修饰及转运相关酶的编码基因。
花青素合成后的运输主要包括囊泡运输及连接蛋白运输两种模式,过程较复杂,细胞质中合成的花色素苷通过几种与转运蛋白相关的途径转移到液泡中,如ABC转运蛋白、谷胱甘肽转移酶(GST)等[12]。GST是目前研究最为深入的花色苷转运蛋白,其中GSTF和GSTU型是植物特有的,且GSTF是研究发现最多的与类黄酮物质积累相关的家族,其直接作为配体蛋白,参与花青素、原花青素的转运[8]。前期,研究人员主要是利用转录组测序的手段筛选获得茶树中花青素转运相关的候选基因。通过对正常光照和遮阴处理的不同茶样的转录组测序,张亚真等[13]发现CsGSTF1的基因表达量随着芽叶的发育显著下降,且与拟南芥中负责转运花青素和原花青素的AtGSTF12高度相似,推测CsGSTF1可能与茶树中花青素的转运有关,进而造成花青素的积累。Wei等[14]对遗传群体中分化的绿芽或紫芽茶树的一芽二叶进行转录组分析,发现相对于绿芽茶树,紫芽茶树中花青素晚期生物合成基因3GT(3.2倍和2.1倍)、ANS(1.6倍)和转运相关的基因CsGSTF1(4.6倍)的表达量相对较高,推测茶树中花青素的积累与后期修饰、转运能力的强弱息息相关。Wei等[15]进一步基于代谢组学、转录组学及QTL定位等方法,验证了CsGSTF1表达与紫芽性状的关联性;在拟南芥tt19-8突变体(AtGSTF12缺陷型突變体)中过表达CsGSTF1发现,CsGSTF1能够恢复tt19-8突变体的花青素缺失表型,但不能恢复其透明种皮的表型(与原花青素累积有关),证实了CsGSTF1是专一性参与花青素累积的关键基因,其表达水平直接决定茶叶中花青素的积累量。Liu等[16]通过体外重组试验也发现3个重组CsGSTs中,只有CsGSTF1对花青素表现出较高的亲和力,进一步说明了该基因的重要性。
三、茶树中花青素合成的转录调控
虽然类黄酮的合成途径已经清晰,合成途径的相关酶类基因也基本明确,但由于花青素类化合物种类复杂,涉及到多个代谢途径,如苯丙烷途径、类黄酮合成途径等,并形成多种产物,它们的合成途径存在许多交叉点,也意味着合成调控的复杂性。花青素的代谢途径的关键酶类决定了最终形成的花青素种类,而转录因子则被认为是调控花青素积累的主要因素之一。以往大量的研究表明,MYB、bHLH、WD40这3类蛋白是参与花青苷合成的主要转录调控因子,上述3种转录因子自身特殊结构的调控或者协同形成转录激活复合物(MBW复合物),与花青苷生物合成的结构基因的启动子相结合,达到激活或抑制不同基因的表达,参与生物合成的多个酶促步骤,进而调控花青素的合成[17-19]。
MYB是研究较多的茶树中花青素、儿茶素等类黄酮化合物调控转录因子,同时也是花青素生物合成中MBW复合体的主要决定因子[20]。例如,拟南芥中MYB75(PAP1)、MYB90(PAP2)、MYB113(PAP3)和MYB114(PAP4)均可与TT8/GL3及TTG1(WD40)形成相应的4种MBW复合物,激活晚期花青素生物合成基因AtDFR、AtANS/LDOX和AtUF3GT的表达,进而导致野生型植株中花青素的大量积累[18];苹果中MdMYB1、MdMYBA和MdMYB10等多个MYB家族基因被克隆与鉴定,并且相关研究表明上述基因是控制果皮花青苷合成的关键因子,它们的转录水平总是与果实花青苷的积累呈正相关[21-23]。在茶树中,通过转录组测序的方式,筛选得到多个与调控花青素积累相关的MYB候选基因。Wei等[14]对茶树芽叶颜色分化遗传群体中紫芽与绿芽单株进行转录组分析,其中CsMYB75与拟南芥中调控花青素合成的AtPAP1高度相似。近期,CsMYB75被证实可以作用花青素转运CsGSTF1基因的启动子,促进紫芽茶花青素的积累[15]。He等[24]发现CsMYB75的表达与AtMYB113最为相似,并且在调控花青素合成方面一致,特异性地使得CHS和花青素3-O-葡糖糖基转移酶基因(A3T)显著上调表达,从而促进紫色芽叶中类黄酮物质的积累。Sun等[25]研究认为1个与拟南芥MYB75同源的CsAN1(即CsMYB75)是紫娟茶树芽叶紫化的关键因子,CsMYB75瞬时转入本氏烟草,促进了其花青素的积累;酵母双杂及双分子荧光互补等试验表明,该基因能够与CsGL3、CsEGL3互作,通过形成MBW复合物调控花青素合成基因CsLDOX的表达;同时CsAN1的表达水平也受表观遗传的调控,CsAN1的表达量与启动子的低甲基化水平呈正相关。该研究从转录水平上初步阐明了茶树花青素合成的分子机制。近期,王留彬等[26]发现CsMYB75基因与前期控制茶树新梢颜色的QTL实现共定位,该研究从遗传学角度进一步证实了CsMYB75参与茶树花青素合成过程的调控。
除MYB之外,bHLH转录因子是植物中类黄酮相关的第二大转录因子家族,WD40则属于被认识的较少的转录因子。茶树中bHLH和WD40这2种转录因子在调控茶树花青素生物累积方面的研究也较少。相关研究主要是利用基因芯片、茶树基因组及转录组测序鉴定得到了多个与茶树中花青素富集的候选基因bHLH和WD40[27-28],其具体的调控机制有待进一步验证。
四、茶树中花青素合成的转录后水平的调控
随着现代分子生物学技术的快速发展,除了参与植物生长发育和胁迫反应外,miRNA对于初级和次级代谢也发挥着重要的作用。研究表明,在转录后水平上miRNA对植物花青素的合成具有不可替代的调控作用。植物中已报道的与花色素生物合成调控相关的家族有miR156、miR828、miR858和miR165/166等,不同miRNA家族对花色素生物合成的调控机制各异。miR828可诱发TAS4转录本的剪切,调节拟南芥和苹果中MYB家族转录因子的表达[29-30];miRNA156通过靶向SPL转录因子,影响MYB-bHLH-WD40复合体的转录激活活性,从而抑制ANS和DFR等基因的表达,参与调控花青素的生物合成[31];miRNA858通过靶向MYB12转录因子基因参与调控CHS和FLS的表达影响黄酮醇的合成,间接影响花青素的含量[32];miRNA165/166主要是通过其靶基因负向调控花青素的生物合成来影响植物色泽[33]。
目前,关于茶树花青素代谢的研究主要集中在MYB/bHLH/WD对花青素生物合成途径转录水平的调控,与其他植物相比,茶树中miRNA的研究起步较晚,主要是利用高通量测序、生物信息学鉴定、植物芯片等技术筛选得到茶树中大量miRNA,并发现其在生物、非生物胁迫及儿茶素、萜类物质合成方面起着调控作用,而对于探究miRNA在紫化芽叶茶树花青素积累中的作用的研究较少。陈林波等[34]对紫芽茶树紫娟、绿芽茶树云抗10号和福鼎大白茶进行miRNA测序,发现miRNA828a在紫娟叶片中差异表达,基于测序数据对miRNA828a的靶基因进行预测,结果发现miR828a靶向MYB转录因子的多个基因,推测miR828a靶向MYB类转录因子参与调控茶树花青素的生物合成。
五、展望
花青素是一种具有保健功能的多酚类物质,对人体具有较好的降压、减肥、降脂、预防心脑血管疾病和改善视力、预防眼部疲劳等功效;同时,花青素作为一种天然抗氧化剂,在茶树抵御过高光强、低温等逆境胁迫中具有一定的保护作用。因此,人们对选育特异紫色芽叶茶树品种、开发富含花青素的功能性茶产品越来越关注[35]。
近年来,茶树中花青素生物合成途径较为清晰,相关的大部分结构基因已得到分离与鉴定,茶树紫化芽叶形成的调控研究已经取得了較大进展,但仍不足以揭示其复杂的调控机理。因此,借助功能基因组学、蛋白组学、代谢组学及表观遗传学等技术手段,进一步挖掘调控花青素合成的新基因,并对其功能和表达调控的内在机理进行探究,有助于为富含花青素的茶树品种的培育及高花青素保健茶产品的开发利用提供更为坚实的理论基础。
参考文献
[1] 宛晓春. 茶叶生物化学[M]. 北京: 中国农业出版社, 2003: 8-15.
[2] BHATTACHARYA U, ADAK S, MAJUMDER N, et al. Antimutagenic and anticancer activity of Darjeeling tea in multiple test systems[J]. BMC Complementary and Alternative Medicine, 2014, 14(1): 1-10.
[3] KATSUHIKO F, TADASHI I, YUKIHIKO H. Antibacterial activity of tea polyphenols against phytopathogenic bacteria[J]. Agricultural and Biological Chemistry, 1991, 55(7): 1895-1897.
[4] MATSUO N, YAMADA K, SHOJI K, et al. Effect of tea polyphenols
on histamine release from rat basophilic leukemia (RBL-2H3) cells: the structure-inhibitory activity relationship[J]. Allergy, 2010, 52(1):58-64.
[5] HOLTON T A, CORNISH E C. Genetics and biochemistry of anthocyanin biosynthesis[J]. Plant Cell, 1995, 7(7): 1071-1083.
[6] 蒋会兵, 孙云南, 李梅, 等. 紫娟茶树叶片不同发育期花青素积累及合成相关基因的表达[J]. 茶叶科学, 2018, 38(2): 174-182.
[7] LAI Y S, LI S, TANG Q, et al. The dark-purple tea cultivar 'Ziyan' accumulates a large amount of delphinidin-related anthocyanins[J]. Journal of Agricultural and Food Chemistry, 2016, 64(13): 2719-2726.
[8] 张亚真, 张芬, 王丽鸳, 等. 植物谷胱甘肽转移酶在类黄酮累积中的作用[J]. 植物生理学报, 2015, 51(11): 1815-1820.
[9] SCHÄFFNER A R. Flavonoid biosynthesis and arabidopsis genetics: more good music[J]. Journal of Experimental Botany, 2016, 67(5): 1203-1204.
[10] 李莉, 赵越, 马君兰. 苯丙氨酸代谢途径关键酶: PAL、C4H、4CL研究新进展[J]. 生物信息学, 2007(4): 187-189.
[11] SCHWINN K, MIOSIC S, DAVIES K, et al. The B-ring hydroxylation pattern of anthocyanins can be determined through activity of the flavonoid 3'-hydroxylase on leucoanthocyanidins[J]. Planta, 2014, 240(5): 1003-1010.
[12] ALFENITO M R, SOUER E, GOODMAN C D, et al. Functional complementation of anthocyanin sequestration in the vacuole by widely divergent glutathione S-transferases[J]. The Plant Cell, 1998, 10(7): 1135-1149.
[13] 張亚真, 韦康, 王丽鸳, 等. 基于转录组测序对茶树GST基因表达的研究[J]. 茶叶科学, 2016, 36(5): 513-522.
[14] WEI K, ZHANG Y Z, WU L Y, et al. Gene expression analysis of bud and leaf color in tea[J]. Plant Physiology and Biochemistry, 2016, 107: 310-318.
[15] WEI K, WANG L Y, ZHANG Y Y, et al. A coupled role for CsMYB75 and CsGSTF1 in anthocyanin hyperaccumulation in purple tea[J]. Plant Journal, 2019, 97(5): 825-840.
[16] LIU Y J, JIANG H, ZHAO Y, et al. Three Camellia sinensis glutathi- one S-transferases are involved in the storage of anthocyanins, fla- vonols, and proanthocyanidins[J]. Planta, 2019, 250(4): 1163-1175.
[17] MANO H, OGASAWARA F, SATO K, et al. Isolation of a regulatory gene of anthocyanin biosynthesis in tuberous roots of purple-fleshed sweet potato[J]. Plant Physiology, 2007, 143(3): 1252-1268.
[18] GONZALEZ A, ZHAO M, LEAVITT J M, et al. Regulation of the anthocyanin biosynthetic pathway by the TTG1/bHLH/Myb transcriptional complex in Arabidopsis seedlings[J]. Plant Journal, 2008,53(5): 814-827.
[19] TAO R Y, YU W J, GAO Y H, et al. Light-induced basic/helix-loop-helix 64 enhances anthocyanin biosynthesis and undergoes constitutively photomorphogenic 1-mediated degradation in pear [J]. Plant Physiology, 2020, 184(4): 1684-1701.
[20] HTAY N A, KIL K C. Roles of R2R3-MYB transcription factors in
transcriptional regulation of anthocyanin biosynthesis in horticultural plants[J]. Plant Molecular Biology, 2018, 98(1): 1-18.
[21] ESPLEY R V, HELLENS R P, PUTTERILL J, et al. Red colouration in apple fruit is due to the activity of the MYB transcription factor, MdMYB10[J]. Plant Journal, 2007, 49(3): 414-427.
[22] BAN Y, HONDA C, HATSUYAMA Y, et al. Isolation and functional analysis of a MYB transcription factor gene that is a key regulator for the development of red coloration in apple skin[J]. Plant and Cell Physiology, 2007, 48(7): 958-970.
[23] TAKOS A M, JAFFE F W, JACOB S R, et al. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J]. Plant Physiology, 2006, 142(3): 1216-1232.
[24] HE X J, ZHAO X C, GAO L P, et al. Isolation and characterization of key genes that promote flavonoid accumulation in purple-leaf tea (Camellia sinensis L.)[J]. Scientific Reports, 2018, 8(1): 130.
[25] SUN B M, ZHU Z S, CAO P R, et al. Purple foliage coloration in tea (Camellia sinensis L.) arises from activation of the R2R3-MYB transcription factor CsAN1[J]. Scientific Reports, 2016, 6: 32534.
[26] 王留彬, 周斌, 彭敏, 等. 茶树CsAN1基因的表达, 连锁定位及其与新梢颜色的关系研究[J]. 四川农业大学学报, 2019, 37(6): 814-820.
[27] 马春雷, 姚明哲, 王新超, 等. 利用基因芯片筛选茶树芽叶紫化相关基因[J]. 茶叶科学, 2011, 31(1): 59-65.
[28] 蒋会兵, 夏丽飞, 田易萍, 等. 基于转录组测序的紫芽茶树花青素合成相关基因分析[J]. 植物遗传资源学报, 2018, 19(5): 967-978.
[29] HSIEH L C, LIN S I, SHIH A C C, et al. Uncovering small RNA- mediated responses to phosphate deficiency in Arabidopsis by deep sequencing[J]. Plant Physiology, 2009, 151: 2120-2132.
[30] CHEN H M, CHEN L T, PATEL K, et al. 22-nucleotide RNAs trigger secondary siRNA biogenesis in plants[J]. Proceedings of the National Academy of Sciences, 2010, 107(34): 15269-15274.
[31] GOU J Y, FELIPPES F F, LIU C, et al. Negative regulation of anthocyanin biosynthesis in Arabidopsis by a miR156-targeted SPL transcription factor[J]. The Plant Cell, 2011, 23: 1512-1522.
[32] CHEN Q J, DENG B H, GAO J, et al. Comparative analysis of miRNA abundance revealed the function of Vvi-miR828 in fruit coloring in root restriction cultivation grapevine (Vitis vinifera L.)[J]. International Journal Molecular Sciences, 2019, 20: 4058.
[33] YAN J, GU Y Y, JIA X J, et al. Effective small RNA destruction by the expression of a short tandem target mimic in Arabidopsis[J]. The Plant Cell, 2012(2): 415-427.
[34] 陳林波, 夏丽飞, 刘悦, 等. 基于高通量测序筛选‘紫娟’花青素合成相关的miRNA[J]. 茶叶科学, 2019, 39(6): 681-691.
[35] 李强, 项建, 郑国杨, 等. 我国叶色特异茶树品种选育推广与产业化发展探析[J]. 中国茶叶, 2020, 43(9): 52-57.