西藏黑斑原鮡消化道寄生蠕虫的群落结构和感染情况
2021-09-08潘瑛子
潘瑛子
(西藏自治区农牧科学院水产科学研究所, 西藏土著鱼类繁育与利用技术工程研究中心, 拉萨 850032)
鱼类寄生蠕虫种类包括绦虫、单殖吸虫、复殖吸虫、盾腹吸虫、线虫和棘头虫, 其群落由一定时间内寄生于一定空间内某种鱼类或所有鱼类的蠕虫种群的集合构成, 结构特征包括物种组成、多样性和优势物种三方面[1]。
西藏位于青藏高原西南部, 拥有着独特而复杂的地理环境, 包括多样的地形、多变的气候、相对较低的纬度等, 水资源十分丰富。西藏特殊的环境造就了特殊的鱼类区系[2], 各水系中的鱼类由于长期地理隔离, 演化出特有种甚至是特有属[3]。如隶属于鲇形目(Siluriformes)、鮡科(Sisoridae)、原鮡属(Glyptosternum)的黑斑原鮡(Glyptosternum maculatum), 是中国唯一的原鮡属鱼类[4—6], 在中国仅分布于雅鲁藏布江, 也是雅鲁藏布江中唯一分布于海拔4200 m以上江段的鮡科鱼类[7,8]。由于黑斑原鮡的特殊性, 它成为了全面研究中国鮡科鱼类系统发育, 以及生物地理学和高原适应进化机制的重要物种[9—12], 对它的研究包括个体生物学[13—18]、遗传学[19—22]、群体形态[4—6]、微生物群落[23]和人工繁育[5,24,25]等诸多方面, 其基因组草图[26]也已公布。但黑斑原鮡寄生虫的相关研究, 却未见报道。西藏鱼类寄生虫的研究非常有限, 除新种的报道[27—29]外, 李文祥等[30]对雅鲁藏布江支流拉萨河土著鱼类体内寄生蠕虫的群落结构特征进行了研究, 在5种裂腹鱼和1种高原鳅的腹腔和消化道中共发现寄生蠕虫10种, 其中, 裂腹鱼寄生蠕虫物种组成相似, 多样性指数较高, 优势物种为线虫和棘头虫。潘瑛子等[31]总结了这些研究成果, 初步推测西藏的鱼类寄生虫组成与中国其他地区存在差异, 其区系组成与西藏鸟类区系密切相关。近期对哲古措土著鱼类消化道寄生蠕虫群落结构及感染情况[32]的研究结果也印证了上述推测, 该研究在高原裸鲤(Gymnocypris waddellii)消化道中发现了5种寄生蠕虫, 大部分为广布性寄生虫, 鸟类在其传播过程中起到了重要作用; 该群落的Shannon-Wiener多样性指数为0.70—1.27, Berger-Parker优势度指数为0.38—0.76,优势类群为线虫, 线虫的种群动态表现出一定的季节性, 但复殖吸虫、绦虫和棘头虫四季的感染率和平均丰度均较低,异尾高原鳅(Triplophysa stewartii)的消化道中未发现任何寄生蠕虫。
黑斑原鮡和拉萨河土著鱼类均分布于雅鲁藏布江, 它们消化道中的寄生蠕虫种类组成是否较为相似呢? 其群落结构会呈现出怎样的特点? 在整个群体及不同性别、不同全长群体中, 消化道寄生蠕虫各个种群的感染情况又是怎样的? 本文将分析黑斑原鮡消化道寄生蠕虫群落结构及感染情况, 进一步明确西藏土著鱼类寄生蠕虫的种类组成和寄生特点, 为研究体内寄生蠕虫的环境适应性及与宿主的协同进化提供基础资料。
1 材料与方法
1.1 寄生蠕虫样品的采集、保存
2019年5—8月, 样品采集工作于西藏自治区农牧科学院水产科学研究所雅鲁藏布江渔业资源繁育基地内进行。将黑斑原鮡胃及肠道剪开, 用手术刀刮取内容物置于10 cm×10 cm的玻璃板中央, 盖上相同大小的玻璃板, 压平后在重庆光电HG880323便携式解剖镜下进行观察。将观察到的蠕虫取出,按虫种分别存放于装有0.65%生理盐水的不同培养皿中。待一批样品观察完毕后, 将虫体洗净, 用70%乙醇和100%乙醇保存, 分别用于形态学鉴定和分子生物学检测。
1.2 消化道寄生蠕虫的种类鉴定
形态学与分子生物学方法相结合对消化道寄生蠕虫种类进行鉴定。形态学鉴定在综合实验楼病理检测实验室进行, 对属和种的判断参考书籍[1,33]中各类寄生蠕虫的分类检索表和形态特征。测序使用Sanger法, 复殖吸虫测序的mtDNA为12S, 线虫则分别对12S mtDNA和18S rDNA进行了测序, 并获取了绦虫和棘头虫的18S rDNA、ITS基因序列及线粒体基因组全序列。其中, 原头绦虫未定种和新棘吻虫未定种还对ITS序列进行了测序。将获取的基因序列在NCBI数据库中进行比对。
1.3 数据的统计与分析
用直尺和电子秤对黑斑原鮡的全长和体重进行测量, 记录性别, 并对寄生蠕虫的种类及数量进行统计。群落多样性和种群优势度分别用Shannon-Wiener指数和Berger-Parker指数来衡量, Shannon-Wiener指数SW=-∑pilnpi,pi为第i种寄生虫的数量与所有寄生虫数量的比值, Berger-Parker指数BP=nmax/n-1,n是所有寄生虫个体数量的总和,nmax是感染丰度最大的一类寄生虫数量[1]。计算感染率、感染强度和平均丰度, 感染强度为某种寄生虫感染数量最小值和最大值的范围, 感染率=N′/N,平均丰度=n′/N,N′为被某种寄生虫感染的鱼类样本数,N为鱼类样本总数,n′为某种寄生虫的总数[1], 平均丰度用“平均值±标准差”表示。用WPS表格2019对数据进行统计和计算, 用Olympus SZX16体视显微镜和cellSens Entry图像分析软件对虫体进行拍照。
2 结果
2.1 宿主黑斑原鮡的性别及全长
共解剖黑斑原鮡383尾, 其中, 雌性145尾, 雄性202尾, 解剖后仍无法判定性别的36尾。其全长为11.00—34.00 cm, 平均全长(20.89±5.36) cm。
2.2 黑斑原鮡消化道寄生蠕虫的物种组成
在黑斑原鮡消化道中, 共采集到绦虫2种, 复殖吸虫1种, 棘头虫2种, 线虫2种(表 1)。其中, 1种棘头虫为裸鲤棘头虫(E. gymnocyprii)[33], 对盲囊属线虫为C. eudyptulae, 其他寄生蠕虫为未定种。

表1 黑斑原鮡消化道寄生蠕虫的物种组成Tab. 1 Species composition of gastrointestinal helminths of G. maculatum in Tibet Autonomous Region
深槽绦虫未定种 该虫体型较大, 背腹扁平,身体分节, 头节具沟槽, 无钩或棘, 未成熟节片宽大于长, 成熟节片宽与长较为接近, 妊娠节片长大于宽。每个节片有生殖器官1套, 均分布于髓部, 子宫中位, 形状不规则, 卵巢位于子宫后, 形状亦不规则,卵黄腺疏散分布于生殖器官四周, 阴茎囊横列于阴道口内侧。生殖孔随机开口于虫体每个节片边缘中部。卵椭圆形(图 1)。
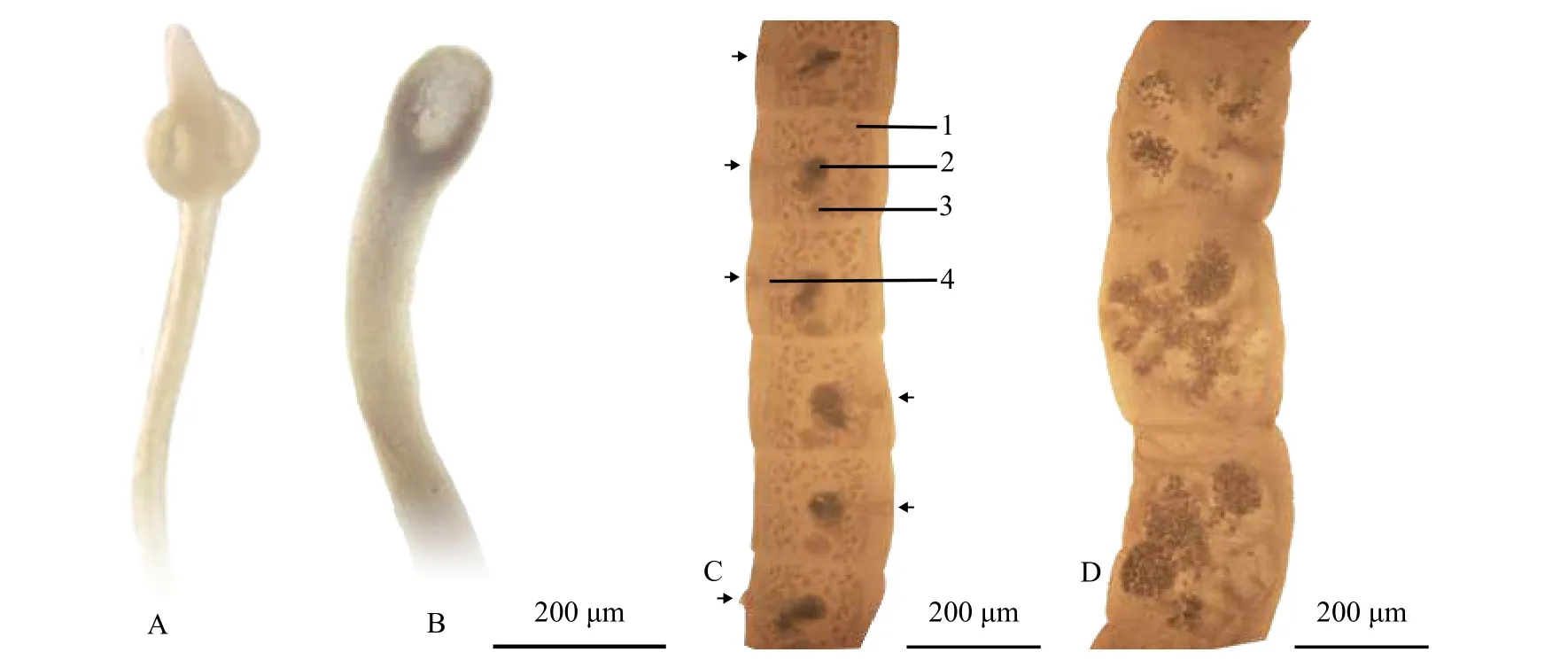
图1 深槽绦虫未定种Fig. 1 Bathybothrium sp.
将线粒体基因组中的12S、COX1和CytbmtDNA分别在NCBI数据库中进行比对, 一致性最高分别为77.13(KX434430.1)、79.49%(JQ280884.1)和77.73%(KX434430.1); 18S rDNA基因一致性最高98.36%, 该序列(DQ925305.1)所属物种隶属于深槽绦虫属, 与形态鉴定结果一致。
原头绦虫未定种 虫体较细小, 背腹扁平,身体分节。头节有4个侧吸盘, 无顶吸盘, 亦无钩或棘; 有颈部; 靠近颈部的节片长大于宽, 随着宽度的逐渐增加, 后部节片宽大于长, 且不十分规整, 最末端节片形状似倒三角形; 生殖孔随机开口于虫体每个节片边缘, 阴茎囊横列于开口内侧, 睾丸圆形, 分布于整个髓部, 卵巢双叶, 位于节片后端(图 2)。

图2 原头绦虫未定种Fig. 2 Proteocephalus sp.
将12S、COX1和CytbmtDNA在NCBI数据库中进行比对, 一致性最高的分别为73.16% (NC_046386.1)、93.75% (JQ268552.1)和75.42% (JQ26 8541.1); 18S rDNA基因比对到2个序列(KX768 934.1和KX768933.1), 一致性分别为99.78%和99.27%, 对应原头绦虫属的2个不同物种; ITS基因序列比对后一致性最高为99.04%(DQ768186.1), 为同属未定种。
异肉吸虫未定种 虫体光滑无棘, 头部稍小而尾部钝圆, 体白色, 略透明。有咽而无前咽。口吸盘位于身体前端, 腹吸盘大于口吸盘, 位于虫体前半部分。肠分支, 沿体两侧向下。阴茎囊发达,位于腹吸盘斜上方并紧挨腹吸盘。2个睾丸相连且基本等大, 位于体中部略偏后位置。卵巢位于腹吸盘与前睾丸之间, 椭圆形, 小于前睾丸。卵黄腺从腹吸盘沿体两侧延伸至体末端, 并密布于后睾丸后部。虫卵椭圆形, 棕色或淡棕色, 分布于腹吸盘与前睾丸之间及两侧。排泄囊管状, 从睾丸后方伸至体末端(图 3)。

图3 异肉吸虫未定种Fig. 3 Allocreadium sp.
从形态看, 该异肉吸虫的外形、卵黄腺大小和疏密程度、口吸盘与睾丸之间的距离等, 与哲古措高原裸鲤寄生的异肉吸虫[32]存在差异。将2种异肉吸虫的12S mtDNA序列进行比对, 一致性为92.86%, 两者同属不同种, 与形态鉴定结果一致。
新棘吻虫未定种 白色或淡黄色, 体表光滑无棘, 外形似香蕉, 略向腹面弯曲, 身体后部略细于身体前部; 体壁可见椭圆形巨核, 腹面1个, 背面4—5个。吻短而小, 呈膨大的球状; 吻钩呈螺旋状排列, 6列, 每列3个, 共18个; 每列的第1个吻钩较宽大, 第2和第3个吻钩等大, 小于第一个吻钩; 吻腺两根, 呈棒状, 一根有巨核1个, 另一根有巨核2个; 吻腺在个体间的长度存在较大差异, 短的不及体中部,长的可超过体中部到达体末端; 雌虫体腔内可见椭圆形卵, 分散排布, 体腔末端可见生殖系统; 雄虫的2个睾丸相连, 位于躯干中部略偏下位置; 睾丸下方为黏液腺, 呈合胞体结构; 黏液腺贮囊颜色较深, 有时与黏液腺重叠, 有时位于黏液腺下方, 连接着黏液腺管, 黏液腺管两侧为贮精囊; 雄虫交接囊可伸出体外, 呈钟罩状(图 4)。大小介于1.22—11.78 mm。
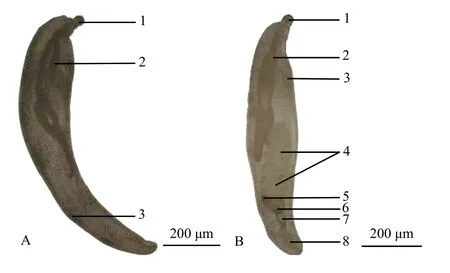
图4 新棘吻虫未定种Fig. 4 Neoechinorhynchus sp.
拉萨河土著鱼类寄生的新棘吻虫根据形态被鉴定为青海新棘吻虫(Neoechinorhynchus qinghaiensis)[30], 而刘立庆等[34]记录的青海新棘吻虫体长为l.82—5.33 mm, 体型较小。NCBI数据库中没有青海新吻虫的基因序列数据, 无法进行比对。为确定种类, 笔者于2020年6月底对青海湖裸鲤(Gymnocypris przewalskii)消化道寄生蠕虫进行了采样,将采集到的青海新棘吻虫进行基因测序, 与黑斑原鮡寄生新棘吻虫的18S rDNA和ITS基因序列进行了比对, 一致性为99.39%和94.24%, 两者为不同种。
裸鲤棘头虫 又称湟鱼棘头虫。体型大于新棘吻虫未定种, 大小介于5.66—20.40 mm。体色鲜艳, 以黄色居多, 偶见黄色底色、体表带橙色环状花纹的个体, 体壁较厚。吻呈圆柱形; 吻钩16列,每列9个, 第1个略小, 2—6个等大且最大, 后3个小于前面6个, 后2个又小于倒数第3个, 吻鞘较深, 呈棒状。吻腺短而粗, 呈棒状, 与吻鞘长度相近。雌虫体腔内可见椭圆形卵, 分散排布。雄虫的2个睾丸相连, 呈椭圆形, 基本等大; 黏液腺位于睾丸后侧, 6个, 呈倒梨形; 雄虫交接囊可伸出体外, 呈钟罩状(图 5)。

图5 裸鲤棘头虫雄虫Fig. 5 Male of E. gymnocyprii
将其COX1 mtDNA序列(线粒体基因组全序列MT345686)在NCBI数据库中比对, 与裸鲤棘头虫(MT169753.1和MT169743.1)一致性为99.1%; 将其与青海湖裸鲤消化道中采集的裸鲤棘头虫的18S rDNA序列进行比对, 一致性为100%, 但吻钩的数量和大小等与刘立庆等[34]的描述存在区别。
C. eudyptulae异源性寄生虫, 鱼类为其中间宿主, 黑斑原鮡消化道中寄生的为该虫的幼虫。该幼虫具有3片唇瓣, 尾部较尖, 体表被环纹(图 6)。

图6 Contracaecum eudyptulaeFig. 6 C. eudyptulae
将该线虫的12S mtDNA序列在NCBI数据库中进行比对, 与鲁道夫对盲囊线虫(Contracaecum rudolphii)12S基因序列的一致性最高为94.37% (FJ42 6246.1和EF014283.1)。其18S rDNA序列与C. eudyptulae的一致性为100%(EF180072.1)。
杆咽线虫属线虫 虫体细长, 口囊漏斗状,在口囊前部内侧可见齿嵴, 神经环位于食道肌质部,雌虫阴门在体中侧偏后, 雄虫尾部可见乳突, 交合刺不等长(图 7)将该虫的12S mtDNA序列在NCBI数据库中进行比对, 一致性最高为83.16%(MT350402.1), 18S rDNA序列与杆咽线央属的十余个种一致性均高于97%。
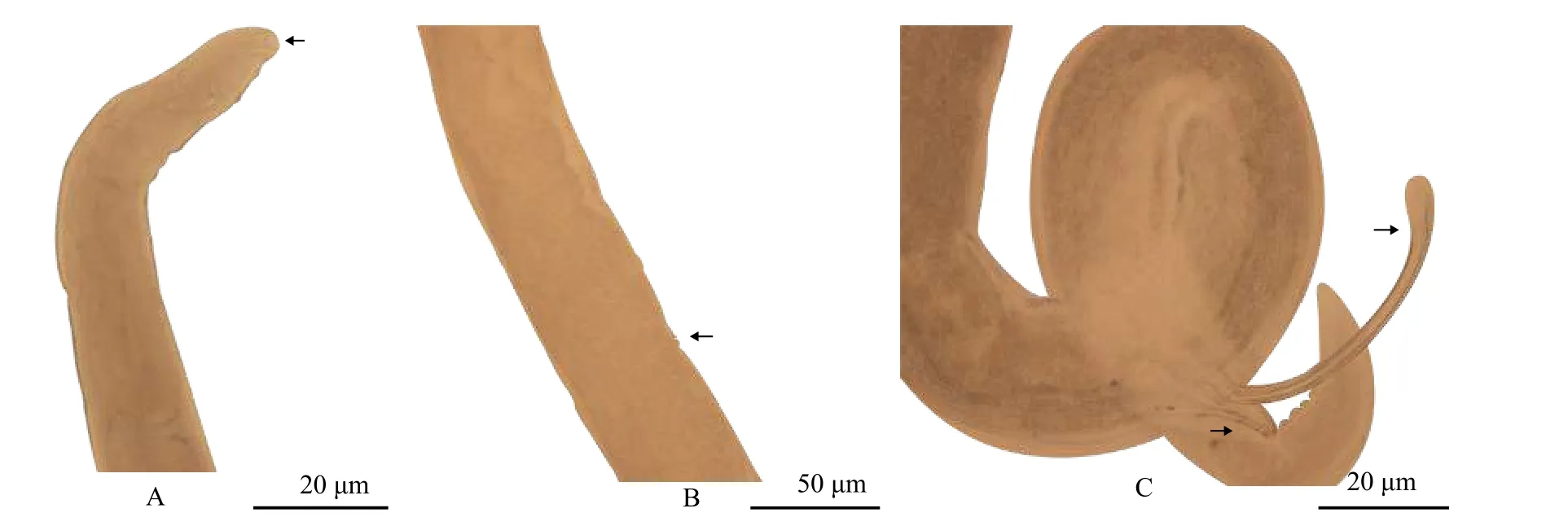
图7 杆咽线虫属线虫Fig. 7 Rhabdochona sp.
2.3 黑斑原鮡消化道寄生蠕虫感染情况
黑斑原鮡群体消化道寄生蠕虫感染情况 黑斑原鮡群体消化道寄生蠕虫感染情况见表 2, 数据显示:C. eudyptulae的感染数量、感染率、感染强度和平均丰度均为最高, 新棘吻虫未定种次之, 杆咽线虫未定种最低。
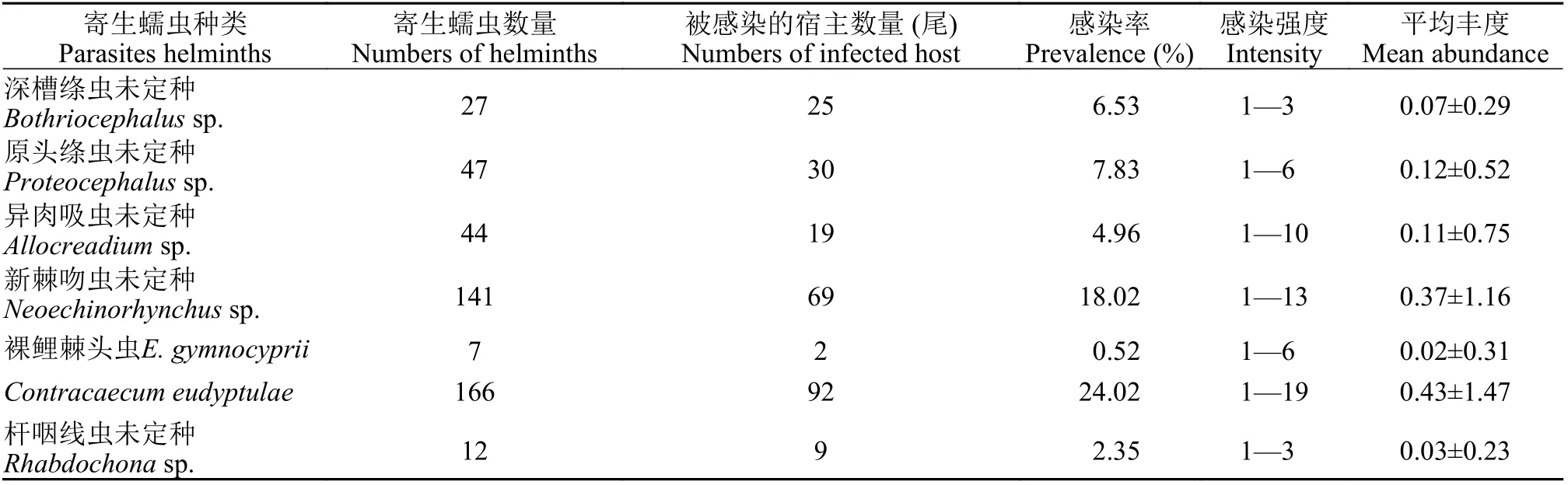
表2 黑斑原鮡群体消化道寄生蠕虫感染情况Tab. 2 Infection of gastrointestinal helminths of G. maculatum in Tibet Autonomous Region
不同性别黑斑原鮡的消化道寄生蠕虫感染情况 不同性别黑斑原鮡消化道寄生蠕虫的感染情况见表 3黑斑原鮡雌性群体, 7种寄生蠕虫均有感染, 感染率以C. eudyptulae最高, 新棘吻虫未定种次之, 裸鲤棘头虫和杆咽线虫未定种最低; 平均丰度以新棘吻虫未定种和C. eudyptulae最高, 深槽绦虫未定种次之, 异肉吸虫未定种和裸鲤棘头虫最低;感染强度以新棘吻虫未定种最高。

表3 不同性别黑斑原鮡消化道寄生蠕虫感染情况Tab. 3 Infection of gastrointestinal helminths of G. maculatum with different sexes in Tibet Autonomous Region
黑斑原鮡雄性群体, 7种寄生蠕虫均有感染, 感染率以新棘吻虫未定种和C. eudyptulae最高, 原头绦虫未定种次之, 裸鲤棘头虫最低; 平均丰度以C.eudyptulae最高, 新棘吻虫未定种次之, 裸鲤棘头虫最低; 感染强度以C. eudyptulae最高。
不能分辨性别的群体只感染了C. eudyptulae和新棘吻虫未定种, 感染强度均较低, 感染率和平均丰度均以C. eudyptulae为最高。
不同全长黑斑原鮡的消化道寄生蠕虫感染情况 以5 cm为间隔将黑斑原鮡分为5个全长组,即10 cm≤L<15 cm、15 cm≤L< 20 cm、20 cm≤L<25 cm、25 cm≤L< 30 cm和30 cm≤L< 35 cm。不同全长黑斑原鮡消化道寄生蠕虫感染情况见表 4。
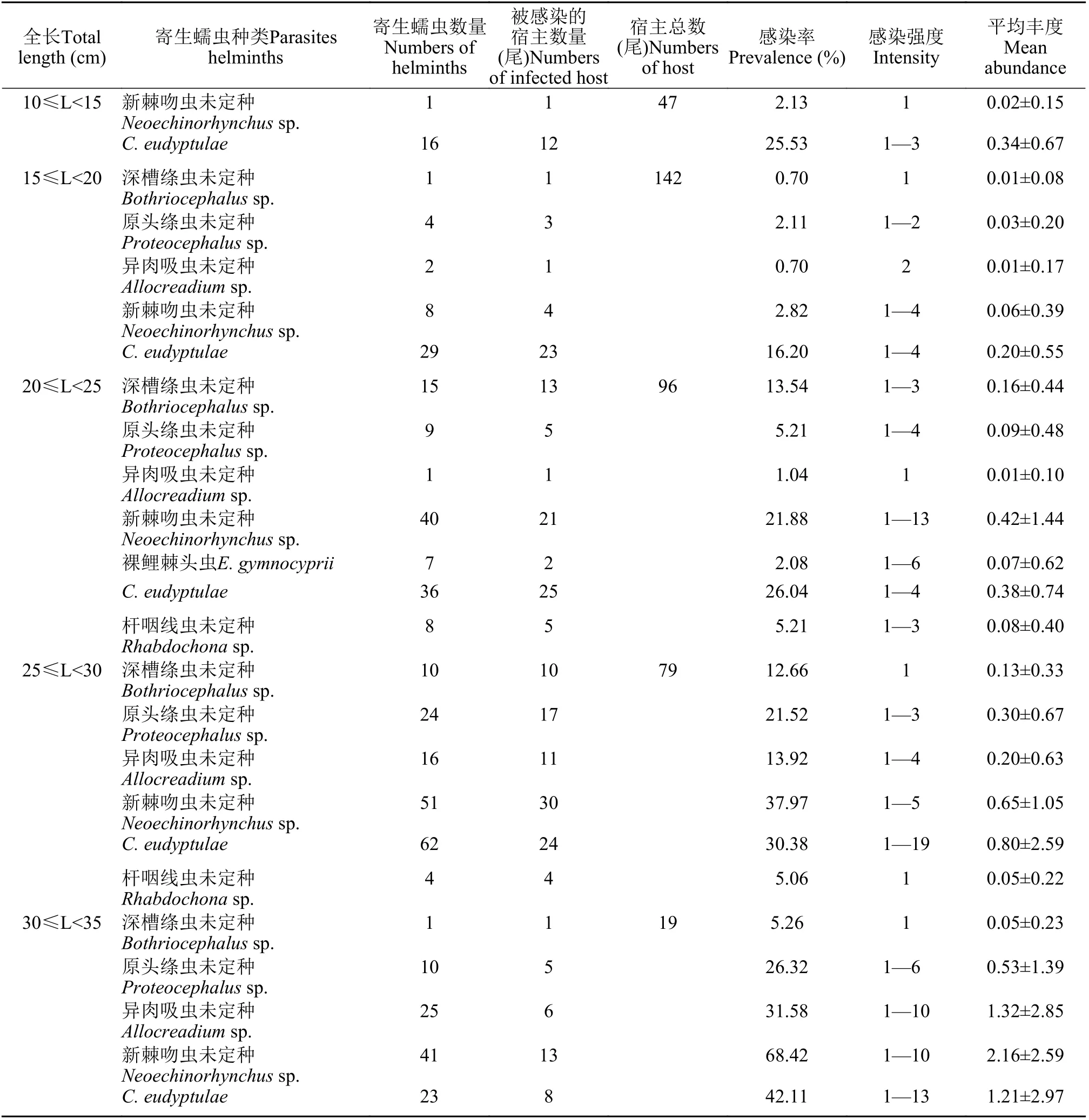
表4 不同全长黑斑原鮡消化道寄生蠕虫感染情况Tab. 4 Infection of gastrointestinal helminths of G. maculatum with different total length in Tibet Autonomous Region
在10 cm≤L<15 cm和15 cm≤L< 20 cm全长组中,C. eudyptulae的感染率和平均丰度最高。10 cm≤L<15 cm组只发现了新棘吻虫未定种和C. eudyptulae两种寄生蠕虫。15 cm≤L< 20 cm组未发现裸鲤棘头虫和杆咽线虫未定种, 新棘吻虫未定种的感染率和平均丰度均较低, 原头绦虫未定种与其接近,高于深槽绦虫未定种和异肉吸虫未定种的感染率和平均丰度。
在20 cm≤L<25 cm组中, 寄生蠕虫的感染率和平均丰度基本呈现上升趋势, 感染率以C. eudyptulae最高, 新棘吻虫未定种次之, 异肉吸虫未定种最低; 平均丰度以新棘吻虫未定种最高,C. eudyptulae次之, 异肉吸虫未定种最低; 感染强度以新棘吻虫未定种最高。
在25 cm≤L< 30 cm组中, 未发现裸鲤棘头虫,感染率以新棘吻虫未定种最高,C. eudyptulae次之,杆咽线虫未定种最低; 平均丰度以C. eudyptulae最高, 新棘吻虫未定种次之, 杆咽线虫未定种最低; 感染强度以C. eudyptulae最高。
在30 cm≤L< 35 cm组中, 未现裸鲤棘头虫和杆咽线虫未定种, 感染率以新棘吻虫未定种最高,C. eudyptulae次之, 深槽绦虫未定种最低; 平均丰度以新棘吻虫未定种最高, 异肉吸虫未定种次之, 深槽绦虫未定种最低。除深槽绦虫未定种外, 其余4种寄生蠕虫的感染率和平均丰度均为全部体长组中最高; 感染强度以C. eudyptulae最高。
2.4 黑斑原鮡消化道寄生蠕虫群落的多样性及优势种群
黑斑原鮡消化道寄生蠕虫的多样性和优势种群见表 5, 在整个群体中, Shannon-Wiener指数为1.53, 群落多样性较高, 优势物种为C. eudyptulae。

表5 黑斑原鮡消化道寄生蠕虫群落的多样性及优势物种Tab. 5 Diversity and dominant species of gastrointestinal helminths’community of G. maculatum in Tibet Autonomous Region
对于不同性别的黑斑原鮡, 雌性和雄性消化道寄生蠕虫群落的Shannon-Wiener指数分别为1.57和1.47, 群落多样性较高; 而在性别不明的群体中,Shannon-Wiener指数则较低, 仅为0.26。C. eudyptulae在3个群体中均为优势物种, 在雌性群体中, 新棘吻虫未定种也是优势物种。
对于不同全长的黑斑原鮡, 除10 cm≤L<15 cm组外, 其余各组消化道寄生蠕虫群落的Shannon-Wiener指数均高于1, 也显示了较高的多样性。20 cm≤L<25 cm和30 cm≤L<35 cm全长组的优势物种为新棘吻虫未定种, 其余三组为C. eudyptulae。
3 讨论
将分布于西藏高原的黑斑原鮡、拉萨河7种土著鱼类和哲古措高原裸鲤消化道寄生蠕虫群落结构特征进行比较(表 6), 可以发现: 黑斑原鮡消化道具有更多的寄生蠕虫物种, 即物种丰富度更高, 三者的Shannon-Wiener指数都较高, 优势类群基本以线虫为主。

表6 西藏3个水域土著鱼类消化道寄生蠕虫的群落结构比较Tab. 6 Comparison of community structure of native fishes’ gastrointestinal helminths in three waters of Tibet Autonomous Region
一般认为, 寄生虫群落的物种丰富度与鱼类的食性和营养级水平呈正相关, 宿主的食性越广, 营养级水平越高, 则寄生虫的丰富度也越高[35,36]。黑斑原鮡是以摄食鱼类和底栖动物为主的偏肉食性的杂食性鱼类, 浮游动植物、着生藻类和有机碎屑也是其食物来源[14], 在雅鲁藏布江中游处于较高的营养级水平, 属于顶级捕食者之一[37]。消化道寄生蠕虫一般具有复杂的生活史, 生活周期的完成需要1个或多个中间宿主, 浮游动物和底栖动物都是其中间宿主, 黑斑原鮡通过摄食中间宿主而感染寄生蠕虫。而对其他鱼类的摄食也会使黑斑原鮡获得一定的寄生蠕虫。拉萨河7种土著鱼类与黑斑原鮡生活的水域相通, 但消化道寄生蠕虫物种组成存在差异, 食性差异可能是产生这种差异的重要原因之一。
在性别不明和全长10 cm≤L<15 cm的黑斑原鮡群体中, Shannon-Wiener指数仅为0.22和0.26, 远低于整个群体、雌雄群体和其他全长组群体, 这可能与黑斑原鮡个体大小有关。不少研究都以鱼类的全长或体长作为反映鱼类年龄的参数[38], 因为相较年龄, 全长或体长数据更容易获取。一般来说,鱼类的年龄与全长呈正相关, 而黑斑原鮡群体中存在两性异形现象, 雄性个体体型大于雌性个体[4], 故可以认为在同一性别中, 全长越长的黑斑原鮡, 年龄也越大。可以根据生殖突的形状来区分黑斑原鮡雌雄个体[4], 而当个体太小, 从外观无法直接判定性别时, 解剖并观察性腺, 若还无法判断雌雄, 则列为性别不明, 这部分黑斑原鮡全长以10 cm≤L<15 cm居多, 最大的个体全长亦不超过20 cm。有假说认为, 宿主体积越大, 生活的寄生虫越多; 而宿主的年龄越大, 获得新的寄生虫的可能性也越大, 因为时间具有累积效应[39]。在性别不明和全长10 cm≤L<15 cm的群体中, 黑斑原鮡体型和年龄均较小, 消化道寄生蠕虫的种类和数量较少, 因而Shannon-Wiener指数也较低。随着全长的增加, 15 cm≤L<20 cm和20 cm≤L<25 cm全长组黑斑原鮡消化道寄生蠕虫群落的Shannon-Wiener指数呈上升趋势, 全长超过25 cm后, Shannon-Wiener指数反而降低了。多样性指数对寄生群落中物种的丰富度和每个物种对群落的贡献都很敏感, 它反映了物种丰富度和均匀度[40]。通过对32个鱼类宿主样本消化道寄生蠕虫均匀度与寄生蠕虫群落相关变量的研究发现, 多样性随群落中物种的均匀度增加而增加,与寄生蠕虫的丰度呈负相关[41]。在20 cm≤L<25 cm全长组中, 7种寄生蠕虫均被发现, 平均丰度介于(0.01±0.10)—(0.42±1.44); 在25 cm≤L<30 cm全长组中,寄生蠕虫物种数为6种, 平均丰度介于(0.05±0.22)—(0.80±2.59); 在30 cm≤L<35 cm全长组中, 只发现了5种寄生蠕虫, 平均丰度介于(0.05±0.23)—(2.16±2.59)。可以看出, 随着黑斑原鮡体长的增加, 寄生蠕虫物种间平均丰度差异越来越大, 平均丰度高的寄生蠕虫在群落中的数量上占据了主导地位, 使群落的均匀度降低。平均丰度差异越大, 群落的均匀度也越低, 群落的多样性随之降低了。对于不同性别黑斑原鮡的消化道寄生蠕虫群落, 在雄性群体中寄生蠕虫物种的均匀度较低, 反映群落多样性的Shannon-Wiener指数也低于雌性群体。
在雅鲁藏布江干流日喀则江段、支流拉萨河和高原湖泊哲古措3个水域的土著鱼类消化道寄生蠕虫群落中(表 6), 优势类群基本都是线虫。其中,C. eudyptulae是异源寄生虫, 而异源性寄生虫一般具有较强的扩散和建群能力[30], 这可能也是C. eudyptulae在黑斑原鮡群体中成为优势物种的重要原因之一。
