挖掘教材内容 拓展教材实验——以“电解氯化钠溶液”实验探究为例
2021-09-03安徽省六安第二中学河西校区237000
安徽省六安第二中学河西校区(237000) 徐 敏 孙 瑞
新课程理念下,化学实验的功能应由激发学生积极地接受学习转变为促进学生主动地探究性学习。探究性学习是指学生在教师指导下,自主获取知识和技能,体验和了解科学探究的过程和方法。在化学教学中,教师要为学生的学习创设探究情境,建立探究的氛围,把握探究的深度,激发学生的探究欲望,引导学生体验探究的过程,自己发现问题,提出问题,分析问题以及解决问题。
1 课前讨论,预测现象
学生已经学习了人教版化学选修4教材第4章“电解原理及应用”课程,掌握了用惰性电极电解饱和食盐水的原理,理解了电解原理的实质。
问题:利用电解原理,用铜电极电解饱和食盐水,如何书写电极反应式?会产生什么实验现象?
生:阴极产生氢气,阳极铜电极溶解,溶液中有蓝色沉淀产生。两极电极反应及电池方程式:
阳极:Cu-2e-=Cu2+
阴极:2H2O+2e-=H2↑+2OH-

由于传统的电解装置(见图1)不方便收集气体进行检验,现将电解装置进行了改进(见图2)进行演示实验,学生认真观察并记录实验现象。
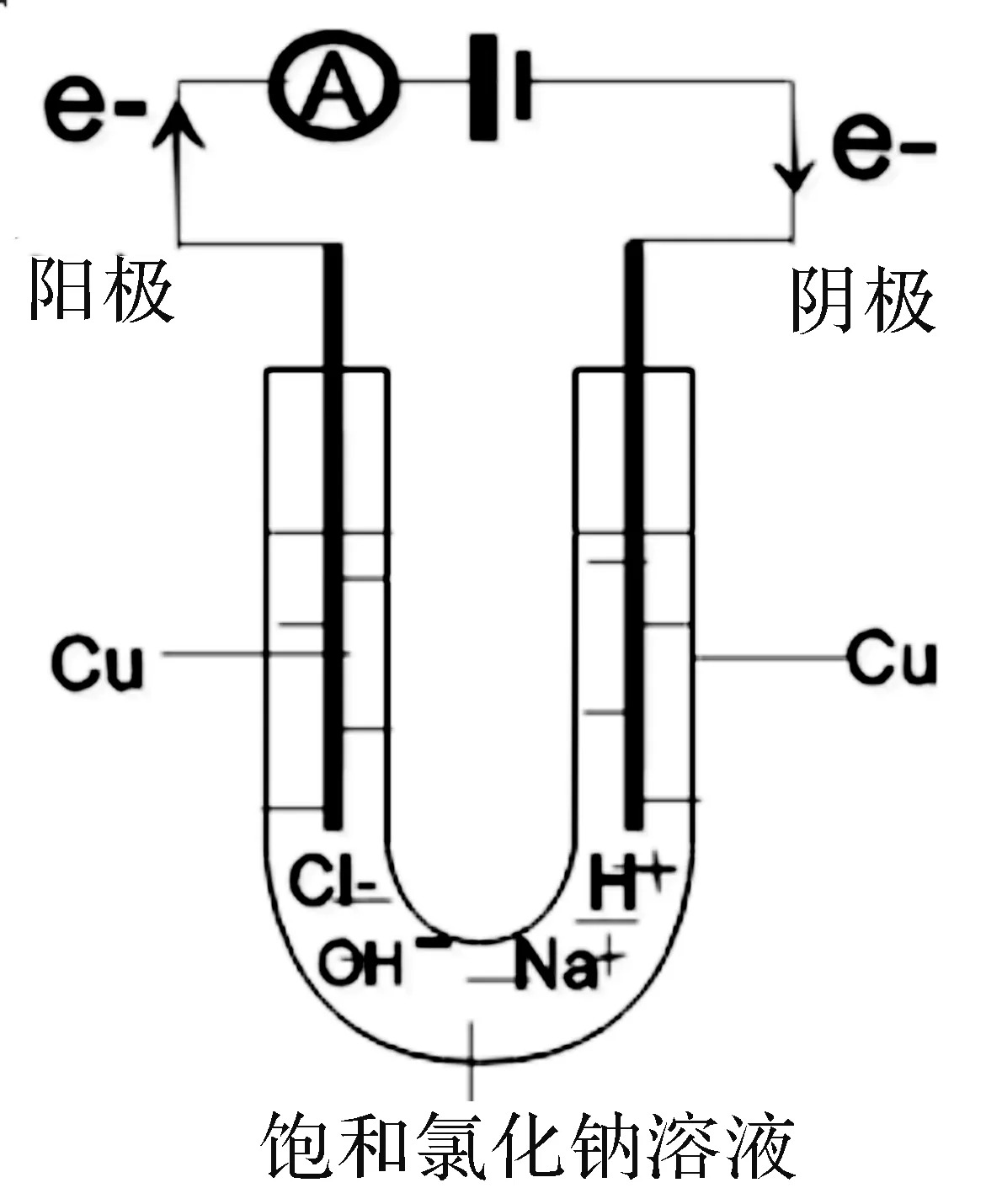
图1 传统装置
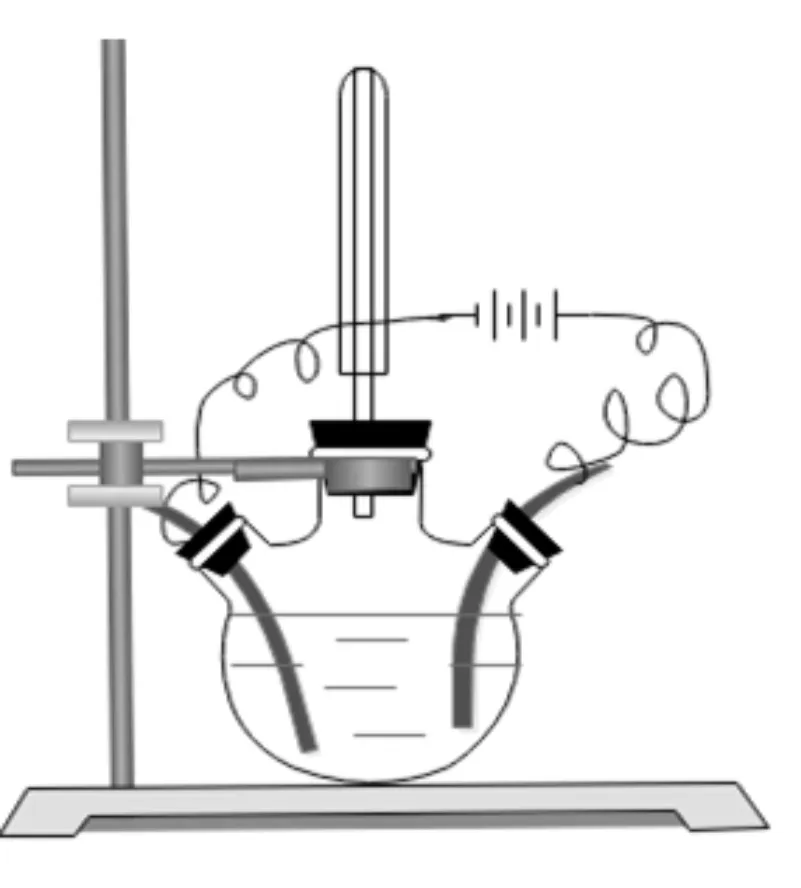
图2 改进装置
生:没有看到预测的蓝色氢氧化铜沉淀。观察到实验现象是:在阴极产生大量气体(应该是H2);在阳极出现白色浑浊→黄色沉淀→橙黄色沉淀的变化(见图3)。

图3 实验现象
通过实验学生产生了认知冲突,为什么没有看到蓝色的氢氧化铜沉淀?白色浑浊、黄色沉淀、橙黄色沉淀分别是什么?
2 查找资料,大胆猜想
由于学生的知识水平有限,查阅资料归纳出一价铜和二价铜的一些化合物的颜色和溶解性(见表1),学生据此讨论并推测。
生:根据表1,推测到阳极附近产生的白色浑浊物为CuCl,黄色沉淀是CuOH,随后出现的橙黄色沉淀是CuOH和Cu2O的混合物。

表1 不同价态铜的化合物的颜色和溶解性
是不是如学生所说呢?如何验证猜想是否正确呢?实验是检验真理的重要手段。
3 设计实验,检验分析
3.1 改进电解装置,使两极产物分开
为了仔细观察阳极产物颜色的变化,笔者用饱和食盐水浸泡过的纱布制作了一个盐桥(见图4),并将两极电解产物分开。电解一段时间后,阴极有大量气泡析出,阳极只看到电极周围有白色浑浊物但并没有变黄。

图4 改进电解装置
3.2 分组合作,检验两极产物
将学生分成三个组,分工查阅资料进行检验。
第一小组:经查阅资料他们发现CuCl很容易被氧化变成蓝色。检验阳极白色浑浊物质是否为CuCl。
第一组设计的方案:让阳极产生的白色浑浊物放置一段时间,看看它的颜色变化。12 h后,白色沉淀变成了蓝色(见图5),进而说明阳极产生的沉淀是CuCl。相关反应如下:

图5 第一组实验方案产生的实验现象
4CuCl+O2+4H2O=3CuO+CuCl2+3H2O+2HCl
第二小组:经查阅CuCl和CuOH的溶度积常数(CuCl、CuOH的溶度积常数分别1.2×10-6、1.2×10-14),认为白色沉淀CuCl遇到阴极产生的NaOH后会转化成更难溶的CuOH黄色沉淀。
第二组设计的方案:是将两极产物混合看是否有黄色沉淀产生,或者直接向阳极产物中滴加NaOH溶液,观察颜色变化。相关反应如下:
CuCl+OH-=CuOH+Cl-
观察到白色沉淀变为黄色沉淀(见图6),该实验现象验证了第二组学生的猜测。

图6 第二组实验方案产生的实验现象
第三小组:查阅资料发现黄色的CuOH容易分解成红色的Cu2O,且二者均易溶于氨水形成蓝色的络合物。检验橙黄色沉淀是否为CuOH和Cu2O的混合物。
第三组设计方案:滴加氨水观察沉淀和溶液颜色变化来检验橙黄色沉淀是否为CuOH和Cu2O的混合物。
相关反应方程式如下:
Cu2O+4NH3·H2O=2[Cu(NH3)2]+(无色)+2OH-+3H2O
4[Cu(NH3)2]+(无色)+8NH3·H2O+O2=4[Cu(NH3)4]2+(绛蓝色)+4OH-+6H2O
第三小组实验现象是橙黄色沉淀溶解,最后变成绛蓝色(见图7)和预期一致。

图7 第三组实验方案产生的实验现象
通过大胆猜想并通过实验检验分析,学生明白了用铜电极电解饱和氯化钠溶液时产生的现象及发生的反应。
3.3 分析现象,得出结论
用铜电极电解饱和氯化钠溶液的电极反应如下:
阴极:2H2O+2e-=2OH-+H2↑
阳极:2Cu-2e-=2Cu+
Cu++Cl-=CuCl↓(白色)
CuCl(白色)+OH-=CuOH(黄色)+Cl-
2CuOH(黄色)=Cu2O(红色)+H2O
4CuCl(白色)+O2+4H2O=3CuO+CuCl2+3H2O(蓝色)+2HCl
4 拓展实验,升华思维
通过前面的探究,学生知道了用铜电极电解饱和氯化钠溶液,并不产生蓝色的氢氧化铜沉淀,而是先产生白色沉淀,随后变黄,最终变成橙黄色沉淀。
如果改变氯化钠溶液的浓度,现象又如何呢?如何选择氯化钠溶液的浓度呢?实践需要理论的指导才能减少盲目的摸索。
经查阅资料,c(NaCl)=2.14 mol/L就是阳极电解产物发生变化的临界点。当c(NaCl)>2.14 mol/L时,铜阳极电解产物为Cu+化合物;当c(NaCl)<2.14 mol/L时,铜阳极电解产物为Cu2+化合物,析出蓝色沉淀Cu(OH)2。
总之,教材是培养学生人文素养的重要途径,也是一种特殊的知识载体。本实验教学采用理论与实践相结合,遇到新问题引导学生及时发现并尝试解决,不局限于课本知识。通过查阅资料,用理论指导实践,逐步探究真理。动手与动脑结合,注重化学学科核心素养的培养与落实。先通过让学生观察铜电极电解饱和氯化钠溶液的演示实验,让学生产生认知冲突,进而引导学生通过查阅资料并动手实验逐步对电解产物展开分析与检验,从而让学生明白铜电极电解饱和食盐水所发生的反应和产生的现象。同时,通过小组合作探究,学生提高了实践能力、创新能力以及解决问题的能力。
