长期相对高、低环境温度对肉鸡回肠微生物多样性的影响*
2021-09-01沈丽艳杨玉婷冉津铭张春勇安清聪曹振辉潘洪彬
沈丽艳,杨玉婷,高 欢,冉津铭,张春勇,安清聪,曹振辉,潘洪彬
(1.云南农业大学,云南省动物营养与饲料重点实验室,云南 昆明 650201;2.达州职业技术学院 经济管理系,四川 达州 635000)
中国是家禽养殖大国,肉鸡产业是中国畜牧业中现代化、规模化、集约化、组织化和市场化程度最高的产业之一[1]。环境温度是影响肉鸡生长发育的因素之一,据报道,热应激降低肉鸡采食量、平均日增质量及饲料转化效率,而冷应激增加肉鸡采食量和死亡率,降低肉鸡机体细胞免疫性能,引起肉仔鸡腹水症和疾病发病率的增加[2]。肠道菌群作为机体的重要组成部分,参与家禽的生长发育、消化吸收、营养免疫、生物拮抗及其各种功能和结构的发生、发展及衰退的全过程[3-4]。其中,回肠是吸收营养物质的主要部位,以兼性和微嗜氧性细菌为主,以乳酸杆菌科最为丰富[5]。研究发现:环境温度是影响家禽肠道菌群的重要因素之一,随着环境温度的改变,家禽肠道正常菌群也会受到影响[6]。WANG 等[7]发现:高温显著影响肉鸡回肠菌群的α 和β 多样性,主要增加回肠微生物的物种丰富度;BURKHOLDER 等[8]使用变性梯度凝胶电泳法发现:高温下肉鸡肠道微生物群落结构发生变化。SHI等[9]发现:热应激导致盲肠厚壁菌门的丰度增加,拟杆菌门的丰度降低。CHEVALIER 等[10]研究发现:小鼠长期暴露于寒冷环境(6 ℃)会明显改变肠道中细菌的组成。然而,目前研究多集中在短期环境温度变化(急性冷、热应激)对肉鸡肠道微生物组成的影响,而长期的相对环境温度变化对肉鸡肠道微生物的影响则鲜见报道。因此,本试验通过研究长期相对高温和相对低温环境对肉鸡回肠微生物多样性的影响,以期为环境温度通过肠道微生物影响肉鸡健康提供理论基础。
1 材料与方法
1.1 试验动物饲养与管理
1.1.1 试验设计
300 只1 日龄健康艾维茵肉仔鸡(湖南顺成养鸡专业合作社)随机分为3 组,每组100 只,NRC无抗日粮两阶段饲喂至42 d,以北京畜禽育种公司推荐的AV500 肉鸡饲养管理手册的温度控制参数为对照,分为高温组(HI 组)、对照组(CI组)和低温组(LI 组),各组的初始温度分别为36.5、33.5 和30.5 ℃,温度随日龄平行递减。与对照组相比,高、低温组每天温差均为3 ℃,至42 d 各组分别降至22、19 和16 ℃,其他饲养条件一致。各组实际控制温度变化见表1。
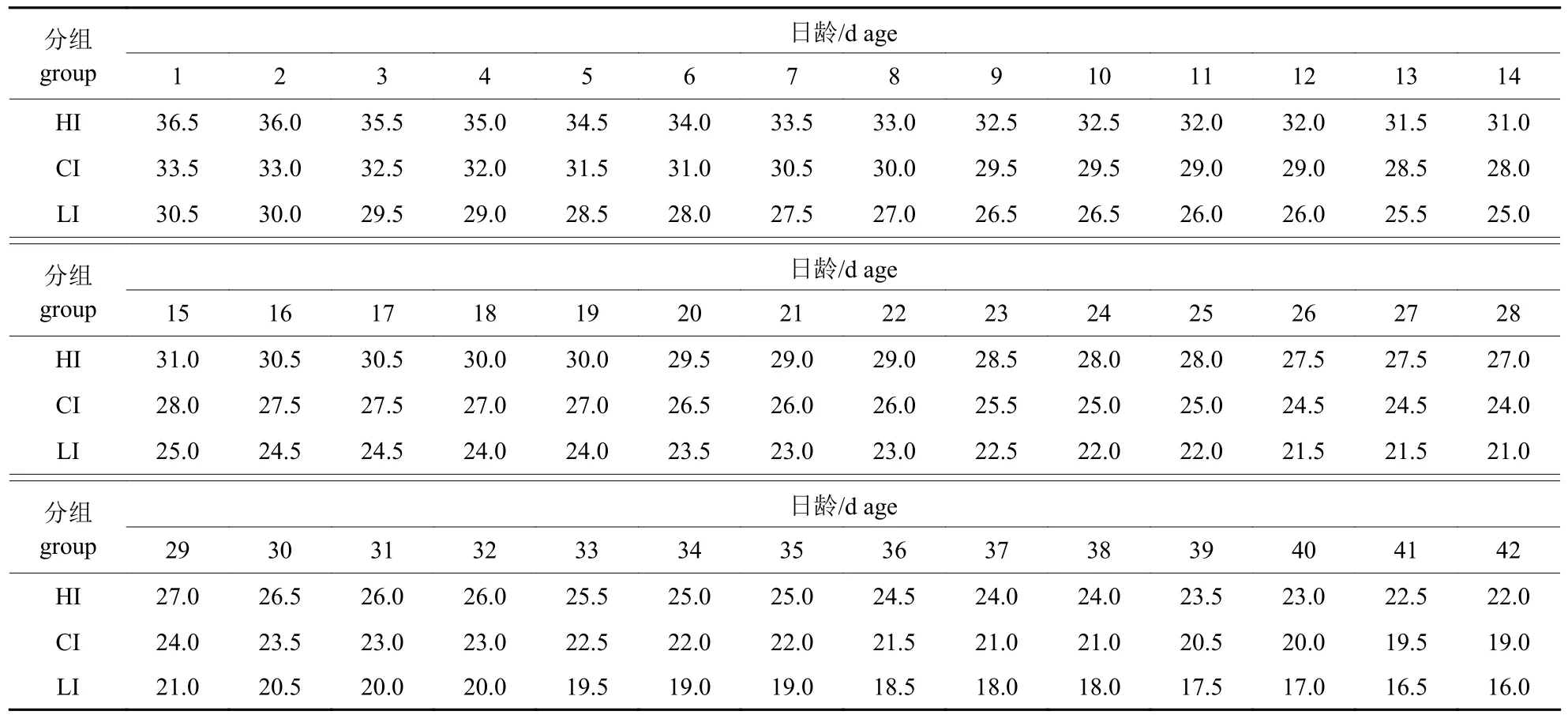
表1 鸡舍实际温度变化Tab.1 Change of temperature in chicken breeding ℃
1.1.2 饲养管理
试验在云南省畜牧兽医科学院畜禽环境研究所家禽实验基地进行,鸡舍为7.20 m×3.50 m×3.50 m,共3 栋,稻壳垫料地面平养,每栋鸡舍均为自动控温和通风,并配有4 个槽式给料器和4 个自动供水器,饲养过程中光照时间管理为:第1 天为24 h 光照;第2~8 天为23~18 h 光照;第9~21 天为12 h 光照;第22~35 天为18 h 光照;第36~42 天为18~23 h,当体质量<160 g(1~8 d)时,光照强度为30~60 lx;当体质量≥160 g(9~42 d)时,光照强度为5~10 lx。相对湿度管理为:第1~7 天为30%~50%,第8~21 天为40%~60%,第22~42 天为50%~70%。肉仔鸡按常规管理,自由采食、自由饮水。
1.2 试验方法
1.2.1 样品采集
饲养至第42 天,随机选取肉鸡36 只(12 只/组)屠宰。迅速采集回肠食糜,冻存管液氮保存,用于微生物总DNA 提取和PCR 扩增。
1.2.2 回肠微生物总DNA 的提取和PCR 扩增
每只鸡取回肠食糜样本(100±1) mg,采用QIAamp®Fast DNA Stool Mini Kit 方法提取细菌总DNA。用核酸浓度检测仪检测DNA 浓度后,于-80 ℃保存。
1.3 生物信息学分析
1.3.1 OTU 聚类
在97%相似度下利用Usearch 序列分析软件对Clean Reads 进行OTU 聚类分析,根据每个回肠食糜样品中聚类获得的OTU 在该样品的丰度,计算出3 组间共有和特有的OTU 数量。
1.3.2 α 多样性分析
α 多样性包括Chao1、Observed species、PDwhole tree、Shannon 和Simpson 指数,利用QIIME[11-12]软件计算样品的α 多样性指数的值,并作出相应的稀释曲线。根据1 组n值(一般为1 组小于总序列数的等差数列)与其相对应的α 多样性指数的期望值作出曲线,并作出各样品α 多样性指数的数据统计表[13]。
1.3.3 β 多样性分析
β 多样性是用来比较1 对样品在物种多样性方面存在的差异大小。unifrac 是通过利unifrac是通过利用系统进化的信息来比较样品间的物种群落差异,分为加权unifrac (weighted unifrac)与非加权unifrac (unweighted unifrac)两种;其中,加权unifrac 考虑了序列的丰度,非加权 unifrac不考虑序列丰度。MRPP 组间差异分析是用于分析组间微生物群落结构的差异是否显著的一种分析方法[14]。相似性Anosim 分析是一种非参数检验,用来检验组间(两组或多组)的差异是否显著大于组内差异,从而判断分组是否有意义[15]。
1.3.4 物种丰度与分类统计
从各个OTU 中挑选出丰度最高的1 条序列,作为该OTU 的代表序列;将该代表序列与已知物种的16S 数据库(RDP,http://rdp.cme.msu.edu)进行比对,从而对每个OTU 进行物种归类。根据物种注释情况,统计每个样品注释到各分类水平(门、纲、目、科和属)上的序列数量。根据物种注释结果,分别在各分类水平上对各个样品作物种profiling 相应的柱状图。
1.3.5 LDA Effect Size 分析
LDA Effect Sizee (LEfSe)分析[16]采用线性判别分析估算每个组分(物种)丰度对差异效果影响的大小,找出对样品划分产生显著性差异影响的群落或物种。
1.3.6 功能注释与差异表达分析
(Kyoto encyclopedia of genes and genomes,KEGG)京都基因和基因组百科全书,http://www.genome.jp/kegg)是基因组破译方面的公共数据库[17]。该数据库是系统分析基因功能、联系基因组信息和功能信息的大型知识库。利用16S rRNA 基因和参考序列数据库,应用PICRUSt 软件预测微生物群落功能[18]。
1.4 数据统计与分析
试验数据采用Excel 2019 进行整理,使用SPSS 22.0 软件,对测序数据α 多样性和微生物区系丰度进行单因素方差分析,并用Duncan氏法进行多重比较。试验结果以“平均值±标准差”表示。对于厚壁菌门/拟杆菌门(F/B)的比值,根据厚壁菌门和拟杆菌门在各组每个生物学个体中的相对丰度进行统计分析。
为评估优势属与KEGG 途径之间的相关性,在GraphPad Prism 7.0 中执行Spearman 分析[19],P<0.05 被认为具有统计学意义(n=12)。
2 结果与分析
2.1 OTU 聚类分析
如图1 所示:HI、CI 和LI 组分别获得968、968 和1 241 个OTU;3 组共有的OTU 数量为543 个,其占比分别为56.10%、56.10%和43.76%;各组特有的OTU 数量分别为192、139 和429 个,各占19.83%、14.36%和34.57%。
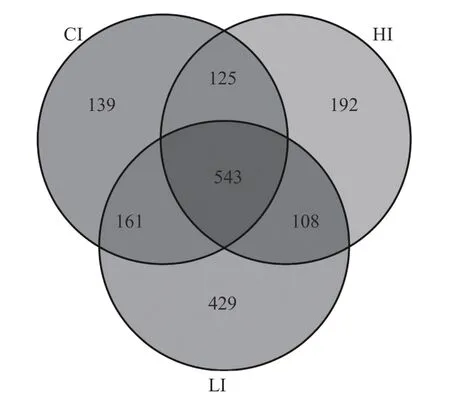
图1 组间OTU 分布Venn 图)Fig.1 Venn diagram of OTU distribution between groups
2.2 α 多样性分析
如表2 所示:与CI 组相比,HI 组Observed species、Shannon 和Simpson 指数显著升高,LI组Shannon 和Simpson 指数显著升高(P<0.05)。
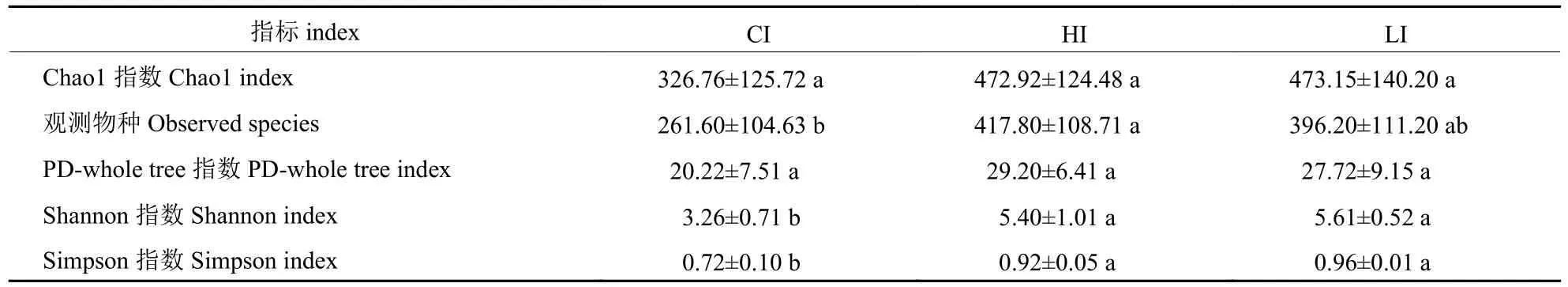
表2 α 多样性分析Tab.2 α diversity analysis
2.3 β 多样性分析
如表3 和图2 所示:基于UniFrac 分析利用系统进化的信息比较组间的物种群落差异,在考虑物种丰度的情况下,A=0.096,δe=0.46>δo=0.42,R=0.188,P=0.001,组间微生物群落结构差异显著;在不考虑物种丰度的情况下,A=0.041,δe=0.62>δo=0.60,R=0.163,P=0.002,组间微生物群落结构差异显著。这表明组间差异显著大于组内差异,分组有意义。
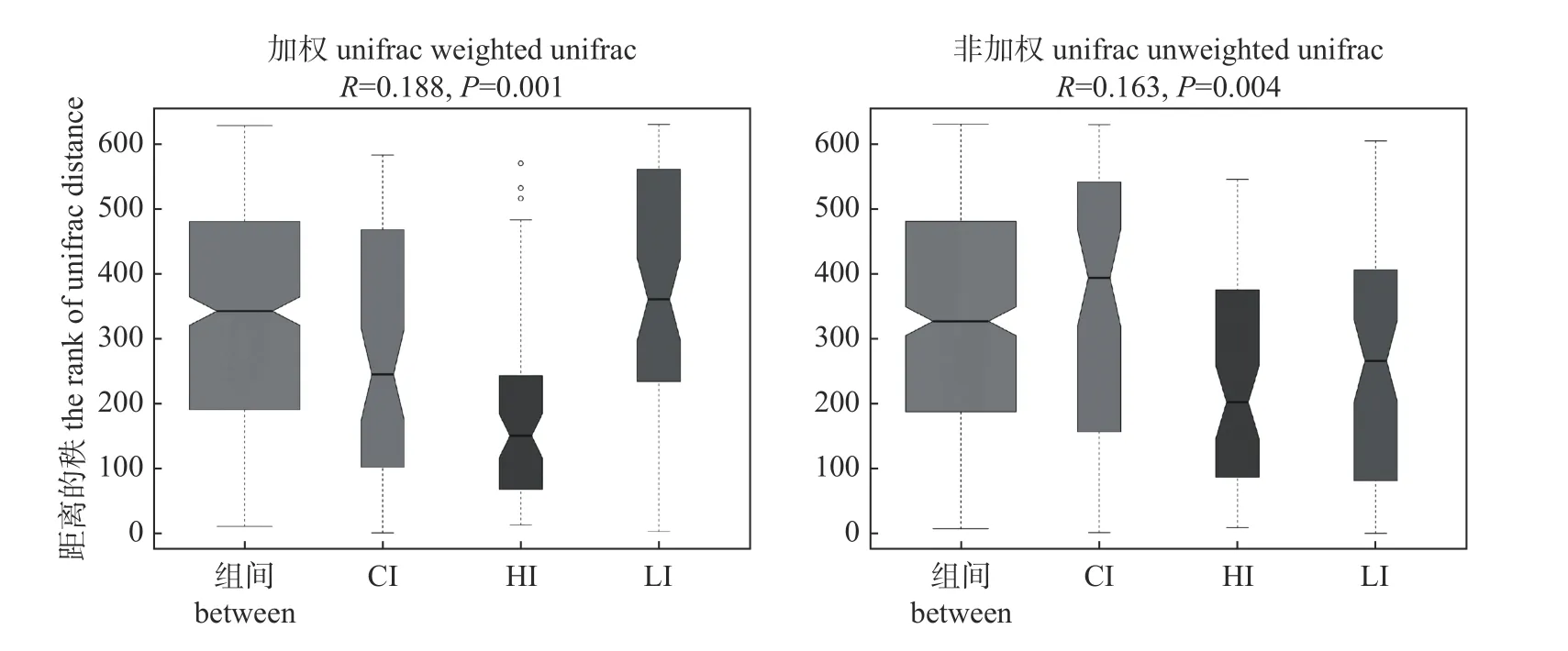
图2 回肠微生物16S rRNA 样品的组间Anosim 相似性指数分析图)Fig.2 Analysis of Anosim similarity index between groups of ileum microube 16S rRNA

表3 物种MRPP 组间差异分析Tab.3 Analysis of differences between species MRPP groups
2.4 回肠食糜微生物物种丰度与分类统计
如表4 所示:与CI 组相比,HI 组厚壁菌门和蓝细菌/叶绿体的相对丰度分别增加29.47%和0.81%,F/B的比值增加7.8%,拟杆菌门的相对丰度降低27.82% (P<0.05);LI 组厚壁菌门的相对丰度增加11.16%,F/B的比值降低0.11% (P>0.05)。
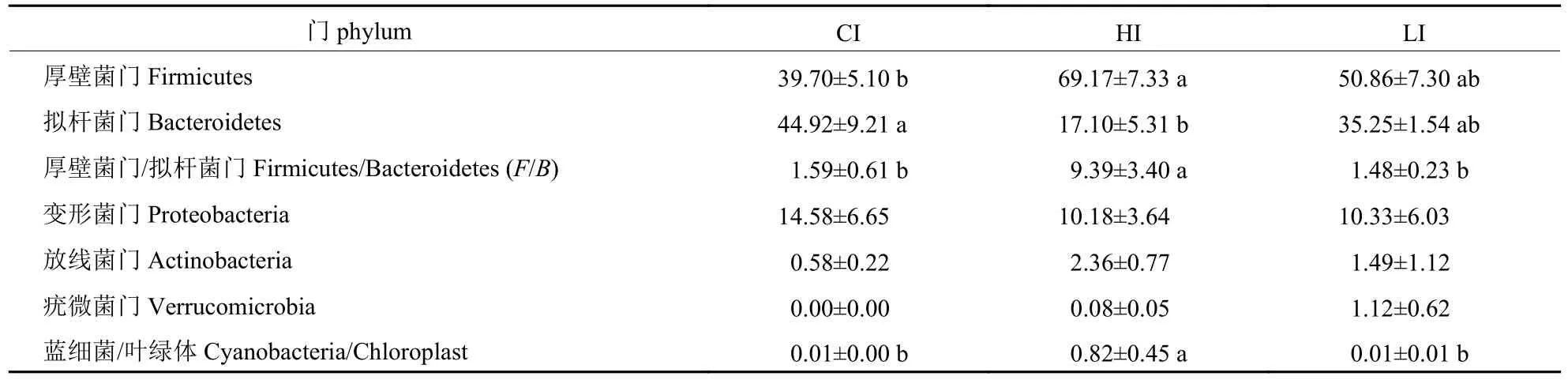
表4 肉鸡回肠微生物门水平组成及差异分析Tab.4 Composition and difference analysis of ileum microbial at phylum levels in broilers
如表5 所示:与CI 组相比,HI 组乳酸菌属和曲霉菌属的相对丰度分别增加31.87%和1.59%;LI 组梭菌属XI和志贺氏大肠杆菌属的丰度分别降低28.7%和9.98%,贪噬菌属和短波单胞菌属的相对丰度分别增加3.69%和2.08% (P<0.05)。
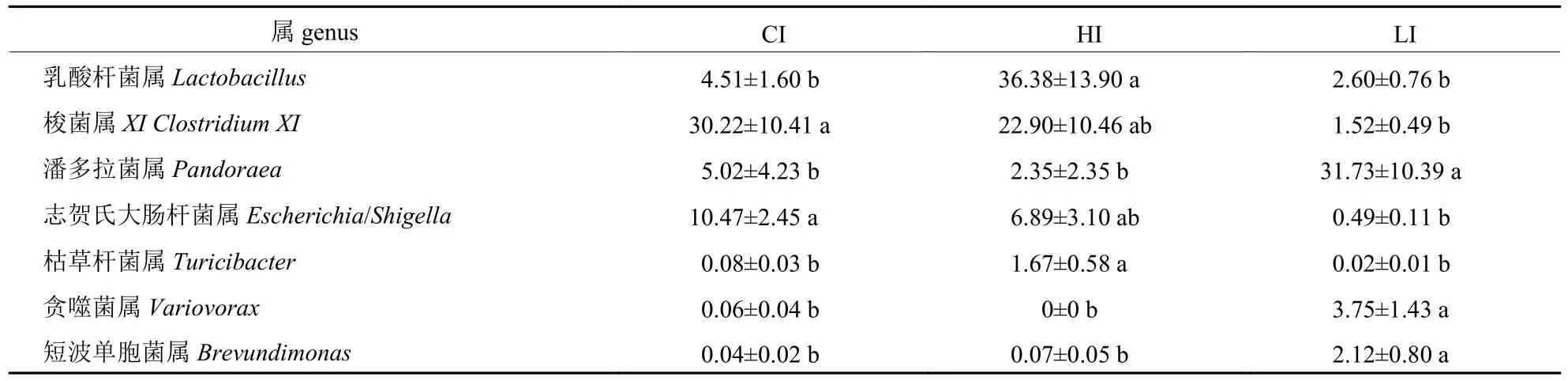
表5 肉鸡回肠微生物属水平组成及差异分析Tab.5 Composition and difference analysis of ileum microbial at genus levels in broilers
2.5 组间回肠食糜微生物显著性差异分析
如图3 所示:在门水平,LI 组中疣微菌门和螺旋体门显著富集;HI 组中厚壁菌门、蓝细菌/叶绿体显著富集。在纲水平,疣微菌纲等2 个纲在LI 组中显著富集;杆菌纲等4 个纲在HI 组中显著富集。在目水平,疣微菌目等3 个目在LI 组中显著富集;乳杆菌目等5 个目在HI 组中显著富集。在科水平,CI 组中消化链球菌科显著富集;伯克氏菌科等6 个科在LI 组中显著富集;乳酸杆菌科等18 个科在HI 组中显著富集。在属水平,梭菌属XI等3 个属在CI 组中显著富集;潘多拉菌属等16 个属在LI 组中显著富集;乳酸菌属等23 个属在HI 组中显著富集。
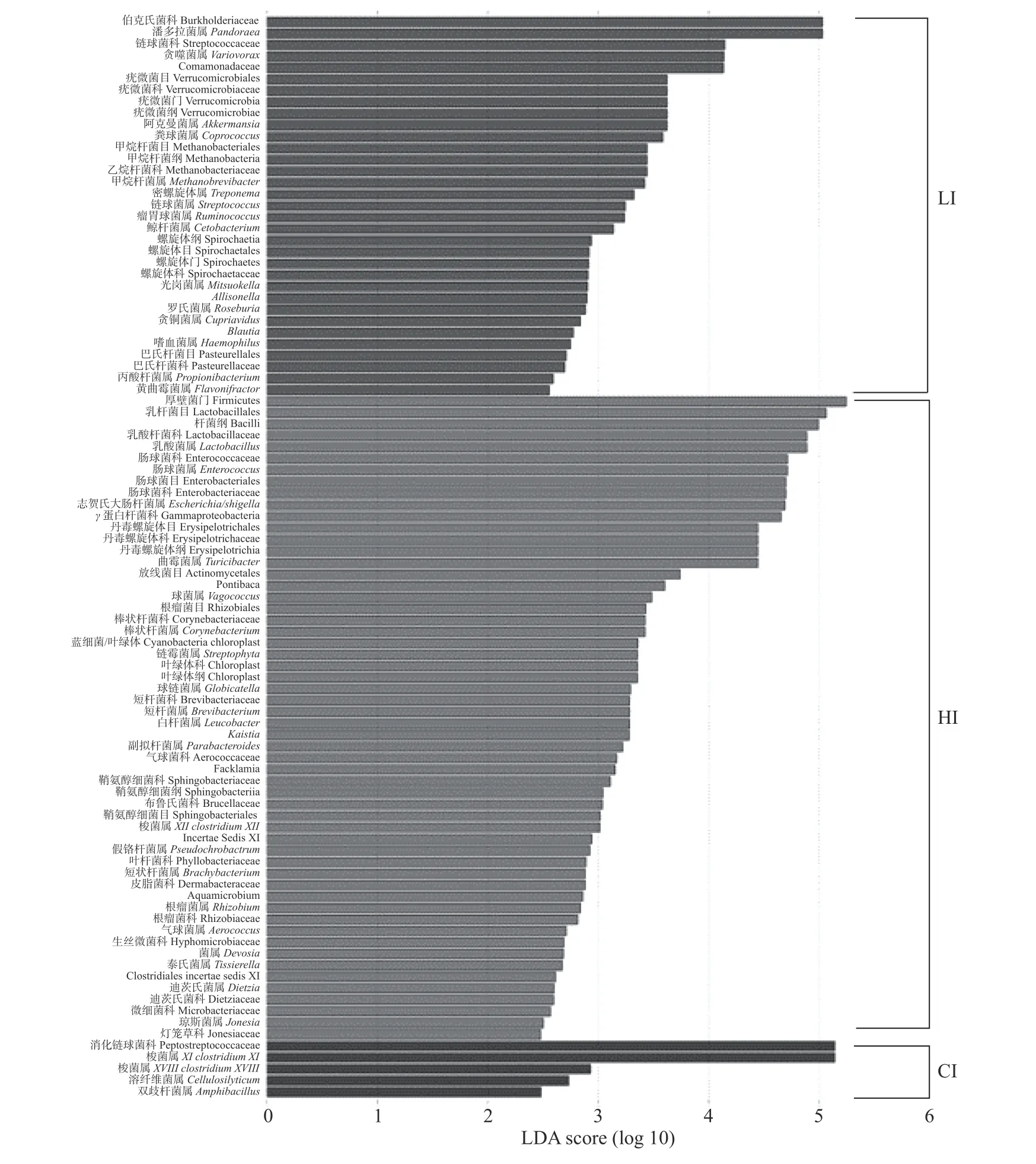
图3 CI、HI 和LI 组回肠微生物LDA 值分布柱状图)Fig.3 LDA value distribution map of CI,HI and LI groups ileum microbiota
2.6 回肠食糜微生物功能注释及组间差异分析
如图4 所示:CI 组在L3 层级显著富集到的信号通路为转录机制。LI 组在L3 层级显著富集到的信号通路分别为乙醛酸和二羧酸代谢、苯丙氨酸、酪氨酸和色氨酸的生物合成、氧化磷酸化、萘降解、C5 支化二元酸代谢、过氧物酶体、脂质生物合成蛋白质、蛋白质折叠和相关加工、PPAR 信号通路、多环芳烃降解、生物素代谢、脂肪细胞因子信号通路、细胞分裂。HI 组在L3 层级显著富集到的信号通路分别为DNA 修复和重组蛋白、磷酸转移酶系统PTS、嘌呤代谢、复制重组与修复蛋白、核糖体生物合成、染色体、氨基酰基tRNA 的生物合成、光合作用的蛋白质、光合作用、丙酮酸代谢、碱基切除修复、四环素的生物合成、RNA 聚合酶、D-丙氨酸代谢、霍乱弧菌致病循环、结核病、核黄素代谢和二甲苯降解。
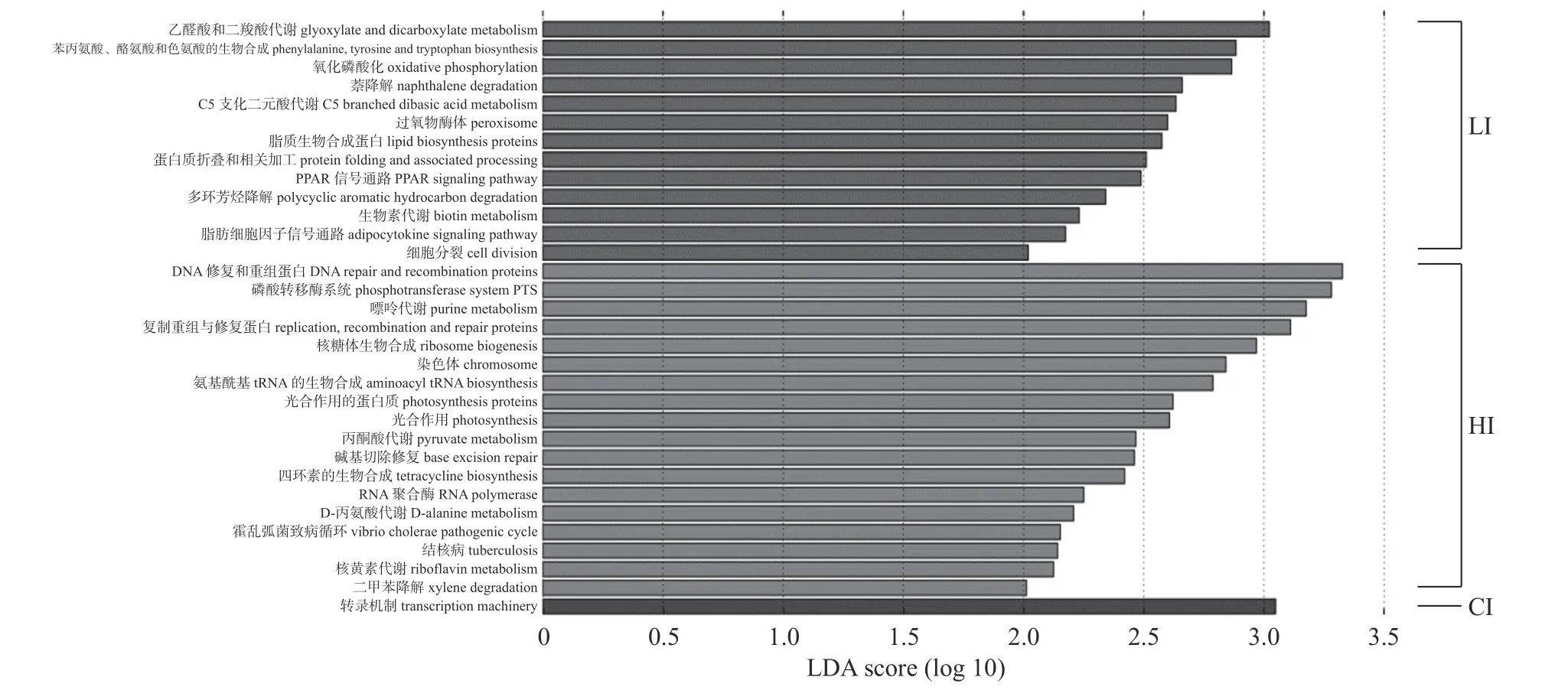
图4 HI、CI 和LI 组在L3 层级(LDA>2)富集信号通路的KEGG 分析)Fig.4 KEGG analysis of enriched signal pathways in the HI,CI and LI groups at L3 hierarchy (LDA>2)
2.7 回肠差异微生物组成与代谢通路关联分析
如图5 所示:CI 组梭状芽孢杆菌XVIII 与转录机制通路呈正相关(r=0.47,P=0.003 9)。HI 组乳酸菌属与磷酸转移酶系统(r=0.50,P=0.001 8)、复制重组与修复蛋白(r=0.38,P=0.021)、四环素的生物合成 (r=0.33,P=0.047)、RNA 聚合酶(r=0.44,P=0.007 2)、D-丙氨酸代谢(r=0.60,P=0.000 1)、霍乱弧菌致病循环(r=0.37,P=0.028)、二甲苯降解 (r=0.47,P=0.003 7)通路呈正相关。肠球菌与磷酸转移酶系统 (r=0.63,P<0.001)、复制重组与修复蛋白 (r=0.38,P=0.023)、霍乱弧菌致病循环 (r=0.42,P=0.011)通路呈正相关。志贺氏大肠杆菌属与复制重组与修复蛋白 (r=0.38,P=0.023)、四环素的生物合成 (r=0.36,P=0.047)、霍乱弧菌致病循环 (r=0.41,P=0.028)呈正相关。LI 组富集的乙醛酸和二羧酸代谢等12 个信号通路与潘多拉菌属等16 个差异属呈正相关(P<0.05)。
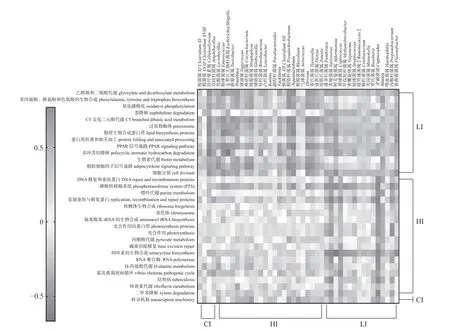
图5 微生物变化与通路相关性的热图分析)Fig.5 Heatmap analysis of the correlation between microbial changes and pathways
3 讨论
环境温度是影响家禽生产的一个重要因素,急性、慢性热应激均会使肉鸡肠道菌群发生改变。WANG 等[20]报道对肉鸡进行热应激处理(温控组21 ℃±1 ℃、高温组31 ℃±1 ℃)发现:高温显著影响回肠微生物区系的α 多样性(Chao1,P=0.002;PD-whole tree,P=0.002),表明高温增加了回肠微生物区系的物种丰富度。ZHU 等[21]通过DGGE 图谱分析表明:饲养温度变化对肉鸡盲肠微生物的组成有显著影响。本研究结果显示:高温显著增加了Shannon 和Simpson 指数,因此推测长期相对高温环境增加了回肠肠道菌群的多样性。
鸡肠道中主要以厚壁菌门为主,其次为变形菌门、拟杆菌门和放线菌门[22]。据报道,热应激(38 ℃)对肠道菌群影响较为明显,肠道菌群改变可导致肠道的消化吸收功能发生改变[23]。与CI组相比,长期相对高温环境使肉鸡厚壁菌门增加。这与之前的研究结果一致,即较高的环境温度增加了厚壁菌门的丰度[20]。厚壁菌门是小鼠和人类肠道微生物中最大的群体[24],且产生的内孢子能抵抗恶劣环境[25]。拟杆菌门对胃肠道的正常发育有影响,可以降解蛋白质和碳水化合物[26]。与CI 组相比,HI 组厚壁菌门/拟杆菌门的比值增加,LI 组厚壁菌门/拟杆菌门的比值降低。研究发现:厚壁菌门/拟杆菌门比值的增强与人的脂肪沉积和体质量下降负相关[27-28]。据报道,厚壁菌门的增加和回肠变形菌门的降低有益于肠道健康,有助于提高肉鸡的生长性能[29]。因此,厚壁菌门在长期相对高温环境饲养条件下相对丰度的增加可能有助于肉鸡适应环境应激。
乳酸杆菌是人类和其他哺乳动物微生物群的重要组成部分,存在于呼吸道、胃肠道和生殖道[30],可以通过利用碳水化合物产生乳酸。乳酸杆菌可以改善宿主胃肠道功能,降低肠道pH,恢复宿主肠道菌群平衡,抑制病原菌的生长,还能定植于肠黏膜形成黏膜屏障,保护肠道健康[31]。乳酸杆菌也可以改善鸡肠道微生物区系,提高有益菌数量,与肠道病原菌竞争定植位点,平衡肠道微生态区系[32-33]。志贺氏菌属是引起细菌性痢疾的病原菌[34],志贺氏大肠杆菌属的相对丰度降低可以促进肠道健康[35]。本研究结果显示:高温使肉鸡回肠乳酸杆菌属的丰度显著增加,大肠杆菌属的丰度显著降低,原因可能是高温能影响肉鸡回肠微生物优势菌群的组成,降低环境温度应激对肉鸡的危害。因此,长期相对高温饲养环境下乳酸杆菌的增加、志贺氏大肠杆菌属的降低可能有助于平衡肠道微生物,促进肉鸡健康生长。
曲霉菌属属于厚壁菌门,具有生物转化和生物降解作用[36]。本研究结果显示:HI 组曲霉菌属显著增加。因此,长期相对高温环境饲养肉鸡,可能会增加肉鸡对有害物质的降解,促进肉鸡健康生长。潘多拉菌属是一种革兰氏阴性致病菌,属于变形杆菌的β 亚类,参与抗外源性生物降解[37],已证明能够产生奥西林酶,该酶增加了对阿霉素和碳青霉烯的耐药性[38]。贪噬菌属属于丛枝藻科和β-变形杆菌[39],是一种普遍存在的β 蛋白细菌,参与植物的生长促进和外源物质的降解[40]。本研究结果显示:LI 组潘多拉菌属和贪噬菌属显著增加。因此,长期相对低温环境饲养肉鸡,可能会增加有害菌的生长,不利于肉鸡健康生长。
磷酸转移酶系统(phosphotransferase system,PTS)最初在大肠杆菌(E.coli)中被发现,后来在许多其他细菌中被发现,是一种催化碳水化合物吸收和转化为磷酸酯的转运系统[41]。本研究中,HI 组乳酸菌属与PTS 通路呈正相关。因此,在长期相对高温环境下,可能通过乳酸菌属影响磷酸转移酶系统PTS 通路。乙醛酸和二羧酸代谢是碳水化合物代谢的关键环节,它使细胞获得能量,并以高能分子的形式暂时储存释放的能量,参与脂肪酸代谢[42]。苯丙氨酸、酪氨酸和色氨酸的生物合成是胃食管癌潜在的生物标记物[43]。本研究中,LI 组潘多拉菌属与乙醛酸和二羧酸代谢通路呈正相关。因此,在长期相对低温环境下可能通过Pandoraea影响代谢通路。
4 结论
长期相对高温使肉鸡回肠微生物多样性增加,厚壁菌门和乳酸杆菌属增加,拟杆菌门降低,嘌呤代谢和D-丙氨酸代谢等相关信号通路显著富集;长期相对低温使肉鸡回肠微生物多样性增加,梭状芽孢杆菌XI、志贺氏大肠杆菌属降低,苯丙氨酸、酪氨酸和色氨酸的生物合成、脂质生物合成蛋白质等相关信号通路显著富集。
