去泛素化酶在结直肠癌中的研究进展
2021-08-27刘德良谭玉勇
韩 柳, 郭 婷, 刘德良, 谭玉勇
韩柳, 郭婷, 刘德良, 谭玉勇, 中南大学湘雅二医院消化内科 湖南省长沙市 410011
韩柳, 郭婷, 刘德良, 谭玉勇, 中南大学消化病研究中心 湖南省长沙市410011
0 引言
去泛素化酶(deubiquitinating enzymes, DUBs)发现于上世纪90年代, 其广泛分布于机体的各种细胞内, 通过水解蛋白质底物上所存在的泛素链, 对蛋白质产生去泛素化作用, 从而调节蛋白质的降解, 同时也可对蛋白质的功能产生影响[1]. 目前已发现的去泛素化酶包括6大亚家族, 共约90多种去泛素化酶成员, 这些酶通过其生物化学功能, 在细胞的生长、DNA修复、炎症反应、免疫调节、神经功能、肿瘤发生发展及分子信号通路等多方面发挥重要作用[2].
结直肠癌作为发病率、死亡率最高的五大恶性肿瘤之一, 严重的威胁了人类健康, 影响人类寿命及生活质量, 造成了较重的社会经济负担. 越来越多的研究报道发现去泛素化酶家族在结直肠癌的发生发展中起到重要的调控作用, 本文就此相关进展作如下综述.
1 泛素蛋白特异性蛋白酶家族
泛素蛋白特异性蛋白酶家族(ubiquitin-specific processing proteases, USPs)属于半胱氨酸蛋白酶, 是目前已知的DUBs中成员最多, 结构功能最具多样性的一类成员, 已发现50多名成员[3]. 该家族都具有高度保守的USP域, 其三个子域形成独特的结构, 类似于人类的右手手掌、拇指及其余手指, 前两个子域之间包含催化位点, 而手指域负责与远端泛素链接[2]. 多种成员已报道与肿瘤发生发展有关, 如USP4, USP7, USP14, USP21, USP22, USP33,USP39, USP46及USP54等, 已知与结直肠癌发生发展相关的成员有USP1, USP4, USP5, USP9X, USP10, USP14,USP17, USP22, USP33, USP44, USP46及USP54.
USP1是一种785氨基酸去泛素化酶, 含有His和Cys结构域, 在泛素特异性加工(UBP)家族所有成员中高度保守[4]. Xu等[5]发现USP1在原发性CRC中呈高表达, 高表达USP1与结肠癌分期晚和生存时间短相关, 敲降USP1可引起G2/M细胞周期阻滞、下调BCL-2和MCL-1表达,USP1抑制剂ML323可增强结直肠癌细胞对DNA损伤化疗药物敏感性.
USP4是一种重要的细胞通路调节因子, 参与调节P53、TGF-β应答、NF-κB信号传导和剪接, 在肿瘤发生发展中发挥重要作用[6]. Xing等[7]发现USP4表达在结肠直肠癌组织中显著升高, 并且与肿瘤大小、分化程度、远处转移和生存率相关, 并阐明其机制为USP4通过去泛素化PRL-3从而稳定化PRL-3, 进而激活PI3K/AKT信号传导, 下调E-钙粘蛋白表达. 此外, Yun等[8]发现USP4可通过去泛素化β-catenin调控WNT/β-catenin途径来促进结直肠癌的发展, 同时他们筛选一种高选择性的USP4抑制剂,Neural red (NR), 发现其可以阻碍CRC肿瘤细胞的生长.
USP14对真核生物至关重要, 其参与调节细胞生理的许多方面, 研究表明USP14可在体外抑制蛋白酶体, 还可抑制细胞中的蛋白质周转[9]. Wu等[10]人发现USP14在正常的结直肠上皮细胞中不表达或低表达, 而在结直肠癌细胞中其表达水平显著升高, 其表达水平与病理分期、淋巴结转移、肝转移密切相关, 且高表达的USP14患者其预后较差. 后续的组织微阵列分析表明USP14通过增强Wnt/β-catenin信号传导而促进CRC发生发展[11,12].
研究表明IL-4和IL-6诱导了USP17的表达并进一步调节细胞生长和存活, 并通过逆转K63连接的RCE1的泛素化来调节细胞增殖[13]. USP17在结直肠癌细胞系高表达, 其表达在细胞周期中受到严格调控, 并在介导细胞周期进程中发挥重要作用, 敲除USP17可显著抑制细胞增殖并引起G1/S细胞周期阻滞[14]. 除此之外, Kim等[15]发现USP5在结直肠癌中呈高表达, 且其表达水平与P53表达状态相关.
USP22具有调控肿瘤细胞周期的正向作用, 不少研究证实USP22是潜在的肿瘤干细胞标志物. Jiang等[16]研究表明USP22在结直肠癌中的阳性表达率明显高于癌旁正常组织, 并指出其可能通过去泛素化胞浆内的β-catenin, 进一步促进FoxM1核内转移, 从而参与肿瘤细胞的侵袭、转移. 姜争等[17]发现USP22可通过BMI-1介导活化Akt通路, 从而控制结直肠癌细胞周期的进展. 敖宁等[18]认为USP22可通过参与调控BMI-1/INK4a/ARF/、AKt等多种结直肠癌相关信号通路, 并有助于提高STAT3的增殖作用, 而他们的研究同时也认为, 该去泛素化酶可通过SIRT1-STAT3/MMP9途径降低结直肠癌细胞的侵袭能力, 因此考虑USP22在结直肠癌细胞中有多种作用. Liu等[19]人发现USP22的高表达与结直肠癌肝转移密切相关, 也同样证实USP22通过BMI-1/INK4a/ARF/、AKt等信号通路调节结直肠癌细胞的细胞周期.
Liu等[20]研究发现USP33在结直肠癌组织及结直肠癌肝转移瘤组织中与正常组织相比均为低表达, 其表达水平与肿瘤分化程度、肿瘤转移及患者预后生存密切相关, 其潜在机制可能为下调ß-arrestin2的泛素化水平,从而抑制CXCR4内吞过程, 阻断其下游的ERK通路, 进而下调结直肠癌细胞EMT蛋白表达及侵袭能力. Huang等[21]发现USP33通过去泛素化Robo1从而下调Silt2表达水平, 进一步抑制CRC细胞迁移.
Li等[22]通过体内外研究表明USP46是结直肠癌的抑癌因子, 其可促进结直肠癌中PHLPP的去泛素化并稳定其表达水平从而抑制AKt信号传导, 进而抑制结直肠癌发生发展.
Fang等[23]过对结肠癌样本进行分析后 发现, USP9X作为Mcl-1的去泛素化酶, 与Mcl-1和B淋巴细胞瘤-xL(Bcelllymphoma-extralarge, BclxL)在多数结肠肿瘤样本中高表达并且共存, 而 Mcl-1和Bcl-xL的表达水平与临床分期相关. 体外实验表明USP9X的抑制剂WP1130能促进Mcl-1降解, 与ABT-737联合应用显示出化疗的协同作用,促进多种结直肠肿瘤细胞的凋亡[24].
USP10主要定位在细胞质中, 可以对翻译后转移至细胞质中的多种蛋白质去泛素化, 通过与G3BP之间的相互作用调控细胞的增殖、细胞周期、凋亡与自噬等生理过程. 成迎迎等[25]的实验显示, USP10在结直肠癌中低表达, 并且与结直肠癌的发生有关, 而与其发展及预后无明显相关性. Lin等[26]通过细胞学实验发现USP10可以通过去泛素化作用稳定SIRT6蛋白, 从而拮抗c-myc的转录激活, 最终抑制结直肠腺癌的发生. 然而, Ouyang等[27]通过多种实验证明USP10能够稳定MSI2修饰相关的去泛素酶链来调节MSI2的表达实现促进结直肠癌的作用. Li等人最新的研究[28]发现USP10可以与PYD domain-containing protein 7(NLRP7)相互作用, 在结直肠癌细胞中催化NLRP7的去泛素化, 而NLRP7在体内外均能促进肿瘤细胞的增殖和转移.
USP44是USP家族的重要成员, USP44具有保守的USP结构域, USP44对于肿瘤的发生发展起着促进还是抑制作用, 取决于肿瘤的种类. Huang等人[29]通过研究发现, 在结直肠癌中, USP44过表达增加了Axin1蛋白, 而减少了β catenin, c myc和cyclin D1蛋白, USP44通过抑制Wnt/β catenin通路抑制结直肠癌细胞增殖同时促进细胞凋亡, 因此, USP44是结直肠癌的抑癌因子, 也是结直肠癌治疗的潜在靶点.
USP54在结直肠癌的发展过程中也有起到一定的作用. Fraile等[30]使用氮氧甲烷(AOM)和硫酸右旋糖酐钠(DSS)在USP54+/+和USP54KF/KF小鼠中诱导结肠癌, 实验结果显示有USP54缺陷的小鼠浸润性肿瘤数量显著减少. 为了进一步阐明USP54在结肠癌中的相关性, 分析了USP54在结直肠腺瘤和正常粘膜转录数据中的表达情况, 发现与匹配的正常粘膜相比, 腺瘤中USP54的表达显著增加. 因此, 证明了USP54在结直肠癌干细胞中出现过表达, 促进肿瘤的发生发展, USP54的下调可以降低结直肠癌的发生风险.
2 泛素蛋白羧基端水解酶家族
泛素蛋白羧基端水解酶家族(ubiquitin carboxyl-terminal hydrolases, UCHs)是一类可催化泛素C-末端小分子肽类的去泛素化酶, 由于其具有封闭的环路, 不能对多聚泛素蛋白链和大的折叠蛋白质进行加工[31]. 其亚家族由四个成员组成: UCH-L1, UCH-L3, UCH37和BRCA1相关蛋白-1(BAP1)[32]. 先前的研究表明, UCH酶在一些信号传导和细胞周期调控中起关键作用, 并和人类恶性肿瘤密切相关[33]. 目前UCH-L1, UCH-L3, UCH 37在结直肠癌方面有相关研究报道.
UCH-L1又名蛋白基因产物9.5, 其编码基因位于4p14染色体, 是一种由223个氨基酸组成的半胱氨酸水解酶, 可水解泛素和一些未折叠的多肽之间的化学键,或切下一些泛素基因产物, 从而产生游离的泛素单体,另一方面也有实验[34]显示UCH-L1存在泛素链接酶活性, 在体内具有稳定泛素单体的作用, 因此, UCH-1存在泛素化及去泛素化双重作用. Yamazaki等[35]研究表明UCH-L1在结直肠癌组织中检测到表达, 而正常肠黏膜组无表达, 并且表达水平与肿瘤大小和浸润范围相关.Farnebo等[36]实验发现UCH-L1表达与结直肠癌淋巴结转移相关. Okochi-Takada等[37]进一步发现UCH-L1在结直肠癌细胞系中其启动子的甲基化水平提高.
UCH-L3是UCH家族的重要组成部分, 研究[38]已经发现UCH-L3在乳腺癌中有着高表达, 此外, 它最近也被认定为是一种新的DNA修复介质. UCH-L3在结直肠癌中的具体作用机制目前还尚未清楚, Li等人[39]通过研究发现UCH-L3在结直肠癌中存在有高表达, 表明其与肿瘤的发生发展有一定的关系, 此外, Li等人还进了体外研究, 结果发现UCH-L3调控结直肠癌细胞中SOX12的表达, UCH-L3介导的SOX12表达需要PI3K/AKT/mTOR通路. 因此, UCH-L3通过AKT/mTOR/SOX12轴发挥致癌作用, 可作为治疗和结直肠癌预后的潜在靶点生物标志物.
UCH37是去泛素化酶家族成员, 其可通过从蛋白泛素连接链的远端亚基水解聚泛素从而抑制蛋白降解[40].邓显伦等[41]通过qRT-PCR和免疫组织化学技术检测结直肠癌石蜡组织标本中 UCH37 mRNA及蛋白的表达水平, 发现UCH37在结直肠癌组织中的表达水平高于癌旁组织. UCH37与结直肠癌淋巴结转移和TMN分期有关,因此UCH37的表达水平也能影响结直肠癌患者预后.
3 JAMM/MPN结构域相关的金属蛋白酶家族
JAMM/MPN结构域相关的金属蛋白酶(JAB1/MPN/MOV34 metalloproteases, JAMAs)是一类能结合泛素化蛋白上泛素分子的蛋白酶, 具有MPN序列, 由较为保守的一个天冬氨酸残基及两个组氨酸残基构成, 并且与二价的锌离子共同组成活性催化中心[42]. JAMM/MPN结构域相关的金属蛋白酶被发现于存在于古细菌, 细菌和真核生物的蛋白质中, 其构成包括26S蛋白酶体的Rpn11亚基[43]. 家族成员包括PSMD7, PSMD14, EIF3H, BRCC36,CSCN5, CSCN6, AMSH, AMSH-LP, MPND, PRPF8,MYSM1, STAMBPL1等[44]. 目前关于该家族在疾病中的研究进展较少, 且缺乏与结直肠癌有关的相关研究, 有研究显示[45]STAMBPL1可通过调节Tax的定位和稳定性来调节NF-κB的活化水平, 而NF-κB在多种人类恶性侵袭性肿瘤中都有高表达, 在肿瘤的形成、增生和免疫炎症反应中扮演着较为重要的角色, NF-κB同样高表达于结直肠癌中, 且状态表现为激活, 因此推断STAMBPL1可能在结直肠癌的发生发展中起到一定作用, 但需要更多的研究来进一步验证.
RPN11 又称PSMD14/poh1, 是蛋白酶体19S调节颗粒盖子结构中的特异性去泛素化酶, 在调节多种信号通路中发挥关键作用, 包括维持蛋白质稳定性, 双链DNA断裂修复, 胚胎干细胞分化和细胞增殖等[46,47]. 王晓林等[48]发现, RPN11 在结直肠癌组织中表达的阳性率明显高于正常结直肠组织. RPN11 的高表达也与恶性肿瘤细胞的增殖有一定的关系, 因此推测, RPN11参与结直肠癌肿瘤细胞的增殖.
4 Machado Joseph病蛋白结构域蛋白酶家族
Machado–Joseph病蛋白结构域蛋白酶家族(Machado–Joseph disease protein domain proteases, MJDs)由四个不同的成员组成, 包括Ataxin-3(ATXN3), ATXN3L, JOSD1和JOSD2, 均具有泛素水解酶活性, Ataxin-3在3型脊髓小脑性共济失调或马查多-约瑟夫病中发生突变, 该蛋白质具有多聚泛素化链编辑酶的活性, 可以调控蛋白质的折叠并保持结构的稳定, 同时其泛素水解酶活性对于维持正常寿命是必需的, 从而表明编辑泛素链有助于长寿调节[49], 而另外三位成员都具有两个组氨酸残基和一个半胱氨酸残基, 三者形成高度保守的催化三联体[50]. 目前尚无MJDs在结直肠癌方面的相关研究, Sacco等[51]发现Ataxin-3、ATXN3L及JOSD1可下调非小细胞肺癌抑制因子PTEN表达, 并参与到PtdIns3-K/PKB信号通路的调控. Liu等[52]近期发现p53是ATXN-3的一种新型底物,ATXN3可抑制p53降解稳定其表达. 因PTEN和p53通路在结肠癌发生发展中起重要作用, 故推测该家族成员可能参与结直肠癌发生发展.
5 单核细胞趋化蛋白诱导蛋白酶家族
单核细胞趋化蛋白诱导蛋白酶家族(monocyte chemotactic protein-induced protein family, MCPIP)为新近发现的去泛素化酶, 其成员已知的包括MCPIP1,MCPIP2, MCPIP3, MCPIP4, MCPIP5, MCPIP6, MCPIP7[53].目前有关以上成员的研究较少, 它的去泛素化酶功能目前还不清楚, 可能底物包括TRAF2, TRAF3和TRAF6[54].Miekus等[55]在ccRCC细胞系中证实了MCPIP1在介导癌细胞转移方面有着重要的作用, 此外, 还发现MCPIP1还可以影响c-met受体的表达水平和磷酸化, 且c-met的异常可以促进结直肠癌的发展.
6 结论
去泛素化酶具有多个成员及家族, 其分布广泛、功能复杂. 去泛素化酶在蛋白质的调节中起着重要的作用, 在转录、翻译、修饰、等多方面参与细胞内的蛋白质相关进程, 对肿瘤的发生发展有着一定的促进或者抑制作用. 去泛素化酶主要参与以下的生命活动[56]: (1)移除靶蛋白的泛素链, 阻止靶蛋白在蛋白酶体中被降解; (2)使底物的蛋白质发生去泛素化; (3)加工泛素前体, 释放成熟的泛素分子; (4)促进泛素介导的信号发生转变. 然而, 目前的研究多为生物学实验室对其明确生化结构与分子作用机制的研究, 也有部分关于病原微生物致病作用、免疫与炎症反应、神经系统疾病、肿瘤调控等方面的研究, 对于疾病发生更详细的机制, 包括与结直肠肿瘤的研究还需进一步深入探索. 明确去泛素化酶家族的作用机制, 探寻其在结直肠肿瘤发生、发展中的作用位点, 将为结直肠肿瘤的治疗提供新的思路, 进而有助于找出有效的治疗靶点和药物(表1总结了目前已发现的与结直肠癌相关的DUBs及可能的底物及抑制剂).
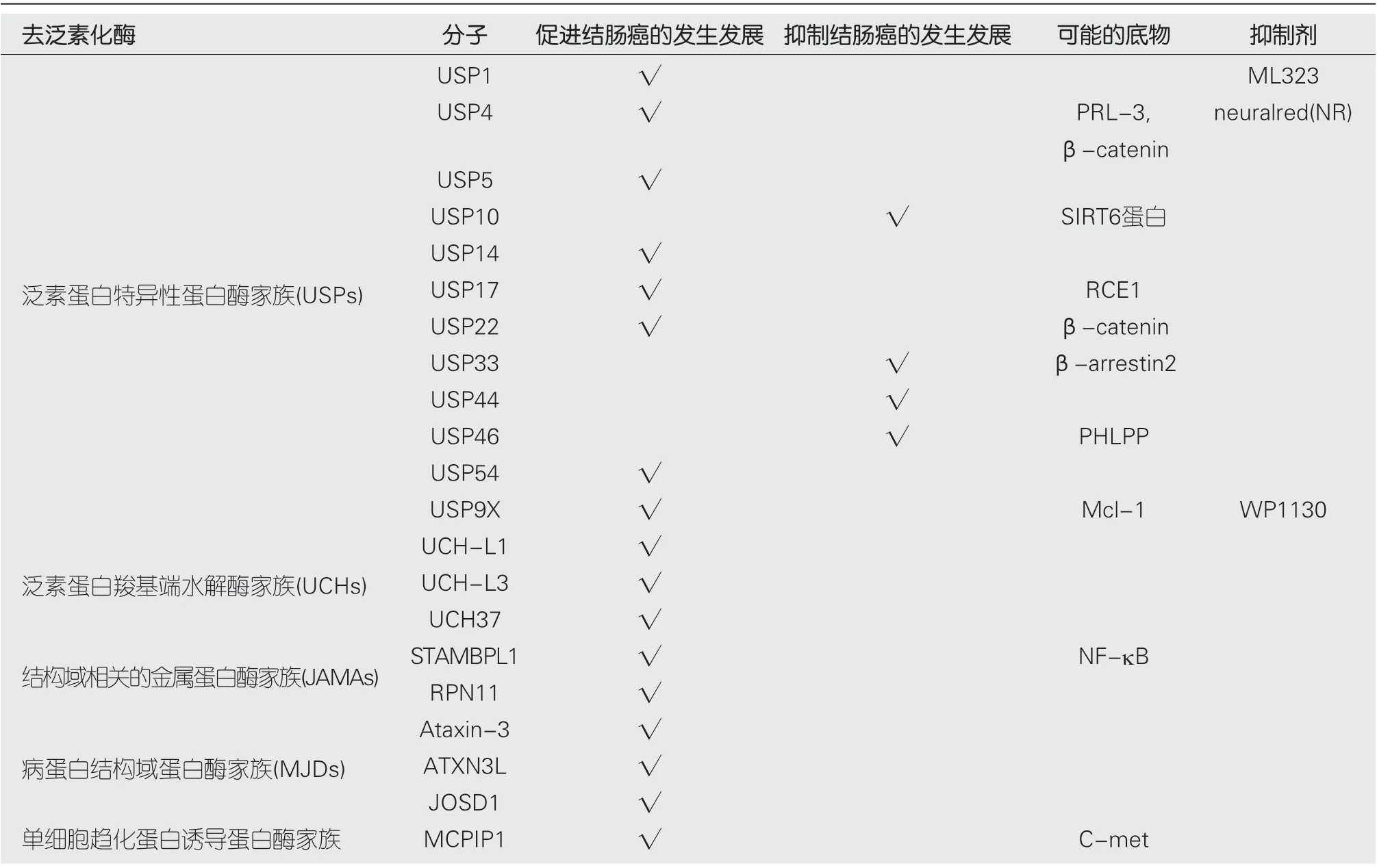
表1 目前已报道的与结直肠癌相关的DUBs及可能的底物及抑制剂
